Как да се получи амониев нитрат от азотна киселина. нитрити; нитрати. Характеристики на метода на изпаряване
Ако намерите грешка на страница, изберете я и натиснете Ctrl + Enter
Приготвяне на азотен оксид у дома
Има няколко начина за получаване на смешен газ. Най-достъпният у дома е методът на Г. Дейви - термичното разлагане на амониев нитрат (амониев нитрат) според реакцията:
NH4NO3 = N2O + 2H2O.
В лабораторни условия е по-удобно да се нагрява сулфаминова киселина с азотна киселина:
NH 2 SO 2 OH + HNO 3 (73%) = N 2 O + H 2 SO 4 + H 2 O.
Сулфаминовата и азотната киселина обаче се получават по-трудно, затова ще се съсредоточим върху разлагането на амониевия нитрат. Между другото, разлагането на амониев нитрат се използва за синтезиране на азотен оксид в индустриален мащаб.
Когато амониевият нитрат се нагрява, протичат няколко реакции. Ето откъси от книгата Л.И. Багал Химия и технология за иницииране на експлозиви (1975)
Амониевият нитрат, когато се нагрее малко над точката му на топене (сухият амониев нитрат се топи при 169,6°C), се разлага според реакцията
NH 4 NO 3 NH 3 + HNO 3 (1)
<...>
Реакцията на разлагане на азотен оксид и вода е изследвана от Berthelot, Thomsen и Velay. Първите двама изследователи установиха, че реакцията е екзотермична
NH 4 NO 3 => N 2 O + 2H 2 O + 8,8 kcal (2)
Основните реакции на разлагане на амониев нитрат при температури до 270°C са (1) и (2). Разтопеният амониев нитрат при нагряване над 250-260°C може да отдели азотни оксиди, азот и вода:
NH4NO3 => 0.5N2 + NO + 2H2O
4NH 4 NO 3 => 3N 2 + N 2 O 4 + 8H 2 O
3NH 4 NO 3 => 2N 2 + N 2 O 3 + 6H 2 O
Saunders (1922), въз основа на резултатите от газовия анализ, стигна до извода, че основните реакции на разлагане при температури до 260 ° C са (1) и (2), както и реакцията
5NH3 + 3HNO3 => 4N2 + 9H2O
Според него разлагането при експлозия протича според реакцията
8NH 4 NO 3 => 16H 2 O + 2NO 2 + 4NO + 5N 2
<...>
За нормалния процес на образуване на азотен оксид при разлагането на амониев нитрат, неговият температурен режим и степен на чистота са от изключително значение.
Както може да се види от горните данни, амониевият нитрат, когато се нагрява до 240-250 ° C, се разлага, за да образува азотен оксид и вода, но дори при тази температура полученият "суров" газ съдържа пари на азотна киселина, азотни оксиди NO и NO 2, амоняк, хлор (поради хлоридни примеси), азот и „мъгла” от сублимиран амониев нитрат. Ясно е, че такава смес не може да се вдишва (ако възникне идеята да се повторят експериментите на Дейви), тъй като тя смъртоносно!Освен това, ако колбата е затворена с гумена запушалка, тогава дори след краткотрайна употреба тя постепенно се срутва (с образуването на напълно безвредни продукти).
Следователно методът за производство на смешен газ чрез нагряване на амониев нитрат в тиган (който често се препоръчва от „гурутата“ за смях на „лаиците“) изглежда в най-добрия случай като черен хумор.
Нека да преминем към инсталацията.Амониевият нитрат се разлага в колба Wurtz при леко нагряване. По-добре е да използвате термометър, но можете да го направите без него, ако е необходимо. Както показва опитът, по-добре е да се използва нагряване до приблизително 220 ° C, като в този случай се наблюдава леко "кипене" на стопилката. Полученият „суров газ“ за пречистване първо преминава през охлаждан с лед капан за събиране на дестилирана вода, смесена с азотна киселина. След това газът преминава през колба Drexel с разтвор на железен сулфат; той също служи като вид индикатор за скоростта на отделяне на газ. След това газът се измива в импровизирана перална машина (с порест спрей) с разтвор на 5-7% алкален (натриев или калиев хидроксид), където се изчиства от NO 2, азотна киселина и хлор. И накрая, при третото измиване с порест спрей, в който се излива разтвор на железен (II) сулфат, азотният оксид се изчиства от NO и следи от останали примеси. След това газът съдържа азотен оксид с малко вода и азот, както и следи от NO 2 и NO.
Трябва да се помни, че пречистването на азотен оксид, ако се използва за повторение на експериментите на Дейви, трябва да се даде Специално внимание, в противен случай газът ще бъде токсичен.
Като реакционен товар се използва амониев нитратен тор (амониев нитрат).
Нитритите и нитратите се различават не само по име, те също имат различни елементи във формулата си. Има обаче нещо, което ги „прави сходни“. Обхватът на приложение на тези вещества е доста широк. Те присъстват и в човешкото тяло и ако се натрупат твърде много от тях, човекът получава тежко отравяне, което може да доведе дори до смърт.
Какво представляват нитратите
Просто казано, нитратите са соли на азотната киселина. Във формулата си съдържат едноцифрен анион. Преди това нитратите се наричаха. Сега това е името, дадено на минералите, както и на торовете, използвани в селското стопанство.
Нитратите се произвеждат с помощта на азотна киселина, която атакува метали, оксиди, соли и хидроксиди. Всички нитрати могат да се разреждат във вода. В твърдо състояние те са силни окислители, но свойствата им изчезват, ако към разтвора се добави азотна киселина.
Нитратите запазват свойствата си при обикновени температури, но при ниски се топят до пълното им разлагане. Процесът на получаване на тези вещества е много сложен, така че вероятно ще представлява интерес само за химиците.
Нитратите са основа за експлозиви - това са амонити и други вещества. Използват се предимно като минерални торове. Вече не е тайна, че растенията използват азота от солта, за да изграждат клетките на телата си. Растението произвежда хлорофил, от който живее. Но в човешкото тяло нитратите се превръщат в нитрити, които могат да докарат човек до гроба.
Нитритите също са соли
Нитритите също са соли на азотната киселина, но с различна формула в химичния си състав. Известни са натриевите и калциевите нитрити. Известни са също нитрити на олово, сребро, алкални, алкалоземни и 3D метали.
Това са кристални вещества, които също са присъщи на калия или бария. Някои вещества са силно разтворими във вода, докато други, като сребро, живак или медни нитрити, са слабо разтворими в нея. Трябва да се отбележи, че нитритите също са практически неразтворими в органични разтворители. Но ако повишите температурата, разтворимостта на нитритите се подобрява.
Човечеството използва нитритите в производството на азотни багрила, за производството на капролактам, а също и като окислители и редуциращи реагенти в гумената, текстилната и металообработващата промишленост. Например, натриевият нитрит е добър консервант и се използва при производството на бетонови смеси като ускорител на втвърдяването и добавка против замръзване.
Нитритите са отровни за човешкия хемоглобин, така че трябва да се отстраняват ежедневно от тялото. Те влизат в човешкото тяло директно или с други вещества. Ако човешкото тяло функционира нормално, необходимото количество вещество остава, а ненужното се отстранява. Но ако човек е болен, възниква проблем с отравяне с нитрити.
Химията е завладяваща наука. Тези, които се интересуват не само от теория, но и опитват уменията си на практика, знаят точно за какво говорим. Всеки ученик е запознат с повечето елементи от периодичната таблица. Но всеки ли е успял да опита да смеси реактиви и да проведе химически тестове от първа ръка? Дори и днес не всички съвременни училища разполагат с необходимото оборудване и реактиви, така че химията остава наука, отворена за независимо изучаване. Мнозина се стремят да го разберат по-дълбоко, като провеждат изследвания у дома.
Нито един домашен работник не може без азотна киселина - изключително важно нещо в домакинството. Трудно е да се получи веществото: то може да бъде закупено само в специализиран магазин, където покупките се извършват с документи, потвърждаващи употребата на веществото за мирни цели. Следователно, ако сте DIYer, най-вероятно няма да можете да получите този компонент. Тук възниква въпросът как да направите азотна киселина у дома. Процесът не изглежда сложен, но изходът трябва да бъде вещество с достатъчно ниво на чистота и необходимата концентрация. Няма начин да направите това без уменията на химик експериментатор.
Къде се използва веществото?
Разумно е да се използва азотна киселина за безопасни цели. Веществото се използва в следните области на човешката дейност:
- създаване на оцветяващи пигменти;
- Проявяване на фотографски филми;
- приготвяне на лекарства;
- рециклиране на пластмасови изделия;
- използване в химията;
- торене на градински и зеленчукови култури;
- производство на динамит.

Чистата азотна киселина в непроменен вид се явява като течно вещество, което при контакт с въздуха започва да отделя бели пари. Замръзва вече при -42 o C и кипи при +80 o C. Как да премахнете вещество като азотна киселина със собствените си ръце у дома?
Метод 1
Димящото вещество се получава чрез излагане на концентрата на натриев (калиев) нитрат (натриев (калиев) нитрат). В резултат на реакцията се получава желаното вещество и натриев (калиев) хидрогенсулфат. Реакционната схема изглежда така: NaNO 3 + з 2 ТАКА 4 => HNO 3 + NaHSO 4. Не забравяйте, че концентрацията на полученото вещество зависи от преди да влезе в реакцията.
Метод 2
Получаването на азотна киселина у дома с по-ниска концентрация на веществото става по същия начин, само трябва да замените натриевия нитрат с амониев нитрат. Химическото уравнение изглежда така: Н.Х. 4 НЕ 3 + з 2 ТАКА 4 =>(Н.Х.4) 2 ТАКА 4 + HNO 3 . Моля, имайте предвид, че амониевият нитрат е по-достъпен от калиевия или натриевия нитрат, поради което повечето изследователи провеждат реакцията въз основа на него.

Колкото по-висока е концентрацията на H 2 SO 4, толкова по-концентрирана ще бъде азотната киселина. За да се получи балансирано вещество, е необходимо да се увеличи обемът на електролита, необходим за реакцията. За да постигнат желания резултат, на практика те използват метода на изпаряване, който се състои в постепенно намаляване на обема на електролита с около 4 пъти оригинала.
Характеристики на метода на изпаряване
На дъното на съда се изсипва пресят пясък и се поставя резервоар с електролит. При този процес газовата печка се загрява чрез увеличаване или намаляване на топлината. Процесът отнема много време, така че търпението е важно по този въпрос. Експертите препоръчват използването на котли - стъклени или керамични тръби, предназначени за химически експерименти, включително изпаряване. Те неутрализират образуването на мехурчета и намаляват силата на кипене, предотвратявайки пръскането на веществото. При такива условия е допустимо да се получи азотна киселина у дома с концентрация около 93%.
Инструменти и реактиви за практическо приготвяне на веществото
За да извършите реакцията, ще ви трябва:
- концентрирана H 2 SO 4 (>95%) - 50 ml;
- амониев нитрат, калий, натрий;
- 100 ml контейнер;
- 1000 ml контейнер;
- стъклена фуния;
- еластични ленти;
- водна баня;
- натрошен лед (може да се замени със сняг или студена вода);
- термометър.

Получаването на азотна киселина у дома, подобно на всяка друга химическа реакция, изисква следните предпазни мерки:
- В процеса на производство на азотна киселина у дома е необходимо да се поддържа температура в рамките на 60-70 o C. Ако тези граници бъдат превишени, киселината ще започне да се разпада.
- По време на реакцията могат да се отделят пари и газове, така че когато работите с киселини, не забравяйте да използвате защитна маска. Ръцете трябва да бъдат защитени от внезапен контакт на веществото с кожата, така че химиците работят в гумени ръкавици. В големите химически заводи, където хората влизат в контакт с опасни за здравето вещества, работниците обикновено работят в специални защитни костюми.
Сега знаете как да получите азотна киселина в проста реакция. Бъдете внимателни, когато използвате такова вещество и го използвайте само за мирни цели.
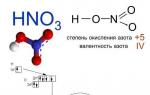
Азотната киселина е силна киселина. Неговите соли - нитрати- получени чрез действието на HNO 3 върху метали, оксиди, хидроксиди или карбонати. Всички нитрати са силно разтворими във вода. Нитратният йон не се хидролизира във вода.
Солите на азотната киселина се разлагат необратимо при нагряване и съставът на продуктите на разлагане се определя от катиона:
а) нитрати на метали, разположени в серията на напрежение вляво от магнезия:
б) нитрати на метали, разположени в диапазона на напрежението между магнезий и мед:
в) нитрати на метали, разположени в серията на напрежение вдясно от живака:
г) амониев нитрат:
Нитратите във водни разтвори практически не проявяват окислителни свойства, но при високи температури в твърдо състояние те са силни окислители, например при топене на твърди вещества:
Цинкът и алуминият в алкален разтвор редуцират нитратите до NH3:
Нитратите се използват широко като торове. Освен това почти всички нитрати са силно разтворими във вода, така че в природата има изключително малко от тях под формата на минерали; изключения са чилийският (натриев) нитрат и индийският нитрат (калиев нитрат). Повечето нитрати се получават по изкуствен път.
Течният азот се използва като хладилен агент и за криотерапия. В нефтохимията азотът се използва за прочистване на резервоари и тръбопроводи, проверка на работата на тръбопроводи под налягане и увеличаване на производството на находища. В минното дело азотът може да се използва за създаване на взривобезопасна среда в мини и за разширяване на скални слоеве.
Важна област на приложение на азота е използването му за по-нататъшен синтез на голямо разнообразие от съединения, съдържащи азот, като амоняк, азотни торове, експлозиви, багрила и др. Големи количества азот се използват в производството на кокс („сух гасене на кокс") по време на разтоварване на кокс от батерии за коксови пещи, както и за "пресоване" на гориво в ракети от резервоари към помпи или двигатели.
В хранително-вкусовата промишленост азотът е регистриран като хранителна добавка E941, като газообразна среда за опаковане и съхранение, хладилен агент и течен азот се използва при бутилиране на масла и негазирани напитки за създаване на свръхналягане и инертна среда в меки контейнери.
Камерите на гумите на колесника на самолета са пълни с азотен газ.
31. Фосфор – получаване, свойства, приложение. Алотропия. Фосфин, фосфониеви соли – получаване и свойства. Метални фосфиди, получаване и свойства.
Фосфор- химичен елемент от 15-та група от третия период на периодичната система на Д. И. Менделеев; има атомен номер 15. Елементът е част от пниктогенната група.
Фосфорът се получава от апатити или фосфорити в резултат на взаимодействие с кокс и силициев диоксид при температура около 1600 ° C:
Получените фосфорни пари се кондензират в приемника под слой вода в алотропна модификация под формата на бял фосфор. Вместо фосфорити, за получаване на елементарен фосфор, други неорганични фосфорни съединения могат да бъдат редуцирани с въглища, например метафосфорна киселина:
Химичните свойства на фосфора до голяма степен се определят от неговата алотропна модификация. Белият фосфор е много активен, в процеса на преминаване към червен и черен фосфор химическата активност намалява. Белият фосфор във въздуха, когато се окислява от кислорода на въздуха при стайна температура, излъчва видима светлина; сиянието се дължи на фотоемисионната реакция на окисление на фосфора.
Фосфорът лесно се окислява от кислород:
(с излишък на кислород)
(с бавно окисление или липса на кислород)
Взаимодейства с много прости вещества - халогени, сяра, някои метали, проявяващи окислителни и редуциращи свойства: с метали - окислител, образува фосфиди; с неметали - редуциращ агент.
Фосфорът практически не се свързва с водород.
В студени концентрирани разтвори на алкали реакцията на диспропорциониране също протича бавно:
Силните окислители превръщат фосфора във фосфорна киселина:
Реакцията на окисление на фосфора възниква при запалване на кибрит; Бертолетовата сол действа като окислител:
Най-химически активен, токсичен и запалим е белият („жълт”) фосфор, поради което се използва много често (в запалителни бомби и др.).
Червеният фосфор е основната модификация, произвеждана и консумирана от индустрията. Използва се в производството на кибрит, експлозиви, запалителни състави, различни видове горива, както и смазочни материали за екстремно налягане, като геттер в производството на лампи с нажежаема жичка.
При нормални условия елементарният фосфор съществува под формата на няколко стабилни алотропни модификации. Всички възможни алотропни модификации на фосфора все още не са напълно проучени (2016). Традиционно се разграничават четири модификации: бял, червен, черен и метален фосфор. Понякога те също се наричат основеналотропни модификации, което означава, че всички други описани модификации са смес от тези четири. При стандартни условия само три алотропни модификации на фосфора са стабилни (например белият фосфор е термодинамично нестабилен (квазистационарно състояние) и се трансформира с времето при нормални условия в червен фосфор). При условия на свръхвисоко налягане металната форма на елемента е термодинамично стабилна. Всички модификации се различават по цвят, плътност и други физични и химични характеристики, особено химическа активност. Когато състоянието на дадено вещество преминава към по-термодинамично стабилна модификация, химическата активност намалява, например по време на последователното превръщане на белия фосфор в червен, след това червения в черен (метален).
Фосфин (фосфид водород, фосфид водород, фосфорен хидрид, фосфан PH 3) е безцветен, отровен газ (при нормални условия) със специфична миризма на гнила риба.
Фосфинът се получава чрез взаимодействие на бял фосфор с гореща основа, например:
Може да се получи и чрез третиране на фосфиди с вода или киселини:
При нагряване хлороводородът реагира с бял фосфор:
Разлагане на фосфониев йодид:
Разлагане на фосфонова киселина:
или възстановяването му:
Химични свойства.
Фосфинът е много различен от неговия двойник, амоняка. Неговата химическа активност е по-висока от тази на амоняка, той е слабо разтворим във вода, тъй като основата е много по-слаба от амоняка. Последното се обяснява с факта, че H–P връзките са слабо поляризирани и активността на несподелената двойка електрони във фосфора (3s 2) е по-ниска от тази на азота (2s 2) в амоняка.
При липса на кислород, когато се нагрява, той се разлага на елементи:
спонтанно се запалва във въздуха (в присъствието на дифосфинови пари или при температури над 100 °C):
Показва силни възстановителни свойства:
Когато взаимодейства със силни протонни донори, фосфинът може да произведе фосфониеви соли, съдържащи PH 4 + йон (подобно на амония). Фосфониевите соли, безцветни кристални вещества, са изключително нестабилни и лесно се хидролизират.
Фосфониевите соли, като самия фосфин, са силни редуциращи агенти.
Фосфиди- бинарни съединения на фосфора с други по-малко електроотрицателни химични елементи, в които фосфорът показва отрицателна степен на окисление.
Повечето фосфиди са съединения на фосфор с типични метали, които се получават чрез директно взаимодействие на прости вещества:
Na + P (червен) → Na 3 P + Na 2 P 5 (200 °C)
Борният фосфид може да се получи или чрез директно взаимодействие на вещества при температура около 1000 °C, или чрез реакция на борен трихлорид с алуминиев фосфид:
BCl 3 + AlP → BP + AlCl 3 (950 °C)
Металните фосфиди са нестабилни съединения, които се разлагат с вода и разредени киселини. При това се получава фосфин и в случай на хидролиза - метален хидроксид; в случай на взаимодействие с киселини - соли.
Ca 3 P 2 + 6H 2 O → 3Ca(OH) 2 + 2PH 3
Ca 3 P 2 + 6HCl → 3CaCl 2 + 2PH 3
При умерено нагряване повечето фосфиди се разлагат. Топи се при свръхналягане на фосфорни пари.
Борният фосфид BP, напротив, е огнеупорен (точка на топене 2000 °C, с разлагане), много инертно вещество. Разлага се само с концентрирани окислителни киселини, реагира при нагряване с кислород, сяра и основи по време на синтероване.
32. Фосфорни оксиди - структура на молекулите, получаване, свойства, приложение.
Фосфорът образува няколко оксида. Най-важните от тях са фосфорен оксид (V) P 4 O 10 и фосфорен оксид (III) P 4 O 6. Често техните формули се записват в опростена форма - P 2 O 5 и P 2 O 3. Структурата на тези оксиди запазва тетраедричната подредба на фосфорните атоми.
Фосфорен (III) оксид P 4 O 6- восъчна кристална маса, която се топи при 22,5°C и се превръща в безцветна течност. Отровни.
Когато се разтвори в студена вода, образува фосфорна киселина:
P 4 O 6 + 6H 2 O = 4H 3 PO 3,
а при взаимодействие с алкали - съответните соли (фосфити).
Силен редуциращ агент. При взаимодействие с кислорода се окислява до P 4 O 10.
Фосфорният (III) оксид се получава чрез окисление на бял фосфор в отсъствието на кислород.
Фосфорен (V) оксид P 4 O 10- бял кристален прах. Температура на сублимация 36°C. Той има няколко модификации, една от които (така наречената летлива) има състав P 4 O 10. Кристалната решетка на тази модификация е съставена от P 4 O 10 молекули, свързани една с друга чрез слаби междумолекулни сили, които лесно се разрушават при нагряване. Оттук и нестабилността на този сорт. Други модификации са полимерни. Те са образувани от безкрайни слоеве от PO 4 тетраедри.
Когато P 4 O 10 взаимодейства с вода, се образува фосфорна киселина:
P 4 O 10 + 6H 2 O = 4H 3 PO 4.
Като киселинен оксид, P 4 O 10 реагира с основни оксиди и хидроксиди.
Образува се при високотемпературно окисление на фосфор в излишък на кислород (сух въздух).
Поради изключителната си хигроскопичност, фосфорният (V) оксид се използва в лабораторни и индустриални технологии като изсушаващ и дехидратиращ агент. По своето изсушаващо действие превъзхожда всички други вещества. Химически свързаната вода се отстранява от безводната перхлорна киселина, за да се образува нейният анхидрид:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
P 4 O 10 се използва като десикант за газове и течности.
Широко използван в органичния синтез при реакции на дехидратация и кондензация.
(А) Нитрити
Подлежи на съответствие изключения, посочени в общите разпоредби за тази подгрупа, тази позиция включва нитритите, металните соли на азотната киселина (HNO 2) (позиция).
- Натриев нитрит(NaNO2). Получава се чрез редуциране на натриев нитрат с олово и по време на производството на оловен кал. Безцветни кристали, хигроскопични и силно разтворими във вода. Използва се като окислител при боядисване на вани; в органичния синтез; за обработка на месо; във фотографията; като отрова за плъхове и др.
- калиев нитрит(KNO 2). Получава се по същите методи като натриевия нитрит или чрез действието на серен диоксид върху смес от калциев оксид и калиев нитрат. Бял кристален прах или жълтеникави пръчици; често съдържа други соли като примеси. Разтваря се във вода и става много дифузен във въздуха с влошаване на свойствата. Използва се за същите цели като натриевия нитрит.
- Бариев нитрит(Ba(NO 2) 2). Кристали, използвани в пиротехниката.
- други нитрити. Те включват амониев нитрит, нестабилен и експлозивен продукт; използван като разтвор за производство на азот в лабораторията.
(Б) Нитрати
Подлежи на съответствие изключения, посочени в общите разпоредби за тази подгрупа, тази позиция включва нитрати, соли на метали и азотна киселина (позиция), с изключениеамониев нитрат и натриев нитрат, както чист, така и суров ( стокова позицияили ). (Вижте по-долу за други изключения.)
Тук се включват и основните нитрати.
- Калиев нитрат(KNO 3) (наричан още "селитра"). Получава се от натриев нитрат и калиев хлорид. Представлява безцветни кристали или стъкловидна маса, или бял кристален прах, разтворим във вода и хигроскопичен в суровата си форма. Използва се подобно на натриевия нитрат, а също и за производство на барут, химически детонатори, в пиротехниката, за производство на кибрит и металургични флюсове.
- Бисмутови нитрати:
(А) неутрален бисмутов нитрат(Bi(NO 3) 3 5H 2 O). Получава се при действието на азотна киселина върху бисмут; големи безцветни дифузни кристали. Използва се за производство на оксиди или соли на бисмут и някои лакове;
б) основен бисмутов нитрат(BiNO 3 (OH) 2). Получава се от неутрален бисмутов нитрат; перлено бял прах, неразтворим във вода. Използва се в медицината (за лечение на стомашно-чревни заболявания); в производството на керамика (бои за дъга), в козметиката, в производството на предпазители и др.
- Магнезиев нитрат(Mg(NO 3) 2 6H 2 O). Безцветни кристали, разтворими във вода. Използва се в пиротехниката, за производство на огнеупорни продукти (с магнезиев оксид), светещи решетки и др.
- Калциев нитрат(Ca(NO3)2). Получава се чрез третиране на натрошен варовик с азотна киселина. Бяла течна маса, разтворима във вода, алкохол и ацетон. Използва се в пиротехниката, в производството на експлозиви, кибрит, торове и др.
- Железен нитрат(Fe(NO 3) 3 6H 2 O или 9H 2 O). Сини кристали. Използва се като щрих за боядисване и печат (чист или смесен с ацетат). В медицината се използва чист воден разтвор.
- Кобалтов нитрат(Co(NO 3) 2 6H 2 O). Лилави, червеникави или кафеникави кристали, разтворими във вода и течни. Използва се при производството на кобалтово синьо или кобалтово жълто и симпатични мастила; за декориране на керамика; за електроотлагане на кобалт и др.
- Никелов нитрат(Ni(NO 3) 2 6H 2 O). Водоразтворими, разхлабващи се зелени кристали. Използва се в производството на керамика (кафяви пигменти); за боядисване (като щрих); по време на електроотлагане на никел; за производство на никелов оксид или катализатори от чист никел.
- Меден нитрат(Cu(NO 3) 2). Получава се чрез разтваряне на мед в азотна киселина и последваща кристализация (съдържа 3 или 6 водни молекули в зависимост от температурата). Сини или зелени кристали, разтворими във вода, хигроскопични; отровни. Използва се в пиротехниката; в производството на багрила; при боядисване или щамповане на текстилни материали (мордант); за производство на меден оксид и производство на фотохартия; при нанасяне на галванично покритие, за придаване на изкуствена патина на металите и др.
- Стронциев нитрат(Sg(NO 3) 2). Получава се чрез действието на стронциев оксид или стронциев сулфид върху азотна киселина при нагряване под формата на безводна сол или под формата на хидратирана сол (с 4 водни молекули) при ниски температури. Безцветен кристален прах, разтичащ се, разтворим във вода, разлага се при нагряване. Използва се в пиротехниката (червена светлина), в производството на кибрит.
- Кадмиев нитрат(Cd(NO 3) 2 4H 2 O). Получава се от оксид. Безцветни игли, дифузни, разтворими във вода. Използва се като оцветител в керамичната или стъкларската промишленост.
- Бариев нитрат(Ba(NO 3) 2). Получава се от естествен карбонат (уитерит) (стокова позиция). Безцветни или бели кристали или кристален прах; разтворим във вода, отровен. Използва се в пиротехниката (зелена светлина); при производството на експлозиви, оптично стъкло, керамични глазури, бариеви соли или нитрати и др.
- Оловен нитрат(Pb(NO 3) 2). Оловен нитрат се образува като страничен продукт при производството на оловен диоксид чрез действието на азотната киселина върху червено олово. Безцветни кристали, разтворими във вода; отровни. Използва се в пиротехниката (жълта светлина), при производството на кибрит, експлозиви и някои багрила; в кожарството, фотографията и литографията; за получаване на оловни соли като окислител в органичния синтез.
В допълнение към горното изключения, Също не включвайследните продукти.