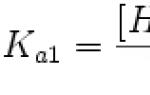Csal lap hormon enzimek. Lehninger biokémiájának alapjai Módszerek a sejt metabolikus aktivitásának szabályozására
DINAMIKUS BIOKÉMIA
FejezetIV.8.
Anyagcsere és energia
Anyagcsere vagy anyagcsere - a szervezetben zajló kémiai reakciók összessége, amelyek ellátják az élethez szükséges anyagokkal és energiával. Az anyagcserében két fő szakasz különböztethető meg: előkészítő - amikor a táplálék útján bevitt anyag kémiai átalakuláson megy keresztül, melynek eredményeként bejuthat a vérbe, majd behatol a sejtekbe, valamint maga az anyagcsere, azaz az anyagcsere. a sejtekbe behatolt vegyületek kémiai átalakulásai.
Metabolikus út - ez egy adott anyag kémiai átalakulásának jellege és sorrendje a szervezetben. Az anyagcsere folyamata során keletkező köztes termékeket metabolitoknak nevezzük, és az anyagcsereút utolsó vegyülete a végtermék.
Az összetett anyagok egyszerűbbekre bontásának folyamatát ún katabolizmus. Így az élelmiszerben lévő fehérjék, zsírok és szénhidrátok egyszerűbb komponensekre (aminosavak, zsírsavak és monoszacharidok) bomlanak le az emésztőrendszerben lévő enzimek hatására. Ez energiát szabadít fel. A fordított folyamatot, vagyis az egyszerűbb vegyületekből összetett vegyületek szintézisét nevezzük anabolizmus . Ez energiaráfordítással jár. Az emésztés eredményeként képződő aminosavakból, zsírsavakból és monoszacharidokból új sejtfehérjék, membránfoszfolipidek és poliszacharidok szintetizálódnak a sejtekben.
Van egy koncepció amfibolizmus amikor egy vegyület elpusztul, de egy másik szintetizálódik.
Anyagcsere ciklus egy olyan anyagcsereút, amelyben az egyik végtermék azonos a folyamatban részt vevő vegyületek egyikével.
Egy adott anyagcsereút egy adott vegyület (szénhidrátok vagy fehérjék) átalakulásának összessége. Az általános anyagcsereút az, amikor két vagy több típusú vegyület vesz részt (az energia-anyagcserében szénhidrátok, lipidek és részben fehérjék vesznek részt).
Metabolikus szubsztrátok - élelmiszerekkel szállított vegyületek. Ezek között vannak fő tápanyagok (fehérjék, szénhidrátok, lipidek) és kisebb mennyiségben (vitaminok, ásványi anyagok) is.
Az anyagcsere intenzitását a sejt bizonyos anyag- vagy energiaigénye határozza meg, a szabályozás négyféleképpen történik:
1) Egy adott anyagcsereút teljes reakciósebességét az ezen az úton lévő enzimek koncentrációja, a környezet pH-értéke, az egyes köztes termékek intracelluláris koncentrációja, valamint a kofaktorok és koenzimek koncentrációja határozza meg.
2) A szabályozó (alloszterikus) enzimek aktivitása, amelyek általában katalizálják az anyagcsere-pályák kezdeti szakaszait. Legtöbbjüket ennek az útvonalnak a végterméke gátolja, és ezt a fajta gátlást "visszacsatolásnak" nevezik.
3) Genetikai szabályozás, amely meghatározza egy adott enzim szintézisének sebességét. Feltűnő példa az indukálható enzimek megjelenése a sejtben, válaszul a megfelelő szubsztrát ellátására.
4) Hormonális szabályozás. Számos hormon képes aktiválni vagy gátolni számos enzimet az anyagcsere-útvonalakban.
Az élő szervezetek termodinamikailag instabil rendszerek. Kialakulásukhoz és működésükhöz folyamatos energiaellátás szükséges, sokoldalú felhasználásra alkalmas formában. Ahhoz, hogy energiát nyerjen, a bolygó szinte minden élőlénye alkalmazkodott az ATP egyik pirofoszfát kötésének hidrolizálásához. Ezzel kapcsolatban az élő szervezetek bioenergetikájának egyik fő feladata a felhasznált ATP pótlása ADP-ből és AMP-ből.
A sejtben a fő energiaforrás a szubsztrátok légköri oxigénnel történő oxidációja. Ez a folyamat háromféleképpen megy végbe: oxigén hozzáadása a szénatomhoz, hidrogén absztrakciója vagy egy elektron elvesztése. A sejtekben az oxidáció a hidrogén és az elektronok szekvenciális átvitele formájában megy végbe a szubsztrátumból az oxigénbe. Ebben az esetben az oxigén redukáló vegyület (oxidálószer) szerepét tölti be. Az oxidatív reakciók az energia felszabadulásával jönnek létre.A biológiai reakciókat viszonylag kis energiaváltozás jellemzi. Ezt úgy érik el, hogy az oxidációs folyamatot több köztes szakaszra bontják, ami lehetővé teszi, hogy kis adagokban nagy energiájú vegyületek (ATP) formájában tárolják. Az oxigénatom redukciója, amikor proton- és elektronpárral kölcsönhatásba lép, vízmolekula képződéséhez vezet.
Szöveti légzés
Ez a testszövetek sejtjei oxigénfogyasztási folyamata, amely részt vesz a biológiai oxidációban. Ezt a fajta oxidációt ún aerob oxidáció . Ha a hidrogéntranszfer lánc végső akceptorja nem az oxigén, hanem más anyagok (például piroszőlősav), akkor ezt a fajta oxidációt ún. anaerob.
Hogy. A biológiai oxidáció egy szubsztrát dehidrogénezése közbenső hidrogénhordozók és végső akceptor segítségével.
Légzőlánc (szöveti légzési enzimek) protonok és elektronok hordozói az oxidált szubsztrátumból az oxigénbe. Az oxidálószer olyan vegyület, amely képes elektronokat fogadni. Ezt a képességet mennyiségileg jellemzik redoxpotenciál egy standard hidrogénelektródhoz képest, amelynek pH-ja 7,0. Minél kisebb egy vegyület potenciálja, annál erősebbek a redukáló tulajdonságai, és fordítva.
Hogy. bármely vegyület csak egy nagyobb redoxpotenciállal rendelkező vegyületnek tud elektronokat adni. A légzési láncban minden következő láncszem nagyobb potenciállal rendelkezik, mint az előző.
A légzőlánc a következőkből áll:
1. NAD-függő dehidrogenáz;
2. FAD-függő dehidrogenáz;
3. Ubikinon (Ko Q);
4. Citokróm b, c, a + a 3.
NAD-függő dehidrogenázok . Koenzimként tartalmaz FELETTÉs NADP. A nikotinamid piridingyűrűje elektronokat és hidrogénprotonokat képes befogadni.
FAD és FMN-függő dehidrogenázok koenzimként a B2-vitamin foszfor-észterét tartalmazzák ( HÓBORT).
Ubikinon (Ko K ) elvonja a hidrogént a flavoproteinektől és átalakul hidrokinon.
Citokrómok - olyan kromoprotein fehérjék, amelyek a vas-porfirinek, mint protetikus csoportok jelenléte miatt képesek elektronok felvételére. Olyan anyagból elektront fogadnak el, amely valamivel erősebb redukálószer, és egy erősebb oxidálószernek adják át. A vasatom a porfirin gyűrű síkjának egyik oldalán a hisztidin aminosav imidazolgyűrűjének nitrogénatomjához, a másik oldalon a metionin kénatomjához kapcsolódik. Ezért a citokrómokban lévő vasatom potenciális oxigénmegkötő képessége elnyomódik.
BAN BEN citokróm c a porfirin sík kovalensen kapcsolódik a fehérjéhez két cisztein maradékon keresztül, és citokrómexb És , nem kovalens kötéssel fehérjével.
BAN BEN citokróm a+a 3 (citokróm-oxidáz) protoporfirin helyett porfirin A-t tartalmaz, amely számos szerkezeti jellemzőben különbözik egymástól. A vas ötödik koordinációs pozícióját egy aminocsoport foglalja el, amely egy aminocukor-maradékhoz tartozik, amely magának a fehérjének a része.
A hemtől, a hemolgobintól eltérően a citokrómokban lévő vasatom reverzibilisen átalakulhat kettős állapotból háromértékű állapotba, ami biztosítja az elektrontranszportot (további részletekért lásd az 1. mellékletet „A hemoproteinek atomi és elektronszerkezete”).
Az elektrontranszport lánc működési mechanizmusa
A mitokondrium külső membránja (4.8.1. ábra) a legtöbb kis molekula és ion számára permeábilis, a belső membrán szinte minden ion számára (kivéve H protonok) és a legtöbb töltetlen molekula számára áteresztő.
A légzőlánc összes fenti komponense a belső membránba ágyazódik. A protonok és elektronok szállítását a légzési lánc mentén az összetevői közötti potenciálkülönbség biztosítja. Ebben az esetben minden 0,16 V-os potenciálnövekedés elegendő energiát szabadít fel egy ATP-molekula ADP-ből és H 3 PO 4-ből történő szintéziséhez. Ha egy O2-molekula elfogy, 3 molekula keletkezik ATP.
Az oxidációs folyamatok és az ATP képződése ADP-ből és foszforsavból, pl. A foszforiláció a mitokondriumokban történik. A belső membrán számos redőt - cristae - képez. A teret egy belső membrán – a mátrix – határolja. A belső és a külső membrán közötti teret intermembránnak nevezzük.
Egy ilyen molekula három nagy energiájú kötést tartalmaz. Makroergikus vagy energiadús olyan kémiai kötés, amely felbomlása esetén több mint 4 kcal/mol szabadul fel. Az ATP hidrolitikus lebomlása során ADP-vé és foszforsavvá 7,3 kcal/mol szabadul fel. Pontosan ugyanennyit fordítanak az ATP előállítására ADP-ből és foszforsavmaradékból, és ez az egyik fő módja az energia tárolásának a szervezetben.
Az elektronok légzési láncon történő szállítása során energia szabadul fel, amelyet egy foszforsavmaradék ADP-hez való hozzáadására fordítanak, hogy egy molekula ATP-t és egy vízmolekulát képződjenek. A légzési lánc mentén egy elektronpár átvitele során 21,3 kcal/mol szabadul fel és raktározódik el három ATP molekula formájában. Ez az elektronszállítás során felszabaduló energia mintegy 40%-át teszi ki.
Az energia sejtben való tárolásának ezt a módját ún oxidatív foszforiláció vagy kapcsolt foszforiláció.
Ennek a folyamatnak a molekuláris mechanizmusait a legteljesebben Mitchell kemoozmotikus elmélete magyarázza meg, amelyet 1961-ben terjesztett elő.
Az oxidatív foszforiláció mechanizmusa (4.8.2. ábra):
1) A NAD-függő dehidrogenáz a belső mitokondriális membrán mátrix felületén található, és egy pár hidrogén elektront adományoz az FMN-függő dehidrogenáznak. Ebben az esetben a mátrixból egy protonpár is átjut az FMN-be, és ennek eredményeként FMN H 2 keletkezik. Ekkor a NAD-hoz tartozó protonpárt a membránközi térbe tolják.
2) A FAD-függő dehidrogenáz egy pár elektront adományoz a Co.-nak K és pár protont lök a membránközi térbe. Miután megkapta az elektronokat Co K felvesz egy protonpárt a mátrixból és Co-vá alakul Gyors útmutatás 2.
3) Ko Q A H2 egy protonpárt lök a membránközi térbe, és egy elektronpár a citokrómokhoz, majd az oxigénhez kerül, így vízmolekulát képez.
Ennek eredményeként, amikor egy elektronpárt egy lánc mentén a mátrixból a membránközi térbe juttatunk, 6 proton (3 pár) pumpálódik, ami potenciálkülönbség és pH-különbség kialakulásához vezet a belső felületek között. membrán.
4) A potenciálkülönbség és a pH-különbség biztosítja a protonok mozgását a protoncsatornán keresztül a mátrixba.
5) A protonoknak ez a fordított mozgása az ATP szintáz aktiválásához, valamint az ATP ADP-ből és foszforsavból történő szintéziséhez vezet. Egy elektronpár (azaz három pár proton) átvitelekor 3 ATP molekula szintetizálódik (4.7.3. ábra).

A légzés és az oxidatív foszforiláció folyamatainak disszociációja akkor fordul elő, amikor a protonok elkezdenek behatolni a mitokondriumok belső membránjába. Ebben az esetben a pH-gradiens kiegyenlítődik, és a foszforiláció hajtóereje megszűnik. A kémiai szétkapcsolókat protonoforoknak nevezik; képesek protonokat szállítani a membránon keresztül. Ezek tartalmazzák 2,4-dinitro-fenol, pajzsmirigyhormonok stb. (4.8.3. ábra).
A mátrixból keletkező ATP-t a transzlokáz enzimek, míg ellenkező irányban egy molekula ADP és egy molekula foszforsav kerül a mátrixba a citoplazmába. Nyilvánvaló, hogy az ADP és a foszfát transzport megzavarása gátolja az ATP szintézist.
Az oxidatív foszforiláció sebessége elsősorban az ATP-tartalomtól függ, minél gyorsabban fogyasztják, minél több ADP halmozódik fel, annál nagyobb az energiaigény, és ezáltal az oxidatív foszforiláció aktívabb. Az oxidatív foszforiláció sebességének az ADP sejtkoncentrációjával történő szabályozását légzésszabályozásnak nevezzük.

HIVATKOZÁSOK A FEJEZETHEZ IV.8.
1. Byshevsky A. Sh., Tersenov O. A. Biokémia az orvos számára // Jekatyerinburg: Uralsky Rabochiy, 1994, 384 pp.;
2. Knorre D. G., Myzina S. D. Biological chemistry. – M.: Feljebb. iskola 1998, 479 pp.;
3. Leninger A. Biokémia. A sejtszerkezet és -funkciók molekuláris alapjai // M.: Mir, 1974, 956 pp.;
4. Pustovalova L.M. Műhely a biokémiáról // Rostov-on-Don: Phoenix, 1999, 540 pp.;
5. Stepanov V. M. Molekuláris biológia. A fehérjék szerkezete és funkciói // M.: Higher school, 1996, 335 pp.;
A Földön élő szervezetek teljes sokfélesége két fő csoportra osztható, amelyeket különböző energiaforrások - autotróf és heterotróf szervezetek - felhasználása különböztet meg. Az elsők (autotrófok) elsősorban zöld növények, amelyek a Nap sugárzó energiáját közvetlenül képesek felhasználni a fotoszintézis folyamatában, szervetlen vegyületekből szerves vegyületeket (szénhidrátokat, aminosavakat, zsírsavakat stb.) hozva létre. Más élő szervezetek a kész szerves anyagokat asszimilálják, energiaforrásként vagy műanyagként használják fel testük felépítéséhez. Meg kell jegyezni, hogy a legtöbb mikroorganizmus heterotróf is. Azonban nem képesek felszívni a teljes élelmiszer-részecskéket. Különleges emésztőenzimeket választanak ki környezetükbe, amelyek lebontják az élelmiszer-anyagokat, kis, oldható molekulákká alakítva azokat, és ezek a molekulák behatolnak a sejtekbe. Az anyagcsere eredményeként a táplálékkal elfogyasztott anyagok a sejt saját anyagaivá, struktúráivá alakulnak, emellett a szervezet energiát kap a külső munka elvégzéséhez. Az önreprodukció, vagyis a testszerkezetek és a szaporodás folyamatos megújulása az élő szervezetek anyagcseréjének legjellemzőbb jellemzője, amely megkülönbözteti az élettelen természetben zajló anyagcserétől. |
Az anyagcsere, amely elválaszthatatlanul kapcsolódik az energiacseréhez, az élő rendszerekben az anyag és az energia átalakulásának természetes rendje, amelynek célja azok megőrzése és önreprodukciója. F. Engels az élet legfontosabb tulajdonságának az anyagcserét jegyezte meg, amelynek megszűnésével maga az élet is megszűnik. Hangsúlyozta ennek a folyamatnak a dialektikus jellegét, és rámutatott arra
Az orosz fiziológia megalapítója, I. M. Sechenov következetesen materialista szemszögből vizsgálta az anyagcsere szerepét a szervezetek életében. K. A. Timiryazev következetesen azt az elképzelést követte, hogy az élő szervezetekre jellemző fő tulajdonság az élőlényeket alkotó anyag és a környezet anyaga közötti állandó aktív csere, amelyet a szervezet folyamatosan észlel, asszimilál, valami hasonlóvá alakít, ismét megváltozik. és megkülönbözteti a disszimiláció folyamatában. I. P. Pavlov az anyagcserét az élettevékenység megnyilvánulásának, a test élettani funkcióinak alapjának tekintette. Az életfolyamatok kémiájának megismeréséhez jelentős mértékben járult hozzá A. I. Oparin, aki az anyagcsere fejlődésének alapvető mintázatait tanulmányozta a földi élet megjelenése és fejlődése során.
ALAPVETŐ FOGALMAK ÉS KIFEJEZÉSEK
Vagy az anyagcsere a szervezetben zajló kémiai reakciók összessége, amelyek az élethez szükséges anyagokkal és energiával látják el: önfenntartás és önszaporodás. Az önreprodukció alatt egy kívülről érkező anyag átalakulását a test anyagaivá és struktúráivá kell érteni, ami a szövetek folyamatos megújulását, növekedését és szaporodását eredményezi.
Az anyagcserében vannak:
- külső csere- magában foglalja az anyagok sejten kívüli átalakulását a szervezetbe jutásuk útján és az anyagcseretermékek eltávolítását onnan [előadás]
.
Az anyagok szervezetbe jutása és az anyagcseretermékek felszabadulása együttesen alkotja a környezet és a szervezet közötti anyagcserét, és külső csereként definiálható.
Az anyagok (és az energia) külső cseréje folyamatosan történik.
Az emberi szervezet a külső környezetből oxigént, vizet, ásványi sókat, tápanyagokat, vitaminokat kap a sejtek, szövetek szerkezeti elemeinek felépítéséhez, megújulásához, az energiaképzéshez. Mindezeket az anyagokat élelmiszerterméknek nevezhetjük, amelyek egy része biológiai eredetű (növényi és állati eredetű termékek), kisebb része nem biológiai eredetű (víz és benne oldott ásványi sók).
A táplálékkal ellátott tápanyagok lebomlanak aminosavak, monoszacharidok, zsírsavak, nukleotidok és egyéb anyagok képződésével, amelyek a sejt szerkezeti és funkcionális összetevőinek folyamatos lebomlása során keletkező azonos anyagokkal keveredve alkotják a teljes készletet. a szervezet metabolitjaitól. Ezt az alapot két irányban költik el: egy részét a sejt leromlott szerkezeti és funkcionális komponenseinek megújítására fordítják; másik része az anyagcsere végtermékeivé alakul, amelyek kiürülnek a szervezetből.
Amikor az anyagok végtermékekké bomlanak le, energia szabadul fel, egy felnőttnél 8000-12000 kJ (2000-3000 kcal) naponta. Ezt az energiát a test sejtjei különféle típusú munkák elvégzésére, valamint a testhőmérséklet állandó szinten tartására használják fel.
- közbenső csere- magában foglalja az anyagok biológiai sejten belüli átalakulását azok bejutásának pillanatától a végtermékek keletkezéséig (például aminosav-anyagcsere, szénhidrát-anyagcsere stb.)
Metabolikus szakaszok. Három egymást követő szakasz van.
Olvasson többet a
- bevitel (A táplálkozás az anyagcsere (a környezetből a szervezetbe jutó anyagok) szerves része)
- emésztés (Az emésztés biokémiája (tápanyagok emésztése))
- felszívódás (Az emésztés biokémiája (tápanyagok felszívódása))
II. Anyagok mozgása és átalakulása a szervezetben (köztes anyagcsere) |
A közbenső anyagcsere (vagy anyagcsere) az anyagok átalakulása a szervezetben attól a pillanattól kezdve, hogy bejutnak a sejtekbe, egészen a végső anyagcseretermékek keletkezéséig, azaz olyan kémiai reakciók összessége, amelyek az élő sejtekben végbemennek, és anyaggal és energiával látják el a szervezetet. létfontosságú tevékenységéhez, növekedéséhez és szaporodásához. Ez az anyagcsere legösszetettebb része.
A sejtbe jutva a tápanyag metabolizálódik – egy sor kémiai változáson megy keresztül, amelyeket enzimek katalizálnak. Az ilyen kémiai változások specifikus sorrendjét metabolikus útvonalnak, a keletkező köztes termékeket pedig metabolitoknak nevezzük. Az anyagcsere-pályák metabolikus térkép formájában ábrázolhatók.
| Tápanyag-anyagcsere | ||
| Szénhidrát | Lipidek | Belkov |
A szénhidrátok katabolikus útjai
A szénhidrátok anabolikus útjai
|
Lipid katabolikus út
Anabolikus lipid útvonal
|
A fehérje katabolikus útvonala
Az aminosavak anabolikus útja
|
A foszfolipid és a triacilglicerin szintézisútjai közötti versengés miatt a közös szubsztrátokért minden olyan anyag, amely elősegíti a foszfolipid szintézist, megakadályozza a triacilglicerinek lerakódását a szövetekben. Ezeket az anyagokat lipotróp faktoroknak nevezzük. Ide tartoznak a foszfolipidek szerkezetei és komponensei: kolin, inozitol, szerin; olyan anyag, amely elősegíti a szerin-foszfatidok dekarboxilezését - piridoxál-foszfát; metilcsoport donor - metionin; folsav és cianokobalamin, amelyek részt vesznek a metilcsoport transzfer koenzimek (THFA és metilkobalamin) képzésében. Használhatók olyan gyógyszerekként, amelyek megakadályozzák a triacilglicerin túlzott lerakódását a szövetekben (zsíros infiltráció).
|
||
| 24. táblázat: Ember napi anyagcseréje (kerekített értékek; körülbelül 70 kg testtömegű felnőtt) | |||
| Anyagok | Tartalom a szervezetben, g | Napi fogyasztás, g | Napi kiosztás |
| O2 | - | 850 | - |
| CO2 | - | - | 1000 |
| Víz | 42 000 | 2200 | 2600 |
| Szerves anyag: | |||
| mókusok | 15 000 | 80 | - |
| lipidek | 10 000 | 100 | - |
| szénhidrátokat | 700 | 400 | - |
| nukleinsavak | 700 | - | - |
| karbamid | - | - | 30 |
| Ásványi sók | 3 500 | 20 | 20 |
| Teljes | 71 900 | 3650 | 3650 |
Az anyagcsere-tevékenység következtében a test minden részében káros anyagok képződnek, amelyek a vérbe jutva el kell távolítani őket. Ezt a funkciót a vesék látják el, amelyek leválasztják a káros anyagokat, és a hólyagba juttatják, ahonnan aztán kiürülnek a szervezetből. Az anyagcsere folyamatában más szervek is részt vesznek: máj, hasnyálmirigy, epehólyag, belek, verejtékmirigyek.
Az ember az anyagcsere fő végtermékeit vizelettel, széklettel, izzadsággal és kilélegzett levegővel választja ki - CO 2, H 2 O, karbamid H 2 N - CO - NH 2. A szerves anyagok hidrogéne H 2 O formájában ürül ki, és a szervezet több vizet bocsát ki, mint amennyit elfogyaszt (lásd 24. táblázat): a szerves anyagok hidrogénéből és a belélegzett oxigénből körülbelül 400 g víz képződik naponta a szervezetben. levegő (metabolikus víz). A szerves anyagok szén- és oxigéntartalma CO 2 formájában, a nitrogén pedig karbamid formájában távozik el.
Ezenkívül az ember sok más anyagot is kiválaszt, de kis mennyiségben, így ezek hozzájárulása a szervezet és a környezet közötti anyagcsere általános egyensúlyához csekély. Meg kell azonban jegyezni, hogy az ilyen anyagok felszabadulásának élettani jelentősége jelentős lehet. Például a hem bomlástermékeinek vagy az idegen vegyületek anyagcseretermékeinek felszabadulásának megzavarása, beleértve a gyógyszereket is, súlyos anyagcserezavarokat és testfunkciókat okozhat.
Metabolikus szubsztrátok- élelmiszerből származó kémiai vegyületek. Közülük két csoport különböztethető meg: a fő tápanyagok (szénhidrátok, fehérjék, lipidek) és a kis mennyiségben szállított mellékanyagok (vitaminok, ásványi anyagok).
Szokás különbséget tenni a pótolható és pótolhatatlan tápanyagok között. Az esszenciális tápanyagok azok, amelyeket a szervezet nem képes szintetizálni, ezért táplálékkal kell ellátni őket.
Metabolikus út- ez egy adott anyag kémiai átalakulásának jellege és sorrendje a szervezetben. Az átalakulási folyamat során keletkező köztes termékeket metabolitoknak nevezzük, és az anyagcsereút utolsó vegyülete a végtermék.
A kémiai átalakulások folyamatosan mennek végbe a szervezetben. A szervezet táplálkozása következtében a kiindulási anyagok metabolikus átalakulásokon mennek keresztül; Az anyagcsere végtermékei folyamatosan távoznak a szervezetből. Így a szervezet egy termodinamikailag nyitott kémiai rendszer. Az anyagcsererendszer legegyszerűbb példája egyetlen el nem ágazó anyagcserelánc:




-->a -->b -->c -->d -->
Egy ilyen rendszerben az anyagok állandó áramlásával dinamikus egyensúly jön létre, ha az egyes metabolitok képződésének sebessége megegyezik a fogyasztás sebességével. Ez azt jelenti, hogy az egyes metabolitok koncentrációja állandó marad. A rendszernek ezt az állapotát stacionáriusnak, az ilyen állapotú anyagok koncentrációit pedig stacionárius koncentrációknak nevezzük.
Egy adott pillanatban élő szervezet nem felel meg az álló állapot adott definíciójának. Ha azonban figyelembe vesszük a paramétereinek átlagos értékét viszonylag hosszú időn keresztül, megállapítható azok relatív állandósága, és ezzel indokolt a stacioner rendszer fogalmának alkalmazása az élő szervezetekre. [előadás] .

ábrán. A 64. ábra egy el nem ágazó metabolikus lánc hidrodinamikai modelljét mutatja be. Ebben az eszközben a hengerekben lévő folyadékoszlop magassága az a-d metabolitok koncentrációját, a hengerek közötti összekötő csövek áteresztőképessége pedig a megfelelő enzimreakciók sebességét modellezi.
A rendszerbe állandóan belépő folyadék esetén a folyadékoszlop magassága minden hengerben állandó marad: ez egy álló állapot.
Ha a folyadék bejutásának sebessége növekszik, akkor az összes hengerben a folyadékoszlop magassága és a folyadékáramlás sebessége az egész rendszeren megnövekszik: a rendszer új álló állapotba lépett. Hasonló átmenetek mennek végbe az élő sejt anyagcsere-folyamataiban.
A metabolitkoncentráció szabályozása
Jellemzően egy metabolikus láncban van egy reakció, amely sokkal lassabban megy végbe, mint az összes többi reakció – ez a sebesség korlátozó lépése a folyamatban. Az ábrán egy ilyen fokozatot az első és a második henger közötti keskeny összekötő cső modellez. A sebességkorlátozó szakasz határozza meg a kiindulási anyag metabolikus lánc végtermékévé való átalakulásának teljes sebességét. A sebességkorlátozó reakciót katalizáló enzim gyakran szabályozó enzim: aktivitása sejtes inhibitorok és aktivátorok hatására megváltozhat. Ily módon az anyagcsere-út szabályozása biztosított. ábrán. A 64. ábrán látható, hogy az első és a második henger között egy szeleppel ellátott átmeneti cső egy szabályozó enzimet modellez: a szelep felemelésével vagy leengedésével a rendszer átvihető egy új álló állapotba, eltérő általános folyadékáramlási sebességgel és más folyadékszintekkel a szelepben. hengerek.
Az elágazó metabolikus rendszerekben a szabályozó enzimek általában katalizálják az első reakciókat az elágazás helyén, mint például a b -> c és a b -> i reakciókat az 1. ábrán. 65. Ez biztosítja az anyagcsererendszer egyes ágainak önálló szabályozásának lehetőségét.

Sok metabolikus reakció visszafordítható; áramlásuk irányát élő sejtben a termék későbbi reakcióban történő elfogyasztása vagy a termék reakciószférából való eltávolítása, például kiválasztás határozza meg (65. ábra).
Amikor a szervezet állapota megváltozik (táplálékfelvétel, átmenet a pihenésből a fizikai aktivitásba stb.), megváltozik a metabolitok koncentrációja a szervezetben, azaz új stacionárius állapot jön létre. Azonban azonos körülmények között, például egy éjszakai alvás után (reggeli előtt), ezek megközelítőleg azonosak minden egészséges embernél; A szabályozó mechanizmusok hatására az egyes metabolitok koncentrációja a jellemző szinten marad. Ezeknek a koncentrációknak az átlagos értékei (az ingadozási határokat jelölve) a norma egyik jellemzőjeként szolgálnak. Betegségek esetén a metabolitok egyensúlyi koncentrációja megváltozik, és ezek a változások gyakran egy adott betegségre jellemzőek. A betegségek laboratóriumi diagnózisának számos biokémiai módszere ezen alapul.
Az anyagcsereútnak két iránya van: anabolizmus és katabolizmus (1. ábra).
- Az anabolikus reakciók arra irányulnak, hogy az egyszerűbb anyagokat bonyolultabb anyagokká alakítsák át, amelyek a sejt szerkezeti és funkcionális összetevőit alkotják, mint például koenzimek, hormonok, fehérjék, nukleinsavak stb. Ezek a reakciók túlnyomórészt reduktívak, szabad kémiai energia felhasználásával járnak együtt. (endergonikus reakciók). Az energiaforrás számukra a katabolizmus folyamata. Ezenkívül katabolikus energiát használnak a sejt funkcionális aktivitásának biztosítására (motor és mások).
- A katabolikus átalakulások olyan folyamatok, amelyekben a táplálékkal bevitt és a sejtben lévő összetett molekulák egyszerű komponensekre (szén-dioxid és víz) bomlanak le; ezek a reakciók általában oxidatívak, és szabadenergia felszabadulásával járnak (exergonikus reakciók).
Amfibolikus út(kettős) - olyan út, amely során a katabolikus és az anabolikus átalakulások kombinálódnak, azaz. Az egyik vegyület megsemmisülésével együtt egy másik szintézise is megtörténik.
Az amfibolikus utak az anyagok végső, vagy végső oxidációs rendszeréhez kapcsolódnak, ahol végtermékekké (CO 2 és H 2 O) égnek nagy mennyiségű energia képződésével. Rajtuk kívül az anyagcsere végtermékei a karbamid és a húgysav, amelyek az aminosavak és nukleotidok cseréjének speciális reakcióiban keletkeznek. Az ATP-ADP rendszeren keresztüli metabolizmus és a metabolitok amfibolikus ciklusa közötti kapcsolatot vázlatosan mutatja az 1. ábra. 2.
ATP-ADP rendszer Az ATP-ADP ciklus (ATP-ADP ciklus) egy olyan ciklus, amelyben ATP molekulák folyamatos képződése megy végbe, amelyek hidrolízisenergiáját a szervezet különféle típusú munkák során hasznosítja.
Ez egy olyan anyagcsereút, amelyben az egyik végtermék azonos a folyamatban részt vevő egyik vegyülettel (3. ábra).
Anaplerotikus út- metabolikus, amelynek végterméke azonos bármely ciklikus út egyik köztes termékével. ábra példájában az anaplerotikus út. 3 a ciklust X termékkel tölti fel (anaplerosis - utánpótlás).
Használjuk ezt a példát. A városban X, Y, Z márkájú autóbuszok közlekednek, ezek útvonalát a diagram (4. ábra) mutatja.
A példa alapján a következőket definiáljuk.
- Egy adott anyagcsereútvonal olyan átalakulások összessége, amelyek csak egy adott vegyületre (például szénhidrátokra, lipidekre vagy aminosavakra) jellemzőek.
- Az általános metabolikus útvonal két vagy több típusú vegyületet (például szénhidrátokat és lipideket vagy szénhidrátokat, lipideket és aminosavakat) magában foglaló átalakulások összessége.
A metabolikus útvonalak lokalizációja
Az eukarióta egyedek katabolikus és anabolikus pályái a sejtben való elhelyezkedésükben különböznek (22. táblázat).
Ez az osztódás az enzimrendszerek sejt bizonyos területeire való bezáródásából fakad (kompartmentalizáció), ami biztosítja az intracelluláris funkciók szegregációját és integrációját, valamint a megfelelő kontrollt.
Jelenleg az elektronmikroszkópos és hisztokémiai vizsgálatoknak, valamint a differenciális centrifugálás módszerének köszönhetően jelentős előrelépés történt az enzimek intracelluláris lokalizációjának meghatározásában. ábrából látható. 74, sejtben található sejt, vagy plazma, membrán, sejtmag, mitokondrium, lizoszómák, riboszómák, tubulusok és vezikulák rendszere - endoplazmatikus retikulum, lamellás komplex, különféle vakuolák, intracelluláris zárványok stb. A fő differenciálatlan része a sejt citoplazmája tömegét tekintve hialoplazma (vagy citoszol).
Megállapítást nyert, hogy az RNS-polimerázok, azaz az mRNS képződését katalizáló enzimek a sejtmagban (pontosabban a sejtmagban) lokalizálódnak. A sejtmag a DNS-replikáció folyamatában részt vevő enzimeket és néhányat tartalmaz (23. táblázat).

| 23. táblázat: Egyes enzimek lokalizációja a sejten belül | |
| Citoszol | Glikolitikus enzimek Pentóz útvonal enzimek Aminosav aktiváló enzimek Zsírsav szintézis enzimek Foszforiláz Glikogén szintáz |
| Mitokondriumok | Piruvát-dehidrogenáz komplex Krebs-ciklus enzimek A zsírsav-oxidációs ciklus enzimei A biológiai oxidáció és az oxidatív foszforiláció enzimei |
| Lizoszómák | Savas hidrolázok |
| Mikroszomális frakció | A fehérjeszintézis riboszómális enzimei Enzimek foszfolipidek, trigliceridek szintéziséhez, valamint számos, a koleszterin szintézisében részt vevő enzim Hidroxilázok |
| Plazma membrán | Adenilát-cikláz, Na+-K+-függő ATPáz |
| Mag | A DNS-replikáció folyamatában részt vevő enzimek RNS polimeráz NAD szintetáz |
Az enzimek és a sejtszerkezetek kapcsolata:
- Mitokondriumok. A biológiai oxidáció (szöveti légzés) és az oxidatív foszforiláció láncának enzimei, valamint a piruvát-dehidrogenáz komplex, a trikarbonsavciklus, a karbamid szintézis, a zsírsavoxidáció stb. enzimei kapcsolódnak a mitokondriumokhoz.
- Lizoszómák. A lizoszómák főleg hidrolitikus enzimeket tartalmaznak, amelyek optimális pH-értéke 5 körüli. Az enzimek hidrolitikus természete miatt ezeket a részecskéket lizoszómáknak nevezik.
- Riboszómák. A fehérjeszintézis enzimei a riboszómákban lokalizálódnak, ezekben a részecskékben az mRNS transzlálódik, és az aminosavak polipeptid láncokba kapcsolódnak, fehérjemolekulákat képezve.
- Endoplazmatikus retikulum. Az endoplazmatikus retikulum a lipidszintézishez szükséges enzimeket, valamint a hidroxilezési reakciókban részt vevő enzimeket tartalmaz.
- Plazma membrán. A Na + és K + -ot szállító ATPáz, az adenilát-cikláz és számos más enzim elsősorban a plazmamembránhoz kapcsolódik.
- Citoszol. A citoszol (hialoplazma) tartalmazza a glikolízis enzimeit, a pentóz ciklust, a zsírsavak és mononukleotidok szintézisét, az aminosavak aktiválását, valamint számos glükoneogenezis enzimet.
táblázatban A 23. ábra összefoglalja a legfontosabb enzimek lokalizációját és az egyes metabolikus szakaszokat a különböző szubcelluláris struktúrákban.
A multienzimes rendszerek az organellumok szerkezetében úgy lokalizálódnak, hogy minden enzim egy adott reakciósorozatban a következő enzim közvetlen közelében helyezkedik el. Emiatt a reakció közbenső termékek diffúziójához szükséges idő lecsökken, és a teljes reakciósor időben és térben szigorúan összehangolt. Ez igaz például a piroszőlősav és a zsírsavak oxidációjában, a fehérjeszintézisben részt vevő enzimekre, valamint az elektrontranszfer és az oxidatív foszforiláció enzimeire.
A kompartmentalizáció azt is biztosítja, hogy kémiailag inkompatibilis reakciók egy időben menjenek végbe, pl. a katabolizmus és az anabolizmus útjainak függetlensége. Így egy sejtben egyszerre mehet végbe a hosszú szénláncú zsírsavak acetil-CoA-stádiumba történő oxidációja és ezzel ellentétes folyamat, a zsírsavak szintézise az acetil-CoA-ból. Ezek a kémiailag inkompatibilis folyamatok a sejt különböző részein mennek végbe: a zsírsavak oxidációja a mitokondriumokban, illetve szintézise a mitokondriumokon kívül a hialoplazmában. Ha ezek az utak egybeesnének és csak a folyamat irányában térnének el, akkor a cserében úgynevezett haszontalan, vagy hiábavaló ciklusok keletkeznének. Az ilyen ciklusok patológiában fordulnak elő, amikor a metabolitok haszontalan keringése lehetséges.
A növények, állatok és mikroorganizmusok különböző osztályaiban az anyagcsere egyéni kapcsolatainak feltárása az élő természetben végbemenő biokémiai átalakulások útjainak alapvető közös vonásait tárja fel.
AZ ANYAGCSERE SZABÁLYOZÁSÁNAK ALAPVETŐ RENDELKEZÉSEI
Az anyagcsere szabályozása celluláris és szubcelluláris szinten történik
- az enzimek szintézisének és katalitikus aktivitásának szabályozásával.
Ilyen szabályozási mechanizmusok közé tartozik
- az enzimszintézis elnyomása az anyagcsereút végtermékei által,
- egy vagy több enzim szintézisének indukálása szubsztrátokkal,
- a már meglévő enzimmolekulák aktivitásának modulálása,
- a metabolitok sejtbe jutásának sebességének szabályozása. Itt a vezető szerepet a protoplazmát körülvevő biológiai membránok és a benne található sejtmag, mitokondriumok, lizoszómák és egyéb szubcelluláris organellumok játsszák.
- a hormonok szintézisének és aktivitásának szabályozásával. Így a fehérje-anyagcserét a pajzsmirigyhormon - tiroxin, a zsíranyagcserét a hasnyálmirigy és a pajzsmirigy, a mellékvese és az agyalapi mirigy hormonjai, a szénhidrát-anyagcserét a hasnyálmirigy hormonjai (inzulin) és a mellékvese hormonjai befolyásolják ( adrenalin). A hormonok hatásmechanizmusában különleges szerepet töltenek be a ciklikus nukleotidok (cAMP és cGMP).
Állatokban és emberekben az anyagcsere hormonális szabályozása szorosan összefügg az idegrendszer koordináló tevékenységével. Az idegrendszer szénhidrát-anyagcserére gyakorolt hatására példa Claude Bernard úgynevezett cukorinjekciója, amely hiperglikémiához és glikozuriához vezet.
- A metabolikus integráció folyamataiban a legfontosabb szerep az agykéregé. Ahogy I. P. Pavlov rámutatott: „Minél tökéletesebb egy állati szervezet idegrendszere, minél centralizáltabb, annál magasabb rendű osztálya egyre inkább irányítja és elosztja a szervezet összes tevékenységét... Ez a magasabb osztály tartalmazza joghatósága alá tartozik a testben előforduló összes jelenség”.
Így a metabolikus reakciók speciális kombinációja, szigorú koordinációja és sebessége együtt alkot egy rendszert, amely felfedi egy visszacsatolási mechanizmus (pozitív vagy negatív) tulajdonságait.

A KÖZÉPES ANYAGCSERE TANULMÁNYOZÁSÁNAK MÓDSZEREI
Az anyagcsere tanulmányozására két megközelítést alkalmaznak:
- az egész szervezeten végzett vizsgálatok (in vivo kísérletek) [előadás]
Az egész szervezet kutatásának klasszikus példája, amelyet e század elején végeztek, a Knoop-kísérletek. Tanulmányozta, hogyan bomlanak le a zsírsavak a szervezetben. Ennek érdekében Knoop különféle páros (I) és páratlan (II) szénatomszámú zsírsavakkal etette a kutyákat, amelyekben a metilcsoportban egy hidrogénatomot C6H5 fenilcsoport helyettesített:
Az első esetben a fenil-ecetsav C 6 H 5 -CH 2 -COOH mindig a kutyák vizeletébe ürült, a második esetben pedig a benzoesav C 6 H 5 -COOH. Ezen eredmények alapján Knoop arra a következtetésre jutott, hogy a zsírsavak lebontása a szervezetben a karboxilvégtől kezdve a két szénből álló fragmensek egymás utáni eliminációján keresztül megy végbe:
CH3-CH2-|-CH2-CH2-|-CH2-CH2-|-CH2-CH2-|-CH2-COOH
Ezt a következtetést később más módszerekkel is megerősítették.
Ezekben a vizsgálatokban Knoop lényegében a molekulák jelölésének módszerét használta: egy olyan fenilgyököt használt, amely nem változik a szervezetben. A XX. század 40-es éveitől kezdve. Széles körben elterjedt az olyan anyagok alkalmazása, amelyek molekulái radioaktív vagy nehéz elemek izotópjait tartalmazzák. Például a kísérleti állatok különböző radioaktív szenet (14 C) tartalmazó vegyületek etetésével megállapították, hogy a koleszterinmolekula összes szénatomja az acetát szénatomjaiból származik:

Jellemzően vagy olyan elemek stabil izotópjait használják, amelyek tömegükben különböznek a testben általánosan előforduló elemektől (általában nehéz izotópok), vagy radioaktív izotópokat. A stabil izotópok közül a leggyakrabban használt izotópok a hidrogén tömege 2 (deutérium, 2 H), a nitrogén tömege 15 (15 N), a szén tömege 13 (13 C) és az oxigén tömege 18 (18 C). A radioaktív izotópok közül a hidrogén (trícium, 3 H), foszfor (32 P és 33 P), szén (14 C), kén (35 S), jód (131 I), vas (59 Fe), nátrium izotópjai (54 Na) használják ) stb.
A vizsgált vegyület egy molekulájának stabil vagy radioaktív izotóppal történő megjelölése és a szervezetbe juttatása után meghatározzák az azokat tartalmazó jelölt atomokat vagy kémiai csoportokat, és miután bizonyos vegyületekben felfedezték őket, következtetést vonnak le a behatolás módjairól. amely a jelzett anyag átalakul a szervezetben. Az izotópjelölés segítségével meghatározható egy anyag szervezetben való tartózkodási ideje is, amely bizonyos közelítéssel a biológiai felezési időt jellemzi, vagyis azt az időt, amely alatt egy izotóp vagy jelölt vegyület mennyisége felére csökken, vagy pontos információt szerezni az egyes sejtek membránjainak permeabilitásával kapcsolatban. Az izotópokat arra is használják, hogy meghatározzák, hogy egy adott anyag egy másik vegyület prekurzora vagy bomlásterméke-e, és meghatározzák a szövetek forgalmának sebességét. Végül, ha több anyagcsereút is létezik, meg lehet határozni, hogy melyik a domináns.
Az egész organizmusokon végzett vizsgálatok során a szervezet táplálkozási igényeit is vizsgálják: ha egy anyag étrendből való kiiktatása a növekedés és fejlődés vagy a szervezet élettani funkcióinak megzavarásához vezet, akkor ez az anyag alapvető táplálkozási tényező. Hasonló módon határozzuk meg a szükséges tápanyagmennyiséget.
- valamint izolált testrészeken végzett vizsgálatok - analitikai-dezintegráló módszerek (in vitro kísérletek, azaz testen kívül, kémcsőben vagy más laboratóriumi edényben). Ezeknek a módszereknek az elve egy összetett biológiai rendszer fokozatos leegyszerűsítése, vagy inkább felbomlasztása az egyes folyamatok elkülönítése érdekében. Ha ezeket a módszereket csökkenő sorrendben, azaz a bonyolultabbtól az egyszerűbb rendszer felé tekintjük, akkor a következő sorrendbe rendezhetők:
- az egyes szervek eltávolítása [előadás]
Amikor szerveket távolítanak el, két vizsgálat tárgya van: egy szervezet eltávolított szerv nélkül és egy izolált szerv.
Elszigetelt szervek. Ha egy anyag oldatát injektálják egy izolált szerv artériájába, és az anyagokat a vénából kiáramló folyadékban elemzik, akkor megállapítható, hogy ez az anyag milyen átalakuláson megy keresztül a szervben. Így például azt találták, hogy a máj a ketontestek és a karbamid képződésének fő helye.
Hasonló kísérletek végezhetők szerveken anélkül, hogy azokat a testből izolálnák (arteriovenosus differencia módszer): ezekben az esetekben a szerv artériájába és vénájába helyezett kanülök segítségével, vagy fecskendővel vesznek vért analízishez. Így például megállapítható, hogy a dolgozó izmokból kiáramló vérben megnő a tejsav koncentrációja, a májon átáramolva pedig a vér tejsavmentesül.
- szövetmetszeti módszer [előadás]
A metszetek vékony szövetdarabok, amelyeket mikrotommal vagy egyszerűen borotvapengével készítenek. A metszeteket tápanyagokat (glükózt vagy másokat) és olyan anyagot tartalmazó oldatban inkubálják, amelynek az adott típusú sejtekben való átalakulását kívánják meghatározni. Az inkubálás után elemzik a vizsgált anyag inkubációs folyadékban lévő anyagcseretermékeit.
A szövetmetszetek módszerét először Warburg javasolta a 20-as évek elején. Ezzel a technikával lehetőség nyílik a szöveti légzés (oxigénfogyasztás és a szövetek szén-dioxid-felszabadulása) vizsgálatára. A szövetmetszetek alkalmazása esetén az anyagcsere vizsgálatában jelentős korlátot jelentenek a sejtmembránok, amelyek gyakran gátat képeznek a sejt tartalma és a „tápanyag” oldat között.
- homogenátumok és szubcelluláris frakciók [előadás]

A homogenátok sejtmentes készítmények. Ezeket a sejtmembránok elpusztításával nyerik szövet homokkal való dörzsölésével vagy speciális eszközökben - homogenizátorokban (66. ábra). A homogenizátumokban nincs átjárhatósági gát a hozzáadott szubsztrátok és az enzimek között.
A sejtmembránok elpusztítása lehetővé teszi a közvetlen érintkezést a sejttartalom és a hozzáadott vegyületek között. Ez lehetővé teszi annak megállapítását, hogy mely enzimek, koenzimek és szubsztrátok fontosak a vizsgált folyamat szempontjából.
A homogenizátumok frakcionálása. A homogenizátumból szubcelluláris részecskék izolálhatók, mind szupramolekuláris (sejtszervecskék), mind egyedi vegyületek (enzimek és egyéb fehérjék, nukleinsavak, metabolitok). Például differenciális centrifugálással megkaphatja a magok, mitokondriumok és mikroszómák frakcióit (a mikroszómák az endoplazmatikus retikulum töredékei). Ezeknek az organellumoknak a mérete és sűrűsége változó, ezért különböző centrifugálási sebességgel ülepednek. Az izolált organellumok használata lehetővé teszi a velük kapcsolatos anyagcsere-folyamatok tanulmányozását. Például izolált riboszómákat használnak a fehérjeszintézis útjainak és mechanizmusainak, a mitokondriumok pedig a Krebs-ciklus vagy a légző enzimek láncának oxidatív reakcióinak tanulmányozására.
A mikroszómák ülepedése után a sejt oldható komponensei a felülúszóban maradnak - oldható fehérjék, metabolitok. Ezen frakciók mindegyike különböző módszerekkel tovább frakcionálható, elkülönítve az alkotó komponenseiket. Az izolált komponensekből lehet rekonstruálni biokémiai rendszereket, például egyszerű „enzim + szubsztrát” rendszert és olyan összetetteket, mint a fehérjék és nukleinsavak szintézisére szolgáló rendszerek.
- enzimrendszer részleges vagy teljes rekonstrukciója in vitro enzimek, koenzimek és egyéb reakciókomponensek felhasználásával [előadás]
Nagy tisztaságú enzimek és koenzimek integrálására szolgál. Például ezzel a módszerrel lehetővé vált egy olyan fermentációs rendszer teljes reprodukálása, amely rendelkezik az élesztő fermentáció minden lényeges tulajdonságával.
- az egyes szervek eltávolítása [előadás]
Természetesen ezek a módszerek csak a végső cél eléréséhez - az egész szervezet működésének megértéséhez - szükséges lépésként értékesek.
AZ EMBERI BIOKÉMIA TANULÁSÁNAK JELLEMZŐI
A Földön élő különböző organizmusok molekuláris folyamataiban messzemenő hasonlóságok vannak. Az olyan alapvető folyamatok, mint a mátrix bioszintézis, az energiaátalakítás mechanizmusai és az anyagok metabolikus átalakulásának fő útvonalai, megközelítőleg azonosak az organizmusokban a baktériumoktól a magasabb rendű állatokig. Ezért az E. coli-val végzett vizsgálatok számos eredménye emberre is alkalmazható. Minél nagyobb a fajok filogenetikai rokonsága, annál gyakoribbak molekuláris folyamataik.
Az emberi biokémiával kapcsolatos ismeretek túlnyomó többségét így szerzik meg: más állatokban előforduló ismert biokémiai folyamatok alapján hipotézist állítanak fel a folyamat legvalószínűbb változatáról az emberi szervezetben, majd a hipotézist direkt vizsgálatokkal tesztelik. emberi sejtek és szövetek. Ez a megközelítés lehetővé teszi az emberektől származó, kis mennyiségű biológiai anyag kutatását. A leggyakrabban használt szövetek a sebészeti beavatkozások során eltávolított szövetek, a vérsejtek (eritrociták és leukociták), valamint az in vitro tenyészetben növesztett emberi szövetsejtek.
Az örökletes emberi betegségek tanulmányozása, amely szükséges a hatékony kezelési módszerek kidolgozásához, egyidejűleg sok információt szolgáltat az emberi szervezetben zajló biokémiai folyamatokról. Különösen az enzim veleszületett hibája okozza a szubsztrát felhalmozódását a szervezetben; az ilyen anyagcserezavarok tanulmányozása során néha új, mennyiségileg jelentéktelen enzimeket és reakciókat fedeznek fel (ezért nem vették észre a norma tanulmányozása során), amelyek azonban életbevágó jelentőséggel bírnak.
Moduláris egység 1 ENZIMEK MINT FEHÉRJES KATALIZÁTOROK
Tanulási célok Legyen képes:
1. Ismertesse az enzimek tulajdonságait és az enzimatikus katalízis jellemzőit fehérjetermészetük alapján!
2. Értékelje a vitaminok szerepét az emberi táplálkozásban, mint a koenzimek szintézisének szubsztrátjait.
3. Határozza meg, hogy az enzimek nómenklatúrájuk alapján egy bizonyos osztályba és alosztályba tartoznak-e!
4. Számítsa ki az enzimaktivitást, és értékelje az enzim affinitását a szubsztráthoz.
Tud:
1. Az enzimek, mint fehérjekatalizátorok szerkezeti jellemzői.
2. Az enzimspecifitás típusai.
3. Az enzimek osztályozásának alapjai, enzimosztályok, példák az enzimek által katalizált reakciókra.
4. A koenzimek és kofaktorok szerkezete és szerepük az enzimatikus katalízisben, a vitaminok szerepe ebben a folyamatban.
5. Az enzimatikus kinetika alapjai.
6. Az enzimaktivitás mértékegységei és meghatározásuk módszerei.
TÉMAKÖR 2.1. AZ ENZIM MINT FEHÉRJE TULAJDONSÁGAI
KATALIZÁTOR
1. Az enzimek fehérje katalizátorok a kémiai reakciók felgyorsítása az élő sejtekben. Rendelkeznek a fehérjékre jellemző összes tulajdonsággal és bizonyos szerkezeti jellemzőkkel, amelyek meghatározzák katalitikus tulajdonságaikat. Az enzimek emellett betartják a katalízis általános törvényeit, és a nem biológiai katalizátorokra jellemző tulajdonságokkal rendelkeznek: felgyorsítják az energetikailag lehetséges reakciókat, állandóan tartják a kémiai rendszer energiáját, és a reakciófolyamat során nem fogyasztanak el.
2. Az enzimeket a következők jellemzik:
sajátosság. Egy enzim biológiai funkcióját, mint minden fehérjét, az határozza meg, hogy szerkezetében egy aktív centrum jelen van, amellyel egy adott ligandum kölcsönhatásba lép. Az enzim aktív helyével kölcsönhatásba lépő ligandumot ún szubsztrát.
katalitikus hatékonyság. A legtöbb enzimkatalizált reakció rendkívül hatékony, 10 8-10 14-szer gyorsabban megy végbe, mint a nem katalizált reakciók. Minden egyes enzimmolekula másodpercenként 100-1000 szubsztrát molekulát képes termékké alakítani.
konformációs labilitás. Egy enzim katalitikus hatékonysága, mint minden fehérjemolekula, a konformációjától, és különösen az aktív centrum konformációjától függ. A sejtekben vannak olyan anyagok, amelyek egyesek felszakadása, más gyenge kötések kialakulása miatt kisebb változásokat okozhatnak az enzimmolekula konformációjában; ez az enzimaktivitás növekedését vagy csökkenését okozhatja.
3. Az enzimaktivitás szabályozható. Az enzimek működése a sejtben általában szigorúan meghatározott: az egyik enzimreakció terméke egy másik enzimreakció szubsztrátja; így kialakítva anyagcsere utak. Szinte minden anyagcsereút számos enzimje között van kulcsfontosságú, ill szabályozó, enzimek, amelyek aktivitása változhat attól függően, hogy a sejtnek szüksége van az anyagcsereút végtermékére.
4. Az enzimreakciók optimális feltételei: hőmérséklet 37-38 °C; normál légköri nyomás, pH 6,9-7,7, jellemző a legtöbb szövetre. Ezzel szemben a hatékony kémiai katalízis gyakran magas hőmérsékletet és nyomást, valamint szélsőséges pH-értéket igényel.
TÉMAKÖR 2.2. AKTÍV KÖZPONT: AZ ENZIM MŰKÖDÉS SPECIFIKUSSÁGA
1. Az enzimek aktív helye- ez a fehérjemolekula egy bizonyos szakasza, amely komplementer módon képes kötődni a szubsztráthoz és biztosítani annak katalitikus átalakulását. Az aktív centrum szerkezetét az aminosav gyökök alkotják, akárcsak bármely fehérje aktív centrumát. Az enzim aktív centruma aminosav-maradékokat tartalmaz, amelyek funkciós csoportjai biztosítják a szubsztrát komplementer kötődését (kötőhely), valamint aminosav-maradékokat, amelyek funkciós csoportjai a szubsztrát kémiai átalakulását végzik (katalitikus hely) ( 2.1. ábra).
Rizs. 2.1. Az enzim aktív centrumának szerkezeti vázlata.
Az enzim aktív centrumát alkotó aminosavak pirossal vannak jelölve: 1 - kötőhely; 2 - katalitikus rész
2. Specificitás- az enzimek legfontosabb tulajdonsága, amely meghatározza az enzimek biológiai jelentőségét. Megkülönböztetni szubsztrátÉs az enzim katalitikus specifitása, amelyeket az aktív központ szerkezete határoz meg.
3. Alatt szubsztrátspecifitás A kifejezés az egyes enzimek azon képességére utal, hogy csak egy vagy több specifikus szubsztráttal lépnek kölcsönhatásba.
Vannak:
- abszolút szubsztrátspecifitás, ha az enzim aktív helye csak egy szubsztráttal komplementer;
- csoport szubsztrát specifitás, ha az enzim azonos típusú reakciót katalizál kis mennyiségű (csoport) szerkezetileg hasonló szubsztráttal;
- sztereospecifitás, ha az enzim csak a szubsztrát létező sztereoizomerjei közül mutat abszolút specifitást.
4. Katalitikus specifitás vagy a szubsztrát konverziós út specifitása, biztosítja ugyanazon szubsztrát átalakulását különböző enzimek hatására. Ezt a megfelelő enzimek aktív centrumainak katalitikus helyeinek szerkezete biztosítja. Például egy molekula
Az emberi májsejtekben található glükóz-6-foszfát négy különböző enzim szubsztrátja: foszfoglükomutáz, glükóz-6-foszfát-foszfatáz, foszfoglükoizomeráz és glükóz-6-foszfát-dehidrogenáz. Azonban ezen enzimek katalitikus helyeinek szerkezeti sajátosságaiból adódóan a glükóz-6-foszfát különböző átalakulásai mennek végbe négy különböző termék képződésével (2.2. ábra).
 Rizs. 2.2. A glükóz-6-foszfát átalakításának katalitikus útvonalai.
Rizs. 2.2. A glükóz-6-foszfát átalakításának katalitikus útvonalai.
A szubsztrát konverziós útvonal specifitása lehetővé teszi ugyanazon szubsztrát transzformációját különböző enzimek hatására. A glükóz-6-foszfát molekula különböző enzimek szubsztrátja, ami különböző termékek képződéséhez vezet
TÉMAKÖR 2.3. AZ ENZIM HATÁSMECHANIZMUS
1. A katalízis során a szubsztrát, amely az enzim aktív helyéhez kötődik egy enzim-szubsztrát (ES) komplexben, kémiai átalakuláson megy keresztül termékké, amely ezután felszabadul. A katalízis folyamata vázlatosan a következőképpen ábrázolható:
Az enzimatikus katalízis folyamata szakaszokra osztható (2.3. ábra). Az I. stádiumban a szubsztrát az enzim aktív centrumának régiójában közeledik és orientálódik. Ennek eredményeként a II indukált levelezést[a szubsztrát (S) és az enzim aktív centrumának konformációjának változása] enzim-szubsztrát komplex (ES) keletkezik. A III. szakaszban a szubsztrátban lévő kötések destabilizálódnak, és instabil enzim-termék komplex (EP) képződik. A IV. szakaszban a komplex (EP) szétesik a reakciótermékek aktív helyről való felszabadulásával és az enzim felszabadulásával.
2. A kémiai reakció energiájának megértéséhez figyelembe kell venni a szubsztrátok és reakciótermékek energiájának változását, valamint az enzimek szerepét ebben a folyamatban. Ismeretes, hogy a reakció végbemeneteléhez a szubsztrátumoknak akkora többletenergiát kell kapniuk (ezt aktiválási energiának nevezzük E a), amely szükséges ahhoz, hogy a szubsztrát molekulák beléphessenek a reakcióba (2.4. ábra). Enzimatikus reakció esetén az aktiválási energia csökken, ami hatékonyabb reakciót biztosít.
 Rizs. 2.3. Az enzimatikus katalízis szakaszai:
Rizs. 2.3. Az enzimatikus katalízis szakaszai:
I - megközelítési szakasz és a szubsztrát orientációja az enzim aktív központjában; II - enzim-szubsztrát komplex képződése (Eb); III - instabil enzim-termék komplex (EP) képződése; IV - reakciótermékek felszabadulása az enzim aktív központjából
 Rizs. 2.4. A szabad energia változása egy kémiai reakció során, amelyet nem katalizálnak és enzimek katalizálnak.
Rizs. 2.4. A szabad energia változása egy kémiai reakció során, amelyet nem katalizálnak és enzimek katalizálnak.
Az enzim csökkenti az E a aktiválási energiát, azaz. csökkenti az energiagát magasságát; ennek következtében nő a reaktív molekulák aránya és nő a reakció sebessége
TÉMAKÖR 2.4. KOFAKTOROK ÉS KOENZIMEK
A legtöbb enzimhez bizonyos nem fehérje anyagok – kofaktorok – jelenléte szükséges a katalitikus aktivitás kifejtéséhez. A kofaktoroknak két csoportja van: fémionok és koenzimek.
1. A fémionok különféle módokon vesznek részt az enzim működésében.
Megváltoztatja a szubsztrát molekula konformációját, amely biztosítja a kiegészítő interakciót az aktív központtal. Például a Mg2+-ATP komplex szubsztrátként működik.
Adja meg az enzim aktív centrumának natív konformációját. Ionok
A Mg 2 +, Mn 2 +, Zn 2 +, Co 2 +, Mo 2 + részt vesznek az enzimek aktív centrumának stabilizálásában és hozzájárulnak a koenzim hozzáadásához.
Stabilizálják az enzimfehérje molekula konformációját. Például cinkionokra van szükség az alkohol-dehidrogenáz enzim kvaterner szerkezetének stabilizálásához, amely katalizálja az etanol oxidációját.
Közvetlenül részt vesz az enzimatikus katalízisben. A Zn 2 +, Fe 2 +, Mn 2 +, Cu 2 + ionok részt vesznek az elektrofil katalízisben. Az elektronátvitelben a változó vegyértékű fémionok is részt vehetnek. Például a citokrómokban (hem-tartalmú fehérjékben) a vasion egy elektron megkötésére és adományozására képes. Ennek a tulajdonságának köszönhetően a citokrómok részt vesznek a redox reakciókban:
 2. Koenzimek szerves anyagok, leggyakrabban vitaminszármazékok, amelyek közvetlenül részt vesznek az enzimatikus katalízisben, mivel az enzimek aktív központjában helyezkednek el. A koenzimet tartalmazó és enzimatikus aktivitású enzimet ún holoenzim. Az ilyen enzim fehérje részét ún apoenzim, amelynek koenzim hiányában nincs katalitikus aktivitása.
2. Koenzimek szerves anyagok, leggyakrabban vitaminszármazékok, amelyek közvetlenül részt vesznek az enzimatikus katalízisben, mivel az enzimek aktív központjában helyezkednek el. A koenzimet tartalmazó és enzimatikus aktivitású enzimet ún holoenzim. Az ilyen enzim fehérje részét ún apoenzim, amelynek koenzim hiányában nincs katalitikus aktivitása.
 A koenzim csak a reakció időpontjában kötődhet az enzim fehérje részéhez, vagy erős kovalens kötésekkel kapcsolódhat az apoenzimmel. Ez utóbbi esetben az ún protézis csoport. A leggyakoribb koenzimekre - vitaminszármazékokra, valamint enzimatikus folyamatokban való részvételükre - a táblázatban talál példákat. 2.1.
A koenzim csak a reakció időpontjában kötődhet az enzim fehérje részéhez, vagy erős kovalens kötésekkel kapcsolódhat az apoenzimmel. Ez utóbbi esetben az ún protézis csoport. A leggyakoribb koenzimekre - vitaminszármazékokra, valamint enzimatikus folyamatokban való részvételükre - a táblázatban talál példákat. 2.1.
asztal 2.1. A főbb koenzimek szerkezete és működése
 A táblázat vége. 2.1.
A táblázat vége. 2.1.
 TÉMAKÖR 2.5. OSZTÁLYOZÁS ÉS NÓMENKLATÚRA
TÉMAKÖR 2.5. OSZTÁLYOZÁS ÉS NÓMENKLATÚRA
ENZIMEK
1. A legtöbb enzim neve tartalmazza az "áz" utótagot, amely a reakció szubsztrátjának nevéhez (például: ureáz, szacharáz, lipáz, nukleáz) vagy egy adott szubsztrát kémiai átalakulásának nevéhez (például: laktát) kapcsolódik. dehidrogenáz, adenilát-cikláz, foszfoglükomutáz, piruvát-karboxiláz). Azonban számos triviális, történelmileg rögzített enzimnév maradt használatban, amelyek nem adnak információt a szubsztrátról vagy a kémiai átalakulás típusáról (például tripszin, pepszin, renin, trombin stb.).
2. A természetben található enzimek rendszerezése érdekében a Biokémiai és Molekuláris Biológiai Nemzetközi Unió (IUBMB) 1961-ben kidolgozott egy nómenklatúrát, amely szerint az összes enzimet hat fő osztályba sorolják, attól függően, hogy milyen kémiai reakciót katalizálnak. Mindegyik osztály számos alosztályból és alosztályból áll, az átalakítandó szubsztrát kémiai csoportjától, az átalakított csoportok donorától és akceptorától, további molekulák jelenlététől stb. Mind a hat osztálynak megvan a maga sorszáma, szigorúan hozzárendelve: 1. osztály - oxidoreduktázok; 2. osztály - transzferázok; 3. osztály - hidrolázok; 4. osztály - liázok; 5. osztály - izomerázok; 6. osztály - ligázok
Ez az osztályozás az enzim pontos azonosításához szükséges: minden enzimhez tartozik kódszám. Például a maldehidrogenáz enzim szisztematikus neve L-malát: NAD oxidoreduktáz, kódszáma pedig 1.1.1.38. Az első számjegy az enzimosztály számát jelöli (ebben az esetben az 1-es szám azt jelzi, hogy az enzim az oxidoreduktázok osztályába tartozik); a második számjegy a katalizált reakció típusát jelzi (ebben a példában a hidroxilcsoport oxidált); a harmadik számjegy egy koenzim (jelen esetben a NAD+ koenzim) jelenlétét jelenti, az utolsó számjegy az enzim sorozatszáma ebben az alcsoportban.
3. Az enzimek főbb osztályainak jellemzői az általuk katalizált reakciók példáival.
1. Oxidoreduktázok különböző redox reakciókat katalizálnak. Az osztály alosztályokra oszlik:
A) dehidrogenázok katalizálja a dehidrogénezési reakciókat (a hidrogén eliminációja az elektronok átvitelével a dehidrogénezett szubsztrátról egy másik akceptorra). Elektronakceptorként a NAD+, NADP+, FAD, FMN koenzimeket használják. Ebbe az alosztályba tartoznak a malát-dehidrogenáz (2.5. ábra), izocitrát-dehidrogenáz, szukcinát-dehidrogenáz, α-ketobutirát-dehidrogenáz stb. enzimek;
 Rizs. 2.5. Malát dehidrogénezési reakció
Rizs. 2.5. Malát dehidrogénezési reakció
b) oxidázok- oxidációs reakciókat katalizálni molekuláris oxigén részvételével (2.6. ábra);
Rizs. 2.6. A reakciót a citokróm-oxidáz enzim katalizálja
V) oxigénázok(hidroxilázok) az oxidációs reakciókat katalizálják azáltal, hogy oxigénatomot építenek be a szubsztrát molekula hidroxilcsoportjába. A reakció molekuláris oxigén részvételével megy végbe, melynek egyik atomja a szubsztráthoz kapcsolódik, a másik pedig egy vízmolekula képződésében vesz részt (2.7. ábra).
 Rizs. 2.7. A fenilalanin hidroxilezési reakciója.
Rizs. 2.7. A fenilalanin hidroxilezési reakciója.
Reakció koenzimek: tetrahidrobiopterin (H 4 BP) és dihidrobiopterin (H 2 BP)
2. Transzferázok- katalizálja a funkciós csoportok átviteli reakcióit. Az átvitt csoporttól függően alosztályokra oszthatók: aminotranszferázok (2.8. ábra), aciltranszferázok, metiltranszferázok, glikoziltranszferázok, kinázok (foszfotranszferázok) (2.9. ábra).
 Rizs. 2.8. Az ALT (alanin-a-ketoglutarát aminotranszferáz) enzim által katalizált reakció, amely a transzferázok osztályába, az aminotranszferázok alosztályába tartozik.
Rizs. 2.8. Az ALT (alanin-a-ketoglutarát aminotranszferáz) enzim által katalizált reakció, amely a transzferázok osztályába, az aminotranszferázok alosztályába tartozik.
PF - koenzim piridoxál-foszfát
Rizs. 2.9. A protein-kináz enzim által katalizált reakció, amely a transzferázok osztályába, a foszfotranszferázok alosztályába tartozik.
Az ATP a foszforsav-maradék donorja
3. Hidrolázok katalizálja a hidrolízis reakciókat (kovalens kötés hasítása vízmolekula hozzáadásával a szakadás helyén). A szubsztrátumtól függően alosztályokra vannak osztva. A nevek a szubsztrát molekulától vagy a hidrolizálandó kémiai kötéstől függően alakulnak ki: proteáz, amiláz, glikozidáz, nukleáz, észteráz, foszfatáz stb. 2.10.
Rizs. 2.10. Fehérje molekula hidrolízis reakciója
4. Liázok- a liázok közé tartoznak azok az enzimek, amelyek nem hidrolitikus módon hasítanak le bizonyos csoportokat a szubsztrátokról, mint például a CO 2, H 2 O, NH 2 SH 2 stb., vagy kettős kötéssel kapcsolódnak hozzá (például vízmolekulához). A dekarboxilezési reakciót (a CO 2 molekula eliminációját) az ábra mutatja. 2.11. ábrán látható a vízmolekula hozzáadásának reakciója (hidratáz reakció). 2.12.
 Rizs. 2.11. Dekarboxilezési reakció (egy CO 2 molekula eliminációja)
Rizs. 2.11. Dekarboxilezési reakció (egy CO 2 molekula eliminációja)
PF koenzim piridoxál-foszfát
 Rizs. 2.12. Vízmolekula fumaráthoz való hozzáadásának reakciója
Rizs. 2.12. Vízmolekula fumaráthoz való hozzáadásának reakciója
5. Izomerázok különböző intramolekuláris átalakulásokat katalizálják (2.13. ábra).
 Rizs. 2.13. A reakciót a foszfoglükoizomeráz enzim katalizálja
Rizs. 2.13. A reakciót a foszfoglükoizomeráz enzim katalizálja
6. Ligázok(szintetázok) olyan reakciókat katalizálnak, amelyek bonyolítanak egy molekulát azáltal, hogy két molekulát egymáshoz kapcsolnak kovalens kötés kialakítása céljából; ebben az esetben az ATP vagy más nagy energiájú vegyületek energiáját használjuk fel (2.14. ábra).
 Rizs. 2.14. A reakciót a glutamin-szintetáz enzim katalizálja
Rizs. 2.14. A reakciót a glutamin-szintetáz enzim katalizálja
TÉMAKÖR 2.6. AZ ENZIMATÍV KINETIKA ALAPJAI
KATALÍZIS
1. Az enzimatikus reakciók kinetikája az enzimológia egyik ága, amely az enzimek által katalizált kémiai reakciók sebességének a reagáló anyagok kémiai természetétől és a környezeti tényezőktől való függését vizsgálja.
Az enzimek katalitikus aktivitásának mérésére olyan mutatókat használnak, mint a reakciósebesség vagy az enzimaktivitás. Az enzim reakciósebessége a szubsztrát molekulák számának csökkenése vagy a termékmolekulák egységnyi idő alatti számának növekedése határozza meg. Az enzimatikus reakció sebessége az enzim katalitikus aktivitásának mértéke, és jelölése enzimaktivitás.
A gyakorlatban az enzim aktivitásának jellemzésére hagyományos értékeket használnak: 1 nemzetközi aktivitási egység (NE) annak az enzimmennyiségnek felel meg, amely optimális körülmények között (37°-os hőmérsékleten) 1 µmol szubsztrát 1 perc alatt történő átalakulását katalizálja. C, az oldat optimális pH-értéke) az enzimes reakcióhoz
reakciók. Ezeket az aktivitási egységeket használják az orvosi és gyógyszerészeti gyakorlatban az enzimaktivitás értékelésére:
Egy adott szövet más fehérjéi között az enzimmolekulák számának becsléséhez határozza meg az enzim fajlagos aktivitását (Sp.A.), amely számszerűen megegyezik a konvertált szubsztrát mennyiségével (µmol-ban) egy milligramm (mg) egységnyi idő alatt. fehérje (a szövetből izolált enzim):
Az enzim tisztítási fokát a fajlagos aktivitás határozza meg: minél kevesebb idegen fehérje van, annál nagyobb a fajlagos aktivitás.
2. Az enzimreakciók kinetikáját az enzimreakcióhoz optimális körülmények között vizsgálják. Az optimális körülmények minden enzim esetében egyediek, és elsősorban a reakció hőmérséklete és az oldat pH-értéke határozza meg.
Hőmérséklet emelkedés bizonyos határokig ugyanúgy befolyásolja az enzimreakció sebességét, mint a hőmérséklet bármely kémiai reakciót: a hőmérséklet emelkedésével az enzimreakció sebessége nő. Az enzimatikus kémiai reakció sebességének azonban megvan a maga hőmérsékleti optimuma, aminek a feleslege az enzimaktivitás csökkenésével jár, ami a fehérjemolekula termikus denaturálásával jár (2.15. ábra). A legtöbb emberi enzim esetében az optimális hőmérséklet 37-38 °C.
 Rizs. 2.15. Az enzimatikus reakciósebesség (V) függése a hőmérséklettől
Rizs. 2.15. Az enzimatikus reakciósebesség (V) függése a hőmérséklettől
Az enzimaktivitás a pH-tól függ oldat, amelyben enzimatikus reakció megy végbe. A pH enzimaktivitásra gyakorolt hatása egy adott fehérje és szubsztrát aminosavmaradékai funkcionális csoportjainak ionizációjában bekövetkező változásoknak köszönhető, amelyek biztosítják az enzim-szubsztrát komplex optimális képződését. Minden enzimhez van egy pH-érték, amelynél a maximális aktivitása figyelhető meg (2.16. ábra).
 Rizs. 2.16. Az enzimatikus reakciósebesség (V) függése a közeg pH-jától
Rizs. 2.16. Az enzimatikus reakciósebesség (V) függése a közeg pH-jától
3. Az enzimes reakció kinetikai jellemzői a reaktánsok koncentrációjától függenek. Ha az enzim koncentrációját állandónak hagyjuk, csak a szubsztrát mennyiségét változtatva, akkor az enzimreakció sebességének grafikonját hiperbolával írjuk le (2.17. ábra). A szubsztrát mennyiségének növekedésével a kezdeti reakciósebesség növekszik. Amikor az enzim teljesen telítődik szubsztráttal, pl. adott enzimkoncentráció mellett az enzim-szubsztrát komplexek lehetséges maximális képződése következik be, és a termékképződés legnagyobb sebessége figyelhető meg. A szubsztrátkoncentráció további növelése nem vezet a képződött termék mennyiségének növekedéséhez, pl. a reakciósebesség nem növekszik. Ez az állapot megfelel a maximális reakciósebességnek Vmax
A V max érték az enzim katalitikus aktivitását jellemzi, és meghatározza a termékképződés maximális lehetőségét adott enzimkoncentráció mellett és szubsztrátfelesleg körülményei között; A V max egy adott enzimkoncentráció állandó értéke.
 Rizs. 2.17. A reakciósebesség (V) függése az S szubsztrát koncentrációtól:
Rizs. 2.17. A reakciósebesség (V) függése az S szubsztrát koncentrációtól:
V max a maximális reakciósebesség adott enzimkoncentráció mellett optimális reakciókörülmények között; K m - Michaelis állandó
4. Az enzimhatékonyság fő kinetikai jellemzője az Michaelis állandó - K m. A Michaelis-állandó számszerűen megegyezik azzal a szubsztrát-koncentrációval, amelynél a maximális sebesség fele érhető el. A K m egy adott enzim affinitását jellemzi egy adott szubsztráthoz, és egy állandó érték. Minél kisebb a Km, annál nagyobb az enzim affinitása egy adott szubsztráthoz, annál nagyobb a kezdeti reakciósebesség, és fordítva, minél nagyobb a Km, annál kisebb az enzim affinitása a szubsztráthoz, és annál kisebb a kezdeti reakciósebesség.
1. Másold be a táblázatot a füzetedbe. 2.2. A táblázat kitöltéséhez használja a tankönyvét és a kiegészítő szakirodalmakat. Vonjon le következtetést a változatos étrend szükségességéről az emberi egészség érdekében.
2. Másold be a táblázatot a füzetedbe. 2.3 és töltse ki. A tankönyved segítségével írjon fel egy reakciót minden koenzimre vonatkozóan.
3. Vigye át az enzimaktivitási grafikont a notebookjába (2.18. ábra). Határozza meg és adja meg ezen reakciók V max értékét. Adja meg K-t az elsőben és a másodikban
ügy. Mi a K állandó biokémiai jelentése?
2.2. táblázat. A fő vízoldható vitaminok jellemzői, amelyek a koenzimek prekurzorai
 2.3. táblázat. Alapvető koenzimek
2.3. táblázat. Alapvető koenzimek

 Rizs. 2.18. Az enzimreakciók sebességének függése a szubsztrát koncentrációtól
Rizs. 2.18. Az enzimreakciók sebességének függése a szubsztrát koncentrációtól
ÖNELLENŐRZÉSI FELADATOK
1. Válaszd ki a helyes válaszokat. Enzimek:
A. Fehérjék
B. Csökkentse az enzimatikus reakciók sebességét
B. Specifikus hatásuk van D. Egyszerű fehérjék E. Szabályozásra képesek
2. Válaszd ki a helyes válaszokat. Michaelis állandó (Km):
A. A B enzim szubsztrátspecifitásának jellemzője. Számszerűen megegyezik azzal a szubsztrátkoncentrációval, amelynél a Vmax fele megfigyelhető
B. Jellemzi az enzim affinitását a szubsztráthoz
D. Az enzim aktív centrumának D szubsztráttal való telítettségét jellemzi. Az enzim kinetikai jellemzője
3. Válaszd ki a helyes válaszokat. A PF koenzim a következő osztályokba tartozó enzimekkel működik:
A. Oxidoreduktáz B. Transzferáz
B. Hidroláz G. Liaz D. Izomerázok
4. Mérkőzés. A reakció típusa, amelyben a koenzim részt vesz:
A. Karboxilezés B. Oxidáció-redukció
B. Transzamináció D. Acilezés E. Acetilezés
Koenzim:
2. Piridoxál-foszfát
5. Mérkőzés. Az enzim katalizálja:
A. Csak visszafordíthatatlan reakciók
B. Azonos típusú reakciók kis számú (csoport) szerkezetileg hasonló szubsztrátummal
B. A szubsztrát egyetlen meglévő sztereoizomerjének átalakítása
D. Reakciók koenzimek jelenlétében E. Csak egy szubsztrát átalakítása Szubsztrát specifikusság:
1. Abszolút
2. Csoport
3. Sztereospecifitás
6. Végezze el a "lánc" feladatot:
A) osztályba tartozó enzimek katalizálják a redox reakciókat
A. Transzferázok
B. Oxidoreduktázok
b) ennek az osztálynak egy alosztályába tartozó enzimek hajtanak végre reakciókat
hidrogénatomok eltávolítása a szubsztrátból:
A. Oxidázok
B. Hidroxilázok
B. Dehidrogenázok
V) Ezen enzimek koenzimje a következő:
B. Koenzim A
G) A koenzim a következő vitaminokon alapul:
A. Nikotinsav B. Biotin
B. B 2-vitamin
d) Ennek a vitaminnak a hiánya a következő betegségekhez vezet:
B. Pellagra
B. Makrocita vérszegénység
7. Mérkőzés. Enzim osztály:
A. Oxidoreduktáz B. Hidroláz
B. Ligaza G. Liase
D. Transzferáz
Enzim:
1. Szukcinát-dehidrogenáz
2. Piruvát-karboxiláz.
3. DNS-áz.
8. Egészítse ki a mondatokat a hiányzó szavakkal:
tevékenység. Az apoenzimhez erős kovalens kötésekkel kapcsolódó koenzimet ..................
4. 1-A; 2-B; 3-B
5. 1-D; 2-B; 3-B
6. a) B; b) B; c) B; d) A; e) B
7. 1-A; 2-B; 3-B
8. Holoenzim, apoenzim, koenzim, protéziscsoport
ALAPVETŐ FELTÉTELEK ÉS FOGALMAK
1. Enzimológia
2. Enzim katalízis
3. Enzim-szubsztrát komplex
4. Az enzimatikus katalízis kinetikája
5. Aljzat
6. Enzim aktív hely
7. Maximális reakciósebesség - V max
8. Michaelis állandó - K m
9. Enzimaktivitási egységek
10. Enzim osztályok
11. Enzimspecifitás
12. Enzim kofaktorok
13. Az enzim fajlagos aktivitása
14. Apoenzim
15. Holoenzim
Problémákat megoldani
1. Jelenleg a biokémiai laboratóriumokban automata biokémiai analizátorokat használnak az emberi biológiai folyadékokban lévő enzimek aktivitásának meghatározására. Segítsen a laboratóriumi technikusnak megérteni a laktát-dehidrogenáz (LDH) aktivitás meghatározásához és az LDH aktivitásának kiszámításához használandó reagenseket két betegnél. Ezért:
a) írja le az LDH által katalizált reakciót!
b) jelölje meg az enzim szubsztrátját, koenzimét, vitamin-prekurzorát, forrását;
c) sorolja fel a reakciókörülményeket (hőmérséklet, idő);
d) fejtse ki, hogy milyen paraméterrel értékelhető egy enzimreakció sebessége;
f) számítsa ki az LDH aktivitást a betegek vérében IU/l egységekben. Vonja le a következtetést: melyik beteg aktívabb?
2.4. táblázat. Adatok az LDH aktivitás meghatározásához
2. Az ember homeoterm (a hőmérsékletet állandó szinten tartja) élő szervezet. Az orvostudományban bizonyos esetekben szélsőséges hőmérsékleteket alkalmaznak kezelésre. Különösen a hipotermiás állapotokat használják hosszan tartó műtétekhez, különösen az agyban és a szívben. A hipertermiás állapotokat a szövetek koagulálására használják. Magyarázza meg ezen megközelítések érvényességét az enzimológus szemszögéből! Válaszolni:
a) jelezze, hogy milyen hőmérséklet az optimális a legtöbb emberi enzim számára;
b) rajzolja fel az enzimreakciók sebességének hőmérséklettől való függését ábrázoló grafikont;
c) indokolja a hosszú távú sebészeti beavatkozások szükségességét hipotermiás körülmények között;
d) írja le, hogy a termikus szöveti koagulációs módszer mire épül;
e) jelezze a kritikus hőmérsékletnek való kitettség emberre gyakorolt következményeit.
3. Egy 35 éves beteg szájnyálkahártya gyulladásos folyamataira, izomfáradtságra, kötőhártya-gyulladásra panaszkodott a klinikára. A páciens hosszú ideig monoton diétát evett, kizárva étrendjéből az olyan ételeket, mint a máj, a rozs, a tej és az élesztő. Az orvos B2 hipovitaminózist diagnosztizált. Ismertesse a megfigyelt tünetek okait! Ezért:
a) nevezze meg a B2-vitaminból képződő koenzimeket;
b) jelezze, mely reakciókban vesznek részt ezek a koenzimek;
c) írja fel a képlet munkarészeit a koenzimek oxidált és redukált formáira!
d) mondjon példákat azokra a reakciókra, amelyekben ezek a koenzimek részt vesznek (használjon tankönyvi anyagokat).
4. A savas foszfatáz enzim hidrolizálja a foszforsav-észtereket. Ez az enzim a máj, a lép és a prosztata sejtjeiben képződik; vörösvérsejtek, vérlemezkék, makrofágok és oszteoklasztok tartalmazzák. Ez az enzim a spermiumok akroszómájában is megtalálható, és a megtermékenyítés során lebontja a petesejtek plazmalemma foszfolipidjeit. A savas foszfatáz legnagyobb enzimaktivitása savas pH-értékeken (4,7-6,0) érhető el. Rajzolja fel a reakciósebesség grafikonját a pH függvényében, és magyarázza el, miért változik a savas foszfatáz aktivitása a pH változásával. Adja meg a reakció diagramját! Határozza meg az enzimosztályt és annak specificitását!
5. A vékonybél peptidáz hatására bekövetkező dipeptid átalakulás reakciósebességének vizsgálatakor a következő eredményeket kaptuk: a maximális enzimaktivitás 40 µmol/perc/mg, Km 0,01. Milyen szubsztrátkoncentrációnál a reakciósebesség 10 µmol/perc/mg? Feladatadatok használata:
a) írjon reakcióvázlatot, határozza meg az enzim osztályát és azt a kötést, amelyet a szubsztrátban lebont;
b) rajzolja meg a reakciósebesség grafikonját a szubsztrát koncentrációtól függően, és válaszoljon a probléma kérdésére;
c) adja meg a Ksh definícióját, adja meg a kapcsolatot a Ksh értéke és az enzim szubsztráthoz való affinitása között.
6. A tanuló meghatározta a csirke tojásfehérjéből izolált lizozim enzim fajlagos aktivitását. A lizozim hidrolizálja a bakteriális sejtfal glikoproteinekjét. A hallgató egy szubsztrátot, enzimet és puffert tartalmazó reakcióelegyet inkubált, amely optimális 5,2 pH-értéket biztosít, és megállapította, hogy 1 mg lizozim hatására 15 perc alatt mindössze 12 µmol termék keletkezik. Miután elvégezte a számítást és kiderítette az okot
Az enzim alacsony fajlagos aktivitása miatt emlékezett rá, hogy nem kapcsolta be a termosztátot, ezért a mintákat szobahőmérsékleten inkubálta, és az enzim t értéke 37 °C. A kísérletet optimális körülmények között megismételve azt találta, hogy 15 perc alatt 45 µmol termék képződik 1 mg lizozim hatására. Számítsa ki mindkét esetben az enzim fajlagos aktivitását, és magyarázza meg a hőmérséklet hatásának mechanizmusát az enzimreakció sebességére!
7. A sejtben számos enzim aktivitását más enzimek - a protein-kináz és a foszfoprotein-foszfatáz - szabályozzák. Mutassa be e reakciók jellemzőit; írja le az ezen enzimek által katalizált reakciókat, jelezze, hogy melyik enzimosztályba tartoznak! Vegye figyelembe a szubsztrát specifitását.
2. moduláris egység AZ ENZIM TEVÉKENYSÉGÉNEK SZABÁLYOZÁSA. AZ ENZIMOLÓGIA ORVOSI SZEMPONTJAI
Tanulási célok Legyen képes:
1. Értelmezze az inhibitorok - gyógyszerek, mérgek - hatásának eredményeit a szervezet enzimatikus reakcióira.
2. Ismertesse az enzimaktivitás szabályozásának fontosságát az anyagcsereút sebességének befolyásolásában.
3. Ismertesse az enzimek gyógyszerként való alkalmazásának alapjait!
4. Alkalmazza az enzimek tulajdonságaira és a szervek enzimösszetételére vonatkozó ismereteket normál körülmények között és különböző anyagcserezavarok esetén.
5. Értelmezze az enzimaktivitás meghatározásának eredményeit a betegségek diagnosztizálásában.
Tud:
1. Az enzimgátlók osztályozása hatásmechanizmusuk szerint.
2. Példák a gyógyszerekre - enzimgátlók.
3. A szervezet enzimaktivitásának szabályozásának alapvető mechanizmusai.
4. Az anyagcsere utak szabályozásának elvei és az enzimek szerepe az anyagcsere szabályozásában.
5. Az enzimek használatának alapjai betegségek diagnosztizálására és kezelésére.
TÉMAKÖR 2.7. Enzimaktivitás-gátlók
1. A kifejezés alatt "gátlás enzimaktivitás" kifejezés a katalitikus aktivitás bizonyos vegyi anyagok által okozott specifikus csökkenésére utal, inhibitorok.
Az inhibitorok nagy érdeklődésre tartanak számot az enzimatikus katalízis mechanizmusainak tisztázásában, és segítik az egyes enzimreakciók szerepének megállapítását a szervezet anyagcsereútjaiban. Számos gyógyszer és méreg hatása az enzimaktivitás gátlásának elvén alapul.
2. Az inhibitorok különböző erősségű enzimekhez képesek kötődni. Ez alapján megkülönböztetik megfordíthatóÉs visszafordíthatatlan gátlás. Reverzibilis inhibitorok gyenge, nem kovalens kötéssel kötődnek az enzimhez, és bizonyos körülmények között könnyen elválaszthatók az enzimtől:
E+I↔ EI.
Irreverzibilis gátlás az inhibitormolekula és az enzim közötti kovalens stabil kötések kialakulása esetén:
E+I→ E-I.
3. A hatásmechanizmus szerint a reverzibilis inhibitorokat a következőkre osztják kompetitívÉs nem versenyképes.
A kompetitív gátlás az enzimreakció sebességének reverzibilis csökkenését okozza az inhibitornak az enzim aktív helyéhez való kötődése következtében, ami megakadályozza az enzim-szubsztrát komplex kialakulását. Ez a fajta gátlás akkor következik be, amikor az inhibitor az a szubsztrát szerkezeti analógja; Ennek eredményeként versengés lép fel a szubsztrát és az inhibitormolekulák között az enzim aktív központjához való kötődésért. Ebben az esetben vagy a szubsztrát, vagy az inhibitor kölcsönhatásba lép az enzimmel, enzim-szubsztrát (ES) vagy enzim-inhibitor (EI) komplexeket képezve. Ha enzim-inhibitor (EI) komplex képződik, akkor nem képződik reakciótermék (2.19. ábra).
 Rizs. 2.19. Az enzimaktivitás kompetitív gátlásának sémája
Rizs. 2.19. Az enzimaktivitás kompetitív gátlásának sémája
A kompetitív típusú gátlásra a következő egyenletek érvényesek:
E+S↔ES →E+P; E+I↔ E.I.
A kompetitív gátlás sajátossága, hogy a szubsztrátkoncentráció növekedésével gyengül, mivel a reverzibilis inhibitor nem változtatja meg az enzim szerkezetét. Emiatt magas szubsztrátkoncentráció esetén a reakciósebesség nem tér el az inhibitor hiányában tapasztaltaktól, pl. egy kompetitív inhibitor nem változtatja meg a Vmax-ot, hanem növeli a Km-t.
A kompetitív gátlás klasszikus példája a szukcinát-dehidrogenáz reakció gátlása malonsavval (2.20. ábra). A malonát a szukcinát szerkezeti analógja (két karboxilcsoport jelenléte), és kölcsönhatásba léphet a szukcinát-dehidrogenáz aktív helyével is. Azonban két hidrogénatom átvitele a FAD protéziscsoportba malonsavból nem lehetséges, és ezért a reakció sebessége csökken.
 Rizs. 2.20. Példa a szukcinát-dehidrogenáz kompetitív gátlására malonsavval:
Rizs. 2.20. Példa a szukcinát-dehidrogenáz kompetitív gátlására malonsavval:
A - a szukcinát ionos kötések révén kötődik a szukcinát-dehidrogenáz enzim aktív központjához; B - az enzimes reakció során két hidrogénatomot eltávolítanak a szukcinátból, és hozzáadják a FAD koenzimhez. Ennek eredményeként fumarát képződik, amelyet eltávolítanak a szukcinát-dehidrogenáz aktív helyéről; A B-malonát a szukcinát szerkezeti analógja, a szukcinát-dehidrogenáz aktív helyéhez is kötődik, de a kémiai reakció nem megy végbe
4. Számos gyógyszer a kompetitív gátlás mechanizmusán keresztül fejti ki terápiás hatását. Például az acetilkolin kolinná és ecetsavvá történő hidrolízisének reakcióját az acetilkolinészteráz (AChE) enzim katalizálja (2.21. ábra), és gátolható ezen enzim kompetitív inhibitorai (pl. proserin, endrofónium stb.) (2.22. ábra). Ha ilyen inhibitorokat adunk hozzá, az acetilkolinészteráz aktivitása csökken, az acetilkolin (szubsztrát) koncentrációja nő, ami az idegimpulzusok vezetésének növekedésével jár együtt. A kompetitív acetilkolin-észteráz inhibitorokat izomdisztrófiák, valamint sérülések, bénulás és gyermekbénulás utáni mozgászavarok kezelésére használják.
Rizs. 2.21. Az acetilkolin hidrolízis reakciója AChE hatására
 Rizs. 2.22. Kompetitív inhibitorok kötődése az AChE aktív helyén
Rizs. 2.22. Kompetitív inhibitorok kötődése az AChE aktív helyén
A - szubsztrát (acetilkolin) hozzáadása az enzim aktív központjához.
A nyíl az acetilkolin hidrolízisének helyét jelzi; B - a kompetitív inhibitor proserin hozzáadása az enzim aktív központjához. Nincs reakció; B - a kompetitív inhibitor endrofónium kötődése az enzim aktív központjához. Az inhibitoroknak az AChE aktív helyéhez való kapcsolódása megakadályozza az acetilkolin kötődését
Egy másik példa azokra a gyógyszerekre, amelyek hatásmechanizmusa az enzim kompetitív gátlásán alapul, a tripszin proteolitikus enzim peptid inhibitorainak alkalmazása hasnyálmirigy-betegségek (akut hasnyálmirigy-gyulladás, nekrózis), pl. aprotinin, trasylol, contrical. Ezek a gyógyszerek gátolják a tripszint, amely a környező szövetekbe és a vérbe szabadul fel, és ezáltal megakadályozza a nem kívánt autolitikus eseményeket hasnyálmirigy-betegségekben.
5. Egyes esetekben kompetitív inhibitorok, amelyek kölcsönhatásba lépnek az enzim aktív központjával, alkalmazhatók pszeudosubsztrátok(antimetabolitok), ami hibás szerkezetű termék szintéziséhez vezet. A kapott anyagok nem rendelkeznek a „kívánt” szerkezettel, ezért hiányzik a funkcionális aktivitásuk. Ezek a gyógyszerek közé tartoznak a szulfonamid gyógyszerek.
6. Nem versenyképes Reverzibilis egy olyan enzimreakció gátlása, amelyben az inhibitor az enzimmel az aktív helytől eltérő helyen lép kölcsönhatásba. A nem kompetitív inhibitorok nem a szubsztrát szerkezeti analógjai; nem kompetitív inhibitor hozzáadása az enzimhez megváltoztatja az aktív centrum konformációját és csökkenti az enzimreakció sebességét, azaz. csökkenti az enzimaktivitást. A nem kompetitív inhibitorra példa lehet a nehézfém-ionok hatása, amelyek kölcsönhatásba lépnek az enzimmolekula funkciós csoportjaival, és megzavarják a katalízist.
7. Irreverzibilis inhibitorok csökkenti az enzimaktivitást az enzimmolekulával való kovalens kötések kialakulása következtében. Leggyakrabban az enzim aktív központja módosul. Ennek eredményeként az enzim nem tudja ellátni katalitikus funkcióját.
Az irreverzibilis inhibitorok alkalmazása nagyobb jelentőséggel bír az enzimek hatásmechanizmusának tisztázásában. Egy enzim aktív centrumának szerkezetéről fontos információkat szolgáltatnak azok a vegyületek, amelyek blokkolják az aktív centrum bizonyos csoportjait. Az ilyen inhibitorokat ún különleges. A specifikus inhibitorok közé tartozik diizopropil-fluor-foszfát (DFP). A DPP kovalens kötést képez a szerin OH csoportjával, amely az enzim aktív centrumában található, és közvetlenül részt vesz a katalízisben, ezért a DPP a „szerin” enzimek specifikus irreverzibilis inhibitoraként van besorolva (2.23. ábra). A DPP-t az enzimek aktív helyének szerkezetének vizsgálatára használják az enzimológiában.
Ellentétben a specifikus inhibitorokkal nem specifikus Az inhibitorok kovalens kötéseket képeznek bizonyos enzimcsoportokkal, amelyek nemcsak az aktív centrumban, hanem az enzimmolekula bármely részében is találhatók. Például a jód-acetát (2.24. ábra) kölcsönhatásba lép a fehérje bármely SH csoportjával. Ez a kölcsönhatás megváltoztatja az enzimmolekula konformációját, és ennek megfelelően az aktív centrum konformációját és csökkenti a katalitikus aktivitást.
 Rizs. 2.23. A kimotripszin aktivitás specifikus gátlása DPP alkalmazásával
Rizs. 2.23. A kimotripszin aktivitás specifikus gátlása DPP alkalmazásával
 Rizs. 2.24. Az enzimaktivitás nem specifikus gátlása jód-acetáttal.
Rizs. 2.24. Az enzimaktivitás nem specifikus gátlása jód-acetáttal.
A nem specifikus gátlás a cisztein-SH-csoportok jód-acetát-molekulák általi kovalens módosítása miatt következik be.
8. Példa olyan gyógyszerre, amelynek hatása visszafordíthatatlan enzimgátlással jár, a széles körben használt aszpirin. Ennek a gyulladásgátló nem szteroid gyógyszernek a hatása a ciklooxigenáz enzim gátlásán alapul, amely katalizálja a prosztaglandinok képződését az arachidonsavból. Ennek eredményeként az aszpirin acetil-maradéka hozzáadódik a ciklooxigenáz egyik alegységének szerinjének szabad terminális OH-csoportjához (2.25. ábra). Ez blokkolja a prosztaglandinok képződését (lásd a 8. modult), amelyek biológiai funkciók széles skálájával rendelkeznek, beleértve a gyulladás mediátorait is. Ezért az aszpirint gyulladáscsökkentő gyógyszernek minősítik. A gátolt enzimmolekulák elpusztulnak, a prosztaglandin szintézis csak új enzimmolekulák szintézise után áll helyre.
 Rizs. 2.25. A ciklooxigenáz inaktiválásának mechanizmusa irreverzibilis inhibitor - aszpirin - alkalmazásával
Rizs. 2.25. A ciklooxigenáz inaktiválásának mechanizmusa irreverzibilis inhibitor - aszpirin - alkalmazásával
TÉMAKÖR 2.8. AZ ENZIM TEVÉKENYSÉG SZABÁLYOZÁSA
1. A sejtben minden kémiai reakció enzimek részvételével megy végbe. Ezért az anyagcsereút (egyik anyag szekvenciális átalakulása a másikba) sebességének befolyásolásához elegendő az enzimmolekulák számát vagy aktivitását szabályozni. Általában az anyagcsere utakon vannak kulcsfontosságú enzimek aminek köszönhetően a teljes út sebessége szabályozott. Ezeket az enzimeket (egy vagy több anyagcsereútban) ún szabályozó enzimek. Az enzimreakciók sebességének szabályozása három független szinten történik: az enzimmolekulák számának, a szubsztrát- és koenzimmolekulák elérhetőségének változtatásával, valamint az enzimmolekula katalitikus aktivitásának változtatásával (2.6. táblázat).
2.5. táblázat. Az enzimatikus reakciók sebességének szabályozási módszerei
Szabályozás módja | Jellegzetes |
Az enzimmolekulák számának változása | A sejtben lévő enzimmolekulák számát két folyamat aránya határozza meg: a szintézis és a bomlás. Az enzimszintézis szabályozásának leginkább tanulmányozott mechanizmusa a transzkripció (mRNS szintézis) szintjén van, amelyet bizonyos metabolitok, hormonok és számos biológiailag aktív molekula szabályoz. |
Szubsztrát és koenzim molekulák elérhetősége | Az enzimreakció lefolyását szabályozó fontos paraméter a szubsztrát és a koenzim jelenléte. Minél nagyobb a kiindulási szubsztrát koncentrációja, annál nagyobb a reakciósebesség |
Egy enzimmolekula katalitikus aktivitásának változása | Az enzimaktivitás szabályozásának fő módjai a következők: alloszterikus szabályozás; Szabályozás fehérje-fehérje kölcsönhatások által; Szabályozás az enzimmolekula foszforiláció-defoszforilációjával; Szabályozás részleges (korlátozott) proteolízissel |
Nézzük meg, hogyan szabályozhatjuk az enzimatikus reakciók sebességét az enzimmolekula katalitikus aktivitásának megváltoztatásával.
2. Alloszterikus szabályozás. Alloszterikus enzimek hívott enzimek, aktivitás melyik állítható használva effektor anyagok. Az alloszterikus szabályozásban részt vevő effektorok olyan celluláris metabolitok, amelyek gyakran részt vesznek abban a folyamatban, amelyet szabályoznak.
Az effektor, ami okozza csökkentés (gátlás) enzimaktivitást nevezzük inhibitor. Az effektor, ami okozza növelés (aktiválás) enzimaktivitást nevezzük aktivátor.
Az alloszterikus enzimek bizonyos szerkezeti jellemzőkkel rendelkeznek:
Általában vannak oligomer fehérjék, több protomerből áll;
Van allosztérikus központ, térben távol van a katalitikus aktív helytől;
Az effektorok nem kovalensen kapcsolódnak az enzimhez az alloszterikus (szabályozó) központokban.
Az alloszterikus centrumok, akárcsak a katalitikusok, eltérő specifitást mutathatnak a ligandumok tekintetében: lehet abszolút vagy csoportos. Egyes enzimek több alloszterikus centrummal rendelkeznek, amelyek egy része az aktivátorokra, mások az inhibitorokra specifikusak.
A protomert, amelyen az allosztérikus központ található, hívják szabályozó protomer nem úgy mint katalitikus protomer, aktív centrumot tartalmaz, amelyben kémiai reakció játszódik le.
Az alloszterikus enzimek rendelkeznek azzal a tulajdonsággal együttműködési készség: az alloszterikus effektor és az alloszterikus centrum kölcsönhatása az összes alegység konformációjában kooperatív változást okoz, ami az aktív centrum konformációjának megváltozásához és az enzim szubsztrát iránti affinitásának megváltozásához vezet, ami csökkenti vagy növeli a az enzim katalitikus aktivitása. Ha az allosztérikus centrumhoz inhibitor kötődik, akkor a kooperatív konformációs változások következtében az aktív centrum konformációja megváltozik, ami az enzim szubsztrát iránti affinitásának csökkenését okozza, és ennek megfelelően a konformáció csökkenését okozza. az enzimreakció sebessége. Ezzel szemben, ha egy aktivátor kapcsolódik az alloszterikus központhoz, akkor az enzim affinitása a szubsztráthoz megnő, ami a reakciósebesség növekedését okozza. Az alloszterikus effektorok hatására bekövetkező események sorozatát az ábra mutatja be. 2.26.
Az alloszterikus enzimek szabályozása megfordítható: az effektor leválása a szabályozó alegységről visszaállítja az enzim eredeti katalitikus aktivitását.
Alloszterikus enzimek katalizálja a kulcsreakciókat ennek az anyagcsere-útvonalnak.
Az alloszterikus enzimek fontos szerepet játszanak a különböző anyagcsere-utakban, mivel rendkívül gyorsan reagálnak a sejt belső összetételének legkisebb változásaira. Az anyagcsere-folyamatok sebessége az adott reakcióláncban felhasznált és képződő anyagok koncentrációjától függ. A prekurzorok az alloszterikus enzimek aktivátorai lehetnek az anyagcsereútban. Ugyanakkor, amikor bármely anyagcsereút végterméke felhalmozódik, az enzim alloszterikus inhibitoraként működhet. Ez a szabályozási módszer gyakori a szervezetben, és „negatív visszacsatolásnak” nevezik:
 Rizs. 2.26. Az alloszterikus enzim szerkezetének és működésének vázlata:
Rizs. 2.26. Az alloszterikus enzim szerkezetének és működésének vázlata:
A - egy negatív effektor (inhibitor) hatása. Az inhibitor (I) az alloszterikus centrumhoz kötődik, ami kooperatív konformációs változásokat okoz az enzimmolekulában, beleértve az enzim aktív centrumát is. Csökken az enzim affinitása a szubsztráthoz, és ennek következtében az enzimreakció sebessége csökken; B - egy pozitív effektor (aktivátor) hatása. Az aktivátor (A) az alloszterikus központhoz kötődik, ami kooperatív konformációs változásokat okoz. Az enzim affinitása a szubsztráthoz nő, és az enzimreakció sebessége nő. Mind az inhibitor, mind az aktivátor reverzibilis hatását az enzimaktivitásra kimutatták
Tekintsük a glükóz katabolizmus folyamatának allosztérikus szabályozását, amely az ATP molekula képződésével végződik (2.27. ábra). Abban az esetben, ha a sejtben lévő ATP-molekulákat nem fogyasztják el, akkor ez az anyagcsereút alloszterikus enzimeinek inhibitora: a foszfofruktokináz és a piruvát-kináz. Ugyanakkor a glükóz katabolizmus közbenső metabolitja, a fruktóz-1,6-biszfoszfát a piruvát-kináz enzim alloszterikus aktivátora. Az anyagcsereút végterméke általi gátlás és a kezdeti metabolitok általi aktiválás lehetővé teszi
 Rizs. 2.27. A glükóz katabolizmus folyamatának alloszterikus szabályozása.
Rizs. 2.27. A glükóz katabolizmus folyamatának alloszterikus szabályozása.
Az ATP-molekula a metabolikus útvonal enzimeinek - a foszfofruktokináz és a piruvát-kináz - alloszterikus inhibitora. A fruktóz-1,6-biszfoszfát molekula a piruvát-kináz enzim alloszterikus aktivátora
szabályozza az anyagcsere sebességét. Az alloszterikus enzimek általában katalizálják az anyagcsereút kezdeti reakcióit, irreverzibilis reakciókat, sebességkorlátozó reakciókat (a leglassabbakat) vagy az anyagcsereút elágazási pontján fellépő reakciókat.
3. Szabályozás fehérje-fehérje kölcsönhatások által. Egyes enzimek a fehérje-fehérje kölcsönhatások következtében megváltoztatják aktivitásukat. Az enzimaktivitás ilyen módon történő megváltoztatásának legalább két mechanizmusa különböztethető meg: az enzimek aktiválódása az aktivátor fehérjék hozzáadásával (az adenilát-cikláz enzim aktiválása a G fehérje α-alegysége által, lásd 4. modul) és a változások katalitikus aktivitásában a protomerek asszociációja és disszociációja következtében.
Az enzimek katalitikus aktivitásának protomerek asszociációjával vagy disszociációjával történő szabályozására példaként a protein kináz A enzim szabályozását tekinthetjük.
Protein kináz A(cAMP-dependens) négy kétféle alegységből áll: két szabályozó (R) és két katalitikus (C). Ennek a tetramernek nincs katalitikus aktivitása. A szabályozó alegységek kötőhelyekkel rendelkeznek a ciklikus 3",5"-AMP (cAMP) számára (kettő minden alegységhez). Négy cAMP molekula kapcsolódása két szabályozó alegységhez a szabályozó protomerek konformációjának megváltozásához és a tetramer komplex disszociációjához vezet; így két aktív katalitikus alegység szabadul fel (2.28. ábra). Az aktív protein-kináz A katalizálja a foszforsav-maradék átvitelét az ATP-ből a fehérjék aminosav-maradékainak specifikus OH-csoportjaiba (azaz a fehérjék foszforilációját okozza).
 Rizs. 2.28. A protein kináz A (PKA) aktivitásának szabályozása fehérje-fehérje kölcsönhatásokkal.
Rizs. 2.28. A protein kináz A (PKA) aktivitásának szabályozása fehérje-fehérje kölcsönhatásokkal.
A PKA-t négy cAMP molekula aktiválja, amelyek két szabályozó alegységhez kötődnek, ami a szabályozó protomerek konformációjának megváltozásához és a tetramer komplex disszociációjához vezet. Ez két aktív katalitikus alegységet szabadít fel, amelyek fehérje foszforilációt okozhatnak
A cAMP-molekulák szabályozó alegységekből történő lehasadása a protenkináz A szabályozó és katalitikus alegységeinek inaktív komplex kialakulásához vezet.
4. Enzimek katalitikus aktivitásának szabályozása foszforiláció-defoszforilációval. Biológiai rendszerekben gyakran találkozhatunk olyan mechanizmussal, amely az enzimek aktivitását a kovalens módosulásukkal szabályozza. Az enzimek kémiai módosításának gyors és elterjedt módszere a foszforiláció-defoszforiláció.
Az enzim OH csoportjai foszforiláción mennek keresztül, amelyet enzimek hajtanak végre protein kinázok(foszforiláció) és foszfoprotein foszfatázok(defoszforiláció). Foszforsav-maradék hozzáadása az aktív centrum konformációjának és katalitikus aktivitásának megváltozásához vezet. Ebben az esetben az eredmény kettős lehet: egyes enzimek a foszforiláció során aktiválódnak, míg mások éppen ellenkezőleg, kevésbé aktívak (2.29. ábra). A protein-kinázok és foszfoprotein-foszfatázok aktivitását hormonok szabályozzák, ami lehetővé teszi, hogy a metabolikus útvonalakban kulcsfontosságú enzimek aktivitása a környezeti feltételektől függően gyorsan változzon.
 Rizs. 2.29. Az enzimaktivitás szabályozásának vázlata foszforiláció-defoszforilációval.
Rizs. 2.29. Az enzimaktivitás szabályozásának vázlata foszforiláció-defoszforilációval.
Az enzimek foszforilációja a protein-kináz enzim segítségével történik. A foszforsav-maradék donorja az ATP-molekula. Egy enzim foszforilációja megváltoztatja annak konformációját és az aktív hely konformációját, ami megváltoztatja az enzim affinitását a szubsztráthoz. Ebben az esetben egyes enzimek aktiválódnak a foszforiláció során, míg mások gátolnak. A fordított folyamatot - a defoszforilációt - a foszfoprotein-foszfatáz enzimek okozzák, amelyek lehasítják az enzimről a foszforsavat, és visszaállítják az enzimet eredeti állapotába.
5. Enzimek katalitikus aktivitásának szabályozása részleges (korlátozott) proteolízissel. Egyes, a sejteken kívül működő enzimek (a gyomor-bél traktusban vagy a vérplazmában) inaktív prekurzorokként szintetizálódnak, és csak egy vagy több specifikus peptidkötés hidrolízise következtében aktiválódnak, ami a molekula egy részének eltávolításához vezet. A fehérjemolekula fennmaradó részében konformációs átrendeződés megy végbe, és kialakul az enzim aktív centruma (2.30. ábra). A részleges proteolízis egy példa a szabályozásra, amikor egy enzim aktivitása megváltozik
 Rizs. 2.30. A pepszin aktiválása részleges proteolízissel.
Rizs. 2.30. A pepszin aktiválása részleges proteolízissel.
A pepszinogén (egy inaktív molekula) egy vagy több peptidkötésének hidrolízise következtében a molekula egy része leszakad, és kialakul a pepszin enzim aktív centruma.
visszafordíthatatlan. Az ilyen enzimek általában rövid ideig működnek, amelyet a fehérjemolekula élettartama határoz meg. A részleges proteolízis az emésztési proteolitikus enzimek (pepszin, tripszin, kimotripszin, elasztáz), a peptidhormonok (inzulin), a véralvadási rendszer fehérjéi és számos más fehérje aktiválásának hátterében áll.
TÉMAKÖR 2.9. ENZIMEK ALKALMAZÁSA A GYÓGYSZERBEN
1. Az enzimeket széles körben használják az orvosi gyakorlatban diagnosztikai célokra (enzimdiagnosztika)és terápiás (enzimterápia) alapok. Az enzimeket is használják speciális reagensek
számos metabolit meghatározására. Például a glükóz-oxidáz enzimet a vizeletben és a vérben lévő glükóz mennyiségi meghatározására használják; az ureáz enzimet a biológiai folyadékok karbamidtartalmának meghatározására használják; különböző dehidrogenázok segítségével kimutatható a megfelelő szubsztrátok jelenléte, például piruvát, laktát, etil-alkohol stb.
2. Enzimdiagnosztika egy betegség (vagy szindróma) diagnosztizálásából áll az emberi biológiai folyadékokban lévő enzimek aktivitásának meghatározása alapján.
Az enzimdiagnosztika alapelvei a következő elveken alapulnak:
Normális esetben a vérszérum olyan enzimeket tartalmaz, amelyek speciális funkciókat látnak el, például a véralvadási rendszerben részt vevő enzimeket. A sejtenzimek gyakorlatilag nem hatolnak be az ép sejtekből a vérbe. Minimális mennyiségben néhány sejtenzim kimutatható a vérben;
Nál nél kár sejtmembránok (gyulladás, nekrózis) a vérben vagy más biológiai folyadékokban (például vizeletben), megnő a sérült sejtek intracelluláris enzimjeinek száma, amelyek aktivitása speciális biokémiai vizsgálatokkal rögzíthető;
Az enzimatikus diagnosztikához olyan enzimeket használnak, amelyek bizonyos szervekben domináns vagy abszolút lokalizációval rendelkeznek. (szervspecifikusság);
A felszabaduló enzim mennyiségének arányosnak kell lennie a szövetkárosodás mértékével, és elegendőnek kell lennie aktivitásának meghatározásához;
A sejtek károsodásakor észlelt biológiai folyadékokban lévő enzimek aktivitása eltér a normál értékektől, és meglehetősen hosszú ideig (napokig) stabil;
A csak citoszolos lokalizációjú enzimek megjelenése a vérplazmában gyulladásos folyamatot jelez; mitokondriális vagy nukleáris enzimek kimutatása esetén mélyebb sejtkárosodásról, például nekrózisról beszélhetünk.
Azokat az enzimeket, amelyek ugyanazt a kémiai reakciót katalizálják, de eltérő elsődleges fehérjeszerkezettel rendelkeznek izoenzimek. Kinetikai paramétereikben, aktiválási körülményeikben, valamint az apoenzim és a koenzim közötti kapcsolat jellemzőiben különböznek egymástól. Az izoenzimek megjelenési jellege változatos, de leggyakrabban az ezeket az izoenzimeket vagy alegységeiket kódoló gének szerkezeti eltérései miatt. Az izoenzimek meghatározására szolgáló módszerek a fizikai-kémiai tulajdonságok különbségén alapulnak. Az izoenzimek gyakran szervspecifikus, mivel minden szövet túlnyomórészt egyfajta izoenzimet tartalmaz. Következésképpen egy szerv károsodása esetén az izoenzim megfelelő formája megjelenik a vérben. Az enzimek bizonyos izoenzim formáinak kimutatása lehetővé teszi azok alkalmazását betegségek diagnosztizálására.
Például egy enzim laktát-dehidrogenáz (LDH) katalizálja a laktát (tejsav) piruváttá (piruvósavvá) történő reverzibilis oxidációs reakcióját (2.31. ábra). A laktát-dehidrogenáz egy moláris oligomer fehérje. 134 000 súlyú, kétféle négy alegységből áll - M (az angol izomból - izomból) és H (az angol szívből - szívből). Ezen alegységek kombinációja a laktát-dehidrogenáz öt izoformájának kialakulásának hátterében áll (2.32. ábra, A). Az LDH 1 és LDH 2 a szívizomban és a vesében, az LDH 4 és LDH 5 a vázizmokban és a májban a legaktívabb. Más szövetek ennek az enzimnek más változatait tartalmazzák. Az LDH izoformák elektroforetikus mobilitásban különböznek egymástól, ami lehetővé teszi az LDH izoformák szöveti azonosságának megállapítását (2.32. ábra, B). A szív-, máj- és izombetegségek diagnosztizálásához elektroforézissel tanulmányozni kell az LDH izoformáit a vérplazmában. ábrán. 2,32, B elektroferogramokat mutat
 Rizs. 2.31. Laktát-dehidrogenáz (LDH) által katalizált reakció
Rizs. 2.31. Laktát-dehidrogenáz (LDH) által katalizált reakció
 Rizs. 2.32. Laktát-dehidrogenáz izoformák:
Rizs. 2.32. Laktát-dehidrogenáz izoformák:
A - különböző LDH izoformák szerkezete; B - eloszlás az elektroferogramon és az LDH izoformák relatív mennyisége a különböző szervekben; B - LDH izoformák tartalma a vérplazmában normál körülmények között és patológiában (elektroferogramok - a bal oldalon és fotometriás szkennelés - a jobb oldalon)
egészséges ember, szívinfarktuson átesett és hepatitisben szenvedő beteg vérplazmája. A szövetspecifikus LDH izoformák kimutatását a vérplazmában széles körben használják diagnosztikai tesztként.
Egy másik példa a kreatin-kináz. Kreatin kináz (CK) amely katalizálja a kreatin-foszfát képződés reakcióját (2.33. ábra). A KK molekula egy dimer, amely kétféle M (az angol izomból - izomból) és B (az angol agyból - agyból) alegységből áll. Ezek az alegységek három izoenzimet alkotnak: BB, MB, MM. A BB izoenzim elsősorban az agyban, az MM a vázizmokban és az MV a szívizomban található. A KK izoformák elektroforetikus mobilitása eltérő (2.34. ábra). A szívizominfarktus diagnosztizálásában fontos a CK aktivitás meghatározása a vérplazmában (az MB izoforma szintje emelkedik). Az MM izoforma mennyisége megnőhet a trauma és a vázizmok károsodása során. A BB izoforma nem tud áthatolni a vér-agy gáton, ezért a vérben gyakorlatilag még stroke alatt sem mutatható ki, és nincs diagnosztikus értéke.
 Rizs. 2.33. A kreatin-kináz (CK) enzim által katalizált reakció
Rizs. 2.33. A kreatin-kináz (CK) enzim által katalizált reakció
 Rizs. 2.34. Különféle kreatin-kináz izoformák szerkezete és elektroforetikus mobilitása
Rizs. 2.34. Különféle kreatin-kináz izoformák szerkezete és elektroforetikus mobilitása
Enzimdiagnosztika különböző szervek betegségeinek diagnosztizálására szolgál. Az elemzések sorozata egy adott biokémiai laboratórium képességeitől függ, és folyamatosan fejlesztik. A leggyakoribb enzimdiagnosztikai vizsgálatok a következők:
Szívbetegségek (miokardiális infarktus) esetén - laktát-dehidrogenáz, kreatin-kináz, aszpartát-aminotranszferáz, alanin-aminotranszferáz. A szívinfarktus során a vérben megjelenő egyik első fehérje a troponin;
Májbetegségek esetén - alanin-aminotranszferáz, aszpartát-aminotranszferáz, acetilkolin-észteráz, gamma-glutamil-transzpeptidáz. A hasnyálmirigy betegségei esetén - hasnyálmirigy-amiláz, lipáz;
Prosztata betegségek esetén - savas foszfatáz.
3. Enzimek alkalmazása gyógyszerként aktívan fejlődnek a következő irányokban:
Helyettesítő terápia - enzimek alkalmazása hiányuk esetén;
A komplex terápia elemei - enzimek alkalmazása más terápiával kombinálva.
Az enzimpótló terápia hatásos az elégtelen emésztőnedv-elválasztással járó gyomor-bélrendszeri betegségek esetén. Például a pepszin csökkent szekréciós funkciójú gyomorhurut esetén használatos. A hasnyálmirigy enzimek hiánya nagymértékben kompenzálható a fő hasnyálmirigy enzimeket tartalmazó gyógyszerekkel (festal, enzistal, mesimforte stb.) szájon át szedve is.
Az enzimeket számos betegség további terápiás szereként használják. A proteolitikus enzimeket (tripszin, kimotripszin) helyileg alkalmazzák gennyes sebek kezelésére, az elhalt sejtek fehérjéinek lebontására, a vérrögök vagy viszkózus váladékok eltávolítására a légúti gyulladásos betegségekben. A ribonukleáz és dezoxiribonukleáz enzimkészítményeket vírusellenes gyógyszerként használják adenovírusos kötőhártya-gyulladás és herpetikus keratitis kezelésére.
Az enzimkészítményeket széles körben alkalmazzák trombózisban és thromboemboliában a vérrög elpusztítására. Erre a célra fibrinolizin, sztreptoliáz, streptodecase és urokináz készítményeket használnak.
A hialuronsav lebontását katalizáló hialuronidáz (lidáz) enzimet szubkután és intramuszkulárisan alkalmazzák égési sérülések és műtétek utáni összenövések és hegek feloldására.
Az aszparagináz enzimet (elpusztítja a vérben lévő Asn aminosavat) a vérrák kezelésére használják, korlátozva az Asn aminosav áramlását a tumorsejtekbe. A leukémiás sejtek nem képesek önállóan szintetizálni ezt az aminosavat, ezért a vérben lévő mennyiségének csökkenése rontja ezen sejtek növekedését.
TÉMAKÖR 2.10. ENZIMOPÁTIA
Számos betegség alapja az enzimek működésének megzavarása a sejtben - az ún enzimpátiák. Léteznek elsődleges (örökletes) és másodlagos (szerzett) enzimpátiák. Úgy tűnik, hogy a szerzett enzimpátiák, mint általában a proteinopathiák, minden betegségben megfigyelhetők.
Primer enzimpátiákban a hibás enzimek főként recesszív autoszomális módon öröklődnek. Ilyenkor a hibás enzimet tartalmazó anyagcsereút megszakad (2.35. ábra). A betegség kialakulása ebben az esetben az egyik „forgatókönyv” szerint történhet:
A végtermékek képződése megszakad, ami bizonyos anyagok hiányát okozza (például albinizmus esetén nem termelődik pigment a bőrsejtekben);
A prekurzor szubsztrátok felhalmozódnak, amelyek mérgező hatással vannak a szervezetre (például alkaptonuria esetén egy köztes metabolit halmozódik fel - homogentezinsav, amely az ízületekben lerakódik, gyulladásos folyamatokat okozva bennük).
 Rizs. 2.35. Metabolikus út E 3 enzimes enzimpátiával
Rizs. 2.35. Metabolikus út E 3 enzimes enzimpátiával
FELADATOK TANÁN KÍVÜLI MUNKÁHOZ
Problémákat megoldani
1. A zsírszövet sejtjeiben az anyagcsere folyamatok anabolikusról katabolikusra való átváltása a táplálkozás ritmusától függően történik. Ennek a váltásnak a szabályozásában fontos szerepet játszanak azok a hormonok, amelyek foszforiláció-defoszforiláció útján szabályozzák a kulcsenzimek aktivitását. Egészítse ki a kulcsfontosságú zsírbontó enzim aktivitásának szabályozására vonatkozó sémát (2.36. ábra), ha ismert, hogy ez az enzim (TAG lipáz) foszforilált formában aktív, defoszforilált formában inaktív. A kérdés megválaszolásához:
a) másolja ki a diagramot egy füzetbe, és tüntesse fel a fehérjék foszforilációját és defoszforilációját okozó enzimek nevét (írja a téglalapokba a nevüket);
b) nevezze meg ezen enzimek osztályát;
c) írja le az ezekben a reakciókban részt vevő további szubsztrátumokat és termékeket (írja a négyzetekbe a nevüket);
d) következtetéseket levonni a hormonok szerepéről a sejtanyagcsere szabályozásában.
 Rizs. 2.36. A TAG lipáz aktivitás szabályozása
Rizs. 2.36. A TAG lipáz aktivitás szabályozása
2. Az aszparagináz, amely katalizálja az aszparagin katabolizmusának reakcióját, alkalmazásra talált a leukémia kezelésében. Az aszparagináz anti-leukémiás hatásának előfeltétele az volt, hogy a leukémiás sejtekben egy hibás aszparaginszintézis enzimet, az aszparagin-szintetázt azonosítottak. Indokolja meg az aszparagináz terápiás hatását. Válaszolni:
a) írja le az aszparagin-szintetáz (7. fejezet) és az aszparagináz enzimek által katalizált reakciókat!
b) jelölje meg azokat az osztályokat, amelyekbe ezek az enzimek tartoznak;
c) következtetést levonni a tumorsejtek Asn koncentrációjáról aszparagináz alkalmazásakor;
d) indokolja meg, hogy az aszparagináz használata miért csökkenti a tumorszövet növekedési ütemét.
3. Vidd át a füzetedbe, és töltsd ki a táblázatot. 2.7 Az enzimek gyógyászatban történő felhasználásáról a jelen kézikönyv, tankönyv anyagának felhasználásával.
4. Vidd át a füzetedbe, és töltsd ki a táblázatot. 2.8 a gyógyszerekről - enzimgátlókról, az aktuális rész, tankönyv, kiegészítő irodalom felhasználásával.
2.7. táblázat. Gyógyszerek – enzimgátlók
ÖNELLENŐRZÉSI FELADATOK
1. Válaszd ki a megfelelő választ.
Kompetitív inhibitorok:
A. Kovalens kötéseket alakít ki az enzim aktív központjával B. Lépjen kölcsönhatásba az allosztérikus központtal
B. Kölcsönhatásba lép az enzim aktív helyével, gyenge kötéseket hozva létre
D. Csökkentse K w D. Csökkentse V max
2. Válaszd ki a megfelelő választ. Irreverzibilis inhibitorok:
A. A B szubsztrát szerkezeti analógjai. Kovalens kötéseket képeznek az enzimmel
B. Gyenge kötéseket hozzon létre az enzimmel
D. Lépjen kapcsolatba a szabályozó központtal
D. Csökkentse hatásukat a szubsztrát koncentrációjának növelésével
3. Válaszd ki a helyes válaszokat. Az alloszterikus enzimek általában:
A. Ezek harmadlagos szerkezetű fehérjék
B. Több protomerből áll C. Irreverzibilisen gátolt
D. Aktív és alloszterikus központjaik vannak különböző protomereken
D. Ennek a folyamatnak a metabolitjai szabályozzák
4. Válaszd ki a helyes válaszokat.
Amikor az enzimeket részleges proteolízis szabályozza, a következők fordulnak elő:
A. A fehérje peptidláncának lerövidülése
B. Változások az enzim másodlagos és harmadlagos szerkezetében
B. Irreverzibilis aktiválás
D. Irreverzibilis gátlás
D. Az aktív központ kialakulása
5. Válaszd ki a megfelelő választ.
Az enzimaktivitás szabályozása fehérje-fehérje kölcsönhatásokon keresztül a következőket kíséri:
A. Irreverzibilis gátlás
B. Szabályozó fehérje alegységek kapcsolódása vagy leválása
B. Effektor molekula kapcsolódása az alloszterikus centrumhoz D. Az enzim foszforilációja
D. Az enzim defoszforilációja
6. Válaszd ki a helyes válaszokat. Az enzimdiagnosztika a következőkön alapul:
A. Enzimek felszabadulása a vérbe szövetkárosodás során B. Szervspecifitás
B. Magas enzimstabilitás
D. Bizonyos izoenzimek túlsúlya a különböző szövetekben D. A diagnosztikailag jelentős enzimek alacsony aktivitása vagy teljes hiánya a vérben normális
7. Mérkőzés.
Betegségek diagnosztizálására használják:
B. Prosztata mirigy
B. Hasnyálmirigy D. Vese
D. Szívek Enzim:
1. Kreatin-kináz
2. Amiláz
3. Savas foszfatáz
8. Végezze el a "lánc" feladatot:
a) a szívinfarktus enzimatikus diagnózisa során meghatározott enzimek egyike:
A. Savas foszfatáz B. Laktát-dehidrogenáz
B. Amiláz
b) ez az enzim az enzimek osztályába tartozik:
A. Hidroláz B. Ligáz
B. Oxidoreduktáz
V) Ennek az enzimosztálynak az egyik koenzimje:
A. Piridoxál-foszfát B. Biotin
G) Ennek a koenzimnek a prekurzora a vitamin:
A. Nikotinsav B. Piridoxin
9. Végezze el a „lánc” feladatot:
A) Szerves fluorfoszfátokkal való mérgezés után egy személy a következőket tapasztalja:
A. Pupilla tágulás
B. A simaizomzat fokozott összehúzódása
B. A simaizmok ellazítása
b) Ennek a hatásnak az oka:
A. A Na+, E+-ATPáz károsodott működése B. Az acetilkolin mennyiségének növekedése
B. Az acetilkolin mennyiségének csökkentése
V) Ez annak a ténynek köszönhető, hogy a fluorofoszfátok:
A. Az acetilkolinészteráz (AChE) kompetitív inhibitorai
B. Alkoss kovalens kötést az AChE-vel
B. Az acetilkolin szintézisének megzavarása
G) Ezt a gátlási módszert nevezik:
A. Irreverzibilis B. Reverzibilis
B. Versenyképes
d) hasonló gátlási módszer figyelhető meg a következő esetekben:
A. Trasylol B. Aspirin
B. Proserina
AZ „ÖNELLENŐRZÉSI FELADATOKRA” VONATKOZÓ VÁLASZOK SZABVÁNYAI
3. B, G, D
4. A, B, C, D
6. A, B, D, D
7. 1-D, 2-B, 3-B
8. a) B, b) C, c) C, d) A
9. a) B, b) B, c) B, d) A, e) B
ALAPVETŐ FELTÉTELEK ÉS FOGALMAK
1. Anyagcsere út
2. Enzimgátlás
3. Enzimaktiválás
4. Reverzibilis gátlás
5. Irreverzibilis gátlás
6. Kompetitív gátlás
7. Alloszterikus szabályozás
8. Allosztérikus effektorok
9. Kulcsenzimek
10. Szabályozás forsforilációval - defoszforiláció
11. Szabályozás fehérje-fehérje kölcsönhatások által
12. Részleges proteolízis
13. Izoenzimek
14. Enzimpátia
15. Enzimdiagnosztika
FELADATOK A TANÉLETI MUNKÁHOZ
Problémákat megoldani
1. Az emberi sejtekben a nukleinsavak szintéziséhez szükséges purin nukleotidok szintézisének metabolikus útja egy ribóz-5-foszfát molekulával kezdődik. A szintézis folyamata során egy bizonyos szakaszban ez a folyamat elágazik, és két purin nukleotid - AMP és GMP - képződésével ér véget (2.37. ábra). Ezen nukleotidok ekvimoláris arányának kialakításához a sejtben számos kulcsenzim többlépcsős szabályozása zajlik, negatív visszacsatolási mechanizmus segítségével. Így az AMP-képződés feleslegével az adenil-szukcinát képződése lelassul, a GMP feleslegével pedig a xantozin-monofoszfát képződése lelassul. Ugyanakkor, ha mindkét nukleotidot nem fogyasztják el, a foszforibozil-difoszfát képződése lelassul. Találja ki, hogy a purin nukleotidok szintéziséhez szükséges metabolikus útvonal mely enzimei szabályozók. Válaszolni:
a) adjon meghatározásokat: „anyagcsereút” és „metabolikus útvonal kulcsenzimei”;
b) találja ki, hogy az ábrán látható enzimek közül melyik. 2,37 szabályozási;
c) megjelöli ezen enzimek szabályozási mechanizmusát, az anyagcsereútban való elhelyezkedésüket és szerkezeti jellemzőit;
d) nevezze meg, mely vegyületek és mely enzimek effektorai;
e) indokolja a „negatív visszacsatolási mechanizmussal” történő szabályozás fogalmát.

Rizs. 2.37. A purin nukleotidok sejtben történő képződésének sémája
2. 1935-ben a német orvos, G. Domagk felfedezte a festékként szintetizált protonzil (vörös streptocid) antimikrobiális hatását. Hamar kiderült, hogy a vörös streptocid hatóanyaga az anyagcseréje során képződő szulfonamid (sztreptocid), amely a szulfonamid gyógyszerek nagy csoportjának őse volt (2.38. ábra).
 Rizs. 2.38. A folsav szerkezete és a szulfonamidok általános képlete
Rizs. 2.38. A folsav szerkezete és a szulfonamidok általános képlete
A szulfonamidok bakteriosztatikus hatása abban áll, hogy a baktériumok folsavszintézise során a dihidropteorát szintáz enzim aktív centrumában a para-aminobenzoesavat (PABA) helyettesítik, ami a nukleinsavak képződéséhez szükséges; ennek következtében a mikroorganizmusok növekedése és fejlődése megzavarodik. A folsavat az emberi szervezet nem szintetizálja, hanem vitaminként táplálékkal látja el.
Ismertesse a szulfonamidok antibakteriális hatásának mechanizmusát, ehhez válaszoljon a kérdésekre:
a) mi a neve ennek a gátlásnak (hasonlítsa össze a szulfonamidok és a PABA szerkezetét)? Hogyan hatnak az ilyen gátlók a Kt-ra és a Vmax-ra
c) miért írnak fel általában azonnal telítő adag szulfonamidot a kezelés során?
d) befolyásolják-e a szulfonamidok a nukleinsavak képződését az emberi sejtekben? Magyarázza meg válaszát.
3. 2 depressziós betegségben szenvedő beteg fordult pszichiáterhez. Ismeretes, hogy az emberek depressziójának oka egyes esetekben a neurotranszmitterek hiánya a szinaptikus hasadékban. Az agyban is vannak a monoamin-oxidázok (MAO) csoportjába tartozó enzimek, amelyek elpusztítják a szinaptikus hasadékban felszabaduló neurotranszmittereket. Az első betegnek pirlindolt írtak fel, amely a szerotonin mediátor szerkezeti analógja. A második a nialamid, amely kovalensen képes kötődni a MAO aktív helyéhez. Magyarázza el ezeknek a gyógyszereknek a hatásmechanizmusát, és jelezze, melyik beteg reagál leggyorsabban a gyógyszerre. Válaszolni:
a) jellemezze ezeknek a gyógyszereknek a MAO-ra gyakorolt hatását, jelezze a különbséget
az enzimmel való kölcsönhatás mechanizmusai;
b) adjon egy sémát pirlindollal és nialamiddal történő MAO gátlására;
c) magyarázza el ezen gyógyszerek gátlási mechanizmusa alapján
melyik lesz tartósabb hatással a szervezetre és miért.
4. Az utóbbi időben megnövekedett a metanol felhasználása a járműápolási termékekben használt műszaki folyadékok, köztük a szélvédőmosó termékek gyártásához. A metil-alkohol vagy metanol fő veszélye, hogy helyettesítő alkoholként használják, ami halálhoz vezet. Így a Roszdravi Tudományos és Gyakorlati Toxikológiai Központ adatai szerint a metanollal mérgezett betegek aránya az összes kórházi betegen belül 0,1-0,5% között mozog. Ismertesse a metanol toxicitás okát és az orvosi kezelés módját, ha ismert, hogy a metanol gátolja az acetaldehid-dehidrogenáz enzim aktivitását, amely részt vesz az etanol lebontásában, ami az acetaldehid felhalmozódását okozza. A kérdés megválaszolásához:
a) írja le az etanol oxidációs reakcióit, figyelembe véve, hogy oxidáció történik!
két szakaszban megy végbe egy köztes vegyület - acetaldehid - képződésével; a végtermék ecetsav; mindkét reakció koenzimje NAD+;
b) írja fel a metanol szerkezeti képletét és adja meg az enzimaktivitás gátlásának mechanizmusát;
c) javasoljon kezelési módot metanol mérgezés esetén.
5. Régen az olasz hölgyek belladonna levet cseppentettek a szemükbe, amitől a pupillák kitágultak, a szemek pedig különleges fényt kaptak. Ma már ismert, hogy hasonló hatást vált ki az atropin alkaloid, amely számos növényben található: belladonna, henbane, datura. Ismertesse az atropin hatásmechanizmusát! Ezért:
a) nevezze meg azokat a receptorokat, amelyeket az atropin gátol (lásd 1. modul), jelölje meg a receptorok típusát és az események sorrendjét, amikor az atropin a szembe kerül;
b) válaszoljon arra, hogy hol alkalmazzák az atropint és a hasonló hatású gyógyszereket a gyógyászatban;
c) jelezze, milyen intézkedéseket lehet tenni atropin túladagolása esetén? Indokolja meg az acetilkolin koncentrációjának növelésének lehetséges módjait, és magyarázza el ennek szükségességét.
6. Nagy adagok alkalmazása koffein az adrenalin hatásaihoz hasonló tüneteket okoz az emberekben: fokozott pulzusszám; hörgők tágulása, izgalom, anyagcsere-változások az energiahordozókat lerakó szövetekben. Magyarázza el a koffein hatásmechanizmusát, szem előtt tartva, hogy a cAMP lebontásáért felelős foszfodiészteráz (PDE) enzim kompetitív inhibitora:
A kérdés megválaszolásához:
a) válasz, melyik anyag koncentrációja nő a sejtben koffein hatására;
b) elmagyarázza a cAMP sejten belüli szabályozó hatásának mechanizmusát; sematikusan ábrázolják az enzim szerkezetét, amely a sejtben a cAMP-koncentráció növekedése miatt aktiválódik;
c) nevezze meg, milyen folyamatok aktiválódnak a sejtben a koffeinhasználat hatására? Írja fel e reakciók diagramját;
d) ne feledje, hogy hasonló hatásmechanizmus figyelhető meg olyan gyógyszereknél, amelyek javítják a vér reológiai tulajdonságait (pl. Trental), valamint a hörgők ellazítására és a hörgőgörcs enyhítésére használt gyógyszerek (pl. teofillin).
7. L. beteget szívinfarktus gyanújával szállították kórházba. A páciens elmondása szerint 5 órával az orvos érkezése előtt légszomjat érzett. Az orvos szívinfarktusra gyanakodott, és kórházba szállította a beteget. A kórházban több napon keresztül biokémiai vérvizsgálatot végeztek a diagnózis megerősítésére. Az elemzések eredményeit a táblázat tartalmazza. 2.9. A kapott adatok megerősítik-e az orvos diagnózisát? Válaszolni:
Enzim | Aktivitás, NE/l | Sokféleség | Aktivitás, NE/l | Sokféleség |
12 órával az érelzáródás után | 72 órával az érelzáródás után |
|||
24 órával az érelzáródás után | 96 órával az érelzáródás után |
|||
48 órával az érelzáródás után | 120 órával az érelzáródás után |
|||
A metabolikus utak szabályozásában háromféle mechanizmus vesz részt. Ezek közül az első, amely a leggyorsabban reagál bármilyen helyzetváltozásra, az alloszterikus enzimek működéséhez kapcsolódik (13-15. ábra), amelyek katalitikus aktivitása megváltozhat speciális anyagok hatására, amelyek stimuláló ill. gátló hatás (ezeket effektoroknak vagy modulátoroknak nevezik; 9.18. szakasz).
Általában az alloszterikus enzimek egy adott multienzimes szekvencia elején vagy annak elején foglalnak helyet, és katalizálják azt a szakaszt, amely korlátozza a teljes folyamat egészének sebességét; Általában egy ilyen szakasz szerepét gyakorlatilag visszafordíthatatlan reakció játssza.
Rizs. 13-15. A katabolikus folyamat szabályozása visszacsatolás típusonként, azaz az alloszterikus enzim gátlása miatt a folyamat végterméke által. A J, K, L stb. betűk ennek az anyagcsereútnak a közbenső termékeit, az E1, E2, E3 stb. betűk pedig az egyes szakaszokat katalizáló enzimeket jelölik. Az első lépést egy alloszterikus enzim (ED) katalizálja, amelyet ennek a reakciósorozatnak a végterméke gátol. Az alloszterikus gátlást egy törött piros nyíl jelzi, amely összeköti a gátló metabolitot az alloszterikus enzim által katalizált reakcióval. A szabályozott lépés (Az EJ enzim által katalizált reakció általában gyakorlatilag visszafordíthatatlan sejtkörülmények között.
Az ATP ADP-ből történő szintézisével kísért katabolikus folyamatokban ez a végtermék, az ATP gyakran a katabolizmus egyik korai szakaszának alloszterikus inhibitoraként hat. Az anabolizmus egyik korai stádiumának alloszterikus inhibitora gyakran a bioszintézis végterméke, például valamilyen aminosav (9.18. szakasz). Egyes alloszterikus enzimek aktivitását specifikus pozitív modulátorok stimulálják. A katabolikus reakciószekvenciák egyikét szabályozó alloszterikus enzim például ki van téve a pozitív modulátorok, az ADP vagy az AMP stimuláló hatásának, és a negatív modulátor, az ATP gátló hatásának. Vannak olyan esetek is, amikor egy anyagcsereút alloszterikus enzimje meghatározott módon reagál más metabolikus útvonalak közbenső vagy végtermékeire. Ennek köszönhetően lehetőség nyílik a különböző enzimrendszerek működési sebességének összehangolására.
A magasabb rendű szervezetek anyagcseréjét szabályozó mechanizmusok második típusa a hormonális szabályozás (13-16. ábra). A hormonok speciális kémiai anyagok (kémiai „hírvivők”), amelyeket különféle endokrin mirigyek termelnek és közvetlenül a vérbe bocsátanak ki; a vér más szövetekbe vagy szervekbe szállítja őket, és itt stimulálják vagy gátolják bizonyos típusú anyagcsere-tevékenységeket. Az epinefrin hormont például a mellékvesevelő választja ki, és a vér a májba szállítja, ahol serkenti a glikogén glükózzá történő lebomlását, ami a vércukorszint emelkedését okozza. Ezenkívül az adrenalin serkenti a glikogén lebomlását a vázizmokban; ez a folyamat laktát képződéséhez és az energia ATP formájában történő tárolásához vezet. Az epinefrin úgy fejti ki ezeket a hatásokat, hogy az izomsejtek vagy májsejtek felszínén lévő specifikus receptorhelyekhez kötődik.
Az adrenalin megkötése jelzésként szolgál; ez a jel továbbítódik a sejt belső részeire, és itt kovalens módosulást okoz, melynek hatására a glikogén-foszforiláz (az első enzim a rendszerben, amely katalizálja a glikogén glükózzá és más termékekké történő átalakulását; 9.22. szakasz) átmegy a sejtből. kevésbé aktív formából egy aktívabbra (13-16. ábra).
Az anyagcserét szabályozó mechanizmusok harmadik típusa ezen enzim sejtbeli koncentrációjának változásaihoz kapcsolódik. Bármely enzim koncentrációját egy adott pillanatban a szintézisének és a bomlási sebességének aránya határozza meg. Egyes enzimek szintézisének sebessége bizonyos körülmények között meredeken növekszik; Ennek megfelelően ennek az enzimnek a koncentrációja a sejtben növekszik. Ha például egy állat szénhidrátban gazdag, de fehérjében szegény táplálékot kap, akkor a mája rendkívül alacsony enzimszintet tartalmaz, amelyek normál körülmények között katalizálják az aminosavak acetil-CoA-vá történő lebomlását. Mivel ezekre az enzimekre gyakorlatilag nincs szükség ilyen étrend mellett, nem termelődnek nagy mennyiségben. Érdemes azonban az állatot fehérjében gazdag étrendre váltani, és egy napon belül érezhetően megnő a májában az enzimek mennyisége, amelyekre most az emészthető aminosavak lebontásához lesz szükség.

Rizs. 13-16. Az enzimreakciók hormonális szabályozása. Az adrenalin hormonnak a májsejtek felszínén elhelyezkedő specifikus receptorokhoz való kötődése következtében ciklikus adenilát képződik egy membránhoz kötött enzim (adenilát-cikláz) részvételével. Ez utóbbi alloszterikus aktivátorként vagy intracelluláris közvetítőként működik, amelynek hatására a glikogén-foszforiláz inaktív formából aktív formába megy át, ami a máj glikogénjének vércukorré történő átalakulásának felgyorsulásával jár. Ezt az anyagcsere-utat részletesen leírja a fejezet. 25.

Rizs. 13-17. Enzim indukció. Az A szubsztrát magas intracelluláris koncentrációja serkentheti az E1, E2 és E3 enzimek bioszintézisét. Ezeknek az enzimeknek a tartalma a sejtben megnő, és ezáltal lehetőség nyílik azoknak a reakcióknak a felgyorsítására, amelyek eredményeként a felesleges A szubsztrát eltávolítható. A feleslegben lévő A szubsztrát tehát jelként szolgál a sejtmag számára, és arra kényszeríti, hogy „bekapcsolja” az El, E2 és E3 enzimek képződését szabályozó géneket. A gének bevonása a megfelelő hírvivő RNS szintézisét jelenti; bejut a riboszómákba, és ennek következtében az E1, E2 és E3 enzimek szintézise megy végbe bennük.
A májsejtek tehát képesek bizonyos enzimek bioszintézisének be- vagy kikapcsolására, a beléjük jutó tápanyagok természetétől függően. Ezt a jelenséget enzimindukciónak nevezzük (13-17. ábra).
1. A sejtben minden kémiai reakció enzimek részvételével megy végbe. Ezért az anyagcsereút (egyik anyag szekvenciális átalakulása a másikba) sebességének befolyásolásához elegendő az enzimmolekulák számát vagy aktivitását szabályozni. Általában az anyagcsere utakon vannak kulcsfontosságú enzimek aminek köszönhetően a teljes út sebessége szabályozott. Ezeket az enzimeket (egy vagy több anyagcsereútban) ún szabályozó enzimek. Az enzimreakciók sebességének szabályozása három független szinten történik: az enzimmolekulák számának, a szubsztrát- és koenzimmolekulák elérhetőségének változtatásával, valamint az enzimmolekula katalitikus aktivitásának változtatásával (2.6. táblázat).
2.5. táblázat. Az enzimatikus reakciók sebességének szabályozási módszerei
| Szabályozás módja | Jellegzetes |
| Az enzimmolekulák számának változása | A sejtben lévő enzimmolekulák számát két folyamat aránya határozza meg: a szintézis és a bomlás. Az enzimszintézis szabályozásának leginkább tanulmányozott mechanizmusa a transzkripció (mRNS szintézis) szintjén van, amelyet bizonyos metabolitok, hormonok és számos biológiailag aktív molekula szabályoz. |
| Szubsztrát és koenzim molekulák elérhetősége | Az enzimreakció lefolyását szabályozó fontos paraméter a szubsztrát és a koenzim jelenléte. Minél nagyobb a kiindulási szubsztrát koncentrációja, annál nagyobb a reakciósebesség |
| Egy enzimmolekula katalitikus aktivitásának változása | Az enzimaktivitás szabályozásának főbb módjai: - alloszterikus szabályozás; - szabályozás fehérje-fehérje kölcsönhatások segítségével; - az enzimmolekula foszforiláció-defoszforilációja általi szabályozása; - szabályozás részleges (korlátozott) proteolízissel |
Nézzük meg, hogyan szabályozhatjuk az enzimatikus reakciók sebességét az enzimmolekula katalitikus aktivitásának megváltoztatásával.
2. Alloszterikus szabályozás. Alloszterikus enzimek hívott enzimek, aktivitás melyik állítható használva effektor anyagok. Az alloszterikus szabályozásban részt vevő effektorok olyan celluláris metabolitok, amelyek gyakran részt vesznek abban a folyamatban, amelyet szabályoznak.
Az effektor, ami okozza csökkentés (gátlás) enzimaktivitást nevezzük inhibitor. Az effektor, ami okozza növelés (aktiválás) enzimaktivitást nevezzük aktivátor.
Az alloszterikus enzimek bizonyos szerkezeti jellemzőkkel rendelkeznek:
Általában vannak oligomer fehérjék, több protomerből áll;
Van allosztérikus központ, térben távol van a katalitikus aktív helytől;
Az effektorok nem kovalensen kapcsolódnak az enzimhez az alloszterikus (szabályozó) központokban.
Az alloszterikus centrumok, akárcsak a katalitikusok, eltérő specifitást mutathatnak a ligandumok tekintetében: lehet abszolút vagy csoportos. Egyes enzimek több alloszterikus centrummal rendelkeznek, amelyek egy része az aktivátorokra, mások az inhibitorokra specifikusak.
A protomert, amelyen az allosztérikus központ található, hívják szabályozó protomer nem úgy mint katalitikus protomer, aktív centrumot tartalmaz, amelyben kémiai reakció játszódik le.
Az alloszterikus enzimek rendelkeznek azzal a tulajdonsággal együttműködési készség: az alloszterikus effektor és az alloszterikus centrum kölcsönhatása az összes alegység konformációjában kooperatív változást okoz, ami az aktív centrum konformációjának megváltozásához és az enzim szubsztrát iránti affinitásának megváltozásához vezet, ami csökkenti vagy növeli a az enzim katalitikus aktivitása. Ha az allosztérikus centrumhoz inhibitor kötődik, akkor a kooperatív konformációs változások következtében az aktív centrum konformációja megváltozik, ami az enzim szubsztrát iránti affinitásának csökkenését okozza, és ennek megfelelően a konformáció csökkenését okozza. az enzimreakció sebessége. Ezzel szemben, ha egy aktivátor kapcsolódik az alloszterikus központhoz, akkor az enzim affinitása a szubsztráthoz megnő, ami a reakciósebesség növekedését okozza. Az alloszterikus effektorok hatására bekövetkező események sorozatát az ábra mutatja be. 2.26.
Az alloszterikus enzimek szabályozása megfordítható: az effektor leválása a szabályozó alegységről visszaállítja az enzim eredeti katalitikus aktivitását.
Alloszterikus enzimek katalizálja a kulcsreakciókat ennek az anyagcsere-útvonalnak.
Az alloszterikus enzimek fontos szerepet játszanak a különböző anyagcsere-utakban, mivel rendkívül gyorsan reagálnak a sejt belső összetételének legkisebb változásaira. Az anyagcsere-folyamatok sebessége az adott reakcióláncban felhasznált és képződő anyagok koncentrációjától függ. A prekurzorok az alloszterikus enzimek aktivátorai lehetnek az anyagcsereútban. Ugyanakkor, amikor bármely anyagcsereút végterméke felhalmozódik, az enzim alloszterikus inhibitoraként működhet. Ez a szabályozási módszer gyakori a szervezetben, és „negatív visszacsatolásnak” nevezik:
 Rizs. 2.26. Az alloszterikus enzim szerkezetének és működésének vázlata:
Rizs. 2.26. Az alloszterikus enzim szerkezetének és működésének vázlata:
A - egy negatív effektor (inhibitor) hatása. Az inhibitor (I) az alloszterikus centrumhoz kötődik, ami kooperatív konformációs változásokat okoz az enzimmolekulában, beleértve az enzim aktív centrumát is. Csökken az enzim affinitása a szubsztráthoz, és ennek következtében az enzimreakció sebessége csökken; B - egy pozitív effektor (aktivátor) hatása. Az aktivátor (A) az alloszterikus központhoz kötődik, ami kooperatív konformációs változásokat okoz. Az enzim affinitása a szubsztráthoz nő, és az enzimreakció sebessége nő. Mind az inhibitor, mind az aktivátor reverzibilis hatását az enzimaktivitásra kimutatták
Tekintsük a glükóz katabolizmus folyamatának allosztérikus szabályozását, amely az ATP molekula képződésével végződik (2.27. ábra). Abban az esetben, ha a sejtben lévő ATP-molekulákat nem fogyasztják el, akkor ez az anyagcsereút alloszterikus enzimeinek inhibitora: a foszfofruktokináz és a piruvát-kináz. Ugyanakkor a glükóz katabolizmus közbenső metabolitja, a fruktóz-1,6-biszfoszfát a piruvát-kináz enzim alloszterikus aktivátora. Az anyagcsereút végterméke általi gátlás és a kezdeti metabolitok általi aktiválás lehetővé teszi
 Rizs. 2.27. A glükóz katabolizmus folyamatának alloszterikus szabályozása.
Rizs. 2.27. A glükóz katabolizmus folyamatának alloszterikus szabályozása.
Az ATP-molekula a metabolikus útvonal enzimeinek - a foszfofruktokináz és a piruvát-kináz - alloszterikus inhibitora. A fruktóz-1,6-biszfoszfát molekula a piruvát-kináz enzim alloszterikus aktivátora
szabályozza az anyagcsere sebességét. Az alloszterikus enzimek általában katalizálják az anyagcsereút kezdeti reakcióit, irreverzibilis reakciókat, sebességkorlátozó reakciókat (a leglassabbakat) vagy az anyagcsereút elágazási pontján fellépő reakciókat.
3. Szabályozás fehérje-fehérje kölcsönhatások által. Egyes enzimek a fehérje-fehérje kölcsönhatások következtében megváltoztatják aktivitásukat. Az enzimaktivitás ilyen módon történő megváltoztatásának legalább két mechanizmusa különböztethető meg: az enzimek aktiválódása az aktivátor fehérjék hozzáadásával (az adenilát-cikláz enzim aktiválása a G fehérje α-alegysége által, lásd 4. modul) és a változások katalitikus aktivitásában a protomerek asszociációja és disszociációja következtében.
Az enzimek katalitikus aktivitásának protomerek asszociációjával vagy disszociációjával történő szabályozására példaként a protein kináz A enzim szabályozását tekinthetjük.
Protein kináz A(cAMP-dependens) négy kétféle alegységből áll: két szabályozó (R) és két katalitikus (C). Ennek a tetramernek nincs katalitikus aktivitása. A szabályozó alegységek kötőhelyekkel rendelkeznek a ciklikus 3",5"-AMP (cAMP) számára (kettő minden alegységhez). Négy cAMP molekula kapcsolódása két szabályozó alegységhez a szabályozó protomerek konformációjának megváltozásához és a tetramer komplex disszociációjához vezet; így két aktív katalitikus alegység szabadul fel (2.28. ábra). Az aktív protein-kináz A katalizálja a foszforsav-maradék átvitelét az ATP-ből a fehérjék aminosav-maradékainak specifikus OH-csoportjaiba (azaz a fehérjék foszforilációját okozza).
 Rizs. 2.28. A protein kináz A (PKA) aktivitásának szabályozása fehérje-fehérje kölcsönhatásokkal.
Rizs. 2.28. A protein kináz A (PKA) aktivitásának szabályozása fehérje-fehérje kölcsönhatásokkal.
A PKA-t négy cAMP molekula aktiválja, amelyek két szabályozó alegységhez kötődnek, ami a szabályozó protomerek konformációjának megváltozásához és a tetramer komplex disszociációjához vezet. Ez két aktív katalitikus alegységet szabadít fel, amelyek fehérje foszforilációt okozhatnak
A cAMP-molekulák szabályozó alegységekből történő lehasadása a protenkináz A szabályozó és katalitikus alegységeinek inaktív komplex kialakulásához vezet.
4. Enzimek katalitikus aktivitásának szabályozása foszforiláció-defoszforilációval. Biológiai rendszerekben gyakran találkozhatunk olyan mechanizmussal, amely az enzimek aktivitását a kovalens módosulásukkal szabályozza. Az enzimek kémiai módosításának gyors és elterjedt módszere a foszforiláció-defoszforiláció.
Az enzim OH csoportjai foszforiláción mennek keresztül, amelyet enzimek hajtanak végre protein kinázok(foszforiláció) és foszfoprotein foszfatázok(defoszforiláció). Foszforsav-maradék hozzáadása az aktív centrum konformációjának és katalitikus aktivitásának megváltozásához vezet. Ebben az esetben az eredmény kettős lehet: egyes enzimek a foszforiláció során aktiválódnak, míg mások éppen ellenkezőleg, kevésbé aktívak (2.29. ábra). A protein-kinázok és foszfoprotein-foszfatázok aktivitását hormonok szabályozzák, ami lehetővé teszi, hogy a metabolikus útvonalakban kulcsfontosságú enzimek aktivitása a környezeti feltételektől függően gyorsan változzon.
 Rizs. 2.29. Az enzimaktivitás szabályozásának vázlata foszforiláció-defoszforilációval.
Rizs. 2.29. Az enzimaktivitás szabályozásának vázlata foszforiláció-defoszforilációval.
Az enzimek foszforilációja a protein-kináz enzim segítségével történik. A foszforsav-maradék donorja az ATP-molekula. Egy enzim foszforilációja megváltoztatja annak konformációját és az aktív hely konformációját, ami megváltoztatja az enzim affinitását a szubsztráthoz. Ebben az esetben egyes enzimek aktiválódnak a foszforiláció során, míg mások gátolnak. A fordított folyamatot - a defoszforilációt - a foszfoprotein-foszfatáz enzimek okozzák, amelyek lehasítják az enzimről a foszforsavat, és visszaállítják az enzimet eredeti állapotába.
5. Enzimek katalitikus aktivitásának szabályozása részleges (korlátozott) proteolízissel. Egyes, a sejteken kívül működő enzimek (a gyomor-bél traktusban vagy a vérplazmában) inaktív prekurzorokként szintetizálódnak, és csak egy vagy több specifikus peptidkötés hidrolízise következtében aktiválódnak, ami a molekula egy részének eltávolításához vezet. A fehérjemolekula fennmaradó részében konformációs átrendeződés megy végbe, és kialakul az enzim aktív centruma (2.30. ábra). A részleges proteolízis egy példa a szabályozásra, amikor egy enzim aktivitása megváltozik
 Rizs. 2.30. A pepszin aktiválása részleges proteolízissel.
Rizs. 2.30. A pepszin aktiválása részleges proteolízissel.
A pepszinogén (egy inaktív molekula) egy vagy több peptidkötésének hidrolízise következtében a molekula egy része leszakad, és kialakul a pepszin enzim aktív centruma.
visszafordíthatatlan. Az ilyen enzimek általában rövid ideig működnek, amelyet a fehérjemolekula élettartama határoz meg. A részleges proteolízis az emésztési proteolitikus enzimek (pepszin, tripszin, kimotripszin, elasztáz), a peptidhormonok (inzulin), a véralvadási rendszer fehérjéi és számos más fehérje aktiválásának hátterében áll.