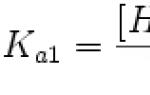Gyenge savak savassági állandóinak meghatározása. Savasság és bázikusság a vízben A tejsav savassági állandójának mutatója
A víz önionizálása
A víz még ismételt desztilláció után is megtartja elektromos áram vezetõ képességét. A víz ezen képessége az önionizációjának köszönhető.
$2H_2O ↔ H_3O^+ + OH^-$
A termodinamikai egyensúlyi állandó alakja:
1. kép
ahol $a_X^(rel)=\frac(a_X^(egyenlő))(a_X^0)$ az $X$ részecske relatív aktivitása az egyensúlyi rendszerben;
$aX^(egyenlő)$ a $X$ részecske abszolút aktivitása egy egyensúlyi rendszerben;
$(a_x)^0$ a $X$ abszolút aktivitása a rendszer termodinamikai állapotában.
A víz relatív aktivitása egyensúlyban gyakorlatilag egységgel egyenlő, mivel a reakció mértéke nagyon kicsi (ha elméletileg nem ionizált vizet vesszük standard állapotnak.
A $OH^-$ és $H_3O^+$ ionok aktivitási együtthatói tiszta vízben az egységhez közelítenek. A reakció egyensúlya erősen balra tolódik el. A $OH^-$ és $H_3O^+$ relatív aktivitása majdnem egyenlő moláris koncentrációjukkal. Ahol
$(K_a)^0 \sim K_(auto) = $
ahol $ és $ moláris koncentrációk;
$K_(auto)$ – a víz autoprolízis állandó értéke: 1,00 $\cdot 10^(-14) \mol^2/l^2$, 25 $^\circ \C.$
A tiszta vízben a $ és a $ koncentrációja tehát egyenlő lesz
$==\sqrt(10^(-14))=10^(-7)$ 25 $^\circ \ C.$ áron
A kiszámítás megkönnyítése érdekében a koncentrációt negatív logaritmusként, $pH$-ként jelöljük:
$pH= -lg $
A tiszta víz pH-értéke $7 $, savas oldatban $pH $ 7 $.
Sav disszociáció és savassági állandó
$AH$ sav esetén a disszociáció a következő egyenlettel fejezhető ki:
$AH + H_2O ↔ A^- + H_3O^+$
Egyensúlyi állapotban a víz relatív sűrűsége az egyik savról a másikra haladva kissé megváltozik, és végtelen hígítással a nullához közelít. Ezért a $K_a^0$ ($AH$) termodinamikai savassági állandót használjuk.
Az aktivitási együtthatók aránya minden savnál azonos, és egyenlő egységgel, ha a folyamatok híg oldatokban mennek végbe.
Ezután híg vizes oldatban a $Ka (AH$) savassági állandót használjuk a saverősség mértékeként, amely a következő képlettel határozható meg:
$Ka (AH)=\frac()()$
A képlet a részecskék moláris koncentrációját jeleníti meg rögzített hőmérsékleten $(25^\circ \C)$ egyensúlyi állapotban.
Minél nagyobb a savassági állandó, annál nagyobb a disszociáció mértéke, annál erősebb a sav. A savasság kiszámításához és jellemzéséhez a $pKa$ savassági állandó negatív logaritmusát használjuk.
$pKa (AH)= -lgKa (AH)$
Minél nagyobb a savassági állandó értéke, annál gyengébb a sav.
A savassági állandó értéke megegyezik annak az oldatnak a $pH$ értékével, amelynél a sav félig ionizálódik:
$pKa (AH) = pH - log \frac()()$
A vizes oldatban lévő vízmolekulák savasságát jellemző érték egyenlő:
$Ka=\frac()()=\frac(Ka_(auto))()=\frac(10^(-14))(55,5)$
Így $25^\circ C$ hőmérsékleten $pKa (H_2O) = 15,7$. Ez az érték jellemzi az oldatban lévő vízmolekulák savasságát.
Hidroniumion esetén $pKa (H_3O^+) = pK_(auto) - pKa = 14-15,7 = -1,7.$
A $pKa$ értékek táblázatos adatok. A $pKa 0$-os savak esetében azonban a táblázat adatai pontatlanok lesznek.
A víz savassági állandóit a $A^-$ és $AH$ koncentrációjának közvetlen mérésével csak akkor lehet meghatározni, ha a sav disszociációja legalább bizonyos mértékig, sőt alig észrevehetően megtörténik.
Ha a sav nagyon gyenge, így gyakorlatilag nem disszociál, akkor a $A^-$ koncentrációja nem mérhető pontosan. Ha éppen ellenkezőleg, a sav olyan erős, hogy szinte teljesen disszociál, akkor nem lehet mérni a $AH$ koncentrációt. Ebben az esetben a savasság meghatározására közvetett módszereket kell alkalmazni.
Bázis ionizációs állandó
A vízben lévő bázis disszociációs állandójának kifejezésére a következő egyenletet használjuk:
$B + H_2O ↔ BH^+ + OH^-$
A bázikussági állandó:
$Kb=\frac())([B])$
Mostanában a bázikussági állandókat gyakorlatilag nem használják a számításokban, mivel a konjugált sav savassági állandójából minden szükséges információt megkaphatunk a $BH^+ bázisról.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
A sav savassági állandója az erősség mértéke:
- $AH$ vagy $BH^+$ protondonorként;
- $A^-$ vagy $B$ proton akceptorként;
- egy erős sav $AH$ vagy $BH^+$ egy gyenge $A^-$ vagy $B$ konjugált bázisnak felel meg, és ekkor a $pKa$ értéke kicsi vagy negatív;
- egy erős bázis $A^-$ vagy $B$ egy gyenge $AH$ vagy $BH^+$ savnak felel meg, és a savassági állandó pozitív lesz
A savak vagy bázisok erőssége közvetlenül csak a $pKa (BH^+) szűk tartományában mérhető. A tartományon kívül a bázikusságot közvetett módszerekkel határozzuk meg. A $pka (BH^+)$ értékei a $-2$ és $17$ közötti intervallumon kívül pontatlanok lesznek.
A savak szerkezete és szilárdsága közötti összefüggés
A savak relatív erőssége megjósolható a központi atom természete és a savmolekula szerkezete alapján.
Az oxigénmentes sav $HX$ és $H_2X$ (ahol $X$ halogén) erőssége annál nagyobb, minél gyengébb a $X-H$ kötés, vagyis minél nagyobb a $X$ atom sugara.
A $HF - HCl - HBr - HI$ és a $H_2S - H_2Se - H_2Te$ sorozatban a savak erőssége nő.
Oxigéntartalmú savak esetén minél nagyobb m értéke a $E(OH)nOm$ összetételű vegyületben, annál nagyobb a savak erőssége.
Így ezen elmélet szerint Sav minden olyan anyag, amelynek molekulái (beleértve az ionokat is) képesek protont adni, pl. legyen protondonor; Bázisnak minősül minden olyan anyag, amelynek molekulái (beleértve az ionokat is) képesek protont kapcsolódni, pl. proton akceptor legyen; Az amfolit minden olyan anyag, amely proton donor és akceptor is egyben.
Ez az elmélet nemcsak a semleges molekulák, hanem az ionok sav-bázis tulajdonságait is megmagyarázza. A sav, feladva egy protont, bázissá alakul, amely ennek a savnak a konjugátuma. A „sav” és „bázis” kifejezések relatív fogalmak, mivel ugyanazok a részecskék – molekulák vagy ionok – a partnertől függően bázikus és savas tulajdonságokat is mutathatnak.
A protolitikus egyensúly során sav-bázis párok jönnek létre. A protonelmélet szerint a hidrolízist, az ionizációt és a semlegesítési reakciókat nem tekintik speciális jelenségnek, hanem a protonok savból bázisra történő szokásos átvitelének tekintik.
Az A részecske egy hidrogénion elválasztása után keletkezik
PH érték
A víz, mint gyenge elektrolit, kis mértékben ionizálódik:
H 2 O ↔ H + + OH - .
A vizes oldatban lévő ionok hidratálódnak (vizes)
A vizet protolitikus amfoteritás jellemzi. A víz önionizációs reakcióját (autoprotolízisét), amelynek során az egyik vízmolekulából (savból) egy proton átmegy egy másik vízmolekulába (bázis), a következő egyenlet írja le:
H 2 O + H 2 O ↔ H 3 O + + OH - .
A víz autoprotolízis egyensúlyi állandója egyenlő:
Az ionizációs állandóra a tömeghatás törvényét alkalmazzuk:
ahol a tevékenység.
A tömörség kedvéért sav-bázis egyensúlyban a H 3 O + helyett írjuk
Mivel a víz nagy feleslegben van oldatban, és kismértékben ionizálódik, megjegyezhető, hogy koncentrációja állandó, és 55,6 mol (1000 g: 18 g/mol = 56 mol) per liter víz.
Ezért a K és (H 2 O) szorzata és a vízkoncentráció egyenlő 1,8 10 -16 mol/l 55,6 mol/l = 10 -14 mol 2 /l 2 -vel. Így = 10 -14 (25 °C-on) állandó érték, jelöli Kwés úgy hívják víz autoprotolízis állandó. Néha az elavult nevet használják - a víz ionos termékét.
Azokat az oldatokat, amelyekben a hidrogénionok és a hidroxidionok koncentrációja azonos, semleges oldatoknak nevezzük = = = 10 -7 mol/l. Savas oldatban > , > 10 -7 mol/l, lúgos oldatban > , > 10 -7 mol/l.
Az egyszerűsítés kedvéért a pH hidrogénindikátort vesszük alapul - a hidrogénionok koncentrációjának decimális logaritmusát, ellenkező előjellel: pH = -lg.
Érdekes tények:
Az izohidrális állapot megsértése ( pH állandóság) szív- és érrendszeri betegségekben, ischaemiában, diabetes mellitusban (acidózis alakul ki). A sav-bázis egyensúlyt légzés, vizelés és izzadás tartja fenn. Ezek a rendszerek lassan működnek, és a savas és lúgos anyagcseretermékek azonnali semlegesítését a szervezet pufferrendszerei végzik. Az izohidrát állapotát számos fizikai-kémiai és élettani mechanizmus együttes hatása biztosítja. A pufferhatást több protolitikus egyensúly kombinálásával érik el.
A savak erősségét protonadó képességük határozza meg. Ennek a képességnek a mértéke az savassági állandó (Ka).
Minél nagyobb a savassági állandó, annál erősebb a sav. Például az ecetsav erősebb, mint a hidrogén-cianid, mivel Ka(CH 3 COOH) = 1,74 10 -5, Ka(HCN) = 1 10 -9. A számítások és a rögzítés megkönnyítése érdekében gyakran nem magukat az állandókat használják, hanem a negatív decimális logaritmusukat: pKa = -lgKa. A pKa értéket ún sav szilárdsági mutatója. Minél magasabb a pKa érték, annál gyengébb a sav.
Az erős savak szinte teljesen átadják protonjukat a vízmolekuláknak, így az oldatban jelenlévő sav valójában egy hidrogénion.
Ebben a tekintetben egy erős egybázisú sav oldatának pH-értékének kiszámításakor a protonok koncentrációja egyenlő a sav koncentrációjával.
c(H3O+) = c(HB).
Gyenge savak oldataiban a hidrogénionok koncentrációja lényegesen alacsonyabb, mint a sav koncentrációja. alapján számítják ki
ennek az egyenletnek mindkét oldala egy képletet ad a gyenge savak oldatainak pH-értékének kiszámításához: pH = 0,5(pKa - log c(HB)).
29. Gyenge elektrolitok. A savasság és a lúgosság állandó. Oswald hígítási törvénye.
A gyenge elektrolitok olyan kémiai vegyületek, amelyek molekulái még erősen híg oldatokban is enyhén disszociálnak olyan ionokká, amelyek dinamikus egyensúlyban vannak a nem disszociált molekulákkal. A gyenge elektrolitok közé tartozik a legtöbb szerves sav és sok szerves bázis vizes és nemvizes oldatokban.
A gyenge elektrolitok a következők:
szinte minden szerves sav és víz;
néhány szervetlen sav: HF, HClO, HClO 2, HNO 2, HCN, H 2 S, HBrO, H 3 PO 4, H 2 CO 3, H 2 SiO 3, H 2 SO 3 stb.;
néhány rosszul oldódó fém-hidroxid: Fe(OH) 3, Zn(OH) 2 stb.
A savas disszociációs állandó (Ka) a sav disszociációjának hidrogénionná és a savmaradék anionjává való reakciójának egyensúlyi állandója. Azoknál a többbázisú savaknál, amelyek disszociációja több szakaszban megy végbe, külön konstansokat használnak a disszociáció különböző szakaszaira, jelölve őket K a1, K a2 stb.
Példa a kétbázisú sav kiszámítására:

![]()
Gyakrabban a K disszociációs állandó helyett a pK értéket használják, amelyet magának az állandónak a negatív decimális logaritmusaként definiálunk:
A bázis olyan kémiai vegyület, amely kovalens kötést tud létrehozni egy protonnal (Brønsted-bázis) vagy egy másik kémiai vegyület üres pályájával (Lewis-bázis). Szűk értelemben a bázisok bázikus hidroxidok - összetett anyagok, amelyek disszociációja során vizes oldatokban csak egyfajta anion hasad le - hidroxidionok OH-.
A Brønsted-Lowry elmélet lehetővé teszi, hogy számszerűsítsük a bázisok erősségét, vagyis azt, hogy mennyire képesek protont elvonni a savaktól. Ezt általában a Kb bázikussági állandó használatával teszik meg, amely egy bázis és egy referencia sav reakciójának egyensúlyi állandója, amelyhez vizet választanak. Minél nagyobb a bázikussági állandó, annál nagyobb a bázis erőssége, és annál nagyobb a képessége a proton elvonatkoztatására. A bázikussági állandót gyakran a pKb bázikussági állandó kitevőjeként fejezik ki. Például az ammóniára, mint Brønsted-bázisra a következőket írhatjuk:

Az Ostwald-féle hígítási törvény egy összefüggés, amely egy bináris gyenge elektrolit híg oldatának egyenértékű elektromos vezetőképességének az oldat koncentrációjától való függését fejezi ki: ![]()
Itt K az elektrolit disszociációs állandója, c a koncentráció, λ és λ∞ az egyenértékű elektromos vezetőképesség értékei c koncentrációnál és végtelen hígításnál. A kapcsolat a tömegcselekvés törvényének és az egyenlőségnek a következménye, ahol α a disszociáció mértéke.
30. A víz gyenge elektrolit. A víz ionos terméke. PH. POh
A víz ionos terméke a H+ hidrogénionok és az OH− hidroxilionok vízben vagy vizes oldatokban való koncentrációjának szorzata, a víz autoprotolízisállandója.
A víz, bár gyenge elektrolit, kis mértékben disszociál:
Ennek a reakciónak az egyensúlya erősen balra tolódik. A víz disszociációs állandója a következő képlettel számítható ki:
![]()
Hidroniumionok (protonok) koncentrációja;
Hidroxidion koncentráció;
Víz koncentrációja (molekuláris formában) a vízben;
A víz koncentrációja a vízben, figyelembe véve annak alacsony disszociációs fokát, gyakorlatilag állandó és (1000 g/l)/(18 g/mol) = 55,56 mol/l.
25 °C-on a víz disszociációs állandója 1,8·10-16 mol/l. Az (1) egyenlet átírható a következőképpen:
Jelöljük a K· = K szorzatot in = 1,8·10–16 mol/l·55,56 mol/l = 10–14 mol²/l² = · (25 °C-on).
A K in állandót, amely megegyezik a protonok és a hidroxidionok koncentrációjának szorzatával, a víz ionos termékének nevezzük. Nem csak a tiszta víz, hanem az anyagok híg vizes oldatai esetében is állandó. A hőmérséklet növekedésével a víz disszociációja növekszik, ezért a Kv is nő, a hőmérséklet csökkenésével - fordítva.
A hidrogén-index, pH - az oldatban lévő hidrogénionok aktivitásának mértéke, és mennyiségileg kifejezi annak savasságát, a hidrogénionok aktivitásának negatív (ellentétes előjellel vett) decimális logaritmusaként számítják ki, mol per literben kifejezve:
Az inverz pH-érték valamivel kevésbé elterjedt - az oldat bázikusságának mutatója, a pOH, amely megegyezik az oldatban lévő OH - ionok koncentrációjának negatív decimális logaritmusával:
Összekapcsolási szint:
Általános esetben, a Bronsted-Lowry protolitikus elméletnek megfelelően, a (4.2) egyenlet szerint gyenge monoprotikus sav disszociációjára:
Valódi termodinamikai állandó NAK NEK ez az egyensúly lesz
ahol minden tevékenység egyensúlyban van. Képzeljük el ezt az arányt a következő formában:
Jelöljük, mint az előző esetben, két állandó szorzatát NAK NEKés a(H 2 O) - (H 2 O) = állandó at T= const. Akkor
vagy hozzávetőlegesen:
ahol minden koncentráció egyensúlyban van. Itt az érték NAK NEK A hívott savas disszociációs (ionizációs) állandó vagy egyszerűen savassági állandó.
Sok gyenge sav esetében a számértékek NAK NEK A nagyon kicsik, így a méret helyett NAK NEK A alkalmaz erősségjelző (vagy egyszerűen jelző):
rK A =- lg NAK NEK A .
A több NAK NEK A(azaz minél kevesebb p NAK NEK A ), annál erősebb a sav.
Legyen a HB egybázisú sav kezdeti koncentrációja egyenlő az oldatban való disszociációjának (ionizációjának) mértékével. Ekkor a [H 3 O + ] és a [B - ] ionok egyensúlyi koncentrációja egyenlő lesz: [H 3 O + ] = [B - ] = αс A , egyensúlyi savkoncentráció [НВ] = Val vel A - α Val vel A = Val vel A(1 - α). Az egyensúlyi koncentrációk ezen értékeit behelyettesítve az egyensúlyi állandó (4.10) kifejezésébe, a következőt kapjuk:
Ha koncentráció helyett Val vel A használja az inverzét V- hígítás (hígítás), l/mol-ban kifejezve, V=1/Val vel A , majd a képletet NAK NEK Aígy fog kinézni:
Ez a kapcsolat és a kifejezés is
leírni Ostwald hígítási törvénye (vagy hígítási törvény) gyenge bináris elektrolithoz. A1-nél (tipikus eset sok analitikai rendszerben)
Könnyen kimutatható, hogy általános esetben bármilyen összetételű gyenge elektrolithoz K n A m, amely a séma szerint ionokra bomlik.
K n A m = P NAK NEK t+ +t A n -
Az Ostwald-féle hígítási törvényt a reláció írja le
Ahol Val vel- gyenge elektrolit, például gyenge sav kezdeti koncentrációja. Tehát a H 3 PO 4 ortofoszforsavhoz (P = 3,
T= 1), amely a séma szerint teljesen ionokra bomlik

![]() .
.
Egy bináris elektrolit esetében az összefüggés a (4.11) lesz. Az a1-hez a következők vannak:
Határozzuk meg az NV egybázisú sav oldatának egyensúlyi pH értékét. A hidrogénionok egyensúlyi koncentrációja
A jelölést használva kapjuk:
pH = 0,5 (r NAK NEK A+p Val vel A). (4.12)
Tehát egy gyenge monoprotikus sav oldatának egyensúlyi pH-értékének kiszámításához ismerni kell ennek a savnak a savassági állandóját. NAK NEK Aés annak kezdeti koncentrációja Val vel A .
Számítsuk ki egy 0,01 mol/l kezdeti koncentrációjú ecetsavoldat pH-ját!
Szobahőmérsékleten az ecetsavhoz NAK NEK A = 1,74·10 -5 és p NAK NEK A = 4,76.
A (4.12) képlet szerint felírhatjuk:
pH = 0,5 (p NAK NEK A+p Val vel A) = 0,5(476-0,01) = 0,5(4,76+2) = 3,38.
Hasonló megfontolás elvégezhető bármely gyenge megoldás egyensúlyára többbázisú savak.
A többbázisú savak fokozatosan, több szakaszban disszociálnak ionokká, amelyek mindegyikét saját egyensúlyi állandó jellemzi. lépcsőzetes sav disszociációs állandó. Például ortobórsav oldatokban H 3 BO 3 egyensúlyok jönnek létre (az állandó értékeket 25 ° C-ra adjuk meg):
H 3 VO 3 + H 2 O = H 3 O + +, NAK NEK 1
= ![]()
H 2 O = H 3 O + +, NAK NEK 2
= ![]()
H 2 O = H 3 O + +, NAK NEK 3 =
Minden következő lépés sav disszociációs állandója kisebb, mint az előző lépés disszociációs állandója - általában több nagyságrenddel.
Az összes fokozatos disszociációs állandó szorzata egyenlő a K teljes savdisszociációs állandóval:
NAK NEK 1 NAK NEK 2 ...NAK NEK P =K.
Így könnyen belátható, hogy az ortobórsav esetében ez az érték
NAK NEK 1
NAK NEK 2
NAK NEK 3
=K= ![]()
van egy teljes sav disszociációs állandó a séma szerint:
4.3.2 Gyenge bázisok oldatainak bázikussági állandója és pH-ja
A savak és bázisok Brønsted-Lowry protolitikus elméletével összhangban, általános esetben egysavas gyenge bázis B vizes oldatokban történő ionizálására a következőket írhatjuk:
B + H 2 O = HB + + OH -
Ha a bázis ionizációs foka a1, akkor ennek a kémiai egyensúlynak az állandója a koncentrációs állandó.
Az előzőhöz hasonlóan eljárva a következőket kapjuk:
NAK NEK = =K b = const mikor T= konst
mint két állandó szorzata NAK NEK=állandó és [H 2 O] = állandó.
Nevezzük a mennyiséget K b , egyenlő tehát,
K b = , (4.13)
gyenge egysavas bázis disszociációs (ionizációs) állandójavagycsak egy alapossági állandó ez az alap, és a nagyságrend
p K b = K b ,
A bázikussági állandó erősségi mutatója (vagy egyszerűen mutatója).
Az Ostwald-hígítási törvény szerint a vizsgált esetben (hasonlóan a (4.11) összefüggéshez)
K b =,
ahol az egysavas gyenge bázis ionizációs foka és a kezdeti koncentrációja. Mivel gyenge bázishoz a1, akkor
Határozzuk meg a kérdéses monosav bázis vizes oldatának egyensúlyi pH értékét szobahőmérsékleten! A (4.7) képletnek megfelelően a következőket kapjuk:
pH = p NAK NEK w - pOH = 14 - pOH.
Határozzuk meg a pOH = [OH - ] értéket. Magától értetődően
[OH - ] = = ![]()
A pOH = [OH - ] mutatók felhasználásával, p NAK NEK b =K bÉs
p = , kapjuk: pOH = 0,5 (p NAK NEK b+ p). Ezt a kifejezést behelyettesítve a pH fenti képletébe, megkapjuk az összefüggést
pH = 14 - pOH = 14 - 0,5 (p NAK NEK b+ p).
Tehát az egyensúlyi pH-érték gyenge egysavas bázis oldatában a (4.15) képlettel számítható ki:
pH = 14-0,5 (p NAK NEK b+ p). (4.15)
Számítsuk ki a pH-t 0,01 mol/l-es vizes ammóniaoldatban, amelyhez szobahőmérsékleten NAK NEK b= és p NAK NEK b = 4,76.
Vizes ammóniaoldatban egyensúly jön létre:
amely többnyire balra tolódik el, így az ammónia ionizációs foka . Ezért a pH-érték kiszámításához használhatja a (4.15) összefüggést:
pH = 14-0,5 (p NAK NEK b+ p) =
Hasonló megfontolás minden gyenge esetében elvégezhető polisav okokból. Igaz, ez körülményesebb kifejezéseket eredményez.
A gyenge polisav bázisok, akárcsak a gyenge többbázisú savak, fokozatosan disszociálnak, és minden disszociációs lépésnek megvan a maga fokozatos bázis disszociációs állandója - lépcsőzetes bázikussági állandó.
Például a Pb(OH) 2 ólom-hidroxid vizes oldatokban két lépésben bomlik ionokra:
![]()
Ugyanezek az egyensúlyok másképpen is felírhatók, ragaszkodva (a protolitikus elmélet keretein belül) a bázis definíciójához, mint olyan anyaghoz, amely protont köt, jelen esetben azt egy vízmolekulától elfogadva:
A lépcsőzetes bázikussági állandók a következő formában ábrázolhatók:
![]()
![]()
A jelzett egyensúlyok rögzítésével feltételezzük, hogy a vízmolekulából egy proton egy hidroxilcsoportba kerül vízmolekula képződésével (), aminek következtében a vízmolekulák száma az ólom (II) atom közelében eggyel nő, és a vezető (II) atomhoz kapcsolódó hidroxilcsoportok száma ), szintén eggyel csökken minden disszociációs lépésben.
Munka NAK NEK 1 NAK NEK 2 =K=[Pb 2+ ][OH - ] 2 /[Pb(OH) 2 ] =
2,865, ahol NAK NEK- teljes disszociációs állandó a séma szerint
vagy más felírt séma szerint
ami végül ugyanarra az eredményre vezet.
Egy másik példa a szerves bázisú etilén-diamin, amely vizes oldatban két lépésben ionizálódik. Első fázis:
![]()
Második szakasz:
![]()
Munka ![]() -
-
teljes disszociációs állandó. Az egyensúlynak felel meg
Az egyensúlyi állandók számértékei fent vannak szobahőmérsékletre.
Akárcsak a többbázisú savak esetében, gyenge polisav bázis esetén az egyes további lépések disszociációs állandója általában több nagyságrenddel kisebb, mint az előző szakasz disszociációs állandója.
táblázatban A 4.2 táblázat egyes gyenge savak és bázisok savassági és bázikussági állandóinak számértékeit mutatja.
4.2. táblázat. Valódi termodinamikai ionizációs állandók egyes savak és bázisok vizes oldataiban.
NAK NEK A- állandó savasság, NAK NEK b- bázikusság állandó,
NAK NEK 1 - disszociációs állandó az első lépéshez,
NAK NEK 2
- disszociációs állandó a második lépéshez stb.
| Gyenge savak disszociációs állandói |
||
| Sav | NAK NEK A | R NAK NEK A=-lg NAK NEK A |
| Nitrogéntartalmú Aminoecetsav Benzoinaya Bór (ortobór) Tetraboric A protolitikus reakciók típusai. MU „Megoldások” 52-55 A víz autoprotolízise. A víz ionos terméke.MU "Megoldások"» 56. oldal A vízmolekulák kis része mindig ionos állapotban van, bár ez egy nagyon gyenge elektrolit. A víz ionizációját és további disszociációját, mint már említettük, a sav-bázis diszproporcionálás vagy autoprotolízis protolitikus reakciójának egyenlete írja le. A víz nagyon gyenge elektrolit, ezért a konjugált sav és a konjugált bázis erős. Ezért ennek a protolitikus reakciónak az egyensúlya balra tolódik el. Ennek az egyensúlynak a K állandója = A vízion-koncentráció × szorzatának mennyiségi értéke az a víz ionos terméke. Ez egyenlő: × = K egyenlő. × 2 = 1 × 10 – 14 Ezért: KH 2O = × = 10–14 vagy egyszerűsített KH 2O = × = 10–14 A KH2O a víz ionos terméke, a víz autoprotolízis állandója vagy egyszerűen a víz állandója. A KH2O a hőmérséklettől függ. A hőmérséklet emelkedésével növekszik. Vegytiszta vízben = = = 1×10 – 7. Ez egy semleges környezet. Az oldat tartalmazhat > – a közeg savas ill< – среда щелочная = ; = PH érték Az oldatok savasságának kvantitatív kifejezésére használja hidrogénion koncentráció jelző pH. A hidrogénindex az oldatban lévő szabad hidrogénionok koncentrációjának negatív decimális logaritmusával egyenlő érték. pH = – log ⇒ = 10 – pH Semleges környezetben pH = 7 Savas pH-n< 7 Lúgos pH-nál > 7 A közeg bázikusságának jellemzésére a pOH hidroxil indikátort használjuk рОН = – log [ОH - ] ⇒ [ОH - ] = 10 – рОН pH + pOH = 14 Þ pH = 14 – pOH és pOH = 14 – pH Képletek savak és bázisok oldatai pH-értékének kiszámításához. pH = – log
Számítsa ki a C(HCl) = 0,1 mol/l értékű HCl-oldat pH-értékét teljes disszociáció mellett! C(HCl) = 0,1 mol/l; pH = – log 0,1 = 1 2. Erős bázisok: [ОH - ] = С(1/z bázis) Ugyanilyen körülmények között számítsuk ki a NaOH-oldat pH-értékét. C(NaOH) = 0,1 mol/l; = = 10 – 13 ; pH = – log 10 – 13 = 13 3. Gyenge savak Számítsa ki a 0,5 mol/l moláris koncentrációjú ecetsav oldat pH-értékét. K CH 3COOH = 1,8×10 – 5. 3×10 – 3 pH = – log 3×10 – 3 = 2,5 4. Gyenge alapok Számítsa ki egy 0,2 mol/l moláris koncentrációjú ammóniaoldat pH-értékét. K NН 3 = 1,76 × 10 – 5 1,88×10 – 3 0,53×10 – 11; pH = – log 0,53×10 – 11 = 11,3 5. C(H +) = [H + ] = 10 – pH pH = 7 mellett [H + ] = 10-7 A pH meghatározására többféle módszer létezik: indikátorok és ionomer eszközök. A pH értéke a szervezetben zajló kémiai reakciókhoz és biokémiai folyamatokhoz. Számos reakció szigorúan meghatározott pH-értéket igényel, hogy egy bizonyos irányban lezajlik. Normális esetben egy egészséges szervezetben a legtöbb biológiai folyadék környezetének reakciója közel semleges. Vér – 7.4 Nyál – 6.6 Bélnedv – 6.4 Epe – 6,9 Vizelet – 5.6 Gyomornedv: a) nyugalmi állapotban – 7.3 b) emésztési állapotban – 1,5-2 A pH normától való eltérésének diagnosztikus (a betegség meghatározása) és prognosztikai (a betegség lefolyása) jelentősége van. Az acidózis a pH eltolódása a savas oldalra, a pH csökken, a hidrogénionok koncentrációja nő. Az alkalózis a pH-érték eltolódása a lúgos tartományba, a pH növekszik, és a hidrogénionok koncentrációja csökken. A vér pH-értékének átmeneti eltérése a normától tizedekkel súlyos zavarokhoz vezet a szervezetben. A vér pH-értékének hosszú távú eltérése végzetes lehet. A vér pH-jának eltérése 6,8-8 lehet, az ezen a tartományon kívüli bármilyen irányú változás összeegyeztethetetlen az élettel. Kombinált és izolált protolitikus egyensúlyok. A protolitikus folyamatok reverzibilis reakciók. A protolitikus egyensúlyok a gyengébb savak és bázisok képződése felé tolódnak el. A proton birtoklásáért különböző erősségű bázisok versengésének tekinthetők. Izolált és kombinált egyensúlyokról beszélnek. Ha több egyidejűleg fennálló egyensúly független egymástól, akkor azokat izoláltnak nevezzük. Az egyik egyensúlyi eltolódása nem vonja maga után a másik egyensúlyi helyzetének változását. Ha az egyik egyensúlyváltozása a másik egyensúlyának megváltozásához vezet, akkor kombinált (konjugált, versengő) egyensúlyokról beszélünk. A kombinált egyensúlyú rendszerekben a domináns folyamat az, amelyet az egyensúlyi állandó nagyobb értéke jellemez. A második folyamat lesz az uralkodó, mert egyensúlyi állandója nagyobb, mint az első folyamat egyensúlyi állandója. Az egyensúly a második folyamatban nagyobb mértékben tolódik el jobbra, mert a metil-amin erősebb bázis, mint az ammónia, az NH 4 + erősebb sav, mint a CH 3 NH 3 +. Következtetés: Az erősebb bázis elnyomja a gyengébb bázis ionizációját. Ezért ha kis mennyiségű sósavat adunk az ammónia és metil-amin keverékéhez, akkor főleg a metil-amin megy keresztül protonálódáson. És még: a legerősebb sav elnyomja a gyenge savak ionizációját. Így a gyomornedvben található sósav elnyomja az (élelmiszerből származó) ecetsav vagy az acetilszalicilsav (gyógyszer) ionizációját. ______________________________________________________________ Kapcsolódó kiadványok
| ||