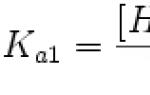Kálium. A kálium tulajdonságai. A kálium felhasználása Hol található a kálium a természetben?
A kálium az első csoport, a kémiai elemek periódusos rendszerének negyedik periódusának fő alcsoportjába tartozó elem, 19-es rendszámmal. Jelöljük K (lat. Kalium) szimbólummal. A kálium egyszerű anyag (CAS-szám: 7440-09-7) ezüstfehér színű lágy alkálifém.
A természetben a kálium csak más elemekkel kombinálva található, például a tengervízben, valamint számos ásványi anyagban. Levegőn nagyon gyorsan oxidálódik, és nagyon könnyen kémiai reakciókba lép, különösen vízzel, lúgot képezve. A kálium kémiai tulajdonságai sok tekintetben nagyon hasonlóak a nátriuméhoz, de biológiai funkciójukat és az élő szervezetek sejtjei általi felhasználásukat tekintve mégis eltérőek.
A név története és eredete
A káliumot (pontosabban vegyületeit) ősidők óta használják. Így a hamuzsír előállítása (amit mosószerként használt) már a 11. században is létezett. A szalma vagy fa égetésekor keletkező hamut vízzel kezelték, majd a keletkező oldatot (lúgot) szűrés után elpárologtatták. A száraz maradék a kálium-karbonáton kívül kálium-szulfátot K2SO4, szódát és kálium-klorid KCl-t tartalmazott.
1807-ben Davy angol kémikus olvadt kálium-hidroxid (KOH) elektrolízisével izolálta a káliumot, és „káliumnak” nevezte el (latinul kálium; ezt a nevet ma is használják angolul, franciául, spanyolul, portugálul és lengyelül). 1809-ben L. V. Gilbert javasolta a „kálium” nevet (latin kalium, arab al-kali - hamuzsír). Ez a név bekerült a német nyelvbe, onnan Észak- és Kelet-Európa legtöbb nyelvébe (beleértve az oroszt is), és „nyert” az elem szimbólumának kiválasztásakor - K.
Nyugta
A káliumot, más alkálifémekhez hasonlóan, olvadt kloridok vagy lúgok elektrolízisével nyerik. Mivel a kloridok olvadáspontja magasabb (600-650 °C), a kiegyenesített lúgok elektrolízisét gyakrabban végzik szóda vagy kálium hozzáadásával (legfeljebb 12%). Az olvadt kloridok elektrolízise során a katódon olvadt kálium, az anódon pedig klór szabadul fel:
K + + e - → K
2Cl - - 2e - → Cl 2
A lúgok elektrolízise során a katódon olvadt kálium, az anódon pedig oxigén szabadul fel:
4OH - - 4e - → 2H 2 O + O 2
Az olvadékból származó víz gyorsan elpárolog. Annak megakadályozására, hogy a kálium kölcsönhatásba lépjen a klórral vagy az oxigénnel, a katód rézből készül, és egy rézhengert helyeznek el felette. A kapott káliumot olvadt formában egy hengerben gyűjtik össze. Az anód nikkelből (lúgok elektrolíziséhez) vagy grafitból (kloridok elektrolíziséhez) henger formájában is készül.
Fizikai tulajdonságok
A kálium egy ezüstös anyag, amely a frissen kialakított felületen jellegzetes fényt mutat. Nagyon könnyű és olvadó. A higanyban viszonylag jól oldódik, amalgámokat képez. Ha káliumot (valamint vegyületeit) adjuk az égő lángjához, az a lángot jellegzetes rózsaszín-lila színűre színezi.
Kémiai tulajdonságok
Az elemi kálium a többi alkálifémhez hasonlóan jellegzetes fémes tulajdonságokkal rendelkezik, kémiailag nagyon aktív és erős redukálószer. Levegőben a friss vágás gyorsan elhalványul a vegyületek (oxidok és karbonátok) filmjei miatt. A légkörrel való hosszan tartó érintkezés esetén teljesen összeomolhat. Robbanásveszélyesen reagál vízzel. Benzin-, kerozin- vagy szilikonréteg alatt kell tárolni, nehogy levegő és víz érintkezzen a felületével. A kálium intermetallikus vegyületeket képez Na, Tl, Sn, Pb, Bi-vel.
A káliumvegyületeket, mint legközelebbi kémiai analógját, a nátriumot, ősidők óta ismerték, és az emberi tevékenység különböző területein alkalmazták. Magukat azonban ezeket a fémeket először csak 1807-ben izolálták szabad állapotban az angolok kísérletei során. tudós G. Davy. Enyhén nedvesített szilárd lúgok elektrolízisével szabad fémeket - káliumot és nátriumot - kaptunk. Davy az új fémet Káliumnak nevezte, de ez a név nem maradt el.
A fém keresztapja Gilbert volt, az Annalen de Physik magazin híres kiadója, aki a "kálium" nevet javasolta; Németországban és Oroszországban fogadták el. Mindkét név olyan kifejezésekből származik, amelyeket jóval a káliumfém felfedezése előtt használtak.
A kálium szó a hamuzsír szóból származik, amely valószínűleg a 16. században jelent meg. Van Helmontban található a 17. század második felében. széles körben használják kereskedelmi termék - hamuzsír - neveként Oroszországban, Angliában és Hollandiában. Oroszra fordítva a potase szó jelentése „fazék hamu vagy fazékban főtt hamu”; a XVI - XVII században. a hamuzsírt hatalmas mennyiségben nyerték ki fahamuból, amelyet nagy kazánokban főztek. A hamuzsírból főleg literált (tisztított) salétromot készítettek, amiből lőport készítettek. Különösen sok hamuzsírt termeltek Oroszországban, az Arzamas és Ardatov melletti erdőkben olyan mobil gyárakban (Maidans), amelyek Alekszej Mihajlovics cár rokonának, egy közeli bojárnak, B. I. Morozovnak voltak.
Ami a kálium szót illeti, az arab alkáli (lúgos anyagok) kifejezésből származik. A középkorban a lúgokat, vagy ahogy akkoriban mondták, a lúgos sókat szinte nem lehetett megkülönböztetni egymástól, és azonos jelentésű nevekkel nevezték őket: nátron, bórax, varek stb. Megtalálták a kali (qila) szót. 850 arab író körül, akkor kezdték el használni a Qali (al-Qali) szót, amely egyes növények hamujából nyert terméket jelölt, az arab qiljin vagy qaljan (hamu) és qalaj (égés) szóhoz kötődik. Az atrokémia korszakában a lúgokat „rögzített” és „illékony” részekre osztották. A 17. században Léteznek nevek alkali fixum minerale (ásványi fixált alkáli vagy nátronlúg), alkáli fixum. növényi (növényi fix lúg vagy kálium és maró kálium), valamint alkáli illékony (illékony lúg vagy NH3). Fekete különbséget tett maró és lágy, vagy szénsavas lúgok között. A lúgok nem jelennek meg az egyszerű testek táblázatában, de a táblázathoz fűzött megjegyzésben Lavoisier jelzi, hogy a rögzített lúgok (kálium és szóda) valószínűleg összetett anyagok, bár alkotórészeik természetét még nem vizsgálták. A 19. század első negyedének orosz kémiai irodalomban. a káliumot káliumnak (Szolovjov, 1824), hamuzsírnak (Sztrahovoj, 1825), hamuzsírnak (Shcheglov, 1830) nevezték; a "Dvigubsky Store"-ban már 1828-ban a kálium (kálium-szulfát) névvel együtt a kálium (kálium-kálium, só-kálium stb.) név is megtalálható. A kálium elnevezés Hess tankönyvének megjelenése után vált általánosan elfogadottá.
| Atomszám | |
| Egy egyszerű anyag megjelenése |
Ezüstfehér puha fém |
| Az atom tulajdonságai | |
| Atomtömeg (móltömeg) |
39.0983 a. e.m. (g/mol) |
| Atomsugár | |
| Ionizációs energia (első elektron) |
418,5 (4,34) kJ/mol (eV) |
| Elektronikus konfiguráció | |
| Kémiai tulajdonságok | |
| Kovalens sugár | |
| Ion sugara | |
| Elektronegativitás (Pauling szerint) |
|
| Elektróda potenciál | |
| Oxidációs állapotok | |
| Egy egyszerű anyag termodinamikai tulajdonságai | |
| Sűrűség | |
| Moláris hőkapacitás |
29,6 J/(K mol) |
| Hővezető |
79,0 W/(m K) |
| Olvadási hőmérséklet | |
| Olvadáshő |
102,5 kJ/mol |
| Forráshőmérséklet | |
| Párolgási hő |
2,33 kJ/mol |
| Moláris térfogat |
45,3 cm³/mol |
| Egyszerű anyag kristályrácsa | |
| Rácsszerkezet |
köbös testközpontú |
| Rács paraméterei | |
| c/a arány | — |
| Debye hőmérséklet | |
| K | 19 |
| 39,0983 | |
| 4s 1 | |
- az első csoport fő alcsoportjának eleme, D. I. Mengyelejev kémiai elemeinek periódusos rendszerének negyedik periódusa, 19-es rendszámmal. K (lat. Kalium) szimbólummal jelölve. A kálium egyszerű anyag (CAS-szám: 7440-09-7) egy lágy alkálifém, ezüstös-fehér színű. A természetben a kálium csak más elemekkel kombinálva található, például a tengervízben, valamint számos ásványi anyagban. Levegőn nagyon gyorsan oxidálódik, és nagyon könnyen kémiai reakciókba lép, különösen vízzel, lúgot képezve. A kálium kémiai tulajdonságai sok tekintetben nagyon hasonlóak a nátriuméhoz, de biológiai funkciójukat és az élő szervezetek sejtjei általi felhasználásukat tekintve mégis eltérőek. A kálium név története és eredete
A káliumot (pontosabban vegyületeit) ősidők óta használják. Így a hamuzsír előállítása (amit mosószerként használt) már a 11. században is létezett. A szalma vagy fa égetésekor keletkező hamut vízzel kezelték, majd a keletkező oldatot (lúgot) szűrés után elpárologtatták. A száraz maradék a kálium-karbonáton kívül kálium-szulfátot K2SO4, szódát és kálium-klorid KCl-t tartalmazott.
1807-ben Davy angol kémikus szilárd kálium-hidroxid (KOH) elektrolízisével izolálta a káliumot, és elnevezte. "kálium"(lat. kálium; ezt a nevet még mindig használják angolul, franciául, spanyolul, portugálul és lengyelül). 1809-ben L. V. Gilbert javasolta a „kálium” (lat. kálium, arabból. al-kali – hamuzsír). Ez a név bekerült a német nyelvbe, onnan Észak- és Kelet-Európa legtöbb nyelvébe (beleértve az oroszt is), és „nyert” az elem szimbólumának kiválasztásakor - K.
Kálium jelenléte a természetben
Szabad állapotban nem található. A kálium a szilvinit KCl NaCl, a karnallit KCl MgCl 2 6H 2 O, a kainit KCl MgSO 4 6H 2 O része, és egyes növények hamujában is jelen van karbonát K 2 CO 3 (kálium) formájában. A kálium minden sejtben megtalálható (lásd az alábbi részt Biológiai szerep).
Kálium - kálium szerzése
A káliumot, más alkálifémekhez hasonlóan, olvadt kloridok vagy lúgok elektrolízisével nyerik. Mivel a kloridok olvadáspontja magasabb (600-650 °C), a kiegyenesített lúgok elektrolízisét gyakrabban végzik szóda vagy kálium hozzáadásával (legfeljebb 12%). Az olvadt kloridok elektrolízise során a katódon olvadt kálium, az anódon pedig klór szabadul fel:
K + + e − → K
2Cl − − 2e − → Cl 2
A lúgok elektrolízise során a katódon olvadt kálium, az anódon pedig oxigén szabadul fel:
4OH − − 4e − → 2H 2 O + O 2
Az olvadékból származó víz gyorsan elpárolog. Annak megakadályozására, hogy a kálium kölcsönhatásba lépjen a klórral vagy az oxigénnel, a katód rézből készül, és egy rézhengert helyeznek el felette. A kapott káliumot olvadt formában egy hengerben gyűjtik össze. Az anód nikkelből (lúgok elektrolíziséhez) vagy grafitból (kloridok elektrolíziséhez) henger formájában is készül.
A kálium fizikai tulajdonságai
A kálium egy ezüstös anyag, amely a frissen kialakított felületen jellegzetes fényt mutat. Nagyon könnyű és olvadó. A higanyban viszonylag jól oldódik, amalgámokat képez. Ha káliumot (valamint vegyületeit) adjuk az égő lángjához, az a lángot jellegzetes rózsaszín-lila színűre színezi.
A kálium kémiai tulajdonságai
A kálium, más alkálifémekhez hasonlóan, jellegzetes fémes tulajdonságokkal rendelkezik, és kémiailag nagyon aktív, könnyen elektronokat ad.
Erős redukálószer. Olyan aktívan egyesül az oxigénnel, hogy nem oxid képződik, hanem kálium-szuperoxid KO 2 (vagy K 2 O 4). Hidrogénatmoszférában hevítve KH kálium-hidrid keletkezik. Jól kölcsönhatásba lép minden nemfémmel, halogenideket, szulfidokat, nitrideket, foszfidokat stb. képez, valamint olyan összetett anyagokkal, mint a víz (a reakció robbanásszerűen megy végbe), különféle oxidok és sók. Ebben az esetben a többi fémet szabad állapotba redukálják.
A káliumot kerozinréteg alatt tárolják.
Kálium-oxidok és kálium-peroxidok
Amikor a kálium reagál a légköri oxigénnel, nem oxidot, hanem peroxidot és szuperoxidot képez:
Kálium-oxid előállítható a fém 180 °C-ot meg nem haladó hőmérsékletre hevítésével nagyon kevés oxigént tartalmazó környezetben, vagy kálium-szuperoxid és káliumfém keverékének melegítésével:
A kálium-oxidok kifejezett bázikus tulajdonságokkal rendelkeznek, és hevesen reagálnak vízzel, savakkal és savas oxidokkal. Gyakorlati jelentőségük nincs. A peroxidok sárgásfehér porok, amelyek vízben oldódnak, lúgokat és hidrogén-peroxidot képeznek:
A szén-dioxid oxigénre cseréjének képességét gázálarcok szigetelésénél és tengeralattjárókon használják. Abszorberként kálium-szuperoxid és nátrium-peroxid ekvimoláris keverékét használják. Ha a keverék nem ekvimoláris, akkor a nátrium-peroxid feleslege esetén több gáz nyelődik el, mint amennyi felszabadul (két térfogat CO 2 elnyelésekor egy térfogatnyi O 2 szabadul fel), és a nyomás zárt térben csökken, és kálium-szuperoxid felesleg esetén (két térfogat CO 2 elnyelésekor három térfogatnyi O szabadul fel 2) több gáz szabadul fel, mint amennyi elnyelődik, és a nyomás nő.
Ekvimoláris elegy esetén (Na 2 O 2:K 2 O 4 = 1:1) az elnyelt és felszabaduló gázok térfogata egyenlő lesz (négy térfogat CO 2 elnyelésekor négy térfogatnyi O 2 szabadul fel ).
A peroxidok erős oxidálószerek, ezért a textiliparban szövetek fehérítésére használják.
A peroxidokat fémek szén-dioxidtól mentes levegőben történő égetésével állítják elő.
Kálium-hidroxidok
Kálium-hidroxid (vagy maró kálium) kemény, fehér, átlátszatlan, nagyon higroszkópos kristályok, amelyek 360 °C-on megolvadnak. A kálium-hidroxid lúg. Vízben jól oldódik és nagy mennyiségű hőt ad le. A kálium-hidroxid oldhatósága 20 °C-on 100 g vízben 112 g.
A kálium felhasználása
- A szobahőmérsékleten folyékony kálium és nátrium ötvözetét hűtőközegként használják zárt rendszerekben, például gyorsneutronos atomerőművekben. Ezenkívül széles körben használják rubídiummal és céziummal készült folyékony ötvözeteit. A nátrium 12%, kálium 47%, cézium 41% ötvözetének olvadáspontja rekord alacsony, -78 °C.
- A káliumvegyületek a legfontosabb biogén elemek, ezért műtrágyaként használják őket.
- A káliumsókat széles körben alkalmazzák a galvanizálásban, mivel viszonylag magas költségük ellenére gyakran jobban oldódnak, mint a megfelelő nátriumsók, és ezért fokozott áramsűrűség mellett is intenzív elektrolitműködést biztosítanak.
Fontos kapcsolatok
A káliumionok lila színe lángol az égő lángjában
- A kálium-bromidot a gyógyászatban és az idegrendszer nyugtatójaként használják.
- Kálium-hidroxid (kálium-kálium) - alkáli elemekben és gázok szárításakor használják.
- Kálium-karbonát (kálium-karbonát) – üveggyártásban műtrágyaként használják.
- Kálium-klorid (sylvin, "káliumsó") - műtrágyaként használják.
- A kálium-nitrát (kálium-nitrát) műtrágya, a fekete por összetevője.
- A kálium-perklorátot és a klorátot (Bertholet-só) gyufák, rakétaporok, világítótöltetek, robbanóanyagok gyártásához és galvanizáláshoz használják.
- A kálium-dikromát (króm) erős oxidálószer, „krómkeverék” készítésére szolgál vegyi edények mosásához és bőrfeldolgozáshoz (cserzés). Használják az acetilén ammóniából, hidrogén-szulfidból és foszfinból történő tisztítására is.
- A kálium-permanganát erős oxidálószer, antiszeptikumként használják az orvostudományban és az oxigén laboratóriumi előállítására.
- Nátrium-kálium-tartarát (Rochelle-só) piezoelektromos anyagként.
- Kálium-dihidrogén-foszfát és dideuterofoszfát egykristályok formájában a lézertechnológiában.
- A kálium-peroxidot és a kálium-szuperoxidot a levegő regenerálására használják tengeralattjárókban és szigetelő gázálarcokban (a szén-dioxidot elnyeli az oxigén felszabadítása érdekében).
- A kálium-fluor-borát fontos folyasztószer az acélok és színesfémek forrasztásához.
- A kálium-cianidot galvanizáláshoz (ezüstözés, aranyozás), aranybányászathoz és acél nitrokarburizálásához használják.
- A káliumot a kálium-peroxiddal együtt a víz hidrogénre és oxigénre történő termokémiai lebontására használják (káliumciklus "Gaz de France", Franciaország).
Biológiai szerep
A kálium a legfontosabb biogén elem, különösen a növényvilágban. Ha a talajban káliumhiány van, a növények nagyon rosszul fejlődnek, csökken a termés, ezért a kivont káliumsók mintegy 90%-a műtrágyaként kerül felhasználásra.
Kálium az emberi szervezetben
A kálium leginkább a sejtekben található, akár 40-szer több, mint a sejtközi térben. A sejtek működése során a felesleges kálium elhagyja a citoplazmát, így a koncentráció fenntartásához vissza kell pumpálni a nátrium-kálium pumpán.
A kálium és a nátrium funkcionális kapcsolatban állnak egymással, és a következő funkciókat látják el:
- Feltételek megteremtése a membránpotenciál és az izomösszehúzódások előfordulásához.
- A vér ozmotikus koncentrációjának fenntartása.
- A sav-bázis egyensúly fenntartása.
- A vízháztartás normalizálása.
- A membrántranszport biztosítása.
- Különféle enzimek aktiválása.
- A szívritmus normalizálása.
Az ajánlott napi káliumadag gyermekeknek 600-1700 milligramm, felnőtteknek 1800-5000 milligramm. A káliumszükséglet a teljes testtömegtől, a fizikai aktivitástól, a fiziológiai állapottól és a lakóhely éghajlatától függ. Hányás, hosszan tartó hasmenés, erős izzadás, vizelethajtók alkalmazása növeli a szervezet káliumszükségletét.
A fő táplálékforrás a szárított sárgabarack, dinnye, bab, kivi, burgonya, avokádó, banán, brokkoli, máj, tej, dióvaj, citrusfélék, szőlő. Sok kálium van a halban és a tejtermékekben.
A felszívódás a vékonybélben történik. A kálium felszívódását a B6-vitamin segíti elő, az alkohol bonyolítja.
Káliumhiány esetén hypokalaemia alakul ki. Zavarok lépnek fel a szív- és vázizomzat működésében. A hosszú távú káliumhiány akut neuralgiát okozhat.
A kálium elemi anyag, fém, annyira aktív, hogy a természetben nem fordul elő rög formájában. A kálium megtalálható az ásványi anyagokban és a tengervízben, a növények és állatok szervezetében, és bőségében a 7. helyen áll. Nagy biogén jelentőségű, hiszen szükséges az élő sejtek működéséhez.
A kálium fizikai és kémiai tulajdonságai
A kálium puha anyag (késsel vágható), ezüstös színű, világos (könnyebb, mint a víz), olvadó. Rózsaszín-lila lánggal ég.
Egy alkálifém, amely aktívan reagál oxigénnel, vízzel, halogénekkel és híg savakkal; a reakciókat gyakran robbanás kíséri. Nem lép reakcióba nitrogénnel. Reagál lúgokkal és alkoholokkal.
A tiszta káliummal végzett munka védőfelszerelést igényel, mivel a bőrön vagy a szemen lévő legkisebb részecskékkel való érintkezés súlyos égési sérüléseket okoz.
A káliumot lezárt vasedényekben kell tárolni olyan anyagok rétege alatt, amelyek megakadályozzák a levegővel való érintkezést: ásványolaj, szilikon, dehidratált kerozin.
A kálium és vegyületeinek felhasználása
Tiszta fém formájában az anyagot korlátozott területeken használják:
- egyes áramforrásokban elektródákat készítenek belőle;
- elektroncsövekben vákuumot fenntartó gázadszorbensként használják; fotocellákban, gázkisüléses lámpákban és készülékekben, hőátalakítókban, fénysokszorozókban;
- szuperoxid előállítására;
- a kálium-40 izotóp segítségével kiszámítjuk a kőzetek korát;
- a mesterséges kálium-42 izotópot radioaktív nyomjelzőként használják az orvostudományban és a biológiában;
- kálium és nátrium ötvözete - normál körülmények között folyékony anyag, nukleáris reaktorokban hűtőközegként használják. Más folyékony káliumötvözetek is használatosak.
 A különféle káliumvegyületekre sokkal nagyobb a kereslet.
A különféle káliumvegyületekre sokkal nagyobb a kereslet.
- Az orvosi gyakorlatban kálium-kloridot, kálium-jodidot, permanganátot és kálium-bromidot használnak. A kálium szükségszerűen szerepel a komplex vitamin-ásványi készítményekben. Testünknek szüksége van rá az izomműködéshez, beleértve a szívet is; a kiegyensúlyozott vérösszetétel, a víz és sav-bázis egyensúly fenntartásához.
- Az ipar által megszerzett kálium oroszlánrésze (több mint 90%) a növények fejlődéséhez létfontosságú hamuzsír-műtrágyák előállítására megy el. Erre a célra a mezőgazdaságban különféle káliumsókat használnak. A legnépszerűbb a salétromsav káliumsója, kálium-nitrát, indiai vagy kálium-nitrát néven ismert.
- A KOH-t (kálium-hidroxidot) akkumulátorokban használják gázok szárítására.
- A kálium-karbonátot (kálium-karbonát) hamuzsír optikai üveg előállításához, műtrágyagyártáshoz, gáztisztítási, szárítási és bőrcserzési folyamatokhoz használják. 
- A kálium-peroxid és a szuperoxid felszívja a szén-dioxidot és oxigént szabadít fel. Ezt a tulajdonságot használják oxigén regenerálására gázálarcokban, bányákban, tengeralattjárókon és űrhajókon.
- A szöveteket peroxiddal fehérítik.
- A káliumvegyületek különféle robbanó- és gyúlékony anyagok részét képezik.
- A kálium-permanganátot az O2 laboratóriumi előállításához használják.
- A káliumvegyületeket galvanizálásban és szerves szintézisben, lézertechnológiában és fényképezésben, acetilén- és acélgyártásban, piezoelektronikában használják. Színesfémek és acélok forrasztására, vegyi edények mosására szolgálnak.
A kálium-jodid, a kálium-nitrát, a kálium-karbonát csak egy kis része a vegyi reagensboltunkban található káliumvegyületeknek. Moszkvában és a moszkvai régióban a Prime Chemicals Grouptól kényelmes és nyereséges a laboratóriumi és termelési termékek beszerzése. Kiváló kiszolgálási, szállítási és átvételi lehetőségeink vannak.
KÁLIUM (latin Kalium), K, a periódusos rendszer rövid alakjának I. csoportjának (a hosszú alak 1. csoportjának) kémiai eleme; atomszám 19; atomtömeg 39,0983; alkálifémekre vonatkozik. A természetes kálium három izotópból áll: 39 K (93,2581%), 40 K (0,0117%; gyengén radioaktív, T 1/2 1,277 10 9 év, β-bomlás 40 Ca-ig), 41 K (6,7302 %). Mesterségesen állítottak elő 32-54 tömegszámú radioizotópokat.
Történelmi hivatkozás. Néhány káliumvegyületet már az ókorban is ismertek, például a kálium-karbonát K 2 CO 3 (ún. növényi lúg) fahamuból izolálták és szappankészítésre használták. Fémes káliumot először G. Davy nyert 1807-ben nedves szilárd KOH-hidroxid elektrolízisével, és káliumnak nevezte el (az angol potash szóból kálium - a kálium-karbonát neve). 1809-ben javasolták a „kálium” nevet (az arab al-kali - hamuzsír szóból). A „kálium” elnevezést megőrizték Nagy-Britanniában, az USA-ban, Franciaországban és más országokban. Oroszországban 1840 óta használják a „kálium” nevet, amelyet Németországban, Ausztriában és a skandináv országokban is átvettek.
Elterjedtség a természetben. A földkéreg káliumtartalma 2,6 tömeg%. A kálium a természetben nem fordul elő szabad állapotban. A kálium jelentős mennyiségben található a nefelin- és leucit-szilikátokban, a földpátokban (például ortoklászban) és a csillámban (például muszkovitban). A saját kálium ásványi anyagok - szilvit, szilvinit, karnallit, kainit, langbeinit K 2 SO 4 ∙2MgSO 4 nagy mennyiségű természetes káliumsót képeznek. A víz és a szén-dioxid hatására a kálium oldható vegyületekké alakul, amelyek részben a tengerekbe kerülnek, részben pedig a talajban visszatartanak. A káliumsók a sós tavak és a földalatti sós vizekben is megtalálhatók.
Tulajdonságok. A káliumatom külső elektronhéjának konfigurációja 4s 1; vegyületekben +1 oxidációs állapotot mutat; a K 0 →K + →K 2+ ionizációs energiák 4,3407 és 31,8196 eV; Pauling elektronegativitás 0,82; atomsugár 220 pm, a K + ion sugara 152 pm (6-os koordinációs szám).
A kálium ezüstfehér puha fém; testközpontú köbös kristályrács; t olvadáspont 63,38 °C, t forráspont 759 °C, sűrűség 856 kg/m 3 (20 °C); hőkapacitás 29,60 J/(mol K) 298 K-en.
A kálium préselhető és hengerelhető, késsel könnyen vágható, és alacsony hőmérsékleten megtartja plaszticitását; Brinell keménység 0,4 MPa.
A kálium nagy kémiai aktivitású fém (a káliumot benzin, kerozin vagy ásványolaj réteg alatt tárolják). Normál körülmények között a kálium kölcsönhatásba lép oxigénnel (K 2 O oxid, K 2 O 2 peroxid, KO 2 szuperoxid képződik - a fő termék), halogénekkel (megfelelő kálium-halogenidekkel), hevítéskor - kénnel (K 2 S szulfid), szelén (szelenid K 2 Se), tellúr (K 2 Te tellurid), foszforral nitrogénatmoszférában (foszfidok K 3 P és K 2 P5), szén (réteges vegyületek KS 8 - KS 60 összetételű), hidrogén (KN) hidrid). A kálium csak elektromos kisülés hatására lép kölcsönhatásba a nitrogénnel (kis mennyiségben KN 3 azid és K 3 N nitrid képződik). A kálium reagál egyes fémekkel, intermetallikus vegyületeket vagy szilárd oldatokat (káliumötvözetek) képezve. A nagy kémiai aktivitással jellemezhető nátriumötvözetek gyakorlati jelentőséggel bírnak; fémek közömbös atmoszférában történő ötvözésével vagy fémes nátrium KOH-hidroxiddal vagy KCl-kloriddal történő hatására nyerik.
A fém kálium erős redukálószer: erőteljesen reagál (normál körülmények között a fém robbanásával és begyulladásával) vízzel (kálium-hidroxid KOH képződik), hevesen (néha robbanással) reagál savakkal (a megfelelő sók képződnek, pl. például kálium-dikromát, kálium-nitrát, kálium-permanganát, kálium-foszfátok, kálium-cianid), a B, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti oxidjait elemekké redukálja; szulfátok, szulfitok, nitrátok, nitritek, karbonátok és egyéb fémek foszfátjai - a megfelelő fémek oxidjaivá. A kálium-fém lassan oldódik folyékony ammóniában, és fémes vezetőképességű sötétkék oldatot képez; az oldott fém fokozatosan reagál az ammóniával, és amid keletkezik: 2K + 2NH 3 = 2KNH 2 + H 2. A kálium kölcsönhatásba lép különféle szerves vegyületekkel: alkoholokkal (alkoholátok képződnek, pl. C 2 H 5 OK etilát), acetilénnel (KS≡CH és KS≡SK acetilenidok), alkilhalogenidekkel (kálium-alkilekkel, pl. etilkálium C 2 H 5 K) és aril-halogenidek (kálium-arilok, például fenil-kálium C6H5K). A fém kálium elindítja az alkének és diének polimerizációs reakcióit. Az N- és O-donor policiklusos ligandumokkal (koronaéterek, kriptandok és egyéb ionofórok) a kálium komplex vegyületeket képez.
A káliummal végzett munka során figyelembe kell venni annak nagy reakcióképességét, beleértve a vízzel való érintkezéskor meggyulladó képességet. Biztonsági okokból gumikesztyűt, védőszemüveget vagy maszkot kell használni. Nagy mennyiségű káliumot speciális kamrákban, inert atmoszférában (argon, nitrogén) kell feldolgozni. Az égő kálium oltásához használjon konyhasót NaCl vagy szódabikarbónát, Na 2 CO 3 -ot.
Biológiai szerep. A kálium biogén elem. Az ember napi káliumszükséglete körülbelül 2 g Élő szervezetekben a káliumionok fontos szerepet játszanak az anyagcsere szabályozásában, különösen az ionok sejtmembránokon keresztüli szállításában (lásd például az Ionpumpák című cikket).
Nyugta. Az iparban a káliumot úgy nyerik, hogy az olvadt KOH-hidroxidot vagy KCl-kloridot fémnátriummal redukálják ellenáramú oszlopban, majd a káliumgőzt kondenzálják. Ígéretesek a kálium előállításának vákuumtermikus módszerei, amelyek a KCl-klorid redukcióján alapulnak, ha alumínium vagy szilícium kalcium-oxid keverékével hevítik (6Kl + 2Al + 4CaO = 6K + 3CaCl 2 + CaO Al 2 O 3 vagy 4Kl + Si + 4CaO = 4K + 2CaCl 2 + 2CaO∙SiO 2), valamint egy káliumötvözet ólommal előállításán alapuló eljárás K 2 CO 3 -karbonát vagy KCl-klorid olvadt ólomkatóddal történő elektrolízisével, majd az ezt követő desztillációval. káliumötvözet. A globális káliumtermelés volumene körülbelül 28 tonna/év (2004).
Alkalmazás. A fémes kálium a kémiai áramforrások elektródáinak anyaga, katalizátor a szintetikus gumi előállításának folyamatában. Különböző káliumvegyületeket széles körben használnak: peroxid K 2 O 2 és szuperperoxid KO 2 - az oxigénregeneráló készítmények komponensei (tengeralattjárókban, űrhajókban és más zárt terekben), KN-hidrid - redukálószer a kémiai szintézisben, kálium ötvözete nátriummal. (10-60 tömeg% Na, folyékony szobahőmérsékleten) - hűtőközeg atomreaktorokban, redukálószer a titángyártásban, reagens gázok oxigéntől és vízgőztől való tisztítására; A káliumsókat káliumműtrágyákként és tisztítószerek összetevőiként használják. A kálium és ionoforok komplexei modellek a káliumionok sejtmembránokon keresztüli transzportjának tanulmányozására. A 42 K (T 1/2 12,36 h) radioaktív izotópot radioaktív indikátorként használják a kémiában, az orvostudományban és a biológiában.
Lit.: Nátrium és kálium. L., 1959; Stepin B. D., Cvetkov A. A. Szervetlen kémia. M., 1994; Szervetlen kémia: elemek kémiája / Szerk.: Yu. D. Tretyakov. M., 2004. T. 2.