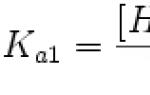Võrevoodi-ensüümid-hormoonid. Lehningeri biokeemia alused Meetodid metaboolse aktiivsuse reguleerimiseks rakus
DÜNAAMILINE BIOKEEMIA
PeatükkIV.8.
Ainevahetus ja energia
Ainevahetus ehk ainevahetus – keemiliste reaktsioonide kogum organismis, mis varustavad teda eluks vajalike ainete ja energiaga. Ainevahetuses saab eristada kahte peamist etappi: ettevalmistav - kui seedimise teel saadud aine läbib keemilisi transformatsioone, mille tulemusena võib see verre siseneda ja seejärel rakkudesse tungida ning ainevahetus ise, s.o. rakkudesse tunginud ühendite keemilised transformatsioonid.
Metaboolne rada - see on konkreetse aine keemiliste muundumiste olemus ja järjestus kehas. Ainevahetusprotsessi käigus tekkivaid vaheprodukte nimetatakse metaboliitideks ja ainevahetusraja viimane ühend on lõppsaadus.
Keeruliste ainete lihtsamateks lagundamise protsessi nimetatakse katabolism. Seega lagunevad toidus olevad valgud, rasvad ja süsivesikud seedetrakti ensüümide toimel lihtsamateks komponentideks (aminohapped, rasvhapped ja monosahhariidid). See vabastab energiat. Nimetatakse pöördprotsessi ehk keerukate ühendite sünteesi lihtsamatest anabolism . Sellega kaasneb energiakulu. Seedimise tulemusena tekkinud aminohapetest, rasvhapetest ja monosahhariididest sünteesitakse rakkudes uued rakuvalgud, membraanifosfolipiidid ja polüsahhariidid.
On olemas kontseptsioon amfibolism kui üks ühend hävib, aga sünteesitakse teine.
Ainevahetustsükkel on metaboolne rada, mille üks lõppproduktidest on identne ühe selles protsessis osaleva ühendiga.
Konkreetne metaboolne rada on ühe konkreetse ühendi (süsivesikute või valkude) transformatsioonide kogum. Üldine metaboolne rada on siis, kui osalevad kahte või enamat tüüpi ühendid (süsivesikud, lipiidid ja osaliselt valgud osalevad energia metabolismis).
Metaboolsed substraadid - toiduga kaasas olevad ühendid. Nende hulgas on põhitoitaineid (valgud, süsivesikud, lipiidid) ja vähemtähtsaid toitaineid, mida on väikestes kogustes (vitamiinid, mineraalid).
Ainevahetuse intensiivsuse määrab raku vajadus teatud ainete või energia järele, reguleerimine toimub neljal viisil:
1) Konkreetse metaboolse raja kogureaktsioonikiiruse määravad iga ensüümi kontsentratsioon selles rajas, keskkonna pH väärtus, iga vaheprodukti rakusisene kontsentratsioon ning kofaktorite ja koensüümide kontsentratsioon.
2) Reguleerivate (allosteeriliste) ensüümide aktiivsus, mis tavaliselt katalüüsivad metaboolsete radade algstaadiume. Enamikku neist inhibeerib selle raja lõpp-produkt ja seda tüüpi inhibeerimist nimetatakse "tagasisideseks".
3) Geneetiline kontroll, mis määrab konkreetse ensüümi sünteesi kiiruse. Ilmekas näide on indutseeritavate ensüümide ilmumine rakus vastusena vastava substraadi tarnimisele.
4) Hormonaalne regulatsioon. Mitmed hormoonid võivad aktiveerida või pärssida paljusid ensüüme metaboolsetes radades.
Elusorganismid on termodünaamiliselt ebastabiilsed süsteemid. Nende tekkeks ja toimimiseks on vajalik pidev energiavarustus mitmekülgseks kasutamiseks sobival kujul. Energia saamiseks on peaaegu kõik planeedi elusolendid kohanenud hüdrolüüsima üht ATP pürofosfaatsidemetest. Sellega seoses on elusorganismide bioenergeetika üks peamisi ülesandeid kasutatud ATP täiendamine ADP-st ja AMP-st.
Raku peamiseks energiaallikaks on substraatide oksüdeerimine atmosfäärihapnikuga. See protsess toimub kolmel viisil: hapniku lisamine süsinikuaatomile, vesiniku eraldamine või elektroni kadu. Rakkudes toimub oksüdatsioon vesiniku ja elektronide järjestikuse ülekandena substraadist hapnikku. Sel juhul mängib hapnik redutseeriva ühendi (oksüdeeriva aine) rolli. Energia vabanemisega tekivad oksüdatiivsed reaktsioonid.Bioloogilistele reaktsioonidele on iseloomulikud suhteliselt väikesed energiamuutused. See saavutatakse oksüdatsiooniprotsessi jagamisega mitmeks vaheetapiks, mis võimaldab säilitada seda väikeste portsjonitena kõrge energiasisaldusega ühendite (ATP) kujul. Hapnikuaatomi redutseerimine prootonite ja elektronide paariga suhtlemisel viib veemolekuli moodustumiseni.
Kudede hingamine
See on kehakudede rakkude hapnikutarbimise protsess, mis osaleb bioloogilises oksüdatsioonis. Seda tüüpi oksüdatsiooni nimetatakse aeroobne oksüdatsioon . Kui vesiniku ülekandeahela lõplikuks aktseptoriks ei ole hapnik, vaid muud ained (näiteks püroviinamarihape), siis nimetatakse seda tüüpi oksüdatsiooni. anaeroobne.
See. bioloogiline oksüdatsioon on substraadi dehüdrogeenimine vahepealsete vesinikukandjate ja selle lõpliku aktseptori abil.
Hingamisteede kett (koe hingamise ensüümid) on prootonite ja elektronide kandjad oksüdeeritud substraadist hapnikku. Oksüdeeriv aine on ühend, mis on võimeline vastu võtma elektrone. See võime on kvantifitseeritud redokspotentsiaal standardse vesinikelektroodi suhtes, mille pH on 7,0. Mida väiksem on ühendi potentsiaal, seda tugevamad on selle redutseerivad omadused ja vastupidi.
See. iga ühend saab loovutada elektrone ainult suurema redokspotentsiaaliga ühendile. Hingamisahelas on igal järgmisel lülil suurem potentsiaal kui eelmisel.
Hingamisahel koosneb:
1. NAD - sõltuv dehüdrogenaas;
2. FAD-sõltuv dehüdrogenaas;
3. Ubikinoon (Ko Q);
4. Tsütokroom b, c, a + a 3.
NAD-sõltuvad dehüdrogenaasid . Sisaldab koensüümina ÜLAL Ja NADP. Nikotiinamiidi püridiinitsükkel on võimeline vastu võtma elektrone ja vesiniku prootoneid.
FAD ja FMN-sõltuvad dehüdrogenaasid sisaldavad koensüümina B2-vitamiini fosforestrit ( FAD).
Ubikinoon (Ko K ) võtab flavoproteiinidelt vesiniku ära ja muutub hüdrokinoon.
Tsütokroomid - kromoproteiinivalgud, mis on võimelised omandama elektrone, kuna nende koostises on proteesrühmad raudporfüriinid. Nad võtavad elektroni vastu ainest, mis on veidi tugevam redutseerija, ja kannavad selle üle tugevamale oksüdeerivale ainele. Rauaaatom on seotud histidiini aminohappe imidasoolitsükli lämmastikuaatomiga ühel pool porfüriinitsükli tasapinda ja teiselt poolt metioniini väävliaatomiga. Seetõttu pärsitakse tsütokroomides sisalduva raua aatomi potentsiaalne võime hapnikku siduda.
IN tsütokroom c porfüriini tasand on kovalentselt seotud valguga kahe tsüsteiinijäägi kaudu ja tsütokroomeksb Ja , see ei ole kovalentselt seotud valguga.
IN tsütokroom a+a 3 (tsütokroomoksüdaas) protoporfüriini asemel sisaldab porfüriin A, mis erineb mitmete struktuuriomaduste poolest. Raua viienda koordinatsioonipositsiooni hõivab aminorühm, mis kuulub aminosuhkru jääki, mis on osa valgust endast.
Erinevalt heemist hemolgobiinist võib tsütokroomides olev raua aatom pöörduvalt muutuda kahest kolmevalentsesse olekusse, mis tagab elektronide transpordi (vt lisa 1 “Hemoproteiinide aatom- ja elektrooniline struktuur”).
Elektronide transpordiahela töömehhanism
Mitokondrite välismembraan (joonis 4.8.1) on läbilaskev enamikele väikestele molekulidele ja ioonidele, sisemembraan on läbilaskev peaaegu kõikidele ioonidele (v.a H-prootonid) ja enamikule laenguta molekulidele.
Kõik ülaltoodud hingamisahela komponendid on sisestatud sisemembraani. Prootonite ja elektronide transpordi piki hingamisahelat tagab selle komponentide potentsiaalide erinevus. Sel juhul vabaneb iga potentsiaali suurenemine 0,16 V võrra energiat, mis on piisav ühe ATP molekuli sünteesiks ADP-st ja H3PO4-st. Kui üks O2 molekul kulub ära, moodustub 3 molekuli ATP.
ADP-st ja fosforhappest oksüdatsiooni ja ATP moodustumise protsessid s.o. Fosforüülimine toimub mitokondrites. Sisemembraan moodustab palju volte - cristae. Ruumi piirab sisemine membraan – maatriks. Sise- ja välismembraani vahelist ruumi nimetatakse intermembraaniks.
Selline molekul sisaldab kolme suure energiaga sidet. Makroergiline ehk energiarikas on keemiline side, mille purunemisel vabaneb üle 4 kcal/mol. ATP hüdrolüütilisel lagunemisel ADP-ks ja fosforhappeks vabaneb 7,3 kcal/mol. Täpselt sama palju kulub ADP ja fosforhappe jäägist ATP moodustamiseks ning see on üks peamisi viise kehas energia salvestamiseks.
Elektronide transpordil mööda hingamisahelat eraldub energia, mis kulub ADP-le fosforhappejäägi lisamisele, et moodustuks üks ATP molekul ja üks molekul veest. Ühe elektronpaari ülekandmisel mööda hingamisahelat vabaneb 21,3 kcal/mol, mis talletub kolme ATP molekulina. See moodustab umbes 40% elektronide transpordi käigus vabanevast energiast.
Sellist energia salvestamise meetodit rakus nimetatakse oksüdatiivne fosforüülimine või seotud fosforüülimine.
Selle protsessi molekulaarseid mehhanisme selgitab kõige paremini Mitchelli kemoosmootiline teooria, mis esitati 1961. aastal.
Oksüdatiivse fosforüülimise mehhanism (joonis 4.8.2.):
1) NAD-sõltuv dehüdrogenaas asub sisemise mitokondriaalse membraani maatrikspinnal ja loovutab FMN-sõltuvale dehüdrogenaasile paari vesiniku elektrone. Sel juhul läheb maatriksist FMN-i ka prootonite paar ja selle tulemusena moodustub FMN H 2. Sel ajal surutakse NAD-i kuuluv prootonipaar membraanidevahelisse ruumi.
2) FAD-sõltuv dehüdrogenaas loovutab Co-le elektronide paari K ja surub paar prootonit membraanidevahelisesse ruumi. Olles saanud elektronid Co K võtab maatriksist vastu prootonipaari ja muutub Co-ks Kiire abi 2.
3) Ko Q H2 surub prootonipaari membraanidevahelisse ruumi ning elektronpaar kandub tsütokroomidele ja seejärel hapnikku, moodustades veemolekuli.
Selle tulemusena, kui elektronide paar viiakse mööda ahelat maatriksist membraanidevahelisse ruumi, pumbatakse 6 prootonit (3 paari), mis põhjustab potentsiaalsete erinevuste ja pH erinevuse tekkimist sisepinna pindade vahel. membraan.
4) Potentsiaalide erinevus ja pH erinevus tagavad prootonite liikumise prootonikanali kaudu tagasi maatriksisse.
5) See prootonite vastupidine liikumine viib ATP süntaasi aktiveerimiseni ja ATP sünteesini ADP-st ja fosforhappest. Ühe elektronpaari (s.o kolm paari prootoneid) ülekandmisel sünteesitakse 3 ATP molekuli (joon. 4.7.3.).

Hingamise ja oksüdatiivse fosforüülimise protsesside dissotsiatsioon tekib siis, kui prootonid hakkavad tungima läbi mitokondrite sisemembraani. Sel juhul pH gradient ühtlustub ja fosforüülimise liikumapanev jõud kaob. Keemilisi lahtiühendajaid nimetatakse protonofoorideks; need on võimelised transportima prootoneid läbi membraani. Need sisaldavad 2,4-dinitrofenool, kilpnäärmehormoonid jne (joonis 4.8.3.).
Saadud ATP maatriksist tsütoplasmasse viiakse translokaasi ensüümide abil, vastassuunas aga üks ADP molekul ja üks fosforhappe molekul maatriksisse. On selge, et ADP ja fosfaadi transpordi katkemine pärsib ATP sünteesi.
Oksüdatiivse fosforüülimise kiirus sõltub eelkõige ATP sisaldusest, mida kiiremini seda tarbitakse, seda rohkem ADP akumuleerub, seda suurem on energiavajadus ja seega ka oksüdatiivse fosforüülimise protsess aktiivsem. Oksüdatiivse fosforüülimise kiiruse reguleerimist ADP rakulise kontsentratsiooniga nimetatakse hingamiskontrolliks.

PEATÜKI VIITED IV.8.
1. Byshevsky A. Sh., Tersenov O. A. Biokeemia arstile // Jekaterinburg: Uralsky Rabochiy, 1994, 384 lk.;
2. Knorre D. G., Myzina S. D. Bioloogiline keemia. - M .: Kõrgem. kool 1998, 479 lk;
3. Leninger A. Biokeemia. Raku struktuuri ja funktsioonide molekulaarne alus // M.: Mir, 1974, 956 lk.;
4. Pustovalova L.M. Biokeemia töötuba // Rostov-on-Don: Phoenix, 1999, 540 lk.;
5. Stepanov V. M. Molekulaarbioloogia. Valkude struktuur ja funktsioonid // M.: Kõrgkool, 1996, 335 lk.;
Kogu Maal elavate organismide mitmekesisuse võib jagada kahte põhirühma, mida eristab erinevate energiaallikate kasutamine - autotroofsed ja heterotroofsed organismid. Esimesed (autotroofid) on eelkõige rohelised taimed, mis on võimelised fotosünteesi protsessis vahetult ära kasutama Päikese kiirgusenergiat, luues anorgaanilistest orgaanilisi ühendeid (süsivesikuid, aminohappeid, rasvhappeid jne). Teised elusorganismid assimileerivad valmis orgaanilisi aineid, kasutades neid energiaallikana või plastmaterjalina oma keha ehitamiseks. Tuleb märkida, et enamik mikroorganisme on ka heterotroofid. Siiski ei suuda nad terveid toiduosakesi omastada. Nad eritavad oma keskkonda spetsiaalseid seedeensüüme, mis lagundavad toiduaineid, muutes need väikesteks lahustuvateks molekulideks ja need molekulid tungivad rakkudesse. Ainevahetuse tulemusena muudetakse toiduga tarbitud ained raku enda aineteks ja struktuurideks ning lisaks varustatakse keha energiaga välistööde tegemiseks. Isepaljunemine ehk kehastruktuuride pidev uuenemine ja paljunemine on elusorganismide ainevahetuse kõige iseloomulikum tunnus, mis eristab seda eluta looduse ainevahetusest. |
Ainevahetus, mis on lahutamatult seotud energiavahetusega, on elussüsteemides mateeria ja energia muundumise loomulik järjekord, mille eesmärk on nende säilimine ja isepaljunemine. F. Engels märkis elu tähtsaima omadusena ainevahetust, mille lakkamisel lakkab elu ise. Ta rõhutas selle protsessi dialektilist olemust ja juhtis sellele tähelepanu
Vene füsioloogia rajaja I. M. Sechenov käsitles järjekindlalt materialistlikust vaatenurgast ainevahetuse rolli organismide elus. K. A. Timirjazev järgis järjekindlalt ideed, et elusorganisme iseloomustav peamine omadus on pidev aktiivne vahetus organismi moodustava aine ja keskkonna aine vahel, mida organism pidevalt tajub, assimileerib, millekski sarnaseks teisendab, jälle muutub. ja esiletõstmised dissimilatsiooniprotsessis. I. P. Pavlov pidas ainevahetust elutegevuse avaldumise aluseks, keha füsioloogiliste funktsioonide aluseks. Olulise panuse eluprotsesside keemia tundmisse andis A.I.Oparin, kes uuris ainevahetuse evolutsiooni põhimustreid elu tekkimise ja arengu ajal Maal.
PÕHIMÕISTED JA TINGIMUSED
Või ainevahetus on keemiliste reaktsioonide kogum organismis, mis varustavad teda eluks vajalike ainete ja energiaga: enesesäilitamine ja -paljunemine. Enesepaljunemise all mõistetakse väljast tuleva aine muundumist keha enda aineteks ja struktuurideks, mille tulemuseks on pidev kudede uuenemine, kasv ja paljunemine.
Ainevahetuses on:
- väline vahetus- hõlmab ainete rakuvälist muundamist nende sisenemise teel kehasse ja ainevahetusproduktide eemaldamist sellest [saade]
.
Ainete kehasse sattumine ja ainevahetusproduktide vabanemine koos moodustavad ainevahetuse keskkonna ja organismi vahel ning seda defineeritakse kui välist vahetust.
Ainete (ja energia) väline vahetus toimub pidevalt.
Inimorganism saab väliskeskkonnast hapnikku, vett, mineraalsooli, toitaineid, rakkude ja kudede struktuurielementide ehituseks ja uuenemiseks ning energia moodustamiseks vajalikke vitamiine. Kõiki neid aineid võib nimetada toiduaineteks, millest osa on bioloogilist päritolu (taimsed ja loomsed saadused) ja väiksem osa mittebioloogilised (selles lahustunud vesi ja mineraalsoolad).
Toiduga kaasas olevad toitained lagunevad, moodustades aminohappeid, monosahhariide, rasvhappeid, nukleotiide ja muid aineid, mis segunedes samade ainetega, mis tekkisid raku struktuursete ja funktsionaalsete komponentide pideva lagunemise käigus, moodustavad kogu kogumi. keha metaboliitidest. Seda fondi kulutatakse kahes suunas: osa kasutatakse raku lagunenud struktuursete ja funktsionaalsete komponentide uuendamiseks; teine osa muundatakse ainevahetuse lõpptoodeteks, mis väljutatakse organismist.
Ainete lagunemisel lõpp-ainevahetusproduktideks eraldub energiat, täiskasvanul 8000-12000 kJ (2000-3000 kcal) päevas. Seda energiat kasutavad keharakud erinevat tüüpi tööde tegemiseks, samuti kehatemperatuuri hoidmiseks ühtlasel tasemel.
- vahevahetus- hõlmab ainete muundamist bioloogilistes rakkudes nende sisenemise hetkest kuni lõpptoodete moodustumiseni (näiteks aminohapete metabolism, süsivesikute metabolism jne)
Metaboolsed etapid. On kolm järjestikust etappi.
Rohkem selle kohta
- tarbimine (toitumine on ainevahetuse (ainete sattumine keskkonnast kehasse) lahutamatu osa)
- seedimine (Seedimise biokeemia (toitainete seedimine))
- imendumine (Seedimise biokeemia (toitainete imendumine))
II. Ainete liikumine ja muundumine kehas (vahepealne ainevahetus) |
Vaheainevahetus (ehk ainevahetus) on ainete muundumine organismis nende rakkudesse sisenemise hetkest kuni ainevahetuse lõppproduktide moodustumiseni, st elusrakkudes toimuvate keemiliste reaktsioonide kogum, mis varustavad keha ainete ja energiaga. selle elutähtsa tegevuse, kasvu ja paljunemise jaoks. See on ainevahetuse kõige keerulisem osa.
Rakku sattudes metaboliseerub toitaine – see läbib rea keemilisi muutusi, mida katalüüsivad ensüümid. Selliste keemiliste muutuste spetsiifilist järjestust nimetatakse metaboolseks rajaks ja tekkivaid vaheprodukte nimetatakse metaboliitideks. Ainevahetusteid saab kujutada metaboolse kaardi kujul.
| Toitainete ainevahetus | ||
| süsivesikuid | Lipiidid | Belkov |
Süsivesikute kataboolsed rajad
Süsivesikute anaboolsed rajad
|
Lipiidide kataboolne rada
Anaboolsete lipiidide rada
|
Valkude kataboolne rada
Aminohapete anaboolne rada
|
Fosfolipiidide ja triatsüülglütserooli sünteesiradade vahelise konkurentsi tõttu tavaliste substraatide pärast takistavad kõik fosfolipiidide sünteesi soodustavad ained triatsüülglütseroolide ladestumist kudedesse. Neid aineid nimetatakse lipotroopseteks teguriteks. Nende hulka kuuluvad fosfolipiidide struktuurid ja komponendid: koliin, inositool, seriin; aine, mis hõlbustab seriinfosfatiidide dekarboksüülimist - püridoksaalfosfaat; metüülrühma doonor - metioniin; foolhape ja tsüanokobalamiin, mis osalevad metüülrühma ülekande koensüümide (THFA ja metüülkobalamiin) moodustamises. Neid saab kasutada ravimitena, mis takistavad triatsüülglütserooli liigset ladestumist kudedesse (rasva infiltratsioon).
|
||
| Tabel 24. Inimese päevane ainevahetus (ümardatud väärtused; täiskasvanud kehamassiga umbes 70 kg) | |||
| Ained | Sisu kehas, g | Päevane tarbimine, g | Päevane jaotus |
| O2 | - | 850 | - |
| CO2 | - | - | 1000 |
| Vesi | 42 000 | 2200 | 2600 |
| Orgaaniline aine: | |||
| oravad | 15 000 | 80 | - |
| lipiidid | 10 000 | 100 | - |
| süsivesikuid | 700 | 400 | - |
| nukleiinhapped | 700 | - | - |
| uurea | - | - | 30 |
| Mineraalsoolad | 3 500 | 20 | 20 |
| Kokku | 71 900 | 3650 | 3650 |
Ainevahetustegevuse tulemusena tekivad kõigis kehaosades kahjulikud ained, mis satuvad verre ja tuleb eemaldada. Seda funktsiooni täidavad neerud, mis eraldavad kahjulikud ained ja saadavad need põide, kust need seejärel organismist väljutatakse. Ainevahetusprotsessis osalevad ka teised organid: maks, pankreas, sapipõis, sooled, higinäärmed.
Inimene eritab peamised ainevahetuse lõppsaadused uriini, väljaheite, higi ja väljahingatavas õhus - CO 2, H 2 O, uurea H 2 N - CO - NH 2. Orgaaniliste ainete vesinik eritub H 2 O kujul ning organism eraldab vett rohkem kui tarbib (vt tabel 24): orgaaniliste ainete vesinikust ja sissehingatavast hapnikust moodustub organismis ligikaudu 400 g vett ööpäevas. õhk (ainevahetusvesi). Orgaaniliste ainete süsinik ja hapnik eemaldatakse CO 2 kujul ning lämmastik karbamiidi kujul.
Lisaks eritab inimene palju muid aineid, kuid väikestes kogustes, nii et nende panus üldisesse ainevahetuse tasakaalu organismi ja keskkonna vahel on väike. Siiski tuleb märkida, et selliste ainete vabanemise füsioloogiline tähtsus võib olla märkimisväärne. Näiteks heemi lagunemissaaduste või võõrühendite, sealhulgas ravimite ainevahetusproduktide vabanemise häirimine võib põhjustada tõsiseid ainevahetushäireid ja kehafunktsioone.
Metaboolsed substraadid- toidust pärinevad keemilised ühendid. Nende hulgas võib eristada kahte rühma: peamised toitained (süsivesikud, valgud, lipiidid) ja väikesed, mida tarnitakse väikestes kogustes (vitamiinid, mineraalsed ühendid).
On tavaks teha vahet asendatavatel ja asendamatutel toitainetel. Olulised toitained on need, mida keha ei saa sünteesida ja seetõttu tuleb neid toiduga varustada.
Metaboolne rada- see on konkreetse aine keemiliste muundumiste olemus ja järjestus kehas. Transformatsiooniprotsessi käigus tekkivaid vaheprodukte nimetatakse metaboliitideks ja lõpp-produktiks on ainevahetusraja viimane ühend.
Keemilised muutused toimuvad kehas pidevalt. Organismi toitumise tulemusena toimuvad lähteainetes metaboolsed muutused; Ainevahetuse lõpp-produktid eemaldatakse kehast pidevalt. Seega on organism termodünaamiliselt avatud keemiline süsteem. Lihtsaim näide metaboolsest süsteemist on üks hargnemata metaboolne ahel:




-->a -->b -->c -->d -->
Pideva ainete vooluga sellises süsteemis saavutatakse dünaamiline tasakaal, kui iga metaboliidi moodustumise kiirus on võrdne selle tarbimise kiirusega. See tähendab, et iga metaboliidi kontsentratsioon jääb muutumatuks. Seda süsteemi olekut nimetatakse statsionaarseks ja selles olekus olevate ainete kontsentratsioone nimetatakse statsionaarseteks kontsentratsioonideks.
Elusorganism ei vasta mingil hetkel antud statsionaarse seisundi definitsioonile. Kuid arvestades selle parameetrite keskmist väärtust suhteliselt pika aja jooksul, võib märkida nende suhtelist püsivust ja seeläbi õigustada statsionaarse süsteemi kontseptsiooni rakendamist elusorganismide suhtes. [saade] .

Joonisel fig. 64 kujutab hargnemata metaboolse ahela hüdrodünaamilist mudelit. Selles seadmes modelleerib balloonides oleva vedelikusamba kõrgus vastavalt metaboliitide a-d kontsentratsioone ja silindrite vaheliste ühendustorude läbilaskevõime vastavate ensümaatiliste reaktsioonide kiirust.
Süsteemi siseneva vedeliku konstantsel kiirusel jääb vedelikusamba kõrgus kõigis silindrites muutumatuks: see on statsionaarne olek.
Kui vedeliku sisenemise kiirus suureneb, suureneb vedelikusamba kõrgus kõigis silindrites ja vedeliku voolu kiirus kogu süsteemis: süsteem on liikunud uude statsionaarsesse olekusse. Sarnased üleminekud toimuvad elusraku metaboolsetes protsessides.
Metaboliitide kontsentratsiooni reguleerimine
Tavaliselt toimub metaboolses ahelas reaktsioon, mis kulgeb palju aeglasemalt kui kõik teised reaktsioonid – see on kiirust piirav etapp. Joonisel on selline etapp modelleeritud kitsa ühendustoruga esimese ja teise silindri vahel. Kiirust piirav etapp määrab lähteaine metaboolse ahela lõppsaaduseks muutumise üldise kiiruse. Sageli on kiirust piiravat reaktsiooni katalüüsiv ensüüm reguleeriv ensüüm: selle aktiivsus võib rakuliste inhibiitorite ja aktivaatorite mõjul muutuda. Nii on tagatud ainevahetusraja reguleerimine. Joonisel fig. 64, esimese ja teise silindri vahelise ventiiliga üleminekutoru modelleerib reguleerivat ensüümi: klappi tõstes või langetades saab süsteemi viia uude statsionaarsesse olekusse, kus vedeliku üldine voolukiirus ja muud vedeliku tasemed on erineval tasemel. silindrid.
Hargnenud metaboolsetes süsteemides katalüüsivad reguleerivad ensüümid tavaliselt esimesi reaktsioone hargnemiskohas, nagu reaktsioonid b -> c ja b -> i joonisel fig. 65. See tagab metaboolse süsteemi iga haru iseseisva reguleerimise võimaluse.

Paljud metaboolsed reaktsioonid on pöörduvad; nende voolu suuna elusrakus määrab produkti tarbimine järgnevas reaktsioonis või produkti eemaldamine reaktsioonisfäärist, näiteks eritumisega (joonis 65).
Keha seisundi muutumisel (toidu tarbimine, üleminek puhkuselt kehalisele aktiivsusele jne) muutub metaboliitide kontsentratsioon organismis, st tekib uus statsionaarne seisund. Kuid samadel tingimustel, näiteks pärast öist und (enne hommikusööki), on need kõigil tervetel inimestel ligikaudu ühesugused; Regulatiivsete mehhanismide toime tõttu säilib iga metaboliidi kontsentratsioon talle iseloomulikul tasemel. Nende kontsentratsioonide keskmised väärtused (mis näitavad kõikumiste piire) on üks normi tunnuseid. Haiguste korral muutuvad metaboliitide püsikontsentratsioonid ja need muutused on sageli spetsiifilised konkreetsele haigusele. Sellel põhinevad paljud biokeemilised meetodid haiguste laboratoorseks diagnoosimiseks.
Ainevahetuse teel on kaks suunda – anabolism ja katabolism (joonis 1).
- Anaboolsete reaktsioonide eesmärk on muuta lihtsamad ained keerulisemateks, mis moodustavad raku struktuursed ja funktsionaalsed komponendid, nagu koensüümid, hormoonid, valgud, nukleiinhapped jne. Need reaktsioonid on valdavalt redutseerivad, millega kaasneb vaba keemilise energia kulutamine. (energoonilised reaktsioonid). Nende jaoks on energiaallikaks katabolismi protsess. Lisaks kasutatakse kataboolset energiat raku (motoorse jt) funktsionaalse aktiivsuse tagamiseks.
- Kataboolsed muundumised on protsessid, mille käigus lagunevad komplekssed molekulid, nii toiduga saadud kui ka rakus sisalduvad molekulid lihtsateks komponentideks (süsinikdioksiid ja vesi); need reaktsioonid on tavaliselt oksüdatiivsed ja nendega kaasneb vaba energia vabanemine (eksergoonilised reaktsioonid).
Amfiboolne rada(kahekordne) - tee, mille käigus ühendatakse kataboolsed ja anaboolsed transformatsioonid, st. Koos ühe ühendi hävitamisega toimub teise süntees.
Amfiboolsed rajad on seotud ainete lõpp- ehk lõpliku oksüdatsioonisüsteemiga, kus nad põlevad lõppsaaduseks (CO 2 ja H 2 O) ning moodustuvad suurel hulgal energiat. Lisaks neile on ainevahetuse lõppsaadused uurea ja kusihape, mis tekivad aminohapete ja nukleotiidide vahetusreaktsioonides. Seos ATP-ADP süsteemi kaudu toimuva metabolismi ja metaboliitide amfiboolse tsükli vahel on skemaatiliselt näidatud joonisel fig. 2.
ATP-ADP süsteem(ATP-ADP tsükkel) on tsükkel, mille käigus toimub pidev ATP molekulide moodustumine, mille hüdrolüüsienergiat kasutab organism erinevat tüüpi töödel.
See on metaboolne rada, mille üks lõppproduktidest on identne ühe selles protsessis osaleva ühendiga (joonis 3).
Anaplerootiline rada- metaboolne, mille lõppsaadus on identne mis tahes tsüklilise raja ühe vaheproduktiga. Anaplerootiline rada joonise fig. 3 täiendab tsüklit tootega X (anapleroos – täiendamine).
Kasutame seda näidet. Linnas sõidavad bussid markidega X, Y, Z. Nende marsruudid on näidatud diagrammil (joonis 4).
Selle näite põhjal määratleme järgmise.
- Konkreetne metaboolne rada on transformatsioonide kogum, mis on iseloomulik ainult konkreetsele ühendile (näiteks süsivesikud, lipiidid või aminohapped).
- Üldine metaboolne rada on transformatsioonide kogum, mis hõlmab kahte või enamat tüüpi ühendeid (näiteks süsivesikuid ja lipiide või süsivesikuid, lipiide ja aminohappeid).
Metaboolsete radade lokaliseerimine
Eukarüootsete indiviidide kataboolsed ja anaboolsed rajad erinevad rakus paiknemise poolest (tabel 22).
Selline jagunemine on tingitud ensüümsüsteemide piiramisest raku teatud piirkondadega (kompartmentaliseerimine), mis tagab nii rakusiseste funktsioonide segregatsiooni ja integratsiooni kui ka sobiva kontrolli.
Praegu on tänu elektronmikroskoopilistele ja histokeemilistele uuringutele, samuti diferentsiaaltsentrifuugimise meetodile saavutatud märkimisväärseid edusamme ensüümide rakusisese lokaliseerimise määramisel. Nagu näha jooniselt fig. 74, rakust võib leida raku ehk plasma, membraani, tuuma, mitokondrid, lüsosoomid, ribosoomid, torukeste ja vesiikulite süsteemi – endoplasmaatilise retikulumi, lamellkompleksi, mitmesuguseid vakuoole, rakusiseseid inklusioone jne. Peamine diferentseerimata osa raku tsütoplasma massi järgi on hüaloplasma (või tsütosool).
On kindlaks tehtud, et RNA polümeraasid ehk ensüümid, mis katalüüsivad mRNA moodustumist, paiknevad tuumas (täpsemalt tuumas). Tuum sisaldab ensüüme, mis osalevad DNA replikatsiooni protsessis ja mõned teised (tabel 23).

| Tabel 23. Mõnede ensüümide lokaliseerimine rakus | |
| Tsütosool | Glükolüütilised ensüümid Pentoosi raja ensüümid Aminohappeid aktiveerivad ensüümid Rasvhapete sünteesi ensüümid Fosforülaas Glükogeeni süntaas |
| Mitokondrid | Püruvaatdehüdrogenaasi kompleks Krebsi tsükli ensüümid Rasvhapete oksüdatsioonitsükli ensüümid Bioloogilise oksüdatsiooni ja oksüdatiivse fosforüülimise ensüümid |
| Lüsosoomid | Happe hüdrolaasid |
| Mikrosomaalne fraktsioon | Valkude sünteesi ribosomaalsed ensüümid Ensüümid fosfolipiidide, triglütseriidide, aga ka mitmete kolesterooli sünteesis osalevate ensüümide sünteesiks Hüdroksülaasid |
| Plasma membraan | Adenülaattsüklaas, Na+-K+-sõltuv ATPaas |
| Tuum | DNA replikatsiooni protsessis osalevad ensüümid RNA polümeraas NAD süntetaas |
Ensüümide ja rakustruktuuride vaheline seos:
- Mitokondrid. Mitokondritega on seotud bioloogilise oksüdatsiooni (koehingamise) ja oksüdatiivse fosforüülimise ahela ensüümid, samuti püruvaadi dehüdrogenaasi kompleksi ensüümid, trikarboksüülhappe tsükkel, uurea süntees, rasvhapete oksüdatsioon jne.
- Lüsosoomid. Lüsosoomid sisaldavad peamiselt hüdrolüütilisi ensüüme, mille optimaalne pH on umbes 5. Ensüümide hüdrolüütilise olemuse tõttu nimetatakse neid osakesi lüsosoomideks.
- Ribosoomid. Valgu sünteesi ensüümid paiknevad ribosoomides, nendes osakestes transleeritakse mRNA ja aminohapped seotakse polüpeptiidahelateks, et moodustada valgumolekule.
- Endoplasmaatiline retikulum. Endoplasmaatiline retikulum sisaldab lipiidide sünteesiks vajalikke ensüüme, samuti ensüüme, mis osalevad hüdroksüülimisreaktsioonides.
- Plasma membraan. Plasmamembraan on peamiselt seotud ATPaasiga, mis transpordib Na + ja K +, adenülaattsüklaasi ja mitmeid teisi ensüüme.
- Tsütosool. Tsütosool (hüaloplasma) sisaldab glükolüüsi, pentoositsükli, rasvhapete ja mononukleotiidide sünteesi, aminohapete aktiveerimise ensüüme, aga ka paljusid glükoneogeneesi ensüüme.
Tabelis. 23 võtab kokku andmed olulisemate ensüümide lokaliseerimise ja üksikute metaboolsete etappide kohta erinevates rakuvälistes struktuurides.
Multiensüümsüsteemid paiknevad organellide struktuuris nii, et iga ensüüm paikneb antud reaktsioonide järjestuses järgmise ensüümi vahetus läheduses. Tänu sellele väheneb reaktsiooni vaheühendite difusioonile kuluv aeg ning kogu reaktsioonide jada on ajas ja ruumis rangelt kooskõlastatud. See kehtib näiteks püroviinamarihappe ja rasvhapete oksüdatsioonis, valgusünteesis osalevate ensüümide, aga ka elektronide ülekande ja oksüdatiivse fosforüülimise ensüümide kohta.
Osadeks jaotamine tagab ka keemiliselt kokkusobimatud reaktsioonide üheaegse toimumise, s.t. katabolismi ja anabolismi teede sõltumatus. Seega võib rakus üheaegselt toimuda pika ahelaga rasvhapete oksüdeerumine atsetüül-CoA staadiumisse ja vastupidine protsess, rasvhapete süntees atsetüül-CoA-st. Need keemiliselt kokkusobimatud protsessid toimuvad raku erinevates osades: rasvhapete oksüdatsioon mitokondrites ja nende süntees väljaspool mitokondreid hüaloplasmas. Kui need teed langeksid kokku ja erineksid vaid protsessi suuna poolest, tekiksid vahetuses nn kasutud ehk asjatud tsüklid. Sellised tsüklid esinevad patoloogias, kui metaboliitide kasutu ringlus on võimalik.
Erinevate taimede, loomade ja mikroorganismide klasside ainevahetuse üksikute seoste väljaselgitamine paljastab eluslooduse biokeemiliste muutuste radade põhimõttelise ühisosa.
AINEVAHETUSE REGULEERIMISE PÕHISÄTTED
Toimub ainevahetuse reguleerimine rakulisel ja subtsellulaarsel tasemel
- reguleerides ensüümide sünteesi ja katalüütilist aktiivsust.
Sellised reguleerivad mehhanismid hõlmavad
- ensüümide sünteesi pärssimine ainevahetusraja lõpp-produktide poolt,
- ühe või mitme ensüümi sünteesi indutseerimine substraatide poolt,
- juba olemasolevate ensüümmolekulide aktiivsuse moduleerimine,
- metaboliitide rakku sisenemise kiiruse reguleerimine. Siin mängivad juhtivat rolli protoplasmat ümbritsevad bioloogilised membraanid ja selles paiknevad tuum, mitokondrid, lüsosoomid ja muud subtsellulaarsed organellid.
- reguleerides hormoonide sünteesi ja aktiivsust. Seega mõjutab valkude ainevahetust kilpnäärmehormoon - türoksiin; rasvade ainevahetust mõjutavad kõhunäärme ja kilpnäärme, neerupealiste ja hüpofüüsi hormoonid; süsivesikute ainevahetust mõjutavad kõhunäärme (insuliin) ja neerupealiste hormoonid ( adrenaliin). Eriline roll hormoonide toimemehhanismis on tsüklilistel nukleotiididel (cAMP ja cGMP).
Loomadel ja inimestel on ainevahetuse hormonaalne regulatsioon tihedalt seotud närvisüsteemi koordineeriva tegevusega. Näide närvisüsteemi mõjust süsivesikute ainevahetusele on Claude Bernardi niinimetatud suhkrusüst, mis põhjustab hüperglükeemiat ja glükosuuriat.
- Metaboolse integratsiooni protsessides on kõige olulisem roll ajukoorel. Nagu märkis I. P. Pavlov: „Mida täiuslikum on loomaorganismi närvisüsteem, mida tsentraliseeritum on, seda kõrgemal on tema osakond üha enam kogu organismi tegevuste juht ja jagaja... See kõrgem osakond sisaldab endas tema jurisdiktsiooni alla kuuluvad kõik kehas esinevad nähtused".
Seega eriline kombinatsioon, range koordinatsioon ja metaboolsete reaktsioonide kiirus koos moodustavad süsteemi, mis paljastab tagasiside mehhanismi omadused (positiivsed või negatiivsed).

KESKMISE AINEVAHETUSE UURIMISE MEETODID
Ainevahetuse uurimiseks kasutatakse kahte lähenemisviisi:
- uuringud kogu organismi kohta (in vivo katsed) [saade]
Klassikaline näide terve organismi uurimisest, mis viidi läbi selle sajandi alguses, on Knoopi katsed. Ta uuris, kuidas rasvhapped organismis lagunevad. Selleks toitis Knoop koertele erinevaid paaris (I) ja paaritu (II) süsinikuaatomite arvuga rasvhappeid, milles üks vesinikuaatom metüülrühmas asendati fenüülradikaaliga C6H5:
Esimesel juhul eritus koerte uriiniga alati fenüüläädikhape C 6 H 5 -CH 2 -COOH ja teisel juhul bensoehape C 6 H 5 -COOH. Nende tulemuste põhjal järeldas Knoop, et rasvhapete lagunemine kehas toimub kahe süsiniku fragmendi järjestikuse elimineerimise kaudu, alustades karboksüüli otsast:
CH3-CH2-|-CH2-CH2-|-CH2-CH2-|-CH2-CH2-|-CH2-COOH
Seda järeldust kinnitasid hiljem ka teised meetodid.
Põhimõtteliselt kasutas Knoop nendes uuringutes molekulide märgistamise meetodit: ta kasutas märgisena fenüülradikaali, mis ei muutu kehas. Alates umbes XX sajandi 40ndatest. Laialt on levinud selliste ainete kasutamine, mille molekulid sisaldavad elementide radioaktiivseid või raskeid isotoope. Näiteks katseloomadele erinevate radioaktiivset süsinikku (14 C) sisaldavate ühenditega söötmisel tehti kindlaks, et kõik kolesterooli molekulis olevad süsinikuaatomid pärinevad atsetaadi süsinikuaatomitest:

Tavaliselt kasutatakse kas elementide stabiilseid isotoope, mis erinevad massi poolest kehas tavaliselt leiduvatest elementidest (tavaliselt rasked isotoobid) või radioaktiivseid isotoope. Stabiilsetest isotoopidest kasutatakse enim vesinikku massiga 2 (deuteerium, 2 H), lämmastikku massiga 15 (15 N), süsinikku massiga 13 (13 C) ja hapnikku massiga. 18 (18 C). Radioaktiivsetest isotoopidest vesiniku (triitium, 3 H), fosfori (32 P ja 33 P), süsiniku (14 C), väävli (35 S), joodi (131 I), raua (59 Fe), naatriumi isotoobid (54 Na) kasutatakse ) jne.
Pärast uuritava ühendi molekuli märgistamist stabiilse või radioaktiivse isotoobi abil ja selle kehasse viimist määratakse neid sisaldavad märgistatud aatomid või keemilised rühmad ning pärast nende avastamist teatud ühendites tehakse järeldus, kuidas on mida märgistatud aine kehas muundub. Isotoobimärgise abil saab määrata ka aine organismis viibimise aja, mis teatud ligikaudselt iseloomustab bioloogilist poolestusaega, st aega, mille jooksul isotoobi või märgistatud ühendi kogus väheneb poole võrra, või saada täpset teavet üksikute rakkude membraanide läbilaskvuse kohta. Isotoope kasutatakse ka selleks, et teha kindlaks, kas antud aine on mõne teise ühendi eelkäija või lagunemissaadus, ja määrata kudede ringluse kiirust. Lõpuks, kui on olemas mitu metaboolset rada, on võimalik kindlaks teha, milline neist on domineeriv.
Tervete organismide uuringutes uuritakse ka organismi toitumisvajadust: kui mõne aine väljajätmine toidust toob kaasa kasvu ja arengu või organismi füsioloogiliste funktsioonide katkemise, siis on see aine oluline toitumistegur. Vajalikud toitainete kogused määratakse kindlaks sarnaselt.
- ja uuringud isoleeritud kehaosadel - analüütilis-lagundamismeetodid (in vitro katsed, s.t väljaspool keha, katseklaasis või muudes laboratoorsetes anumates). Nende meetodite põhimõte on keeruka bioloogilise süsteemi järkjärguline lihtsustamine või pigem lagunemine, et eraldada üksikud protsessid. Kui vaadelda neid meetodeid kahanevas järjekorras, st keerukamatest lihtsamateni, saab neid järjestada järgmises järjekorras:
- üksikute elundite eemaldamine [saade]
Elundite eemaldamisel on kaks uurimisobjekti: eemaldatud elundita organism ja isoleeritud organ.
Eraldatud elundid. Kui isoleeritud organi arterisse süstitakse mingi aine lahus ja veenist voolavas vedelikus analüüsitakse aineid, siis on võimalik kindlaks teha, milliseid muundumisi see aine elundis läbib. Näiteks sel viisil leiti, et maks on peamine ketokehade ja uurea moodustumise koht.
Sarnaseid katseid saab läbi viia organitega ilma neid kehast isoleerimata (arteriovenoosse erinevuse meetod): sellistel juhtudel võetakse analüüsimiseks verd elundi arterisse ja veeni sisestatud kanüülide või süstla abil. Nii saab näiteks kindlaks teha, et töötavatest lihastest voolavas veres suureneb piimhappe kontsentratsioon ning maksa kaudu voolates vabaneb veri piimhappest.
- koelõike meetod [saade]
Sektsioonid on õhukesed koetükid, mis on valmistatud mikrotoomi või lihtsalt habemenuga. Sektsioone inkubeeritakse lahuses, mis sisaldab toitaineid (glükoosi või muud) ja ainet, mille transformatsioone teatud tüüpi rakkudes soovitakse määrata. Pärast inkubeerimist analüüsitakse inkubatsioonivedelikus leiduva uuritava aine ainevahetusprodukte.
Koelõikude meetodi pakkus esmakordselt välja Warburg 20ndate alguses. Seda tehnikat kasutades on võimalik uurida kudede hingamist (hapnikutarbimist ja süsinikdioksiidi vabanemist kudede poolt). Oluliseks piiranguks ainevahetuse uurimisel koelõigete kasutamisel on rakumembraanid, mis sageli toimivad barjäärina rakusisu ja “toitelahuse” vahel.
- homogenaadid ja subtsellulaarsed fraktsioonid [saade]

Homogenaadid on rakuvabad preparaadid. Need saadakse rakumembraanide hävitamisel, hõõrudes kangast liivaga või spetsiaalsetes seadmetes - homogenisaatorites (joonis 66). Homogenaatides ei ole lisatud substraatide ja ensüümide vahel mitteläbilaskvusbarjääri.
Rakumembraanide hävitamine võimaldab otsest kontakti raku sisu ja lisatud ühendite vahel. See võimaldab kindlaks teha, millised ensüümid, koensüümid ja substraadid on uuritava protsessi jaoks olulised.
Homogenaatide fraktsioneerimine. Homogenaadist saab eraldada subtsellulaarseid osakesi, nii supramolekulaarseid (rakuorganellid) kui ka üksikuid ühendeid (ensüümid ja muud valgud, nukleiinhapped, metaboliidid). Näiteks diferentsiaaltsentrifuugimise abil saate tuumade, mitokondrite ja mikrosoomide fraktsioone (mikrosoomid on endoplasmaatilise retikulumi fragmendid). Need organellid on erineva suuruse ja tihedusega ning seetõttu settivad need erinevatel tsentrifuugimiskiirustel. Eraldatud organellide kasutamine võimaldab uurida nendega seotud ainevahetusprotsesse. Näiteks kasutatakse eraldatud ribosoome valgusünteesi radade ja mehhanismide uurimiseks ning mitokondrite abil Krebsi tsükli või hingamisensüümide ahela oksüdatiivseid reaktsioone.
Pärast mikrosoomide settimist jäävad raku lahustuvad komponendid supernatanti - lahustuvad valgud, metaboliidid. Kõiki neid fraktsioone saab täiendavalt fraktsioneerida, kasutades erinevaid meetodeid, eraldades nende koostisosad. Eraldatud komponentidest on võimalik rekonstrueerida biokeemilisi süsteeme, näiteks lihtsat “ensüüm + substraat” süsteemi ja selliseid keerukaid nagu valkude ja nukleiinhapete sünteesisüsteemid.
- ensüümsüsteemi osaline või täielik rekonstrueerimine in vitro, kasutades ensüüme, koensüüme ja muid reaktsioonikomponente [saade]
Kasutatakse kõrgelt puhastatud ensüümide ja koensüümide integreerimiseks. Näiteks sai seda meetodit kasutades võimalik täielikult reprodutseerida kääritussüsteem, millel on kõik pärmi kääritamise põhiomadused.
- üksikute elundite eemaldamine [saade]
Loomulikult on need meetodid väärtuslikud vaid ülima eesmärgi – kogu organismi toimimise mõistmise – saavutamiseks vajaliku sammuna.
INIMESE BIOKEEMIA ÕPPIMISE TUNNUSED
Maa peal elavate erinevate organismide molekulaarsetes protsessides on kaugeleulatuvaid sarnasusi. Sellised põhiprotsessid nagu maatriksi biosüntees, energia muundamise mehhanismid ja ainete metaboolsete muundumiste peamised rajad on organismides bakteritest kõrgemate loomadeni ligikaudu samad. Seetõttu näivad paljud E. coli-ga tehtud uuringute tulemused olevat rakendatavad ka inimeste puhul. Mida suurem on liikide fülogeneetiline sugulus, seda tavalisemad on nende molekulaarsed protsessid.
Valdav enamus teadmisi inimese biokeemia kohta saadakse sel viisil: teistes loomades toimuvate teadaolevate biokeemiliste protsesside põhjal püstitatakse hüpotees selle protsessi kõige tõenäolisema versiooni kohta inimkehas ja seejärel kontrollitakse hüpoteesi otseste uuringutega. inimese rakud ja koed. Selline lähenemine võimaldab läbi viia uuringuid väikeses koguses inimestelt saadud bioloogilist materjali. Kõige sagedamini kasutatakse kudesid, mis on eemaldatud kirurgiliste operatsioonide käigus, vererakud (erütrotsüüdid ja leukotsüüdid), samuti in vitro kultuuris kasvatatud inimese koerakud.
Inimese pärilike haiguste uurimine, mis on vajalik tõhusate ravimeetodite väljatöötamiseks, annab samaaegselt palju teavet inimkehas toimuvate biokeemiliste protsesside kohta. Eelkõige põhjustab ensüümi kaasasündinud defekt selle substraadi kogunemist organismis; selliseid ainevahetushäireid uurides avastatakse vahel uusi, kvantitatiivselt ebaolulisi ensüüme ja reaktsioone (seetõttu jäid need normi uurimisel tähele panemata), millel on aga eluline tähtsus.
Moodulüksus 1 ENSÜÜMID VALGUKATALÜÜSIDENA
Õppeeesmärgid Oskama:
1. Selgitage ensüümide omadusi ja ensümaatilise katalüüsi tunnuseid nende valgulise olemuse järgi.
2. Hinnata vitamiinide rolli inimese toitumises koensüümide sünteesi substraatidena.
3. Tehke kindlaks, kas ensüümid kuuluvad nende nomenklatuuri järgi teatud klassi ja alamklassi.
4. Arvutage ensüümi aktiivsus ja hinnake ensüümi afiinsust substraadi suhtes.
Tea:
1. Ensüümide kui valgukatalüsaatorite struktuuriomadused.
2. Ensüümi spetsiifilisuse tüübid.
3. Ensüümide klassifitseerimise alused, ensüümide klassid, näited ensüümide poolt katalüüsitavatest reaktsioonidest.
4. Koensüümide ja kofaktorite struktuur ning nende osa ensümaatilises katalüüsis, vitamiinide osa selles protsessis.
5. Ensümaatilise kineetika alused.
6. Ensüümide aktiivsuse ühikud ja nende määramise meetodid.
TEEMA 2.1. ENSÜÜMI KUI VALGU OMADUSED
KATALÜSAATOR
1. Ensüümid on valkude katalüsaatorid keemiliste reaktsioonide kiirendamine elusrakkudes. Neil on kõik valkudele iseloomulikud omadused ja teatud struktuursed omadused, mis määravad nende katalüütilised omadused. Ensüümid alluvad pealegi katalüüsi üldistele seadustele ja neil on mittebioloogilistele katalüsaatoritele iseloomulikud omadused: kiirendavad energeetiliselt võimalikke reaktsioone, hoiavad keemilise süsteemi energia konstantsena ega kulu reaktsiooniprotsessi käigus ära.
2. Ensüüme iseloomustavad:
spetsiifilisus. Ensüümi, nagu iga valgu, bioloogilise funktsiooni määrab selle struktuuris aktiivse keskuse olemasolu, millega konkreetne ligand interakteerub. Ensüümi aktiivse saidiga interakteeruvat ligandi nimetatakse substraat.
katalüütiline efektiivsus. Enamik ensüümide katalüüsitud reaktsioone on väga tõhusad, toimudes 10 8–10 14 korda kiiremini kui katalüüsimata reaktsioonid. Iga ensüümi molekul on võimeline muutma 100 kuni 1000 substraadi molekuli produktiks sekundis.
konformatsiooniline labiilsus. Ensüümi, nagu iga valgu molekuli, katalüütiline efektiivsus sõltub selle konformatsioonist ja eriti aktiivse tsentri konformatsioonist. Rakkudes on aineid, mis osade katkemise ja teiste nõrkade sidemete tekkimise tõttu võivad põhjustada väiksemaid muutusi ensüümmolekuli konformatsioonis; see võib põhjustada ensüümi aktiivsuse suurenemist või vähenemist.
3. Ensüümi aktiivsust saab reguleerida. Ensüümide toime rakus on reeglina rangelt järjestatud: ühe ensümaatilise reaktsiooni saadus on teise substraat; seega moodustades metaboolsed rajad. Peaaegu iga metaboolse raja paljude ensüümide hulgas on võtme- või regulatiivne, ensüümid, mille aktiivsus võib varieeruda sõltuvalt raku vajadusest metaboolse raja lõppprodukti järele.
4. Optimaalsed tingimused ensümaatiliste reaktsioonide jaoks: temperatuur 37-38 °C; normaalne atmosfäärirõhk, pH 6,9-7,7, iseloomulik enamikule kudedele. Seevastu tõhus keemiline katalüüs nõuab sageli kõrgeid temperatuure ja rõhku ning äärmuslikke pH väärtusi.
TEEMA 2.2. AKTIIVNE KESKUS: ENSÜÜMI TOIMIMISE KONKREETSUS
1. Ensüümide aktiivne koht- see on valgu molekuli teatud osa, mis on võimeline substraadiga komplementaarselt seonduma ja tagama selle katalüütilise transformatsiooni. Aktiivse tsentri struktuuri moodustavad aminohapperadikaalid, nagu iga valgu aktiivse tsentri puhul. Ensüümi aktiivne keskus sisaldab aminohappejääke, mille funktsionaalrühmad tagavad substraadi komplementaarse seondumise (sidumissait), ja aminohappejääke, mille funktsionaalrühmad viivad läbi substraadi keemilise transformatsiooni (katalüütiline sait) ( joonis 2.1).
Riis. 2.1. Ensüümi aktiivse tsentri struktuuri skeem.
Punasega on märgitud aminohapped, mis moodustavad ensüümi aktiivse tsentri: 1 - sidumissait; 2 - katalüütiline sektsioon
2. Spetsiifilisus- ensüümide kõige olulisem omadus, mis määrab ensüümide bioloogilise tähtsuse. Eristama substraat Ja ensüümi katalüütiline spetsiifilisus, mis on määratud aktiivse keskuse struktuuriga.
3. Under substraadi spetsiifilisus Termin "tähis" viitab iga ensüümi võimele interakteeruda ainult ühe või mitme spetsiifilise substraadiga.
Eristama:
- substraadi absoluutne spetsiifilisus, kui ensüümi aktiivne sait on komplementaarne ainult ühe substraadiga;
- rühma substraadi spetsiifilisus, kui ensüüm katalüüsib sama tüüpi reaktsiooni väikese koguse (rühma) struktuurilt sarnaste substraatidega;
- stereospetsiifilisus, kui ensüümil on absoluutne spetsiifilisus ainult ühe substraadi olemasoleva stereoisomeeri suhtes.
4. Katalüütiline spetsiifilisus või substraadi muundamise raja spetsiifilisus, tagab sama substraadi transformatsiooni erinevate ensüümide toimel. Selle tagab vastavate ensüümide aktiivtsentrite katalüütiliste kohtade struktuur. Näiteks molekul
Inimese maksarakkudes sisalduv glükoos-6-fosfaat on nelja erineva ensüümi substraat: fosfoglükomutaas, glükoos-6-fosfaatfosfataas, fosfoglükoisomeraas ja glükoos-6-fosfaatdehüdrogenaas. Kuid nende ensüümide katalüütiliste kohtade struktuuriliste iseärasuste tõttu toimuvad glükoos-6-fosfaadi mitmesugused transformatsioonid nelja erineva produkti moodustumisega (joonis 2.2).
 Riis. 2.2. Glükoos-6-fosfaadi muundamise katalüütilised rajad.
Riis. 2.2. Glükoos-6-fosfaadi muundamise katalüütilised rajad.
Substraadi konversiooniraja spetsiifilisus võimaldab transformeerida sama substraati erinevate ensüümide toimel. Glükoos-6-fosfaadi molekul on substraat erinevatele ensüümidele, mis viib erinevate toodete moodustumiseni
TEEMA 2.3. ENSÜÜMI TOIMIMISMEHHANISM
1. Katalüüsi käigus ensüümi-substraadi (ES) kompleksis ensüümi aktiivse saidiga seotud substraat muundub keemiliseks tooteks, mis seejärel vabaneb. Katalüüsiprotsessi võib skemaatiliselt kujutada järgmiselt:
Ensümaatilise katalüüsi protsessi võib jagada etappideks (joonis 2.3). I etapis läheneb substraat ja orienteerub ensüümi aktiivse tsentri piirkonnas. Selle tulemusena II etapis indutseeritud kirjavahetus[substraadi (S) ja ensüümi aktiivse tsentri konformatsiooni muutus] tekib ensüüm-substraadi kompleks (ES). III etapis destabiliseeritakse substraadi sidemed ja moodustub ebastabiilne ensüümi-produkti kompleks (EP). IV etapis laguneb kompleks (EP) koos reaktsiooniproduktide vabanemisega aktiivsest saidist ja ensüümi vabanemisest.
2. Keemilise reaktsiooni energia mõistmiseks on vaja arvestada substraatide ja reaktsioonisaaduste energia muutumist, samuti ensüümide rolli selles protsessis. Teatavasti peavad substraadid reaktsiooni toimumiseks saama sellise koguse lisaenergiat (nimetatakse aktivatsioonienergiaks E a), mis on vajalik substraadi molekulide reaktsiooni sisenemiseks (joonis 2.4). Ensümaatilise reaktsiooni korral aktivatsioonienergia väheneb, mis tagab tõhusama reaktsiooni.
 Riis. 2.3. Ensümaatilise katalüüsi etapid:
Riis. 2.3. Ensümaatilise katalüüsi etapid:
I - lähenemise etapp ja substraadi orientatsioon ensüümi aktiivses keskuses; II - ensüüm-substraadi kompleksi (Eb) moodustumine; III - ebastabiilse ensüümi-produkti kompleksi (EP) moodustumine; IV - reaktsiooniproduktide vabanemine ensüümi aktiivsest keskusest
 Riis. 2.4. Vaba energia muutus keemilise reaktsiooni käigus, katalüüsimata ja ensüümide poolt katalüüsitud.
Riis. 2.4. Vaba energia muutus keemilise reaktsiooni käigus, katalüüsimata ja ensüümide poolt katalüüsitud.
Ensüüm vähendab aktivatsioonienergiat E a, st. vähendab energiabarjääri kõrgust; selle tulemusena suureneb reaktiivsete molekulide osakaal ja reaktsioonikiirus suureneb
TEEMA 2.4. KOFAKTORID JA KOENSÜÜMID
Enamik ensüüme nõuab katalüütilise aktiivsuse avaldamiseks teatud mittevalguliste ainete – kofaktorite – olemasolu. Kofaktoreid on kaks rühma: metalliioonid ja koensüümid.
1. Metalliioonid osalevad ensüümi toimimises mitmel viisil.
Muutke substraadi molekuli konformatsiooni mis pakub täiendavat suhtlust aktiivse saidiga. Näiteks Mg2+-ATP kompleks toimib substraadina.
Need tagavad ensüümi aktiivse saidi loomuliku konformatsiooni. ioonid
Mg 2 +, Mn 2 +, Zn 2 +, Co 2 +, Mo 2 + osalevad ensüümide aktiivse tsentri stabiliseerimises ja aitavad kaasa koensüümi lisamisele.
Need stabiliseerivad ensüümvalgu molekuli konformatsiooni. Näiteks on tsingiioone vaja etanooli oksüdatsiooni katalüüsiva ensüümi alkoholdehüdrogenaasi kvaternaarse struktuuri stabiliseerimiseks.
Osaleb otseselt ensümaatilises katalüüsis. Ioonid Zn 2 +, Fe 2 +, Mn 2 +, Cu 2 + osalevad elektrofiilses katalüüsis. Elektronide ülekandes võivad osaleda ka muutuva valentsiga metalliioonid. Näiteks tsütokroomides (heemi sisaldavad valgud) on raua ioon võimeline siduma ja loovutama ühe elektroni. Selle omaduse tõttu osalevad tsütokroomid redoksreaktsioonides:
 2. Koensüümid on orgaanilised ained, enamasti vitamiinide derivaadid, mis osalevad otseselt ensümaatilises katalüüsis, kuna asuvad ensüümide aktiivses keskuses. Koensüümi sisaldavat ja ensümaatilise aktiivsusega ensüümi nimetatakse holoensüüm. Sellise ensüümi valguosa nimetatakse apoensüüm, millel koensüümi puudumisel puudub katalüütiline aktiivsus.
2. Koensüümid on orgaanilised ained, enamasti vitamiinide derivaadid, mis osalevad otseselt ensümaatilises katalüüsis, kuna asuvad ensüümide aktiivses keskuses. Koensüümi sisaldavat ja ensümaatilise aktiivsusega ensüümi nimetatakse holoensüüm. Sellise ensüümi valguosa nimetatakse apoensüüm, millel koensüümi puudumisel puudub katalüütiline aktiivsus.
 Koensüüm võib seostuda ensüümi valguosaga ainult reaktsiooni ajal või olla tugevate kovalentsete sidemete kaudu seotud apoensüümiga. Viimasel juhul nimetatakse seda proteeside rühm. Tabelis on toodud näited kõige levinumate koensüümide - vitamiini derivaatidest, samuti nende osalemisest ensümaatilistes protsessides. 2.1.
Koensüüm võib seostuda ensüümi valguosaga ainult reaktsiooni ajal või olla tugevate kovalentsete sidemete kaudu seotud apoensüümiga. Viimasel juhul nimetatakse seda proteeside rühm. Tabelis on toodud näited kõige levinumate koensüümide - vitamiini derivaatidest, samuti nende osalemisest ensümaatilistes protsessides. 2.1.
Tabel 2.1. Peamiste koensüümide struktuur ja funktsioon
 Tabeli lõpp. 2.1.
Tabeli lõpp. 2.1.
 TEEMA 2.5. KLASSIFIKATSIOON JA NOMENKLATUUR
TEEMA 2.5. KLASSIFIKATSIOON JA NOMENKLATUUR
ENSÜÜMID
1. Enamiku ensüümide nimi sisaldab järelliidet "ase", mis on lisatud reaktsiooni substraadi nimele (näiteks: ureaas, sahharaas, lipaas, nukleaas) või konkreetse substraadi keemilise muundamise nimele (näiteks: laktaat dehüdrogenaas, adenülaattsüklaas, fosfoglükomutaas, püruvaadi karboksülaas). Kasutusele on jäänud aga hulk triviaalseid, ajalooliselt kinnistunud ensüümide nimetusi, mis ei anna mingit infot ei substraadi ega keemilise muundumise tüübi kohta (näiteks trüpsiin, pepsiin, reniin, trombiin jne).
2. Looduses leiduvate ensüümide süstematiseerimiseks töötas Rahvusvaheline Biokeemia ja Molekulaarbioloogia Liit (IUBMB) 1961. aastal välja nomenklatuuri, mille järgi jagatakse kõik ensüümid kuueks põhiklassiks olenevalt katalüüsitava keemilise reaktsiooni tüübist. Iga klass koosneb arvukatest alamklassidest ja alamklassidest, olenevalt muundatava substraadi keemilisest rühmast, muundatud rühmade doonorist ja aktseptorist, täiendavate molekulide olemasolust jne. Igal kuuel klassil on oma seerianumber, mis on sellele rangelt määratud: 1. klass - oksüdoreduktaasid; 2. klass - transferaasid; 3 klass - hüdrolaasid; 4. klass - lüaasid; 5. klass - isomeraasid; 6. klass - ligaasid
See klassifikatsioon on vajalik ensüümi täpseks tuvastamiseks: iga ensüümi jaoks on koodinumber. Näiteks ensüümi maldehüdrogenaasi süstemaatiline nimi on L-malaat: NAD oksidoreduktaas ja koodnumber on 1.1.1.38. Esimene number tähistab ensüümi klassi numbrit (antud juhul näitab number 1, et ensüüm kuulub oksidoreduktaaside klassi); teine number näitab katalüüsitava reaktsiooni tüüpi (selles näites on hüdroksüülrühm oksüdeerunud); kolmas number tähendab koensüümi (antud juhul NAD+ koensüümi) olemasolu, viimane number on selle alarühma ensüümi seerianumber.
3. Ensüümide põhiklasside omadused koos nende katalüüsitavate reaktsioonide näidetega.
1. Oksüdoreduktaasid katalüüsivad erinevaid redoksreaktsioone. Klass on jagatud alamklassideks:
A) dehüdrogenaasid katalüüsivad dehüdrogeenimisreaktsioone (vesiniku elimineerimine elektronide ülekandmisega dehüdrogeenitud substraadilt teisele aktseptorile). Elektroniaktseptoritena kasutatakse koensüüme NAD+, NADP+, FAD, FMN. Sellesse alamklassi kuuluvad ensüümid malaatdehüdrogenaas (joonis 2.5), isotsitraatdehüdrogenaas, suktsinaatdehüdrogenaas, α-ketobutüraatdehüdrogenaas jne;
 Riis. 2.5. Malaadi dehüdrogeenimisreaktsioon
Riis. 2.5. Malaadi dehüdrogeenimisreaktsioon
b) oksüdaasid- katalüüsida oksüdatsioonireaktsioone molekulaarse hapniku osalusel (joonis 2.6);
Riis. 2.6. Reaktsiooni katalüüsib ensüüm tsütokroom oksüdaas
V) oksügenaasid(hüdroksülaasid) katalüüsivad oksüdatsioonireaktsioone, kaasates hapnikuaatomi substraadi molekuli hüdroksüülrühma. Reaktsioon toimub molekulaarse hapniku osalusel, millest üks aatom on seotud substraadiga ja teine on seotud veemolekuli moodustumisega (joonis 2.7).
 Riis. 2.7. Fenüülalaniini hüdroksüülimisreaktsioon.
Riis. 2.7. Fenüülalaniini hüdroksüülimisreaktsioon.
Reaktsiooni koensüümid: tetrahüdrobiopteriin (H 4 BP) ja dihüdrobiopteriin (H 2 BP)
2. Transferaasid- katalüüsib funktsionaalrühmade ülekandereaktsioone. Sõltuvalt ülekantud rühmast jagunevad nad alamklassidesse: aminotransferaasid (joonis 2.8), atsüültransferaasid, metüültransferaasid, glükosüültransferaasid, kinaasid (fosfotransferaasid) (joonis 2.9).
 Riis. 2.8. Reaktsioon, mida katalüüsib ensüüm ALT (alaniin-a-ketoglutaraataminotransferaas), mis kuulub aminotransferaaside alamklassi transferaaside klassi.
Riis. 2.8. Reaktsioon, mida katalüüsib ensüüm ALT (alaniin-a-ketoglutaraataminotransferaas), mis kuulub aminotransferaaside alamklassi transferaaside klassi.
PF - koensüüm püridoksaalfosfaat
Riis. 2.9. Reaktsioon, mida katalüüsib ensüüm proteiinkinaas, mis kuulub transferaaside klassi, fosfotransferaaside alamklassi.
ATP on fosforhappe jäägi doonor
3. Hüdrolaasid katalüüsivad hüdrolüüsireaktsioone (kovalentse sideme lõhustamine veemolekuli lisamisega purunemiskohas). Need jagunevad olenevalt substraadist alamklassidesse. Nimetused moodustatakse sõltuvalt substraadi molekulist või konkreetsest hüdrolüüsitavast keemilisest sidemest: proteaas, amülaas, glükosidaas, nukleaas, esteraas, fosfataas jne. Valgumolekuli hüdrolüüsi reaktsiooniskeemi näide on näidatud joonisel fig. 2.10.
Riis. 2.10. Valgu molekulide hüdrolüüsi reaktsioon
4. Lüaasid- lüaasid hõlmavad ensüüme, mis lõhustavad substraatidest mittehüdrolüütilisel viisil teatud rühmi, nagu CO 2, H 2 O, NH 2 SH 2 jne, või kinnituvad (näiteks veemolekuli) kaksiksideme kaudu. Dekarboksüülimisreaktsioon (CO2 molekuli elimineerimine) on näidatud joonisel fig. 2.11 ja veemolekuli lisamise reaktsioon (hüdrataasi reaktsioon) on joonisel fig. 2.12.
 Riis. 2.11. Dekarboksüülimisreaktsioon (CO2 molekuli elimineerimine)
Riis. 2.11. Dekarboksüülimisreaktsioon (CO2 molekuli elimineerimine)
PF koensüüm püridoksaalfosfaat
 Riis. 2.12. Reaktsioon veemolekuli lisamisel fumaraadile
Riis. 2.12. Reaktsioon veemolekuli lisamisel fumaraadile
5. Isomeraasid katalüüsivad erinevaid molekulisiseseid transformatsioone (joonis 2.13).
 Riis. 2.13. Reaktsiooni katalüüsib ensüüm fosfoglükoisomeraas
Riis. 2.13. Reaktsiooni katalüüsib ensüüm fosfoglükoisomeraas
6. Ligaasid(süntetaasid) katalüüsivad reaktsioone, mis muudavad molekuli keeruliseks, ühendades kaks molekuli üksteise külge, moodustades kovalentse sideme; sel juhul kasutatakse ATP või teiste suure energiaga ühendite energiat (joonis 2.14).
 Riis. 2.14. Reaktsiooni katalüüsib ensüüm glutamiinsüntetaas
Riis. 2.14. Reaktsiooni katalüüsib ensüüm glutamiinsüntetaas
TEEMA 2.6. ENSÜMATIIVSE KINETIKA ALUSED
KATALÜÜS
1. Ensümaatiliste reaktsioonide kineetika on ensümoloogia haru, mis uurib ensüümide poolt katalüüsitavate keemiliste reaktsioonide kiiruse sõltuvust reageerivate ainete keemilisest olemusest ja keskkonnateguritest.
Ensüümide katalüütilise aktiivsuse mõõtmiseks kasutatakse selliseid näitajaid nagu reaktsioonikiirus või ensüümi aktiivsus. Ensümaatilise reaktsiooni kiirus mille määrab substraadi molekulide arvu vähenemine või produktimolekulide arvu suurenemine ajaühikus. Ensümaatilise reaktsiooni kiirus on ensüümi katalüütilise aktiivsuse mõõt ja seda tähistatakse kui ensüümi aktiivsus.
Praktikas kasutatakse ensüümi aktiivsuse iseloomustamiseks tavapäraseid väärtusi: 1 rahvusvaheline aktiivsusühik (IU) vastab ensüümi kogusele, mis katalüüsib optimaalsetes tingimustes (temperatuur 37°) 1 µmol substraadi muundumist 1 minuti jooksul. C, lahuse optimaalne pH väärtus) ensümaatilise reaktsiooni jaoks
reaktsioonid. Neid aktiivsusühikuid kasutatakse meditsiini- ja farmaatsiapraktikas ensüümi aktiivsuse hindamiseks:
Et hinnata ensüümi molekulide arvu antud koe teiste valkude hulgas, määrake ensüümi spetsiifiline aktiivsus (Sp.A.), mis on arvuliselt võrdne konverteeritud substraadi kogusega (µmol) ühe milligrammi (mg) ajaühiku kohta. valk (koest eraldatud ensüüm):
Ensüümi puhastusastet hinnatakse spetsiifilise aktiivsuse järgi: mida vähem võõrvalke, seda suurem on spetsiifiline aktiivsus.
2. Ensümaatiliste reaktsioonide kineetikat uuritakse ensümaatilise reaktsiooni jaoks optimaalsetes tingimustes. Optimaalsed tingimused on iga ensüümi jaoks individuaalsed ja need määratakse peamiselt reaktsiooni toimumise temperatuuri ja lahuse pH väärtuse järgi.
Temperatuuri tõus teatud piirideni mõjutab see ensümaatilise reaktsiooni kiirust samamoodi nagu temperatuur mis tahes keemilist reaktsiooni: temperatuuri tõustes ensümaatilise reaktsiooni kiirus suureneb. Ensümaatilise keemilise reaktsiooni kiirusel on aga oma temperatuurioptimum, mille ülemääraga kaasneb ensümaatilise aktiivsuse vähenemine, mis on seotud valgu molekuli termilise denaturatsiooniga (joonis 2.15). Enamiku inimese ensüümide jaoks on optimaalne temperatuur 37–38 °C.
 Riis. 2.15. Ensümaatilise reaktsiooni kiiruse (V) sõltuvus temperatuurist
Riis. 2.15. Ensümaatilise reaktsiooni kiiruse (V) sõltuvus temperatuurist
Ensüümi aktiivsus sõltub pH-st lahus, milles toimub ensümaatiline reaktsioon. PH mõju ensüümi aktiivsusele on tingitud muutustest antud valgu ja substraadi aminohappejääkide funktsionaalrühmade ionisatsioonis, mis tagavad ensüümi-substraadi kompleksi optimaalse moodustumise. Igal ensüümil on pH väärtus, mille juures täheldatakse selle maksimaalset aktiivsust (joonis 2.16).
 Riis. 2.16. Ensümaatilise reaktsiooni kiiruse (V) sõltuvus söötme pH-st
Riis. 2.16. Ensümaatilise reaktsiooni kiiruse (V) sõltuvus söötme pH-st
3. Ensümaatilise reaktsiooni kineetilised omadused sõltuvad reagentide kontsentratsioonist. Kui ensüümi kontsentratsioon jätta konstantseks, muutes ainult substraadi kogust, siis kirjeldatakse ensümaatilise reaktsiooni kiiruse graafikut hüperbooliga (joonis 2.17). Substraadi koguse suurenedes suureneb algreaktsiooni kiirus. Kui ensüüm substraadiga täielikult küllastub, st. ensüümi-substraadi komplekside maksimaalne võimalik moodustumine toimub antud ensüümi kontsentratsiooni juures ja täheldatakse suurimat produkti moodustumise kiirust. Substraadi kontsentratsiooni edasine suurendamine ei too kaasa moodustunud produkti koguse suurenemist, s.t. reaktsioonikiirus ei suurene. See olek vastab maksimaalsele reaktsioonikiirusele Vmax
V max väärtus iseloomustab ensüümi katalüütilist aktiivsust ja määrab toote moodustumise maksimaalse võimaluse antud ensüümi kontsentratsiooni juures ja substraadi liia tingimustes; V max on antud ensüümi kontsentratsiooni konstantne väärtus.
 Riis. 2.17. Reaktsioonikiiruse (V) sõltuvus substraadi kontsentratsioonist S:
Riis. 2.17. Reaktsioonikiiruse (V) sõltuvus substraadi kontsentratsioonist S:
V max on maksimaalne reaktsioonikiirus antud ensüümi kontsentratsiooni juures optimaalsetes reaktsioonitingimustes; K m - Michaelise konstant
4. Ensüümide efektiivsuse peamine kineetiline omadus on Michaelise konstant - K m. Michaelise konstant on arvuliselt võrdne substraadi kontsentratsiooniga, mille juures saavutatakse pool maksimaalsest kiirusest. K m iseloomustab antud ensüümi afiinsust antud substraadi suhtes ja on konstantne väärtus. Mida madalam Km, seda suurem on ensüümi afiinsus antud substraadi suhtes, seda suurem on algreaktsiooni kiirus ja vastupidi, mida suurem on Km, seda väiksem on ensüümi afiinsus substraadi suhtes ja seda väiksem on algreaktsiooni kiirus.
1. Kopeerige tabel oma märkmikusse. 2.2. Kasutage tabeli täitmiseks õpikut ja lisakirjandust. Tehke järeldus mitmekülgse toitumise vajadusest inimeste tervise jaoks.
2. Kopeerige tabel oma märkmikusse. 2.3 ja täitke see. Kasutades õpikut, kirjutage üles üks reaktsioon, mis hõlmab iga koensüümi.
3. Teisaldage ensüümi aktiivsuse graafik oma sülearvutisse (joonis 2.18). Määratlege ja näidake nende reaktsioonide V max. Täpsustage K esimeses ja teises
juhtum. Mis on konstandi K biokeemiline tähendus?
Tabel 2.2. Peamiste veeslahustuvate vitamiinide, mis on koensüümide eelkäijad, omadused
 Tabel 2.3. Põhilised koensüümid
Tabel 2.3. Põhilised koensüümid

 Riis. 2.18. Ensümaatiliste reaktsioonide kiiruse sõltuvus substraadi kontsentratsioonist
Riis. 2.18. Ensümaatiliste reaktsioonide kiiruse sõltuvus substraadi kontsentratsioonist
ENESEKOHTAMISÜLESANDED
1. Vali õiged vastused. Ensüümid:
A. Kas valgud
B. Vähendage ensümaatiliste reaktsioonide kiirust
B. Neil on spetsiifiline toime D. Nad on lihtsad valgud E. Nad on võimelised reguleerima
2. Vali õiged vastused. Michaelise konstant (km):
A. on ensüümi substraadi spetsiifilisuse tunnus B. Arvuliselt võrdne substraadi kontsentratsiooniga, mille juures täheldatakse poole Vmax-st
B. Iseloomustab ensüümi afiinsust substraadi suhtes
D. Iseloomustab ensüümi aktiivse tsentri küllastumist substraadiga D. On ensüümi kineetiline omadus
3. Vali õiged vastused. Koensüüm PF toimib järgmiste klasside ensüümidega:
A. Oksidoreduktaas B. Transferaas
B. Hüdrolaas G. Liaz D. Isomeraasid
4. Matš. Reaktsiooni tüüp, milles osaleb koensüüm:
A. Karboksüülimine B. Oksüdatsioon-redutseerimine
B. Transamineerimine D. Atsüülimine E. Atsetüülimine
Koensüüm:
2. Püridoksaalfosfaat
5. Matš. Ensüüm katalüüsib:
A. Ainult pöördumatud reaktsioonid
B. Sama tüüpi reaktsioonid väikese arvu (rühma) struktuurilt sarnaste substraatidega
B. Ainult ühe substraadi olemasoleva stereoisomeeri muundamine
D. Reaktsioonid koensüümide juuresolekul E. Ainult ühe substraadi muundamine Substraadi spetsiifilisus:
1. Absoluutne
2. Rühm
3. Stereospetsiifilisus
6. Täitke "ahela" ülesanne:
A) redoksreaktsioone katalüüsivad selle klassi ensüümid
A. Transferaasid
B. Oksidoreduktaasid
b) selle klassi alamklassi kuuluvad ensüümid viivad läbi reaktsioone
vesinikuaatomite eemaldamine substraadist:
A. Oksidaasid
B. Hüdroksülaasid
B. Dehüdrogenaasid
V) Nende ensüümide koensüüm on:
B. Koensüüm A
G) koensüüm põhineb vitamiinidel:
A. Nikotiinhape B. Biotiin
B. Vitamiin B 2
e) Selle vitamiini puudus põhjustab järgmisi haigusi:
B. Pellagra
B. Makrotsüütiline aneemia
7. Matš. Ensüümiklass:
A. Oksidoreduktaas B. Hüdrolaas
B. Ligaza G. Liase
D. Transferaas
Ensüüm:
1. Suktsinaatdehüdrogenaas
2. Püruvaatkarboksülaas.
3. DNAaas.
8. Täiendage lauseid puuduvate sõnadega:
tegevust. Koensüümi, mis on tugevate kovalentsete sidemetega seotud apoensüümiga, nimetatakse ..................
4. 1-A; 2-B; 3-B
5. 1-D; 2-B; 3-B
6. a) B; b) B; c) B; d) A; e) B
7. 1-A; 2-B; 3-B
8. Holoensüüm, apoensüüm, koensüüm, proteeside rühm
PÕHIMÕISTED JA MÕISTED
1. Ensümoloogia
2. Ensüümkatalüüs
3. Ensüüm-substraadi kompleks
4. Ensümaatilise katalüüsi kineetika
5. Substraat
6. Ensüümi aktiivne sait
7. Maksimaalne reaktsioonikiirus - V max
8. Michaelise konstant - K m
9. Ensüümi aktiivsuse ühikud
10. Ensüümiklassid
11. Ensüümi spetsiifilisus
12. Ensüümi kofaktorid
13. Ensüümi spetsiifiline aktiivsus
14. Apoensüüm
15. Holoensüüm
Probleeme lahendama
1. Praegu kasutatakse biokeemialaborites inimese bioloogilistes vedelikes ensüümide aktiivsuse määramiseks automaatseid biokeemilisi analüsaatoreid. Aidake laboritehnikul mõista reaktiive, mida kasutatakse laktaatdehüdrogenaasi (LDH) aktiivsuse määramiseks ja LDH aktiivsuse arvutamiseks kahel patsiendil. Selle jaoks:
a) kirjutage LDH poolt katalüüsitud reaktsioon;
b) näidata substraat, koensüüm, prekursor-vitamiin, ensüümi allikas;
c) loetleda reaktsioonitingimused (temperatuur, aeg);
d) selgitab, millise parameetri järgi saab hinnata ensümaatilise reaktsiooni kiirust;
f) arvutab LDH aktiivsuse patsientide veres ühikutes RÜ/l. Tehke järeldus: milline patsient on aktiivsem?
Tabel 2.4. Andmed LDH aktiivsuse määramiseks
2. Inimene on homöotermiline (temperatuur hoitakse konstantsel tasemel) elusorganismid. Meditsiinis kasutatakse mõnel juhul raviks äärmuslikke temperatuure. Eelkõige kasutatakse hüpotermilisi tingimusi pikaajaliste operatsioonide puhul, eriti ajus ja südames) hüpertermilisi seisundeid kasutatakse kudede koagulatsiooni eesmärgil. Selgitage nende lähenemisviiside paikapidavust ensümoloogi vaatenurgast. Vastama:
a) näidata, milline temperatuur on enamiku inimese ensüümide jaoks optimaalne;
b) koostada graafik ensümaatiliste reaktsioonide kiiruse sõltuvusest temperatuurist;
c) selgitab pikaajaliste kirurgiliste sekkumiste vajadust hüpotermilistes tingimustes;
d) kirjeldada, millel põhineb kudede termilise koagulatsiooni meetod;
e) näidata kriitilise temperatuuriga kokkupuute tagajärgi inimestele.
3. 35-aastane patsient tuli kliinikusse suu limaskesta põletikuliste protsesside, lihaste väsimuse ja konjunktiviidi kaebustega. Patsient sõi pikka aega monotoonset dieeti, jättes oma dieedist välja sellised toiduained nagu maks, rukis, piim ja pärm. Arst diagnoosis hüpovitaminoosi B2. Selgitage täheldatud sümptomite põhjuseid. Selle jaoks:
a) nimeta B2-vitamiinist moodustunud koensüümid;
b) näidata, millistes reaktsioonides need koensüümid osalevad;
c) kirjutada koensüümide oksüdeeritud ja redutseeritud vormide valemi tööosad;
d) tooge näiteid nende koensüümidega seotud reaktsioonidest (kasutage õpiku materjale).
4. Ensüüm happeline fosfataas hüdrolüüsib fosforhappe estreid. See ensüüm moodustub maksa, põrna ja eesnäärme rakkudes; seda sisaldavad punased verelibled, trombotsüüdid, makrofaagid ja osteoklastid. See ensüüm sisaldub ka spermatosoidide akrosoomis ja viljastamise käigus lagundab munaraku plasmalemma fosfolipiide. Happelise fosfataasi suurim ensümaatiline aktiivsus ilmneb happelise pH väärtustel (4,7-6,0). Joonistage graafik reaktsiooni kiiruse ja pH suhtes ja selgitage, miks happelise fosfataasi aktiivsus muutub koos pH muutustega. Esitage reaktsiooni diagramm. Määrake ensüümiklass ja selle spetsiifilisus.
5. Dipeptiidi muundamise reaktsioonikiirust uurides peensoole peptidaasi toimel saadi järgmised tulemused: maksimaalne ensüümi aktiivsus on 40 µmol/min/mg, Km 0,01. Millise substraadi kontsentratsiooni korral on reaktsiooni kiirus 10 µmol/min/mg? Ülesande andmete kasutamine:
a) koostada reaktsiooniskeem, määrata ensüümi klass ja side, mida see substraadis hävitab;
b) joonistage reaktsioonikiiruse graafik sõltuvalt substraadi kontsentratsioonist ja vastake ülesande küsimusele;
c) annab Ksh definitsiooni, näitab seost Ksh väärtuse ja ensüümi afiinsuse vahel substraadi suhtes.
6. Õpilane määras kanamunavalgest eraldatud ensüümi lüsosüümi spetsiifilise aktiivsuse. Lüsosüüm hüdrolüüsib bakteriraku seina glükoproteiine. Õpilane inkubeeris reaktsioonisegu, mis sisaldas substraati, ensüümi ja puhvrit, mis andis optimaalse pH väärtuse 5,2 ning leidis, et 1 mg lüsosüümi mõjul tekkis 15 minutiga vaid 12 µmol toodet. Olles arvutuse teinud ja põhjuse välja selgitanud
ensüümi madal eriaktiivsus, mäletas ta, et ta ei lülitanud termostaati sisse ja seetõttu inkubeeris proove toatemperatuuril ning ensüümi t oli 37°C. Optimaalsetes tingimustes katset korrates avastas ta, et 15 minutiga moodustus 1 mg lüsosüümi toimel 45 µmol produkti. Arvutage ensüümi eriaktiivsus mõlemal juhul ja selgitage temperatuuri mõju mehhanismi ensümaatilise reaktsiooni kiirusele.
7. Paljude ensüümide aktiivsust rakus reguleerivad teised ensüümid – proteiinkinaas ja fosfoproteiinfosfataas. Märkige nende reaktsioonide tunnused; kirjutage nende ensüümide poolt katalüüsitud reaktsioonid, näidake, millisesse ensüümide klassi need kuuluvad. Pange tähele substraadi spetsiifilisust.
Moodulüksus 2 ENSÜÜMIDE TEGEVUSE REGULEERIMINE. ENSÜMOLOOGIA MEDITSIINILISED ASPEKTID
Õppeeesmärgid Oskama:
1. Tõlgendada pärssivate ravimite – ravimite, mürkide – mõju tulemusi organismi ensümaatilistele reaktsioonidele.
2. Selgitage ensüümi aktiivsuse reguleerimise tähtsust ainevahetusraja kiiruse mõjutamisel.
3. Selgitage ensüümide ravimitena kasutamise põhitõdesid.
4. Rakendada teadmisi ensüümide omadustest ja elundite ensüümkoostisest normaalsetes tingimustes ja erinevate ainevahetushäirete korral.
5. Tõlgendage ensüümi aktiivsuse määramise tulemusi haiguste diagnoosimisel.
Tea:
1. Ensüümi inhibiitorite klassifikatsioon nende toimemehhanismi järgi.
2. Näited ravimitest – ensüümi inhibiitorid.
3. Põhilised mehhanismid ensüümide aktiivsuse reguleerimiseks organismis.
4. Ainevahetuse radade reguleerimise põhimõtted ja ensüümide roll ainevahetuse reguleerimisel.
5. Ensüümide kasutamise alused haiguste diagnoosimisel ja ravimisel.
TEEMA 2.7. ENSÜÜMI AKTIIVSUSE INHIBIITORID
1. Termini all "inhibeerimine ensüümi aktiivsus" viitab teatud kemikaalide põhjustatud katalüütilise aktiivsuse spetsiifilisele vähenemisele. inhibiitorid.
Inhibiitorid pakuvad suurt huvi ensümaatilise katalüüsi mehhanismide selgitamiseks ja üksikute ensümaatiliste reaktsioonide rolli kindlakstegemiseks keha metaboolsetes radades. Paljude ravimite ja mürkide toime põhineb ensümaatilise aktiivsuse pärssimise põhimõttel.
2. Inhibiitorid on võimelised seonduma erineva tugevusega ensüümidega. Selle põhjal eristavad nad pööratav Ja pöördumatu pärssimine. Pöörduvad inhibiitorid seostuvad ensüümiga nõrkade mittekovalentsete sidemetega ja on teatud tingimustel ensüümist kergesti eraldatavad:
E+I↔ EI.
Pöördumatu pärssimine mida täheldatakse kovalentsete stabiilsete sidemete moodustumisel inhibiitormolekuli ja ensüümi vahel:
E+I→ E-I.
3. Toimemehhanismi järgi jagunevad pöörduvad inhibiitorid konkurentsivõimeline Ja mittekonkurentsivõimeline.
Konkurentsivõimeline inhibeerimine põhjustab ensümaatilise reaktsiooni kiiruse pöörduvat langust, mis tuleneb inhibiitori seondumisest ensüümi aktiivse saidiga, mis takistab ensüümi-substraadi kompleksi moodustumist. Seda tüüpi inhibeerimine toimub siis, kui inhibiitor on substraadi struktuurne analoog; selle tulemusena tekib substraadi ja inhibiitormolekulide vahel konkurents ensüümi aktiivse saidiga seondumise pärast. Sel juhul interakteerub substraat või inhibiitor ensüümiga, moodustades ensüümi-substraadi (ES) või ensüümi-inhibiitori (EI) kompleksid. Ensüümi ja inhibiitori (EI) kompleksi moodustumisel reaktsiooniprodukti ei moodustu (joonis 2.19).
 Riis. 2.19. Ensüümide aktiivsuse konkureeriva inhibeerimise skeem
Riis. 2.19. Ensüümide aktiivsuse konkureeriva inhibeerimise skeem
Konkureeriva inhibeerimise puhul kehtivad järgmised võrrandid:
E+S↔ES →E+P; E+I↔ E.I.
Konkurentsi inhibeerimise eripäraks on selle nõrgenemise võimalus substraadi kontsentratsiooni suurenemisega, kuna pöörduv inhibiitor ei muuda ensüümi struktuuri. Seetõttu ei erine reaktsioonikiirus suurte substraadikontsentratsioonide korral inhibiitori puudumisel toimuvast; konkureeriv inhibiitor ei muuda Vmax-i, vaid suurendab Km.
Konkurentsi inhibeerimise klassikaline näide on suktsinaatdehüdrogenaasi reaktsiooni pärssimine maloonhappega (joonis 2.20). Malonaat on suktsinaadi struktuurne analoog (kahe karboksüülrühma olemasolu) ja võib interakteeruda ka suktsinaatdehüdrogenaasi aktiivse saidiga. Siiski ei ole kahe vesinikuaatomi ülekandmine maloonhappest proteesrühma FAD võimalik ja seetõttu väheneb reaktsioonikiirus.
 Riis. 2.20. Näide suktsinaatdehüdrogenaasi konkureerivast pärssimisest maloonhappega:
Riis. 2.20. Näide suktsinaatdehüdrogenaasi konkureerivast pärssimisest maloonhappega:
A - suktsinaat seondub ioonsidemete kaudu ensüümi suktsinaatdehüdrogenaasi aktiivse saidiga; B - ensümaatilise reaktsiooni käigus lõhustatakse suktsinaadist kaks vesinikuaatomit, lisades need FAD koensüümile. Selle tulemusena moodustub fumaraat, mis eemaldatakse suktsinaatdehüdrogenaasi aktiivsest saidist; B - malonaat on suktsinaadi struktuurne analoog; see seondub ka suktsinaatdehüdrogenaasi aktiivse saidiga, kuid keemilist reaktsiooni ei toimu
4. Paljud ravimid avaldavad oma ravitoimet konkureeriva inhibeerimise mehhanismi kaudu. Näiteks katalüüsib atsetüülkoliini hüdrolüüsi reaktsiooni koliiniks ja äädikhappeks ensüüm atsetüülkoliinesteraas (AChE) (joonis 2.21) ja seda saab inhibeerida selle ensüümi konkureerivate inhibiitorite (nt. proseriin, endrofoonium jne) (joonis 2.22). Selliste inhibiitorite lisamisel atsetüülkoliinesteraasi aktiivsus väheneb, atsetüülkoliini (substraadi) kontsentratsioon suureneb, millega kaasneb närviimpulsside juhtivuse suurenemine. Konkureerivaid atsetüülkoliinesteraasi inhibiitoreid kasutatakse lihasdüstroofiate ravis, samuti vigastuste, halvatuse ja poliomüeliidi järgsete liikumishäirete ravis.
Riis. 2.21. Atsetüülkoliini hüdrolüüsi reaktsioon AChE mõjul
 Riis. 2.22. Konkureerivate inhibiitorite seondumine AChE aktiivses kohas
Riis. 2.22. Konkureerivate inhibiitorite seondumine AChE aktiivses kohas
A - substraadi (atsetüülkoliini) lisamine ensüümi aktiivsesse keskusesse.
Nool näitab atsetüülkoliini hüdrolüüsi kohta; B - konkureeriva inhibiitori proseriini lisamine ensüümi aktiivsesse keskusesse. Reaktsiooni pole; B - konkureeriva inhibiitori endrofooniumi kinnitumine ensüümi aktiivsesse keskusesse. Inhibiitorite kinnitumine AChE aktiivse saidi külge takistab atsetüülkoliini seondumist
Veel üks näide ravimitest, mille toimemehhanism põhineb ensüümi konkureerival inhibeerimisel, on proteolüütilise ensüümi trüpsiini peptiid-inhibiitorite kasutamine kõhunäärmehaiguste (äge pankreatiit, nekroos) korral, näiteks aprotiniin, trasülool, kontrikaal. Need ravimid pärsivad trüpsiini, mis vabaneb ümbritsevatesse kudedesse ja verre, ning hoiavad seeläbi ära soovimatud autolüütilised sündmused kõhunäärmehaiguste korral.
5. Mõnel juhul võib kasutada konkureerivaid inhibiitoreid, mis interakteeruvad ensüümi aktiivse keskusega pseudosubstraadid(antimetaboliidid), mis viib vale struktuuriga toote sünteesini. Saadud ainetel puudub "soovitud" struktuur ja seetõttu puudub neil funktsionaalne aktiivsus. Nende ravimite hulka kuuluvad sulfoonamiidravimid.
6. Mittekonkureeriv Pöörduv on ensümaatilise reaktsiooni inhibeerimine, mille käigus inhibiitor interakteerub ensüümiga muus kohas kui aktiivne sait. Mittekonkureerivad inhibiitorid ei ole substraadi struktuursed analoogid; mittekonkureeriva inhibiitori lisamine ensüümile muudab aktiivse tsentri konformatsiooni ja vähendab ensümaatilise reaktsiooni kiirust, s.t. vähendab ensümaatilist aktiivsust. Mittekonkureeriva inhibiitori näide võib olla raskmetalliioonide toime, mis interakteeruvad ensüümmolekuli funktsionaalrühmadega, häirides katalüüsi.
7. Pöördumatud inhibiitorid vähendada ensümaatilist aktiivsust ensüümi molekuliga kovalentsete sidemete moodustumise tulemusena. Kõige sagedamini muutub ensüümi aktiivne keskus. Selle tulemusena ei saa ensüüm täita oma katalüütilist funktsiooni.
Ensüümide toimemehhanismi selgitamiseks pakub suuremat huvi pöördumatute inhibiitorite kasutamine. Olulist teavet ensüümi aktiivse tsentri struktuuri kohta annavad ühendid, mis blokeerivad teatud aktiivtsentri rühmi. Selliseid inhibiitoreid nimetatakse spetsiifiline. Spetsiifilised inhibiitorid hõlmavad diisopropüülfluorofosfaat (DFP). DPP moodustab kovalentse sideme seriini OH-rühmaga, mis asub ensüümi aktiivses keskuses ja osaleb otseselt katalüüsis, mistõttu DPP klassifitseeritakse spetsiifiliseks pöördumatuks seriini ensüümide inhibiitoriks (joonis 2.23). DPP-d kasutatakse ensüümide aktiivse saidi struktuuri uurimiseks ensümoloogias.
Erinevalt spetsiifilistest inhibiitoritest mittespetsiifilised inhibiitorid moodustavad kovalentseid sidemeid teatud ensüümrühmadega, mis paiknevad mitte ainult aktiivses keskuses, vaid ka ensüümi molekuli mis tahes osas. Näiteks joodatsetaat (joonis 2.24) interakteerub valgu mis tahes SH rühmaga. See interaktsioon muudab ensüümi molekuli konformatsiooni ja vastavalt ka aktiivse keskuse konformatsiooni ning vähendab katalüütilist aktiivsust.
 Riis. 2.23. Kümotrüpsiini aktiivsuse spetsiifiline inhibeerimine DPP abil
Riis. 2.23. Kümotrüpsiini aktiivsuse spetsiifiline inhibeerimine DPP abil
 Riis. 2.24. Ensüümide aktiivsuse mittespetsiifiline pärssimine joodatsetaadiga.
Riis. 2.24. Ensüümide aktiivsuse mittespetsiifiline pärssimine joodatsetaadiga.
Mittespetsiifiline inhibeerimine toimub tsüsteiini SH rühmade kovalentse modifitseerimise tõttu joodatsetaadi molekulide poolt
8. Näiteks ravimist, mille toime on seotud ensüümi pöördumatu inhibeerimisega, on laialdaselt kasutatav aspiriin. Selle põletikuvastase mittesteroidse ravimi toime põhineb ensüümi tsüklooksügenaasi inhibeerimisel, mis katalüüsib arahhidoonhappest prostaglandiinide moodustumist. Selle tulemusena lisatakse aspiriini atsetüüljääk tsüklooksügenaasi ühe alaühiku seriini vabale terminaalsele OH-rühmale (joonis 2.25). See blokeerib prostaglandiinide moodustumist (vt moodul 8), millel on lai valik bioloogilisi funktsioone, sealhulgas põletiku vahendajad. Seetõttu on aspiriin klassifitseeritud põletikuvastaseks ravimiks. Inhibeeritud ensüümi molekulid hävivad, prostaglandiinide süntees taastub alles pärast uute ensüümi molekulide sünteesi.
 Riis. 2.25. Tsüklooksügenaasi inaktiveerimise mehhanism, kasutades pöördumatut inhibiitorit - aspiriini
Riis. 2.25. Tsüklooksügenaasi inaktiveerimise mehhanism, kasutades pöördumatut inhibiitorit - aspiriini
TEEMA 2.8. ENSÜÜMI TEGEVUSE REGULEERIMINE
1. Kõik rakus toimuvad keemilised reaktsioonid toimuvad ensüümide osalusel. Seetõttu piisab metaboolse raja (ühe aine järjestikuse teisenemise teiseks) kiiruse mõjutamiseks ensüümi molekulide arvu või nende aktiivsuse reguleerimisest. Tavaliselt on metaboolsetes radades võtmeensüümid mille tõttu reguleeritakse kogu tee kiirust. Neid ensüüme (üks või mitu metaboolses rajas) nimetatakse reguleerivad ensüümid. Ensümaatiliste reaktsioonide kiiruse reguleerimine toimub kolmel sõltumatul tasandil: muutes ensüümi molekulide arvu, substraadi ja koensüümi molekulide kättesaadavust ning muutes ensüümi molekuli katalüütilist aktiivsust (tabel 2.6).
Tabel 2.5. Ensümaatiliste reaktsioonide kiiruse reguleerimise meetodid
Reguleerimise meetod | Iseloomulik |
Ensüümide molekulide arvu muutus | Ensüümmolekulide arv rakus määratakse kahe protsessi suhtega: süntees ja lagunemine. Enim uuritud ensüümide sünteesi reguleerimise mehhanism on transkriptsiooni (mRNA süntees) tasemel, mida reguleerivad teatud metaboliidid, hormoonid ja mitmed bioloogiliselt aktiivsed molekulid. |
Substraadi ja koensüümi molekulide kättesaadavus | Oluline parameeter, mis kontrollib ensümaatilise reaktsiooni kulgu, on substraadi ja koensüümi olemasolu. Mida suurem on lähtesubstraadi kontsentratsioon, seda suurem on reaktsioonikiirus |
Ensüümi molekuli katalüütilise aktiivsuse muutus | Ensüümide aktiivsuse reguleerimise peamised viisid on järgmised: Allosteeriline regulatsioon; Reguleerimine valgu-valgu interaktsioonide kaudu; Reguleerimine ensüümi molekuli fosforüülimise-defosforüülimise teel; Reguleerimine osalise (piiratud) proteolüüsi teel |
Vaatleme võimalusi ensümaatiliste reaktsioonide kiiruse reguleerimiseks, muutes ensüümi molekuli katalüütilist aktiivsust.
2. Allosteeriline regulatsioon. Allosteerilised ensüümid helistas ensüümid, aktiivsus mis saab reguleerida kasutades efektorained. Allosteerilise regulatsiooniga seotud efektorid on rakulised metaboliidid, mis osalevad sageli selles, mida nad reguleerivad.
Efektor, mis põhjustab vähendamine (inhibeerimine) ensüümi aktiivsust nimetatakse inhibiitor. Efektor, mis põhjustab suurendamine (aktiveerimine) ensüümi aktiivsust nimetatakse aktivaator.
Allosteerilistel ensüümidel on teatud struktuurilised omadused:
Tavaliselt on oligomeersed valgud, koosneb mitmest protomeerist;
On allosteeriline keskus, katalüütilisest aktiivsest saidist ruumiliselt kaugel;
Efektorid kinnituvad ensüümile mittekovalentselt allosteerilistes (regulatiivsetes) keskustes.
Allosteerilised keskused, nagu katalüütilised keskused, võivad omada ligandide suhtes erinevat spetsiifilisust: see võib olla absoluutne või rühm. Mõnel ensüümil on mitu allosteerilist tsentrit, millest mõned on spetsiifilised aktivaatoritele, teised inhibiitoritele.
Kutsutakse protomeeri, millel allosteeriline keskus asub regulatiivne protomeer Erinevalt katalüütiline protomeer, mis sisaldab aktiivset keskust, milles toimub keemiline reaktsioon.
Allosteerilistel ensüümidel on omadus koostöövalmidus: allosteerilise efektori interaktsioon allosteerilise tsentriga põhjustab kooperatiivse muutuse kõigi alaühikute konformatsioonis, mis viib aktiivse tsentri konformatsiooni muutumiseni ja ensüümi afiinsuse muutumiseni substraadi suhtes, mis vähendab või suurendab ensüümi katalüütiline aktiivsus. Kui allosteerilisele tsentrile on kinnitatud inhibiitor, siis kooperatiivsete konformatsiooniliste muutuste tulemusena toimub aktiivse tsentri konformatsiooni muutus, mis põhjustab ensüümi afiinsuse vähenemist substraadi suhtes ja vastavalt ensümaatilise reaktsiooni kiirus. Ja vastupidi, kui allosteerilise tsentri külge on kinnitatud aktivaator, suureneb ensüümi afiinsus substraadi suhtes, mis põhjustab reaktsioonikiiruse suurenemist. Sündmuste jada allosteeriliste efektorite toimel on esitatud joonisel fig. 2.26.
Allosteeriliste ensüümide reguleerimine pööratav: efektori eraldumine reguleerivast allüksusest taastab ensüümi esialgse katalüütilise aktiivsuse.
Allosteerilised ensüümid katalüüsida peamisi reaktsioone sellest metaboolsest rajast.
Allosteerilised ensüümid mängivad olulist rolli erinevates metaboolsetes radades, kuna reageerivad ülikiiresti vähimatele muutustele raku sisemises koostises. Ainevahetusprotsesside kiirus sõltub nii kasutatavate kui ka antud reaktsiooniahelas tekkivate ainete kontsentratsioonist. Prekursorid võivad olla allosteeriliste ensüümide aktivaatorid metaboolsetes radades. Samal ajal, kui mis tahes ainevahetusraja lõpp-produkt koguneb, võib see toimida ensüümi allosteerilise inhibiitorina. See reguleerimismeetod on kehas tavaline ja seda nimetatakse "negatiivseks tagasisideks":
 Riis. 2.26. Allosteerilise ensüümi struktuuri ja toimimise skeem:
Riis. 2.26. Allosteerilise ensüümi struktuuri ja toimimise skeem:
A - negatiivse efektori (inhibiitori) toime. Inhibiitor (I) kinnitub allosteerilise tsentri külge, mis põhjustab kooperatiivseid konformatsioonilisi muutusi ensüümi molekulis, sealhulgas ensüümi aktiivses keskuses. Ensüümi afiinsus substraadi suhtes väheneb ja selle tulemusena väheneb ensümaatilise reaktsiooni kiirus; B - positiivse efektori (aktivaatori) toime. Aktivaator (A) seondub allosteerilise keskusega, mis põhjustab kooperatiivseid konformatsioonilisi muutusi. Ensüümi afiinsus substraadi suhtes suureneb ja ensümaatilise reaktsiooni kiirus suureneb. On tõestatud nii inhibiitori kui ka aktivaatori pöörduv toime ensüümi aktiivsusele
Vaatleme glükoosi katabolismi protsessi allosteerilist regulatsiooni, mis lõpeb ATP molekuli moodustumisega (joonis 2.27). Juhul, kui rakus olevaid ATP molekule ei tarbita, on see selle metaboolse raja allosteeriliste ensüümide inhibiitor: fosfofruktokinaasi ja püruvaatkinaasi. Samal ajal on glükoosi katabolismi vahemetaboliit fruktoos-1,6-bisfosfaat püruvaatkinaasi ensüümi allosteeriline aktivaator. Inhibeerimine metaboolse raja lõpp-produkti poolt ja aktiveerimine algsete metaboliitide poolt võimaldab
 Riis. 2.27. Glükoosi katabolismi protsessi allosteeriline reguleerimine.
Riis. 2.27. Glükoosi katabolismi protsessi allosteeriline reguleerimine.
ATP molekul on metaboolsete radade ensüümide - fosfofruktokinaasi ja püruvaatkinaasi - allosteeriline inhibiitor. Fruktoos-1,6-bisfosfaadi molekul on ensüümi püruvaatkinaasi allosteeriline aktivaator
reguleerida ainevahetuse kiirust. Allosteerilised ensüümid katalüüsivad reeglina ainevahetusraja algreaktsioone, pöördumatuid reaktsioone, kiirust piiravaid reaktsioone (kõige aeglasemaid) või reaktsioone metaboolse raja hargnemispunktis.
3. Reguleerimine valk-valk interaktsioonide kaudu. Mõned ensüümid muudavad oma aktiivsust valkude ja valkude koostoime tulemusena. Sel viisil ensüümi aktiivsuse muutmiseks võib eristada vähemalt kahte mehhanismi: ensüümide aktiveerumine aktivaatorvalkude lisamise tulemusena (ensüümi adenülaattsüklaasi aktiveerimine G-valgu α-subühiku poolt, vt moodul 4) ja muutused. katalüütilises aktiivsuses protomeeride assotsieerumise ja dissotsiatsiooni tulemusena.
Näitena ensüümide katalüütilise aktiivsuse reguleerimisest protomeeride assotsieerumise või dissotsiatsiooni teel võime vaadelda ensüümi proteiinkinaasi A regulatsiooni.
Proteiini kinaas A(cAMP-sõltuv) koosneb neljast kahte tüüpi subühikust: kahest reguleerivast (R) ja kahest katalüütilisest (C). Sellel tetrameeril ei ole katalüütilist aktiivsust. Reguleerivatel alaühikutel on sidumissaidid tsüklilise 3,5"-AMP (cAMP) jaoks (kaks iga subühiku kohta). Nelja cAMP molekuli kinnitumine kahe regulatoorse alaühikuga viib regulatoorsete protomeeride konformatsiooni muutumiseni ja tetrameerse kompleksi dissotsiatsioonini; see vabastab kaks aktiivset katalüütilist subühikut (joonis 2.28). Aktiivne proteiinkinaas A katalüüsib fosforhappejäägi ülekannet ATP-st valkude aminohappejääkide spetsiifilistesse OH-rühmadesse (st põhjustab valkude fosforüülimist).
 Riis. 2.28. Proteiinkinaasi A (PKA) aktiivsuse reguleerimine valk-valgu interaktsioonide kaudu.
Riis. 2.28. Proteiinkinaasi A (PKA) aktiivsuse reguleerimine valk-valgu interaktsioonide kaudu.
PKA-d aktiveerivad neli cAMP molekuli, mis seonduvad kahe regulatoorse alaühikuga, mis viib regulatoorsete protomeeride konformatsiooni muutumiseni ja tetrameerse kompleksi dissotsiatsioonini. See vabastab kaks aktiivset katalüütilist subühikut, mis võivad põhjustada valgu fosforüülimist
cAMP molekulide lõhustamine regulatoorsetest subühikutest viib proteiinkinaasi A regulatoorsete ja katalüütiliste subühikute seostumiseni inaktiivse kompleksi moodustumisega.
4. Ensüümide katalüütilise aktiivsuse reguleerimine fosforüülimise-defosforüülimise teel. Bioloogilistes süsteemides leitakse sageli mehhanism ensüümide aktiivsuse reguleerimiseks, kasutades nende kovalentset modifikatsiooni. Kiire ja laialt levinud meetod ensüümide keemiliseks muutmiseks on nende fosforüülimine-defosforüülimine.
Ensüümi OH rühmad läbivad fosforüülimise, mida viivad läbi ensüümid proteiinkinaasid(fosforüülimine) ja fosfoproteiini fosfataasid(defosforüülimine). Fosforhappe jäägi lisamine toob kaasa muutuse aktiivse tsentri konformatsioonis ja selle katalüütilises aktiivsuses. Sel juhul võib tulemus olla kahekordne: mõned ensüümid aktiveeruvad fosforüülimise käigus, teised vastupidi, muutuvad vähem aktiivseks (joonis 2.29). Proteiinkinaaside ja fosfoproteiinfosfataaside aktiivsust reguleerivad hormoonid, mis võimaldab metaboolsete radade võtmeensüümide aktiivsust kiiresti varieeruda sõltuvalt keskkonnatingimustest.
 Riis. 2.29. Ensüümide aktiivsuse reguleerimise skeem fosforüülimise-defosforüülimise teel.
Riis. 2.29. Ensüümide aktiivsuse reguleerimise skeem fosforüülimise-defosforüülimise teel.
Ensüümide fosforüülimine toimub ensüümi proteiinkinaasi abil. Fosforhappejäägi doonoriks on ATP molekul. Ensüümi fosforüülimine muudab selle konformatsiooni ja aktiivse saidi konformatsiooni, mis muudab ensüümi afiinsust substraadi suhtes. Sel juhul mõned ensüümid aktiveeritakse fosforüülimise ajal, teised aga inhibeeritakse. Pöördprotsessi – defosforüülimise – põhjustavad ensüümid fosfoproteiinfosfataasid, mis lõhustavad ensüümist fosforhappejäägi ja viivad ensüümi tagasi algsesse olekusse.
5. Ensüümide katalüütilise aktiivsuse reguleerimine osalise (piiratud) proteolüüsi teel. Mõned ensüümid, mis toimivad väljaspool rakke (seedetraktis või vereplasmas), sünteesitakse inaktiivsete lähteainetena ja aktiveeritakse ainult ühe või mitme spetsiifilise peptiidsideme hüdrolüüsi tulemusena, mis viib molekuli osa elimineerimiseni. Valgu molekuli ülejäänud osas toimub konformatsiooniline ümberkorraldus ja moodustub ensüümi aktiivne kese (joon. 2.30). Osaline proteolüüs on näide reguleerimisest, kui ensüümi aktiivsust muudetakse
 Riis. 2.30. Pepsiini aktiveerimine osalise proteolüüsi teel.
Riis. 2.30. Pepsiini aktiveerimine osalise proteolüüsi teel.
Pepsinogeeni (inaktiivse molekuli) ühe või mitme peptiidsideme hüdrolüüsi tulemusena osa molekulist eraldub ja moodustub pepsiini ensüümi aktiivne kese
pöördumatu. Sellised ensüümid toimivad tavaliselt lühikest aega, mille määrab valgu molekuli eluiga. Osaline proteolüüs on seedetrakti proteolüütiliste ensüümide (pepsiin, trüpsiin, kümotrüpsiin, elastaas), peptiidhormoonide (insuliin), vere hüübimissüsteemi valkude ja paljude teiste valkude aktiveerimise aluseks.
TEEMA 2.9. ENSÜÜMIDE KASUTAMINE MEDITSIINIS
1. Ensüüme kasutatakse laialdaselt meditsiinipraktikas diagnostikana (ensümodiagnostika) ja terapeutiline (ensüümravi) rahalised vahendid. Ensüüme kasutatakse ka kui spetsiifilised reaktiivid
mitmete metaboliitide määramiseks. Näiteks ensüümi glükoosoksüdaasi kasutatakse glükoosi kvantitatiivseks määramiseks uriinis ja veres; ensüümi ureaasi kasutatakse uurea sisalduse hindamiseks bioloogilistes vedelikes; erinevate dehüdrogenaaside abil tuvastatakse sobivate substraatide olemasolu, näiteks püruvaat, laktaat, etüülalkohol jne.
2. Ensümodiagnostika seisneb haiguse (või sündroomi) diagnoosimises, mis põhineb ensüümide aktiivsuse määramisel inimese bioloogilistes vedelikes.
Ensüümidiagnostika põhimõtted põhinevad järgmistel põhimõtetel:
Tavaliselt sisaldab vereseerum ensüüme, mis täidavad spetsiifilisi funktsioone, näiteks neid, mis on seotud vere hüübimissüsteemiga. Rakuensüümid praktiliselt ei tungi tervetest rakkudest verre. Minimaalsetes kogustes võib veres tuvastada mõningaid rakuensüüme;
Kell kahju rakumembraanid (põletik, nekroos) veres või teistes bioloogilistes vedelikes (näiteks uriinis), suureneb kahjustatud rakkude intratsellulaarsete ensüümide arv, mille aktiivsust saab registreerida spetsiaalsete biokeemiliste testidega;
Ensümaatilise diagnostika jaoks kasutatakse ensüüme, millel on teatud organites domineeriv või absoluutne lokalisatsioon. (elundi spetsiifilisus);
Vabanenud ensüümi kogus peaks olema proportsionaalne koekahjustuse astmega ja piisav selle aktiivsuse määramiseks;
Rakkude kahjustamisel tuvastatud ensüümide aktiivsus bioloogilistes vedelikes erineb normaalväärtustest ja on stabiilne üsna pikka aega (päevi);
Ainult tsütosoolse lokaliseerimisega ensüümide ilmumine vereplasmas viitab põletikulisele protsessile; kui tuvastatakse mitokondriaalsed või tuumaensüümid, võime rääkida sügavamast rakukahjustusest, näiteks nekroosist.
Nimetatakse ensüüme, mis katalüüsivad sama keemilist reaktsiooni, kuid millel on erinev primaarne valkude struktuur isosüümid. Need erinevad üksteisest kineetiliste parameetrite, aktiveerimistingimuste ning apoensüümi ja koensüümi vahelise seose omaduste poolest. Isoensüümide välimus on varieeruv, kuid enamasti tuleneb erinevusi neid isoensüüme või nende subühikuid kodeerivate geenide struktuuris. Isoensüümide määramise meetodid põhinevad füüsikalis-keemiliste omaduste erinevustel. Isoensüümid on sageli elundispetsiifiline, kuna iga kude sisaldab valdavalt ühte tüüpi isoensüüme. Järelikult, kui organ on kahjustatud, ilmub verre isoensüümi vastav vorm. Ensüümide teatud isoensüümvormide tuvastamine võimaldab neid kasutada haiguste diagnoosimisel.
Näiteks ensüüm laktaatdehüdrogenaas (LDH) katalüüsib laktaadi (piimhappe) pöörduvat oksüdatsioonireaktsiooni püruvaadiks (püruviinhape) (joon. 2.31). Laktaatdehüdrogenaas on oligomeerne valk, mille mol. kaaluga 134 000, mis koosneb neljast kahte tüüpi subühikust - M (inglise keelest lihas - lihas) ja H (inglise keelest süda - süda). Nende alaühikute kombinatsioon on laktaatdehüdrogenaasi viie isovormi moodustumise aluseks (joonis 2.32, A). LDH 1 ja LDH 2 on kõige aktiivsemad südamelihases ja neerudes, LDH 4 ja LDH 5 - skeletilihastes ja maksas. Teised koed sisaldavad selle ensüümi teisi variante. LDH isovormid erinevad üksteisest elektroforeetilise liikuvuse poolest, mis võimaldab tuvastada LDH isovormide kudede identsust (joon. 2.32, B). Südame-, maksa- ja lihashaiguste diagnoosimiseks on vaja elektroforeesi abil uurida LDH isovorme vereplasmas. Joonisel fig. 2.32, B näitab elektroferogramme
 Riis. 2.31. Laktaatdehüdrogenaasi (LDH) katalüüsitav reaktsioon
Riis. 2.31. Laktaatdehüdrogenaasi (LDH) katalüüsitav reaktsioon
 Riis. 2.32. Laktaatdehüdrogenaasi isovormid:
Riis. 2.32. Laktaatdehüdrogenaasi isovormid:
A - erinevate LDH isovormide struktuur; B - jaotused elektroferogrammil ja LDH isovormide suhtelised kogused erinevates organites; B - LDH isovormide sisaldus vereplasmas normaalsetes tingimustes ja patoloogias (elektroferogrammid - vasakul ja fotomeetriline skaneerimine - paremal)
terve inimese, müokardiinfarkti põdeva ja hepatiidiga patsiendi vereplasma. Diagnostilise testina kasutatakse laialdaselt koespetsiifiliste LDH isovormide tuvastamist vereplasmas.
Teine näide on kreatiinkinaas. Kreatiinkinaas (CK) mis katalüüsib kreatiinfosfaadi moodustumise reaktsiooni (joon. 2.33). KK molekul on dimeer, mis koosneb kahte tüüpi subühikutest M (inglise keelest lihas - lihas) ja B (inglise keelest aju - aju). Need subühikud moodustavad kolm isoensüümi: BB, MB, MM. BB isoensüümi leidub peamiselt ajus, MM-i skeletilihastes ja MV-d südamelihastes. KK isovormidel on erinev elektroforeetiline liikuvus (joon. 2.34). Müokardiinfarkti diagnoosimisel (esineb MB isovormi taseme tõus) on oluline CK aktiivsuse määramine vereplasmas. MM isovormi kogus võib suureneda trauma ja skeletilihaste kahjustuse korral. BB isovorm ei suuda tungida läbi hematoentsefaalbarjääri, mistõttu on see isegi insuldi ajal veres praktiliselt tuvastamatu ja sellel puudub diagnostiline väärtus.
 Riis. 2.33. Reaktsioon, mida katalüüsib ensüüm kreatiinkinaas (CK)
Riis. 2.33. Reaktsioon, mida katalüüsib ensüüm kreatiinkinaas (CK)
 Riis. 2.34. Erinevate kreatiinkinaasi isovormide struktuur ja elektroforeetiline liikuvus
Riis. 2.34. Erinevate kreatiinkinaasi isovormide struktuur ja elektroforeetiline liikuvus
Ensümodiagnostika kasutatakse erinevate organite haiguste diagnoosimiseks. Analüüside komplekt sõltub konkreetse biokeemialabori võimalustest ja seda täiendatakse pidevalt. Kõige tavalisemad ensüümide diagnostilised testid on:
Südamehaiguste (müokardiinfarkt) korral - laktaatdehüdrogenaas, kreatiinkinaas, aspartaataminotransferaas, alaniinaminotransferaas. Üks esimesi valke müokardiinfarkti korral veres ilmub valk - troponiin;
Maksahaiguste korral - alaniini aminotransferaas, aspartaataminotransferaas, atsetüülkoliinesteraas, gamma-glutamüültranspeptidaas. Kõhunäärmehaiguste korral - pankrease amülaas, lipaas;
Eesnäärmehaiguste korral - happeline fosfataas.
3. Ensüümide kasutamine ravimitena arenevad aktiivselt järgmistes suundades:
Asendusravi - ensüümide kasutamine nende defitsiidi korral;
Kompleksse ravi elemendid - ensüümide kasutamine kombinatsioonis muu raviga.
Ensüüm-asendusravi on efektiivne seedetrakti haiguste puhul, mis on seotud seedemahlade ebapiisava eritumisega. Näiteks kasutatakse pepsiini vähendatud sekretoorse funktsiooniga gastriidi korral. Pankrease ensüümide puudulikkust saab suures osas kompenseerida ka peamisi pankrease ensüüme (festaal, enzistaal, mesimforte jt) sisaldavate ravimite suukaudse manustamisega.
Täiendavate raviainetena kasutatakse ensüüme mitmete haiguste puhul. Proteolüütilisi ensüüme (trüpsiin, kümotrüpsiin) kasutatakse lokaalselt mädasete haavade raviks, et lõhustada surnud rakkude valke, eemaldada verehüübed või viskoossed saladused hingamisteede põletikuliste haiguste korral. Ensüümpreparaate ribonukleaasi ja desoksüribonukleaasi kasutatakse viirusevastaste ravimitena adenoviiruse konjunktiviidi, herpeetilise keratiidi ravis.
Ensüümipreparaate on laialdaselt kasutatud tromboosi ja trombemboolia korral trombi hävitamiseks. Sel eesmärgil kasutatakse fibrinolüsiini, streptolüaasi, streptodekaasi, urokinaasi preparaate.
Hüaluroonhappe lagunemist katalüüsivat ensüümi hüaluronidaasi (lidaasi) kasutatakse nahaaluselt ja intramuskulaarselt põletus- ja operatsioonijärgsete adhesioonide ja armide lahendamiseks.
Ensüümi asparaginaas (hävitab veres sisalduvat aminohapet Asn) kasutatakse vere onkoloogiliste haiguste korral, piirates aminohappe Asn sisenemist kasvajarakkudesse. Leukeemiarakud ei ole võimelised selle aminohappe iseseisvaks sünteesiks, seetõttu häirib selle sisalduse vähenemine veres nende rakkude kasvu.
TEEMA 2.10. ENSÜMOPAATIAD
Paljude haiguste aluseks on ensüümide talitluse rikkumine rakus – nn ensümopaatiad. On primaarsed (pärilikud) ja sekundaarsed (omandatud) ensümopaatiad. Omandatud ensümopaatiat, nagu üldiselt proteinopaatiat, täheldatakse kõigi haiguste puhul.
Primaarsete ensümopaatiate korral päranduvad defektsed ensüümid peamiselt retsessiivselt autosomaalselt. Sel juhul on defektset ensüümi sisaldav ainevahetusrada häiritud (joonis 2.35). Haiguse areng võib sel juhul toimuda ühe "stsenaariumi" järgi:
Lõpptoodete moodustumine on häiritud, mis põhjustab teatud ainete puudust (näiteks albinismi korral ei teki naharakkudes pigmenti);
Kogunevad prekursor-substraadid, millel on organismile toksiline toime (näiteks alkaptonuuriaga akumuleerub vahemetaboliit - homogenteeshape, mis ladestub liigestesse, põhjustades neis põletikulisi protsesse).
 Riis. 2.35. Metaboolne rada koos ensüümi E 3 ensümopaatiaga
Riis. 2.35. Metaboolne rada koos ensüümi E 3 ensümopaatiaga
KAVAVÄLISTE TÖÖDE ÜLESANDED
Probleeme lahendama
1. Rasvkoe rakkudes toimub ainevahetusprotsesside ümberlülitumine anaboolsetest kataboolseteks sõltuvalt toitumise rütmist. Selle lüliti reguleerimisel mängivad olulist rolli hormoonid, mis reguleerivad võtmeensüümide aktiivsust fosforüülimise-defosforüülimise teel. Täitke rasvade lagundamise võtmeensüümi aktiivsuse reguleerimise skeem (joonis 2.36), kui on teada, et see ensüüm (TAG lipaas) on aktiivne fosforüülitud kujul ja mitteaktiivne defosforüülitud kujul. Küsimusele vastamiseks:
a) kopeerige diagramm vihikusse ja märkige ensüümide nimetused, mis põhjustavad valkude fosforüülimist ja defosforüülimist (kirjutage nende nimed ristkülikutesse);
b) nimetage nende ensüümide klass;
c) kirjutage üles nendes reaktsioonides osalevad täiendavad substraadid ja tooted (kirjutage nende nimed ruutudesse);
d) teha järeldus hormoonide rollist raku ainevahetuse reguleerimisel.
 Riis. 2.36. TAG lipaasi aktiivsuse reguleerimine
Riis. 2.36. TAG lipaasi aktiivsuse reguleerimine
2. Asparaginaas, mis katalüüsib asparagiini katabolismi reaktsiooni, on leidnud rakendust leukeemia ravis. Asparaginaasi leukeemiavastase toime eelduseks oli asjaolu, et leukeemilistes rakkudes tuvastati asparagiini sünteesiks defektne ensüüm asparagiinisüntetaas. Põhjendage asparaginaasi terapeutilist toimet. Vastama:
a) kirjutage üles reaktsioonid, mida katalüüsivad ensüümid asparagiinisüntetaas (jaotis 7) ja asparaginaas;
b) märkige klassid, kuhu need ensüümid kuuluvad;
c) teha järeldus Asn kontsentratsiooni kohta kasvajarakkudes asparaginaasi kasutamisel;
d) selgitage, miks asparaginaasi kasutamine vähendab kasvajakoe kasvukiirust.
3. Viige see oma märkmikusse ja täitke tabel. 2.7 ensüümide kasutamise kohta meditsiinis, kasutades selle juhendi, õpiku materjali.
4. Viige see oma märkmikusse ja täitke tabel. 2.8 ravimite kohta - ensüümi inhibiitorid, kasutades praegust osa, õpikut, lisakirjandust.
Tabel 2.7. Ravimid – ensüümi inhibiitorid
ENESEKOHTAMISÜLESANDED
1. Vali õige vastus.
Konkureerivad inhibiitorid:
A. Moodustavad kovalentsed sidemed ensüümi aktiivse tsentriga B. Suhtlevad allosteerilise tsentriga
B. Suhelge ensüümi aktiivse saidiga, moodustades nõrgad sidemed
D. Vähenda K w D. Vähenda V max
2. Vali õige vastus. Pöördumatud inhibiitorid:
A. Need on substraadi B struktuursed analoogid. Nad moodustavad ensüümiga kovalentseid sidemeid
B. Moodustage ensüümiga nõrgad sidemed
D. Suhtlege reguleeriva keskusega
D. Vähendage nende toimet substraadi kontsentratsiooni suurendamisega
3. Vali õiged vastused. Allosteerilised ensüümid on üldiselt:
A. Need on tertsiaarse struktuuriga valgud
B. Koosneb mitmest protomeerist C. Pöördumatult inhibeeritud
D. Neil on aktiivsed ja allosteerilised keskused, mis asuvad erinevatel protomeeridel
D. Reguleeritakse selle protsessi metaboliitide poolt
4. Vali õiged vastused.
Kui ensüüme reguleeritakse osalise proteolüüsiga, toimub järgmine:
A. Valgu peptiidahela lühendamine
B. Muutused ensüümi sekundaarses ja tertsiaarses struktuuris
B. Pöördumatu aktiveerimine
D. Pöördumatu pärssimine
D. Aktiivse keskuse moodustumine
5. Vali õige vastus.
Ensüümide aktiivsuse reguleerimisega valkude ja valkude interaktsioonide kaudu kaasneb:
A. Pöördumatu pärssimine
B. Reguleerivate valgu subühikute kinnitumine või eraldumine
B. Efektormolekuli kinnitumine allosteerilisele tsentrile D. Ensüümi fosforüülimine
D. Ensüümi defosforüülimine
6. Vali õiged vastused. Ensümodiagnostika põhineb:
A. Ensüümide vabanemine verre koekahjustuse ajal B. Organispetsiifilisus
B. Kõrge ensüümi stabiilsus
D. Teatud isoensüümide ülekaal erinevates kudedes D. Diagnostiliselt oluliste ensüümide madal aktiivsus või täielik puudumine veres on normaalne
7. Matš.
Kasutatakse haiguste diagnoosimiseks:
B. Eesnääre
B. Pankreas D. Neer
D. Südamed Ensüüm:
1. Kreatiinkinaas
2. Amülaas
3. Happeline fosfataas
8. Täitke "ahela" ülesanne:
a) üks müokardiinfarkti ensümaatilise diagnoosimise käigus määratud ensüümidest on:
A. Happeline fosfataas B. Laktaatdehüdrogenaas
B. Amülaas
b) See ensüüm kuulub ensüümide klassi:
A. Hüdrolaas B. Ligaas
B. Oksidoreduktaas
V) üks selle ensüümide klassi koensüüme on:
A. Püridoksaalfosfaat B. Biotiin
G) Selle koensüümi eelkäija vitamiin on:
A. Nikotiinhape B. Püridoksiin
9. Täitke "ahela" ülesanne:
A) Pärast orgaaniliste fluorofosfaatidega mürgitamist kogeb inimene:
A. Pupillide laienemine
B. Silelihaste suurenenud kontraktsioon
B. Silelihaste lõdvestamine
b) Selle mõju põhjuseks on:
A. Na+, E+-ATPaasi talitlushäired B. Suurenenud atsetüülkoliini kogus
B. Atsetüülkoliini koguse vähendamine
V) See on tingitud asjaolust, et fluorofosfaadid:
A. Need on atsetüülkoliinesteraasi (AChE) konkureerivad inhibiitorid.
B. Moodustage AChE-ga kovalentsed sidemed
B. Häirige atsetüülkoliini sünteesi
G) Seda inhibeerimismeetodit nimetatakse:
A. Pöördumatu B. Pööratav
B. Konkurentsivõimeline
e) Sarnast inhibeerimismeetodit täheldatakse, kui kasutatakse:
A. Trasülool B. Aspiriin
B. Proserina
„ENESEKOHTAMISÜLESANDE“ VASTUSTE STANDARDID
3. B, G, D
4. A, B, C, D
6. A, B, D, D
7. 1-D, 2-B, 3-B
8. a) B, b) C, c) C, d) A
9. a) B, b) B, c) B, d) A, e) B
PÕHIMÕISTED JA MÕISTED
1. Ainevahetusrada
2. Ensüümi inhibeerimine
3. Ensüümi aktiveerimine
4. Pöörduv inhibeerimine
5. Pöördumatu pärssimine
6. Konkurentsivõimeline pärssimine
7. Allosteeriline regulatsioon
8. Allosteerilised efektorid
9. Võtmeensüümid
10. Reguleerimine forsforüülimise teel – defosforüülimine
11. Reguleerimine valk-valk interaktsioonide kaudu
12. Osaline proteolüüs
13. Isoensüümid
14. Ensümopaatia
15. Ensümodiagnostika
ÜLESANDED KLASSITÖÖKS
Probleeme lahendama
1. Inimese rakkudes algab nukleiinhapete sünteesiks vajalike puriini nukleotiidide sünteesi metaboolne rada riboos-5-fosfaadi molekulist. Sünteesiprotsessi käigus teatud etapis see protsess hargneb ja lõpeb kahe puriini nukleotiidi - AMP ja GMP - moodustumisega (joonis 2.37). Nende nukleotiidide ekvimolaarsete suhete moodustamiseks rakus toimub mitme võtmeensüümi mitmeastmeline reguleerimine negatiivse tagasiside mehhanismi abil. Seega aeglustub liigse AMP moodustumise korral adenüülosuktsinaadi moodustumine ja GMP ülejäägi korral ksantosiinmonofosfaadi moodustumine aeglustub. Samal ajal, kui neid mõlemaid nukleotiide ei tarbita, aeglustub fosforibosüüldifosfaadi moodustumine. Arvake ära, millised puriini nukleotiidide sünteesi metaboolse raja ensüümid on reguleerivad. Vastama:
a) anda määratlused: „ainevahetusrada” ja „metaboolse raja võtmeensüümid”;
b) arvake ära, milline joonisel fig. 2,37 on regulatiivsed;
c) näidata nende ensüümide reguleerimise mehhanismi, nende lokaliseerumist metaboolsetes radades ja struktuuri iseärasusi;
d) nimetada, millised ühendid ja millised ensüümid on efektoriteks;
e) põhjendada regulatsiooni mõistet “negatiivse tagasiside mehhanismiga”.

Riis. 2.37. Puriini nukleotiidide moodustumise skeem rakus
2. 1935. aastal avastas Saksa arst G. Domagk värvainena sünteesitud prootonsiili (punase streptotsiidi) antimikroobse toime. Peagi tehti kindlaks, et punase streptotsiidi toimeaineks on selle metabolismi käigus tekkinud sulfoonamiid (streptotsiid), mis oli suure rühma sulfoonamiidravimite esivanem (joon. 2.38).
 Riis. 2.38. Foolhappe struktuur ja sulfoonamiidide üldvalem
Riis. 2.38. Foolhappe struktuur ja sulfoonamiidide üldvalem
Sulfoonamiidide bakteriostaatiline toime seisneb selles, et nad asendavad para-aminobensoehapet (PABA) ensüümi dihüdropteoraadi süntaasi aktiivses keskuses foolhappe sünteesi ajal bakterite poolt, mis on vajalik nukleiinhapete moodustumiseks; selle tagajärjel on mikroorganismide kasv ja areng häiritud. Foolhapet inimkehas ei sünteesita, vaid seda saadakse toiduga vitamiinina.
Selgitage sulfoonamiidide antibakteriaalse toime mehhanismi, selleks vastake küsimustele:
a) kuidas seda tüüpi inhibeerimist nimetatakse (vrd sulfoonamiidide ja PABA struktuure)? Kuidas sellised inhibiitorid mõjutavad Kt ja Vmax
c) miks määratakse tavaliselt ravi ajal koheselt sulfoonamiidide küllastusannus?
d) kas sulfoonamiidid mõjutavad nukleiinhapete moodustumist inimese rakkudes? Selgitage vastust.
3. Psühhiaatri poole pöördus 2 depressiivsete häirete all kannatavat patsienti. On teada, et inimestel on mõnel juhul depressiooni põhjuseks neurotransmitterite puudumine sünaptilises pilus. Samuti on ajus monoamiini oksüdaaside (MAO) rühma ensüüme, mis hävitavad sünaptilisse pilusse vabanenud neurotransmitterid. Esimesele patsiendile määrati pirlindool, mis on vahendaja serotoniini struktuurne analoog. Teine on nialamiid, mis on võimeline kovalentselt seonduma MAO aktiivse saidiga. Selgitage nende ravimite toimemehhanisme ja näidake, milline patsient reageerib kõige tõenäolisemalt ravimile kiiremini. Vastama:
a) iseloomustage nende ravimite toimet MAO-le, näidake erinevust
koostoime mehhanismid selle ensüümiga;
b) anda skeem MAO inhibeerimiseks pirlindooli ja nialamiidi poolt;
c) nende ravimite pärssimise mehhanismi põhjal selgitage
milline neist avaldab kehale pikemaajalist mõju ja miks.
4. Viimasel ajal on sagenenud metanooli kasutamine sõidukihooldustoodetes kasutatavate tehniliste vedelike, sealhulgas esiklaasipesuvahendite tootmiseks. Metüülalkoholi ehk metanooli peamine oht on selle kasutamine surrogaatalkoholina, mis põhjustab surma. Seega on Roszdravi teadusliku ja praktilise toksikoloogia keskuse andmetel metanoolimürgituse saanud patsientide osakaal kõigist haiglaravil viibivatest patsientidest 0,1–0,5%. Selgitada metanooli toksilisuse põhjust ja arstiabi osutamist, kui on teada, et metanool pärsib ensüümi atseetaldehüüddehüdrogenaasi aktiivsust, mis osaleb etanooli katabolismis, mis põhjustab atseetaldehüüdi kuhjumist. Küsimusele vastamiseks:
a) kirjutage etanooli oksüdatsioonireaktsioonid, võttes arvesse, et oksüdatsioon toimub
läheb kahes etapis vaheühendi - atseetaldehüüdi - moodustumisega; lõpptoode on äädikhape; mõlema reaktsiooni koensüümiks on NAD+;
b) kirjutada metanooli struktuurvalem ja näidata ensüümi aktiivsuse pärssimise mehhanism;
c) soovitab ravimeetodit metanoolimürgistuse korral.
5. Vanasti tilgutasid itaalia daamid silmadesse belladonna mahla, mille tõttu pupillid laienesid ja silmad omandasid erilise sära. Praeguseks on teada, et sarnast mõju põhjustab alkaloid atropiin, mida leidub paljudes taimedes: belladonna, henbane, datura. Selgitage atropiini toimemehhanismi. Selle jaoks:
a) nimeta retseptorid, mida atropiin inhibeerib (vt moodul 1), märgi retseptorite tüübid ja sündmuste jada atropiini silma sattumisel;
b) vastake, kus kasutatakse meditsiinis atropiini ja sarnase toimega ravimeid;
c) märkige, milliseid meetmeid saab võtta atropiini üleannustamise korral? Põhjendage võimalikke viise atsetüülkoliini kontsentratsiooni suurendamiseks ja selgitage selle tegevuse vajadust.
6. Suurte annuste kasutamine kofeiini põhjustab inimestel sümptomeid, mis sarnanevad adrenaliini toimega: südame löögisageduse tõus; bronhide laienemine, erutus, ainevahetuse muutused kudedes, mis ladestavad energiakandjaid. Selgitage kofeiini toimemehhanismi, pidades meeles, et see on cAMP lagunemise eest vastutava ensüümi fosfodiesteraasi (PDE) konkureeriv inhibiitor:
Sellele küsimusele vastamiseks:
a) vastus, millise aine kontsentratsioon rakus kofeiini mõjul suureneb;
b) selgitab cAMP regulatiivse toime mehhanismi rakus; skemaatiliselt kujutama ensüümi struktuuri, mis aktiveerub cAMP kontsentratsiooni suurenemise tõttu rakus;
c) nimeta, millised protsessid rakus kofeiini kasutamise tagajärjel aktiveeruvad? Kirjutage nende reaktsioonide diagramm;
d) pidage meeles, et sarnast toimemehhanismi täheldatakse ravimitel, mis parandavad vere reoloogilisi omadusi (nt. Trental), samuti ravimid, mida kasutatakse bronhide lõdvestamiseks ja bronhospasmi leevendamiseks (nt. teofülliin).
7. Patsient L. viidi müokardiinfarkti kahtlusega haiglasse. Patsiendi sõnul tekkis tal 5 tundi enne arsti saabumist õhupuudus. Arst kahtlustas müokardiinfarkti ja paigutas patsiendi haiglasse. Haiglas tehti diagnoosi kinnitamiseks mitme päeva jooksul biokeemiline vereanalüüs. Analüüside tulemused on toodud tabelis. 2.9. Kas saadud andmed kinnitavad arsti diagnoosi? Vastama:
Ensüüm | Aktiivsus, RÜ/l | paljusus | Aktiivsus, RÜ/l | paljusus |
12 tundi pärast veresoone oklusiooni | 72 tundi pärast veresoone oklusiooni |
|||
24 tundi pärast veresoone oklusiooni | 96 tundi pärast veresoone oklusiooni |
|||
48 tundi pärast veresoone oklusiooni | 120 tundi pärast veresoone oklusiooni |
|||
Metaboolsete radade reguleerimisega on seotud kolme tüüpi mehhanismid. Neist esimene, mis reageerib kõige kiiremini igale olukorra muutusele, on seotud allosteeriliste ensüümide toimega (joon. 13-15), mille katalüütiline aktiivsus võib muutuda spetsiaalsete ainete mõjul, millel on stimuleeriv või inhibeeriv toime (neid nimetatakse efektoriteks või modulaatoriteks; punkt 9.18).
Reeglina hõivavad allosteerilised ensüümid koha antud multiensüümide järjestuse alguses või selle alguses ning katalüüsivad seda etappi, mis piirab kogu protsessi kui terviku kiirust; Tavaliselt mängib sellise etapi rolli praktiliselt pöördumatu reaktsioon.
Riis. 13-15. Kataboolse raja reguleerimine tagasiside tüübi järgi, st allosteerilise ensüümi inhibeerimise tõttu selle protsessi lõppsaaduse poolt. Tähed J, K, L jne tähistavad selle ainevahetusraja vaheprodukte ja tähed E1, E2, E3 jne tähistavad ensüüme, mis katalüüsivad üksikuid etappe. Esimest etappi katalüüsib allosteeriline ensüüm (ED), mida inhibeerib selle reaktsioonijärjestuse lõpp-produkt. Allosteerilist inhibeerimist tähistab katkendlik punane nool, mis ühendab inhibeeriva metaboliidi allosteerilise ensüümi poolt katalüüsitava reaktsiooniga. Reguleeritud etapp (EJ ensüümi poolt katalüüsitav on rakutingimustes tavaliselt peaaegu pöördumatu reaktsioon.
Kataboolsetes protsessides, millega kaasneb ATP süntees ADP-st, toimib see lõpptoode ATP sageli katabolismi ühe varajases staadiumis allosteerilise inhibiitorina. Anabolismi ühe varase staadiumi allosteeriline inhibiitor on sageli biosünteesi lõppsaadus, näiteks mõni aminohape (jaotis 9.18). Mõnede allosteeriliste ensüümide aktiivsust stimuleerivad spetsiifilised positiivsed modulaatorid. Allosteeriline ensüüm, mis reguleerib üht kataboolsetest reaktsioonijärjestustest, võib olla allutatud positiivsete modulaatorite ADP või AMP stimuleerivale toimele ja negatiivse modulaatori ATP inhibeerivale toimele. On ka juhtumeid, kui metaboolse raja allosteeriline ensüüm reageerib spetsiifiliselt teiste ainevahetusradade vahe- või lõppsaadustele. Tänu sellele on võimalik koordineerida erinevate ensüümsüsteemide toimekiirust.
Teist tüüpi mehhanismid, mis reguleerivad ainevahetust kõrgemates organismides, on hormonaalne regulatsioon (joon. 13-16). Hormoonid on spetsiaalsed keemilised ained (keemilised "sõnumitoojad"), mida toodavad erinevad endokriinsed näärmed ja eralduvad otse verre; neid transporditakse verega teistesse kudedesse või organitesse ja siin nad stimuleerivad või pärsivad teatud tüüpi metaboolset aktiivsust. Näiteks hormooni epinefriini eritab neerupealise medulla ja see viiakse verega maksa, kus see stimuleerib glükogeeni lagunemist glükoosiks, mis põhjustab veresuhkru taseme tõusu. Lisaks stimuleerib adrenaliin glükogeeni lagunemist skeletilihastes; see protsess viib laktaadi moodustumiseni ja energia salvestamiseni ATP kujul. Epinefriin tekitab neid toimeid, kinnitudes lihasrakkude või maksarakkude pinnal olevate spetsiifiliste retseptorite kohtadesse.
Adrenaliini sidumine toimib signaalina; see signaal edastatakse raku sisemistesse osadesse ja põhjustab siin kovalentse modifikatsiooni, mille mõjul glükogeeni fosforülaas (esimene ensüüm süsteemis, mis katalüüsib glükogeeni muundumist glükoosiks ja muudeks produktideks; punkt 9.22) läheb rakust edasi. vähem aktiivsest vormist aktiivsemaks (joon. 13-16 ).
Kolmandat tüüpi ainevahetust reguleerivad mehhanismid on seotud selle ensüümi kontsentratsiooni muutustega rakus. Mis tahes ensüümi kontsentratsioon igal ajahetkel määratakse selle sünteesi ja lagunemise kiiruste suhtega. Mõnede ensüümide sünteesi kiirus suureneb teatud tingimustel järsult; Vastavalt sellele suureneb selle ensüümi kontsentratsioon rakus. Kui loom saab näiteks süsivesikuterikast, kuid valguvaest toitu, siis tema maks sisaldab äärmiselt madalal tasemel ensüüme, mis normaalsetes tingimustes katalüüsivad aminohapete lagunemist atsetüül-CoA-ks. Kuna sellise dieediga neid ensüüme praktiliselt ei vajata, ei teki neid ka suurtes kogustes. Loom tasub aga üle viia valgurikkale toidule ja päevaga suureneb tema maksas märgatavalt ensüümide sisaldus, mida on nüüd vaja seeditavate aminohapete lagundamiseks.

Riis. 13-16. Ensümaatiliste reaktsioonide hormonaalne reguleerimine. Hormooni adrenaliini kinnitumisel maksarakkude pinnal paiknevatele spetsiifilistele retseptoritele moodustub tsükliline adenülaat membraaniga seotud ensüümi (adenülaattsüklaas) osalusel. Viimane toimib allosteerilise aktivaatorina ehk intratsellulaarse vahendajana, mille mõjul läheb glükogeeni fosforülaas inaktiivsest vormist aktiivseks, millega kaasneb maksa glükogeeni muundamise kiirenemine vere glükoosiks. Seda metaboolset rada on üksikasjalikult kirjeldatud peatükis. 25.

Riis. 13-17. Ensüümi induktsioon. Substraadi A kõrge rakusisene kontsentratsioon võib stimuleerida ensüümide E1, E2 ja E3 biosünteesi. Nende ensüümide sisaldus rakus suureneb ja loob seeläbi võimaluse kiirendada neid reaktsioone, mille tulemusena eemaldatakse liigne substraat A. Substraadi A liig toimib seetõttu signaalina raku tuumale, sundides seda "sisse lülitama" geenid, mis kontrollivad ensüümide El, E2 ja E3 moodustumist. Geenide kaasamine tähendab vastava messenger-RNA sünteesi; see siseneb ribosoomidesse ja selle tulemusena toimub neis ensüümide E1, E2 ja E3 süntees.
Seetõttu on maksarakkudel võime sisse või välja lülitada spetsiifiliste ensüümide biosüntees, olenevalt neisse sisenevate toitainete olemusest. Seda nähtust nimetatakse ensüümi induktsiooniks (joon. 13-17).
1. Kõik rakus toimuvad keemilised reaktsioonid toimuvad ensüümide osalusel. Seetõttu piisab metaboolse raja (ühe aine järjestikuse teisenemise teiseks) kiiruse mõjutamiseks ensüümi molekulide arvu või nende aktiivsuse reguleerimisest. Tavaliselt on metaboolsetes radades võtmeensüümid mille tõttu reguleeritakse kogu tee kiirust. Neid ensüüme (üks või mitu metaboolses rajas) nimetatakse reguleerivad ensüümid. Ensümaatiliste reaktsioonide kiiruse reguleerimine toimub kolmel sõltumatul tasandil: muutes ensüümi molekulide arvu, substraadi ja koensüümi molekulide kättesaadavust ning muutes ensüümi molekuli katalüütilist aktiivsust (tabel 2.6).
Tabel 2.5. Ensümaatiliste reaktsioonide kiiruse reguleerimise meetodid
| Reguleerimise meetod | Iseloomulik |
| Ensüümide molekulide arvu muutus | Ensüümmolekulide arv rakus määratakse kahe protsessi suhtega: süntees ja lagunemine. Enim uuritud ensüümide sünteesi reguleerimise mehhanism on transkriptsiooni (mRNA süntees) tasemel, mida reguleerivad teatud metaboliidid, hormoonid ja mitmed bioloogiliselt aktiivsed molekulid. |
| Substraadi ja koensüümi molekulide kättesaadavus | Oluline parameeter, mis kontrollib ensümaatilise reaktsiooni kulgu, on substraadi ja koensüümi olemasolu. Mida suurem on lähtesubstraadi kontsentratsioon, seda suurem on reaktsioonikiirus |
| Ensüümi molekuli katalüütilise aktiivsuse muutus | Peamised viisid ensüümi aktiivsuse reguleerimiseks on: - allosteeriline regulatsioon; - reguleerimine valgu-valgu interaktsioonide abil; - reguleerimine ensüümi molekuli fosforüülimise-defosforüülimise teel; - reguleerimine osalise (piiratud) proteolüüsiga |
Vaatleme võimalusi ensümaatiliste reaktsioonide kiiruse reguleerimiseks, muutes ensüümi molekuli katalüütilist aktiivsust.
2. Allosteeriline regulatsioon. Allosteerilised ensüümid helistas ensüümid, aktiivsus mis saab reguleerida kasutades efektorained. Allosteerilise regulatsiooniga seotud efektorid on rakulised metaboliidid, mis osalevad sageli selles, mida nad reguleerivad.
Efektor, mis põhjustab vähendamine (inhibeerimine) ensüümi aktiivsust nimetatakse inhibiitor. Efektor, mis põhjustab suurendamine (aktiveerimine) ensüümi aktiivsust nimetatakse aktivaator.
Allosteerilistel ensüümidel on teatud struktuurilised omadused:
Tavaliselt on oligomeersed valgud, koosneb mitmest protomeerist;
On allosteeriline keskus, katalüütilisest aktiivsest saidist ruumiliselt kaugel;
Efektorid kinnituvad ensüümile mittekovalentselt allosteerilistes (regulatiivsetes) keskustes.
Allosteerilised keskused, nagu katalüütilised keskused, võivad omada ligandide suhtes erinevat spetsiifilisust: see võib olla absoluutne või rühm. Mõnel ensüümil on mitu allosteerilist tsentrit, millest mõned on spetsiifilised aktivaatoritele, teised inhibiitoritele.
Kutsutakse protomeeri, millel allosteeriline keskus asub regulatiivne protomeer Erinevalt katalüütiline protomeer, mis sisaldab aktiivset keskust, milles toimub keemiline reaktsioon.
Allosteerilistel ensüümidel on omadus koostöövalmidus: allosteerilise efektori interaktsioon allosteerilise tsentriga põhjustab kooperatiivse muutuse kõigi alaühikute konformatsioonis, mis viib aktiivse tsentri konformatsiooni muutumiseni ja ensüümi afiinsuse muutumiseni substraadi suhtes, mis vähendab või suurendab ensüümi katalüütiline aktiivsus. Kui allosteerilisele tsentrile on kinnitatud inhibiitor, siis kooperatiivsete konformatsiooniliste muutuste tulemusena toimub aktiivse tsentri konformatsiooni muutus, mis põhjustab ensüümi afiinsuse vähenemist substraadi suhtes ja vastavalt ensümaatilise reaktsiooni kiirus. Ja vastupidi, kui allosteerilise tsentri külge on kinnitatud aktivaator, suureneb ensüümi afiinsus substraadi suhtes, mis põhjustab reaktsioonikiiruse suurenemist. Sündmuste jada allosteeriliste efektorite toimel on esitatud joonisel fig. 2.26.
Allosteeriliste ensüümide reguleerimine pööratav: efektori eraldumine reguleerivast allüksusest taastab ensüümi esialgse katalüütilise aktiivsuse.
Allosteerilised ensüümid katalüüsida peamisi reaktsioone sellest metaboolsest rajast.
Allosteerilised ensüümid mängivad olulist rolli erinevates metaboolsetes radades, kuna reageerivad ülikiiresti vähimatele muutustele raku sisemises koostises. Ainevahetusprotsesside kiirus sõltub nii kasutatavate kui ka antud reaktsiooniahelas tekkivate ainete kontsentratsioonist. Prekursorid võivad olla allosteeriliste ensüümide aktivaatorid metaboolsetes radades. Samal ajal, kui mis tahes ainevahetusraja lõpp-produkt koguneb, võib see toimida ensüümi allosteerilise inhibiitorina. See reguleerimismeetod on kehas tavaline ja seda nimetatakse "negatiivseks tagasisideks":
 Riis. 2.26. Allosteerilise ensüümi struktuuri ja toimimise skeem:
Riis. 2.26. Allosteerilise ensüümi struktuuri ja toimimise skeem:
A - negatiivse efektori (inhibiitori) toime. Inhibiitor (I) kinnitub allosteerilise tsentri külge, mis põhjustab kooperatiivseid konformatsioonilisi muutusi ensüümi molekulis, sealhulgas ensüümi aktiivses keskuses. Ensüümi afiinsus substraadi suhtes väheneb ja selle tulemusena väheneb ensümaatilise reaktsiooni kiirus; B - positiivse efektori (aktivaatori) toime. Aktivaator (A) seondub allosteerilise keskusega, mis põhjustab kooperatiivseid konformatsioonilisi muutusi. Ensüümi afiinsus substraadi suhtes suureneb ja ensümaatilise reaktsiooni kiirus suureneb. On tõestatud nii inhibiitori kui ka aktivaatori pöörduv toime ensüümi aktiivsusele
Vaatleme glükoosi katabolismi protsessi allosteerilist regulatsiooni, mis lõpeb ATP molekuli moodustumisega (joonis 2.27). Juhul, kui rakus olevaid ATP molekule ei tarbita, on see selle metaboolse raja allosteeriliste ensüümide inhibiitor: fosfofruktokinaasi ja püruvaatkinaasi. Samal ajal on glükoosi katabolismi vahemetaboliit fruktoos-1,6-bisfosfaat püruvaatkinaasi ensüümi allosteeriline aktivaator. Inhibeerimine metaboolse raja lõpp-produkti poolt ja aktiveerimine algsete metaboliitide poolt võimaldab
 Riis. 2.27. Glükoosi katabolismi protsessi allosteeriline reguleerimine.
Riis. 2.27. Glükoosi katabolismi protsessi allosteeriline reguleerimine.
ATP molekul on metaboolsete radade ensüümide - fosfofruktokinaasi ja püruvaatkinaasi - allosteeriline inhibiitor. Fruktoos-1,6-bisfosfaadi molekul on ensüümi püruvaatkinaasi allosteeriline aktivaator
reguleerida ainevahetuse kiirust. Allosteerilised ensüümid katalüüsivad reeglina ainevahetusraja algreaktsioone, pöördumatuid reaktsioone, kiirust piiravaid reaktsioone (kõige aeglasemaid) või reaktsioone metaboolse raja hargnemispunktis.
3. Reguleerimine valk-valk interaktsioonide kaudu. Mõned ensüümid muudavad oma aktiivsust valkude ja valkude koostoime tulemusena. Sel viisil ensüümi aktiivsuse muutmiseks võib eristada vähemalt kahte mehhanismi: ensüümide aktiveerumine aktivaatorvalkude lisamise tulemusena (ensüümi adenülaattsüklaasi aktiveerimine G-valgu α-subühiku poolt, vt moodul 4) ja muutused. katalüütilises aktiivsuses protomeeride assotsieerumise ja dissotsiatsiooni tulemusena.
Näitena ensüümide katalüütilise aktiivsuse reguleerimisest protomeeride assotsieerumise või dissotsiatsiooni teel võime vaadelda ensüümi proteiinkinaasi A regulatsiooni.
Proteiini kinaas A(cAMP-sõltuv) koosneb neljast kahte tüüpi subühikust: kahest reguleerivast (R) ja kahest katalüütilisest (C). Sellel tetrameeril ei ole katalüütilist aktiivsust. Reguleerivatel alaühikutel on sidumissaidid tsüklilise 3,5"-AMP (cAMP) jaoks (kaks iga subühiku kohta). Nelja cAMP molekuli kinnitumine kahe regulatoorse alaühikuga viib regulatoorsete protomeeride konformatsiooni muutumiseni ja tetrameerse kompleksi dissotsiatsioonini; see vabastab kaks aktiivset katalüütilist subühikut (joonis 2.28). Aktiivne proteiinkinaas A katalüüsib fosforhappejäägi ülekannet ATP-st valkude aminohappejääkide spetsiifilistesse OH-rühmadesse (st põhjustab valkude fosforüülimist).
 Riis. 2.28. Proteiinkinaasi A (PKA) aktiivsuse reguleerimine valk-valgu interaktsioonide kaudu.
Riis. 2.28. Proteiinkinaasi A (PKA) aktiivsuse reguleerimine valk-valgu interaktsioonide kaudu.
PKA-d aktiveerivad neli cAMP molekuli, mis seonduvad kahe regulatoorse alaühikuga, mis viib regulatoorsete protomeeride konformatsiooni muutumiseni ja tetrameerse kompleksi dissotsiatsioonini. See vabastab kaks aktiivset katalüütilist subühikut, mis võivad põhjustada valgu fosforüülimist
cAMP molekulide lõhustamine regulatoorsetest subühikutest viib proteiinkinaasi A regulatoorsete ja katalüütiliste subühikute seostumiseni inaktiivse kompleksi moodustumisega.
4. Ensüümide katalüütilise aktiivsuse reguleerimine fosforüülimise-defosforüülimise teel. Bioloogilistes süsteemides leitakse sageli mehhanism ensüümide aktiivsuse reguleerimiseks, kasutades nende kovalentset modifikatsiooni. Kiire ja laialt levinud meetod ensüümide keemiliseks muutmiseks on nende fosforüülimine-defosforüülimine.
Ensüümi OH rühmad läbivad fosforüülimise, mida viivad läbi ensüümid proteiinkinaasid(fosforüülimine) ja fosfoproteiini fosfataasid(defosforüülimine). Fosforhappe jäägi lisamine toob kaasa muutuse aktiivse tsentri konformatsioonis ja selle katalüütilises aktiivsuses. Sel juhul võib tulemus olla kahekordne: mõned ensüümid aktiveeruvad fosforüülimise käigus, teised vastupidi, muutuvad vähem aktiivseks (joonis 2.29). Proteiinkinaaside ja fosfoproteiinfosfataaside aktiivsust reguleerivad hormoonid, mis võimaldab metaboolsete radade võtmeensüümide aktiivsust kiiresti varieeruda sõltuvalt keskkonnatingimustest.
 Riis. 2.29. Ensüümide aktiivsuse reguleerimise skeem fosforüülimise-defosforüülimise teel.
Riis. 2.29. Ensüümide aktiivsuse reguleerimise skeem fosforüülimise-defosforüülimise teel.
Ensüümide fosforüülimine toimub ensüümi proteiinkinaasi abil. Fosforhappejäägi doonoriks on ATP molekul. Ensüümi fosforüülimine muudab selle konformatsiooni ja aktiivse saidi konformatsiooni, mis muudab ensüümi afiinsust substraadi suhtes. Sel juhul mõned ensüümid aktiveeritakse fosforüülimise ajal, teised aga inhibeeritakse. Pöördprotsessi – defosforüülimise – põhjustavad ensüümid fosfoproteiinfosfataasid, mis lõhustavad ensüümist fosforhappejäägi ja viivad ensüümi tagasi algsesse olekusse.
5. Ensüümide katalüütilise aktiivsuse reguleerimine osalise (piiratud) proteolüüsi teel. Mõned ensüümid, mis toimivad väljaspool rakke (seedetraktis või vereplasmas), sünteesitakse inaktiivsete lähteainetena ja aktiveeritakse ainult ühe või mitme spetsiifilise peptiidsideme hüdrolüüsi tulemusena, mis viib molekuli osa elimineerimiseni. Valgu molekuli ülejäänud osas toimub konformatsiooniline ümberkorraldus ja moodustub ensüümi aktiivne kese (joon. 2.30). Osaline proteolüüs on näide reguleerimisest, kui ensüümi aktiivsust muudetakse
 Riis. 2.30. Pepsiini aktiveerimine osalise proteolüüsi teel.
Riis. 2.30. Pepsiini aktiveerimine osalise proteolüüsi teel.
Pepsinogeeni (inaktiivse molekuli) ühe või mitme peptiidsideme hüdrolüüsi tulemusena osa molekulist eraldub ja moodustub pepsiini ensüümi aktiivne kese
pöördumatu. Sellised ensüümid toimivad tavaliselt lühikest aega, mille määrab valgu molekuli eluiga. Osaline proteolüüs on seedetrakti proteolüütiliste ensüümide (pepsiin, trüpsiin, kümotrüpsiin, elastaas), peptiidhormoonide (insuliin), vere hüübimissüsteemi valkude ja paljude teiste valkude aktiveerimise aluseks.