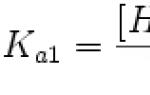Nõrkade hapete happesuse konstantide määramine. Happesus ja aluselisus vees Piimhappe happesuse konstandi indeks
Vee iseioniseerimine
Vesi, isegi pärast korduvat destilleerimist, säilitab elektrijuhtimise võime. See vee võime tuleneb selle iseionisatsioonist.
$2H_2O ↔ H_3O^+ + OH^-$
Termodünaamilise tasakaalukonstandi vorm on järgmine:
Pilt 1.
kus $a_X^(rel)=\frac(a_X^(võrdne))(a_X^0)$ on osakese $X$ suhteline aktiivsus tasakaalusüsteemis;
$aX^(võrdne)$ on osakese $X$ absoluutne aktiivsus tasakaalusüsteemis;
$(a_x)^0$ on $X$ absoluutne aktiivsus süsteemi termodünaamilises olekus.
Vee suhteline aktiivsus tasakaaluolekus on praktiliselt võrdne ühtsusega, kuna reaktsiooniaste on väga väike (kui standardolekuks on teoreetiliselt ioniseerimata vesi.
$OH^-$ ja $H_3O^+$ ioonide aktiivsuskoefitsiendid on puhtas vees ühtsuse lähedal. Reaktsiooni tasakaal on tugevalt nihkunud vasakule. $OH^-$ ja $H_3O^+$ suhtelised aktiivsused on praktiliselt võrdsed nende molaarsete kontsentratsioonidega. Kus
$(K_a)^0 \sim K_(auto) = $
kus $ ja $ on molaarsed kontsentratsioonid;
$K_(auto)$ – vee autoprolüüsi konstant on võrdne $1.00\cdot 10^(-14) \mol^2/l^2$ juures $25^\circ \C.$
Seega on puhtas vees $ ja $ kontsentratsioonid võrdsed
$==\sqrt(10^(-14))=10^(-7)$ hinnaga 25 $^\circ \ C.$
Arvutamise hõlbustamiseks on kontsentratsioon näidatud negatiivse logaritmina, mis on tähistatud kui $ pH $:
$pH= -lg $
Näitajad $pH$ puhta vee puhul on $7$, happelistes lahustes $pH$ 7$.
Happe dissotsiatsioon ja happesuse konstant
Happe $AH$ korral saab dissotsiatsiooni väljendada võrrandiga:
$AH + H_2O ↔ A^- + H_3O^+$
Tasakaaluseisundis muutub vee suhteline tihedus ühelt happelt teisele liikudes veidi ja lõpmatu lahjenduse korral läheneb see nullile. Seetõttu kasutatakse termodünaamilist happesuse konstanti $K_a^0$ ($AH$).
Aktiivsuskoefitsientide suhe on kõigil hapetel ühesugune ja võrdne ühtsusega, kui protsessid toimuvad lahjendatud lahustes.
Seejärel kasutatakse lahjendatud vesilahuses happetugevuse mõõtmiseks happesuse konstanti $Ka (AH$), mille saab määrata järgmise valemiga:
$Ka (AH)=\frac()()$
Valem näitab osakeste molaarset kontsentratsiooni fikseeritud temperatuuril $(25^\circ \C)$ tasakaaluolekus.
Mida kõrgem on happesuse konstant, seda suurem on dissotsiatsiooniaste, seda tugevam on hape. Happesuse arvutamiseks ja iseloomustamiseks kasutatakse happesuse konstandi $pKa$ negatiivset logaritmi.
$pKa (AH)= -lgKa (AH)$
Mida suurem on happesuse konstandi väärtus, seda nõrgem on hape.
Happesuse konstandi väärtus on võrdne lahuse $pH$ väärtusega, mille juures hape poolioniseerub:
$pKa (AH) = pH - log \frac()()$
Veemolekulide happesust iseloomustav väärtus vesilahuses on võrdne:
$Ka=\frac()()=\frac(Ka_(automaatne))()=\frac(10^(-14))(55,5)$
Seega temperatuuril $25^\circ C$ on $pKa (H_2O) = 15,7$. See väärtus iseloomustab veemolekulide happesust lahuses.
Hüdroniumiooni puhul $pKa (H_3O^+) = pK_(auto) - pKa = 14-15,7 = -1,7.$
$pKa$ väärtused on tabeliandmed. Kuid hapete puhul, mille $pKa 0$ on tabeliandmed ebatäpsed.
Happesuse konstandid vees on $A^-$ ja $AH$ kontsentratsioonide otsese mõõtmise teel võimalik määrata ainult siis, kui happe dissotsiatsioon toimub vähemalt mingil määral, isegi vaevumärgatavalt.
Kui hape on väga nõrk, nii et see praktiliselt ei dissotsieeru, siis ei saa $A^-$ kontsentratsiooni täpselt mõõta. Kui hape on vastupidi nii tugev, et dissotsieerub peaaegu täielikult, siis on $AH$ kontsentratsiooni mõõtmine võimatu. Sel juhul kasutatakse happesuse määramiseks kaudseid meetodeid.
Aluse ionisatsioonikonstant
Vees oleva aluse dissotsiatsioonikonstandi väljendamiseks kasutame võrrandit:
$B + H_2O ↔ BH^+ + OH^-$
Aluselisuse konstant on:
$Kb=\frac())([B])$
Viimasel ajal aluselisuskonstante arvutustes praktiliselt ei kasutata, kuna konjugeeritud happe happesuskonstandist saab kogu vajaliku teabe aluse kohta $BH^+.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
Happe happesuse konstant on tugevuse mõõt:
- $AH$ või $BH^+$ prootoni doonoritena;
- $A^-$ või $B$ kui prootoniaktseptorid;
- tugev hape $AH$ või $BH^+$ vastab nõrgale konjugaatalusele $A^-$ või $B$ ja siis on $pKa$ väärtus väike või negatiivne;
- tugev alus $A^-$ või $B$ vastab nõrgale happele $AH$ või $BH^+$ ja happesuse konstant on positiivne
Hapete või aluste tugevust saab otseselt mõõta ainult kitsas vahemikus $pKa (BH^+). $ Väljaspool vahemikku määratakse aluselisus kaudsete meetoditega. $pka (BH^+)$ väärtused väljaspool intervalli $-2$ kuni $17$ on ebatäpsed.
Hapete struktuuri ja tugevuse seos
Hapete suhtelist tugevust saab ennustada keskse aatomi olemuse ja happemolekuli struktuuri põhjal.
Hapnikuvaba happe $HX$ ja $H_2X$ (kus $X$ on halogeen) tugevus on seda suurem, mida nõrgem on side $X-H$, st seda suurem on $X$ aatomi raadius.
Seeriates $HF - HCl - HBr - HI$ ja $H_2S - H_2Se - H_2Te$ suureneb hapete tugevus.
Hapnikku sisaldavate hapete puhul, mida tugevam on m väärtus ühendis $E(OH)nOm$, seda tugevam on hape.
Seega selle teooria kohaselt Hape on igasugune aine, mille molekulid (ka ioonid) on võimelised loovutama prootonit, s.t. olla prootoni doonor; Alus on iga aine, mille molekulid (ka ioonid) on võimelised siduma prootonit, s.t. olla prootonite vastuvõtja; Amfolüüt on mis tahes aine, mis on nii prootonite doonor kui ka aktseptor.
See teooria selgitab mitte ainult neutraalsete molekulide, vaid ka ioonide happe-aluse omadusi. Prootonist loobuv hape muutub aluseks, mis on selle happe konjugaat. Mõisted "hape" ja "alus" on suhtelised mõisted, kuna samadel osakestel – molekulidel või ioonidel – võivad olenevalt partnerist olla nii aluselised kui ka happelised omadused.
Protolüütilise tasakaalu ajal moodustuvad happe-aluse paarid. Prootoniteooria järgi ei peeta hüdrolüüsi, ionisatsiooni ja neutraliseerimise reaktsioone eriliseks nähtuseks, vaid neid peetakse tavapäraseks prootonite ülekandumiseks happest alusele.
Osake A tekkis pärast vesinikuiooni eraldamist
pH väärtus
Vesi nõrga elektrolüüdina läbib vähesel määral ionisatsiooni:
H 2 O ↔ H + + OH - .
Vesilahuses olevad ioonid läbivad hüdratatsiooni (aq.)
Vett iseloomustab protolüütiline amfoteersus. Vee iseionisatsioonireaktsiooni (autoprotolüüsi), mille käigus prooton ühest veemolekulist (happest) läheb üle teisele veemolekulile (alusele), kirjeldatakse võrrandiga:
H 2 O + H 2 O ↔ H 3 O + + OH - .
Vee autoprotolüüsi tasakaalukonstant on võrdne:
Ionisatsioonikonstandile rakendatakse massi mõju seadust:
kus a on tegevus.
Lühiduse huvides kirjutame happe-aluse tasakaalu H 3 O + asemel
Kuna vesi on lahuses suures liias ja läbib vähesel määral ionisatsiooni, siis võib märkida, et selle kontsentratsioon on konstantne ja võrdne 55,6 mol (1000 g: 18 g/mol = 56 mol) liitri vee kohta.
Seetõttu on K ja (H 2 O) korrutis ja vee kontsentratsioon võrdne 1,8 10 -16 mol/l 55,6 mol/l = 10 -14 mol 2 /l 2. Seega = 10 -14 (temperatuuril 25 °C) on konstantne väärtus, tähistatud Kw ja kutsutakse vee autoprotolüüsi konstant. Mõnikord kasutatakse vananenud nimetust - vee ioonprodukt.
Lahuseid, milles vesinikuioonide ja hüdroksiidioonide kontsentratsioon on sama, nimetatakse neutraalseteks lahusteks = = = 10 -7 mol/l. Happelistes lahustes > , > 10 -7 mol/l ja leeliselistes lahustes > , > 10 -7 mol/l.
Lihtsustamise mõttes võtame aluseks vesiniku indikaatori pH - vesinikioonide kontsentratsiooni kümnendlogaritmi, mis on võetud vastupidise märgiga: pH = -lg.
Huvitavaid fakte:
Isohüdrilise oleku rikkumine ( pH püsivus) täheldatud südame-veresoonkonna haiguste, isheemia, suhkurtõve (tekib atsidoos) korral. Happe-aluse tasakaalu säilitatakse hingamine, urineerimine ja higistamine. Need süsteemid töötavad aeglaselt ning happeliste ja aluseliste ainevahetusproduktide kohene neutraliseerimine toimub organismi puhversüsteemide poolt. Isohüdriidi seisundi tagab mitmete füüsikalis-keemiliste ja füsioloogiliste mehhanismide koosmõju. Puhverdusefekt saavutatakse mitme protolüütilise tasakaalu kombineerimisega.
Hapete tugevuse määrab nende võime prootonit loovutada. Selle võime mõõt on happesuse konstant (Ka).
Mida kõrgem on happesuse konstant, seda tugevam on hape. Näiteks äädikhape on tugevam kui vesiniktsüaniidhape, kuna Ka(CH 3 COOH) = 1,74 10 -5, Ka(HCN) = 1 10 -9. Arvutuste ja salvestamise mugavuse huvides ei kasuta nad sageli mitte konstante endid, vaid nende negatiivseid kümnendlogaritme: pKa = -lgKa. pKa väärtust nimetatakse happe tugevusnäitaja. Mida kõrgem on pKa väärtus, seda nõrgem on hape.
Tugevad happed loovutavad peaaegu täielikult oma prootonid veemolekulidele, seega on lahuses olev hape tegelikult hüdroniumioon.
Sellega seoses võrdsustatakse tugeva ühealuselise happe lahuse pH arvutamisel prootonite kontsentratsioon happe kontsentratsiooniga.
c(H3O+) = c(HB).
Nõrkade hapete lahustes on hüdrooniumiioonide kontsentratsioon oluliselt madalam kui happe kontsentratsioon. See arvutatakse selle põhjal
selle võrrandi mõlemad pooled annavad valemi nõrkade hapete lahuste pH arvutamiseks: pH = 0,5(pKa - log c(HB)).
29. Nõrgad elektrolüüdid. Happesuse ja aluselisuse konstant. Oswaldi lahjendusseadus.
Nõrgad elektrolüüdid on keemilised ühendid, mille molekulid on isegi väga lahjendatud lahustes kergelt dissotsieerunud ioonideks, mis on dünaamilises tasakaalus dissotsieerumata molekulidega. Nõrgad elektrolüüdid hõlmavad enamikku orgaanilisi happeid ja paljusid orgaanilisi aluseid vesi- ja mittevesilahustes.
Nõrgad elektrolüüdid on:
peaaegu kõik orgaanilised happed ja vesi;
mõned anorgaanilised happed: HF, HClO, HClO 2, HNO 2, HCN, H 2 S, HBrO, H 3 PO 4, H 2 CO 3, H 2 SiO 3, H 2 SO 3 jne;
mõned halvasti lahustuvad metallihüdroksiidid: Fe(OH) 3, Zn(OH) 2 jne.
Happe dissotsiatsioonikonstant (Ka) on tasakaalukonstant, mis tekib happe dissotsiatsiooni reaktsioonil vesinikiooniks ja happejäägi aniooniks. Mitmealuseliste hapete puhul, mille dissotsiatsioon toimub mitmes etapis, kasutatakse dissotsiatsiooni erinevate etappide jaoks eraldi konstante, tähistades neid K a1, K a2 jne.
Kahealuselise happe arvutamise näide:

![]()
Sagedamini kasutatakse dissotsiatsioonikonstandi K enda asemel väärtust pK, mis on määratletud konstandi enda negatiivse kümnendlogaritmina:
Alus on keemiline ühend, mis võib moodustada kovalentse sideme prootoniga (Brønstedi alus) või mõne muu keemilise ühendi vaba orbitaaliga (Lewise alus). Kitsas tähenduses aluste all mõeldakse aluselisi hüdroksiide - kompleksaineid, mille dissotsiatsioonil vesilahustes eraldub ainult üht tüüpi anioonid - hüdroksiidioonid OH-.
Brønsted-Lowry teooria võimaldab meil kvantifitseerida aluste tugevust, st nende võimet hapetest prootonit eraldada. Tavaliselt tehakse selleks aluselisuskonstanti Kb – aluse ja võrdlushappe reaktsiooni tasakaalukonstanti, mille jaoks valitakse vesi. Mida kõrgem on aluselisuskonstant, seda suurem on aluse tugevus ja seda suurem on selle võime prootonit abstraheerida. Sageli väljendatakse aluselisuskonstanti aluselisuskonstandi eksponendina pKb. Näiteks ammoniaagi kui Brønstedi alusena võime kirjutada:

Ostwaldi lahjendusseadus on seos, mis väljendab binaarse nõrga elektrolüüdi lahjendatud lahuse ekvivalentse elektrijuhtivuse sõltuvust lahuse kontsentratsioonist: ![]()
Siin K on elektrolüüdi dissotsiatsioonikonstant, c on kontsentratsioon, λ ja λ∞ on vastavalt ekvivalentse elektrijuhtivuse väärtused kontsentratsioonil c ja lõpmatu lahjenduse korral. Suhe on massilise tegevuse ja võrdsuse seaduse tagajärg, kus α on dissotsiatsiooniaste.
30. Vesi on nõrk elektrolüüt. Vee ioonne saadus. PH. POh
Vee ioonsaadus on vesinikioonide H+ ja hüdroksüülioonide OH− kontsentratsioonide korrutis vees või vesilahustes, vee autoprotolüüsi konstant.
Kuigi vesi on nõrk elektrolüüt, dissotsieerub see vähesel määral:
Selle reaktsiooni tasakaal on tugevalt nihkunud vasakule. Vee dissotsiatsioonikonstandi saab arvutada järgmise valemi abil:
![]()
hüdrooniumioonide (prootonite) kontsentratsioon;
Hüdroksiidioonide kontsentratsioon;
Vee kontsentratsioon (molekulaarsel kujul) vees;
Vee kontsentratsioon vees, arvestades selle madalat dissotsiatsiooniastet, on praktiliselt konstantne ja moodustab (1000 g/l)/(18 g/mol) = 55,56 mol/l.
25 °C juures on vee dissotsiatsioonikonstant 1,8·10−16 mol/l. Võrrandi (1) saab ümber kirjutada järgmiselt:
Tähistame korrutist K· = K in = 1,8·10–16 mol/l·55,56 mol/l = 10–14 mol/l² = · (temperatuuril 25 °C).
Konstanti K in, mis võrdub prootonite ja hüdroksiidioonide kontsentratsioonide korrutisega, nimetatakse vee ioonsaaduseks. See on konstantne mitte ainult puhta vee, vaid ka ainete lahjendatud vesilahuste puhul. Temperatuuri tõustes suureneb vee dissotsiatsioon, seetõttu suureneb ka Kv, temperatuuri langedes - vastupidi.
Vesinikuindeks, pH - vesinikioonide aktiivsuse mõõt lahuses ja väljendab kvantitatiivselt selle happesust, arvutatakse vesinikioonide aktiivsuse negatiivse (vastupidise märgiga) kümnendlogaritmina, väljendatuna moolides liitri kohta:
Pöördväärtus pH on mõnevõrra vähem levinud - lahuse aluselisuse näitaja pOH, mis on võrdne OH-ioonide kontsentratsiooni negatiivse kümnendlogaritmiga lahuses:
Linkimistase:
Üldjuhul, vastavalt Bronsted-Lowry protolüütilisele teooriale, on võrrandi (4.2) kohaselt nõrga monoprootse happe dissotsiatsiooniks:
Tõeline termodünaamiline konstant TO see tasakaal saab olema
kus kõik tegevused on tasakaalus. Kujutagem ette seda suhet kujul:
Tähistagem, nagu ka eelmisel juhul, kahe konstandi korrutist TO ja a(H2O) kuni (H2O) = konst T= konst. Siis
või ligikaudu:
kus kõik kontsentratsioonid on tasakaalus. Siin on väärtus TO A helistas happe dissotsiatsiooni (ionisatsiooni) konstant või lihtsalt happesuse konstant.
Paljude nõrkade hapete arvväärtused TO A on väga väikesed, nii et suuruse asemel TO A kohaldada tugevusnäidik (või lihtsalt indikaator):
rK A =- lg TO A .
Rohkem TO A(st mida vähem lk TO A ), mida tugevam on hape.
Olgu ühealuselise happe HB algkontsentratsioon võrdne selle dissotsiatsiooni (ionisatsiooni) astmega lahuses. Siis on ioonide [H 3 O + ] ja [B - ] tasakaalukontsentratsioonid võrdsed [H 3 O + ] = [B - ] = αс A , happe tasakaalukontsentratsioon [НВ] = Koos A - α Koos A = Koos A(1 - α). Asendades need tasakaalukontsentratsioonide väärtused tasakaalukonstandi (4.10) avaldisesse, saame:
Kui keskendumise asemel Koos A kasutada selle pöördvõrdelist V- lahjendus (lahjendus), väljendatud l/mol, V=1/Koos A , siis valem TO A näeb välja selline:
See seos ja ka väljend
kirjeldada Ostwaldi lahjendusseadus (või lahjendusseadus) nõrga binaarse elektrolüüdi jaoks. A1 juures (tüüpiline juhtum paljudes analüütilistes süsteemides)
On lihtne näidata, et üldiselt nõrga elektrolüüdi mis tahes koostisega K n A m korral, mis laguneb ioonideks vastavalt skeemile
K n A m = P TO t+ +t A n -
Ostwaldi lahjendusseadust kirjeldab seos
Kus Koos- nõrga elektrolüüdi, näiteks nõrga happe algkontsentratsioon. Niisiis, ortofosforhappe H 3 PO 4 jaoks (P = 3,
T= 1), mis vastavalt skeemile laguneb täielikult ioonideks

![]() .
.
Binaarse elektrolüüdi puhul on seos (4.11). A1 jaoks on meil:
Leiame ühealuselise happe NV lahuse tasakaalu pH väärtuse. Vesinikuioonide tasakaalukontsentratsioon
Kasutades tähistust ja saame:
pH = 0,5 (r TO A+lk Koos A). (4.12)
Seega on nõrga monoprootse happe lahuse pH tasakaalu arvutamiseks vaja teada selle happe happesuse konstanti TO A ja selle esialgne kontsentratsioon Koos A .
Arvutame 0,01 mol/l algkontsentratsiooniga äädikhappe lahuse pH.
Toatemperatuuril äädikhappe jaoks TO A = 1,74·10 -5 ja lk TO A = 4,76.
Valemi (4.12) järgi võime kirjutada:
pH = 0,5 (lk TO A+lk Koos A) = 0,5(476-0,01) = 0,5(4,76+2) = 3,38.
Sarnase kaalutluse võib läbi viia ka mis tahes nõrga lahenduse tasakaalu suhtes mitmealuseline happed.
Polüaluselised happed dissotsieeruvad ioonideks järk-järgult, mitmes etapis, millest igaüht iseloomustab oma tasakaalukonstant astmeline happe dissotsiatsioonikonstant. Näiteks ortoboorhappe lahustes luuakse H 3 BO 3 tasakaalud (konstantsed väärtused on antud temperatuuril 25 ° C):
H 3 VO 3 + H 2 O = H 3 O + +, TO 1
= ![]()
H 2 O = H 3 O + +, TO 2
= ![]()
H 2 O = H 3 O + +, TO 3 =
Iga järgneva etapi happe dissotsiatsioonikonstant on väiksem kui eelmise etapi dissotsiatsioonikonstant – tavaliselt mitme suurusjärgu võrra.
Kõigi järkjärguliste dissotsiatsioonikonstantide korrutis on võrdne kogu happe dissotsiatsioonikonstandiga K:
TO 1 TO 2 ...TO P =K.
Seega on lihtne näha, et ortoboorhappe väärtus
TO 1
TO 2
TO 3
=K= ![]()
on olemas täielik happe dissotsiatsioonikonstant vastavalt skeemile:
4.3.2 Nõrkade aluste lahuste aluselisuskonstant ja pH
Vastavalt Brønsted-Lowry hapete ja aluste protolüütilisele teooriale võime üldiselt ühehappelise nõrga aluse B ioniseerimiseks vesilahustes kirjutada:
B + H 2 O = HB + + OH -
Kui aluse ionisatsiooniaste on a1, võib selle keemilise tasakaalu konstandiks võtta kontsentratsioonikonstandi
Toimides sarnaselt eelmisele, saame:
TO = =K b = konst millal T= konst
kui kahe konstandi korrutis TO=konst ja [H2O] = konst.
Nimetagem kogust K b , võrdne seega
K b = , (4.13)
nõrga ühehappelise aluse dissotsiatsiooni (ionisatsiooni) konstantvõilihtsalt põhilisuse konstant see alus ja suurusjärk
lk K b = K b ,
Aluselisuse konstandi tugevusnäitaja (või lihtsalt indikaator).
Vastavalt Ostwaldi lahjendusseadusele vaadeldaval juhul (sarnaselt seosega (4.11))
K b =,
kus on ühehappelise nõrga aluse ionisatsiooniaste ja selle algkontsentratsioon. Kuna nõrga aluse jaoks a1, siis
Leiame vaadeldava monohappealuse vesilahuse tasakaalulise pH väärtuse toatemperatuuril. Vastavalt valemile (4.7) on meil:
pH = p TO w - pOH = 14 - pOH.
Määrame väärtuse pOH = [OH - ]. Ilmselgelt
[OH-] = = ![]()
Kasutades indikaatoreid pOH = [OH - ], lk TO b =K b Ja
p = , saame: pOH = 0,5 (p TO b+ p). Asendades selle avaldise ülaltoodud pH valemiga, jõuame seoseni
pH = 14 - pOH = 14 - 0,5 (lk TO b+ p).
Seega saab nõrga ühehappelise aluse lahuse tasakaalu pH väärtuse arvutada valemi (4.15) abil:
pH = 14-0,5 (lk TO b+ p). (4.15)
Arvutame pH 0,01 mol/l ammoniaagi vesilahuses, mille jaoks toatemperatuuril TO b= ja lk TO b = 4,76.
Ammoniaagi vesilahuses saavutatakse tasakaal:
mis on enamasti nihutatud vasakule, nii et ammoniaagi ionisatsiooniaste on . Seetõttu võite pH väärtuse arvutamiseks kasutada seost (4.15):
pH = 14-0,5 (lk TO b+ p) =
Sarnase kaalutluse võib läbi viia iga nõrga inimese puhul polühape põhjustel. Tõsi, selle tulemuseks on tülikamad väljendid.
Nõrgad polühappealused, nagu ka nõrgad mitmealuselised happed, dissotsieeruvad astmeliselt ja igal dissotsiatsiooniastmel on ka oma aluse astmeline dissotsiatsioonikonstant – astmeline aluselisuskonstant.
Näiteks pliihüdroksiid Pb(OH) 2 laguneb vesilahustes ioonideks kahes etapis:
![]()
Samad tasakaalud saab kirjutada ka muul viisil, järgides (protolüütilise teooria raames) aluse kui prootonit siduva aine definitsiooni, antud juhul võttes selle vastu veemolekulilt:
Astmelise aluselisuskonstandid saab esitada järgmisel kujul:
![]()
![]()
Selle näidatud tasakaalude registreerimisega eeldatakse, et veemolekulist pärit prooton läheb hüdroksüülrühma, moodustades veemolekuli (), mille tulemusena suureneb veemolekulide arv plii (II) aatomi läheduses. suureneb ühe võrra ja plii (II) aatomiga seotud hüdroksüülrühmade arv ), väheneb samuti ühe võrra igal dissotsiatsioonietapil.
Töö TO 1 TO 2 =K=[Pb2+][OH-]2/[Pb(OH)2] =
2.865, kus TO- summaarne dissotsiatsioonikonstant vastavalt skeemile
või mõne muu kirja pandud skeemi järgi
mis lõpuks viib sama tulemuseni.
Teine näide on orgaaniline alus etüleendiamiin, mis ioniseerub vesilahuses kahes etapis. Esimene aste:
![]()
Teine etapp:
![]()
Töö ![]() -
-
täielik dissotsiatsioonikonstant. See vastab tasakaalule
Tasakaalukonstantide arvväärtused on toodud ülalpool toatemperatuuri kohta.
Nagu mitmealuseliste hapete puhul, on nõrga polühappealuse korral iga järgneva etapi dissotsiatsioonikonstant tavaliselt mitu suurusjärku väiksem kui eelmise etapi dissotsiatsioonikonstant.
Tabelis. Tabelis 4.2 on toodud mõnede nõrkade hapete ja aluste happesuse ja aluselisuse konstantide arvväärtused.
Tabel 4.2. Tõelised termodünaamilised ionisatsioonikonstandid mõnede hapete ja aluste vesilahustes.
TO A- konstantne happesus, TO b- aluselisuskonstant,
TO 1 - esimese sammu dissotsiatsioonikonstant,
TO 2
- dissotsiatsioonikonstant teise sammu jaoks jne.
| Nõrkade hapete dissotsiatsioonikonstandid |
||
| Hape | TO A | R TO A=-lg TO A |
| Lämmastikku sisaldav Aminoäädikhape Benzoinaya Boor (ortoboor) Tetraboric Protolüütiliste reaktsioonide tüübid. MU "Lahendused" lk 52-55 Vee autoprotolüüs. Vee ioonne saadus.MU "Lahendused"» lk 56 Väike osa veemolekulidest on alati ioonses olekus, kuigi tegemist on väga nõrga elektrolüüdiga. Vee ioniseerimist ja edasist dissotsiatsiooni, nagu juba mainitud, kirjeldatakse happe-aluse disproportsiooni ehk autoprotolüüsi protolüütilise reaktsiooni võrrandiga. Vesi on väga nõrk elektrolüüt, seetõttu on moodustunud konjugeeritud hape ja konjugeeritud alus tugevad. Seetõttu nihutatakse selle protolüütilise reaktsiooni tasakaal vasakule. Selle tasakaalu konstant K on võrdne = Veeioonide kontsentratsiooni × korrutise kvantitatiivne väärtus on vee ioonne saadus. See on võrdne: × = K võrdne. × 2 = 1 × 10–14 Seega: KH 2O = × = 10–14 või lihtsustatud KH 2O = × = 10–14 KH2O on vee ioonprodukt, vee autoprotolüüsi konstant või lihtsalt vee konstant. KH2O sõltub temperatuurist. See suureneb temperatuuri tõustes. Keemiliselt puhtas vees = = = 1×10 – 7. See on neutraalne keskkond. Lahus võib sisaldada > – keskkond on happeline või< – среда щелочная = ; = pH väärtus Lahuste happesuse kvantitatiivseks väljendamiseks kasutage vesinikioonide kontsentratsiooni indikaator pH. Vesinikuindeks on väärtus, mis võrdub vabade vesinikuioonide kontsentratsiooni negatiivse kümnendlogaritmiga lahuses. pH = – log ⇒ = 10 – pH Neutraalses keskkonnas pH = 7 Happelise pH juures< 7 Leeliselise pH väärtusega > 7 Söötme aluselisuse iseloomustamiseks kasutatakse hüdroksüülindikaatorit pOH рОН = – log [ОH - ] ⇒ [ОH - ] = 10 – рОН pH + pOH = 14 Þ pH = 14 – pOH ja pOH = 14 – pH Valemid hapete ja aluste lahuste pH arvutamiseks. pH = – log
Arvutage HCl lahuse pH, mille C(HCl) = 0,1 mol/l selle täieliku dissotsiatsiooni tingimustes. C(HCl) = 0,1 mol/l; pH = – log 0,1 = 1 2. Tugevad alused: [ОH - ] = С(1/z alus) Arvutage samadel tingimustel NaOH lahuse pH. C(NaOH) = 0,1 mol/l; = = 10–13; pH = – log 10 – 13 = 13 3. Nõrgad happed Arvutage 0,5 mol/l molaarse kontsentratsiooniga äädikhappe lahuse pH. K CH 3COOH = 1,8 × 10–5. 3 × 10-3 pH = – log 3×10 – 3 = 2,5 4. Nõrgad alused Arvutage 0,2 mol/l molaarse kontsentratsiooniga ammoniaagilahuse pH. K NН 3 = 1,76 × 10 – 5 1,88 × 10 – 3 0,53 × 10 – 11; pH = – log 0,53×10 – 11 = 11,3 5. C(H +) = [H + ] = 10 – pH pH = 7 juures [H + ] = 10–7 PH määramiseks on erinevaid meetodeid: indikaatorite ja ionomeerseadmete kasutamine. PH väärtus keemiliste reaktsioonide ja biokeemiliste protsesside jaoks kehas. Paljud reaktsioonid nõuavad kindlas suunas kulgemiseks rangelt määratletud pH väärtust. Tavaliselt on terves kehas enamiku bioloogiliste vedelike keskkonna reaktsioon neutraalsele lähedane. Veri – 7,4 Sülg – 6,6 Soolemahl – 6,4 Sapp – 6,9 Uriin – 5,6 Maomahl: a) rahuolekus – 7,3 b) seedimise seisundis – 1,5-2 PH kõrvalekaldumisel normist on diagnostiline (haiguse definitsioon) ja prognostiline (haiguse kulg) tähendus. Atsidoos on pH nihkumine happelisele poolele, pH langeb, vesinikioonide kontsentratsioon suureneb. Alkaloos on pH nihkumine aluselisesse piirkonda, pH tõuseb ja vesinikioonide kontsentratsioon väheneb. Vere pH ajutine kõrvalekalle normist kümnendiku võrra toob kaasa tõsiseid häireid organismis. Vere pH pikaajalised kõrvalekalded võivad lõppeda surmaga. Vere pH kõrvalekalded võivad olla 6,8–8; muutused väljaspool seda vahemikku mis tahes suunas ei sobi kokku eluga. Kombineeritud ja isoleeritud protolüütilised tasakaalud. Protolüütilised protsessid on pöörduvad reaktsioonid. Protolüütiline tasakaal nihkub nõrgemate hapete ja aluste moodustumise suunas. Neid võib pidada erineva tugevusega aluste vaheliseks võistluseks prootoni omamise nimel. Nad räägivad isoleeritud ja kombineeritud tasakaalust. Kui mitu samaaegselt eksisteerivat tasakaalu on üksteisest sõltumatud, nimetatakse neid isoleeritud. Tasakaalu nihe ühes neist ei too kaasa teise tasakaaluasendi muutumist. Kui tasakaalu muutus ühes neist toob kaasa tasakaalu muutuse teises, siis räägime kombineeritud (konjugeeritud, konkureerivatest) tasakaaludest. Kombineeritud tasakaaluga süsteemides on domineeriv protsess, mida iseloomustab tasakaalukonstandi suurem väärtus. Valdav on teine protsess, sest selle tasakaalukonstant on suurem kui esimese protsessi tasakaalukonstant. Tasakaal teises protsessis nihkub suuremal määral paremale, sest metüülamiin on tugevam alus kui ammoniaak, NH 4 + on tugevam hape kui CH 3 NH 3 +. Järeldus: Tugevam alus pärsib nõrgema aluse ionisatsiooni. Seetõttu, kui ammoniaagi ja metüülamiini segule lisatakse väike kogus vesinikkloriidhapet, toimub protoneerimisel peamiselt metüülamiin. Ja veel: tugevaim hape pärsib nõrkade hapete ionisatsiooni. Seega pärsib maomahlas leiduv vesinikkloriidhape äädikhappe (saab toidust) või atsetüülsalitsüülhappe (ravimaine) ionisatsiooni. ______________________________________________________________ Sarnased postitused
| ||