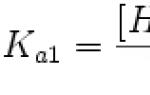Kaalium. Kaaliumi omadused. Kaaliumi kasutusalad Kus leidub kaaliumi looduses?
Kaalium on esimese rühma, keemiliste elementide perioodilisuse tabeli neljanda perioodi põhialarühma element aatomnumbriga 19. Tähistatakse sümboliga K (lat. Kalium). Lihtaine kaalium (CAS number: 7440-09-7) on pehme hõbevalge värvusega leelismetall.
Looduses leidub kaaliumi ainult koos teiste elementidega, näiteks merevees, aga ka paljudes mineraalides. See oksüdeerub õhu käes väga kiiresti ja väga kergesti keemilistesse reaktsioonidesse, eriti veega, moodustades leelise. Kaaliumi keemilised omadused on paljuski väga sarnased naatriumile, kuid bioloogilise funktsiooni ja elusorganismide rakkude kasutuse poolest on need siiski erinevad.
Nime ajalugu ja päritolu
Kaaliumit (täpsemalt selle ühendeid) on kasutatud juba iidsetest aegadest. Seega eksisteeris kaaliumkloriidi (mida kasutati pesuvahendina) tootmine juba 11. sajandil. Põhu või puidu põletamisel tekkinud tuhk töödeldi veega ja saadud lahus (leelis) aurustati pärast filtreerimist. Kuiv jääk sisaldas lisaks kaaliumkarbonaadile kaaliumsulfaati K2SO4, soodat ja kaaliumkloriidi KCl.
1807. aastal eraldas inglise keemik Davy kaaliumi sula kaaliumhüdroksiidi (KOH) elektrolüüsi teel ja nimetas selle "kaaliumiks" (ladina kaalium; seda nimetust kasutatakse siiani inglise, prantsuse, hispaania, portugali ja poola keeles). Aastal 1809 pakkus L. V. Gilbert välja nimetuse "kaalium" (ladina kalium, araabia keelest al-kali - kaalium). See nimi sisenes saksa keelde, sealt enamikesse Põhja- ja Ida-Euroopa keeltesse (sh vene keelde) ja "võitis" selle elemendi sümboli valimisel - K.
Kviitung
Kaalium, nagu ka teised leelismetallid, saadakse sulatatud kloriidide või leeliste elektrolüüsil. Kuna kloriididel on kõrgem sulamistemperatuur (600–650 °C), teostatakse sirgendatud leeliste elektrolüüsi sagedamini sooda või kaaliumkloriidi lisamisega (kuni 12%). Sulanud kloriidide elektrolüüsi käigus eraldub katoodil sula kaalium ja anoodil kloor:
K + + e - → K
2Cl - - 2e - → Cl 2
Leeliste elektrolüüsi käigus eraldub katoodil ka sula kaalium ja anoodil hapnik:
4OH - - 4e - → 2H 2O + O 2
Sulatusest tulev vesi aurustub kiiresti. Et kaalium ei suhtleks kloori või hapnikuga, on katood valmistatud vasest ja selle kohale asetatakse vasesilinder. Saadud kaalium kogutakse sula kujul silindrisse. Anood on valmistatud ka nikli silindri kujul (leeliste elektrolüüsiks) või grafiidist (kloriidide elektrolüüsiks).
Füüsikalised omadused
Kaalium on hõbedane aine, millel on värskelt moodustunud pinnal iseloomulik läige. Väga kerge ja sulav. See lahustub suhteliselt hästi elavhõbedas, moodustades amalgaame. Kui põleti leegile lisada kaaliumi (nagu ka selle ühendeid), värvib see leegi iseloomulikuks roosakasvioletseks värviks.
Keemilised omadused
Elementaarsel kaaliumil, nagu ka teistel leelismetallidel, on tüüpilised metallilised omadused ning see on keemiliselt väga aktiivne ja tugev redutseerija. Õhus tuhmub värske lõige kiiresti, kuna moodustuvad ühendid (oksiidid ja karbonaat). Pikaajalisel kokkupuutel atmosfääriga võib see täielikult kokku kukkuda. Reageerib plahvatuslikult veega. Seda tuleb hoida bensiini, petrooleumi või silikoonikihi all, et vältida õhu ja vee kokkupuudet selle pinnaga. Kaalium moodustab intermetallilisi ühendeid Na, Tl, Sn, Pb, Bi-ga.
Kaaliumiühendid, nagu ka selle lähim keemiline analoog - naatrium, on tuntud juba iidsetest aegadest ja leidnud rakendust erinevates inimtegevuse valdkondades. Need metallid ise eraldati aga esmakordselt vabas olekus alles 1807. aastal inglaste katsete käigus. teadlane G. Davy. Kergelt niisutatud tahkete leeliste elektrolüüsil saadi vabad metallid - kaalium ja naatrium. Davy nimetas uut metalli kaaliumiks, kuid see nimi ei jäänud külge.
Metalli ristiisaks osutus ajakirja "Annalen de Physik" kuulus väljaandja Gilbert, kes pakkus välja nime "kaalium"; see võeti vastu Saksamaal ja Venemaal. Mõlemad nimed pärinevad terminitest, mida kasutati ammu enne kaaliummetalli avastamist.
Sõna kaalium on tuletatud sõnast potas, mis ilmus arvatavasti 16. sajandil. Seda leidub 17. sajandi teisel poolel Van Helmontis. kasutatakse Venemaal, Inglismaal ja Hollandis laialdaselt kaubandusliku toote - kaaliumkloriid - nimetusena. Vene keelde tõlgituna tähendab sõna potashe “poti- või potis keedetud tuhk”; XVI-XVII sajandil. kaaliumkloriidi saadi tohututes kogustes puutuhast, mida keedeti suurtes kateldes. Kaaliumkloriidist valmistati peamiselt litereeritud (puhastatud) salpeetrit, millest valmistati püssirohtu. Eriti palju kaaliumkloriidi toodeti Venemaal, Arzamase ja Ardatovi lähedal asuvates metsades mobiilsetes tehastes (Maidans), mis kuulusid tsaar Aleksei Mihhailovitši sugulasele, lähedasele bojaarile B. I. Morozovile.
Mis puutub sõna kaalium, siis see pärineb araabiakeelsest terminist leelis (leeliselised ained). Keskajal ei olnud leelised või, nagu tollal öeldi, leeliselised soolad üksteisest peaaegu eristamatud ja neid kutsuti samatähenduslike nimedega: natron, booraks, varek jne. Leiti sõna kali (qila). umbes 850 araabia kirjanikku, siis hakati kasutama sõna Qali (al-Qali), mis tähistas mõne taime tuhast saadud toodet, nende sõnadega on seotud araabia qiljin ehk qaljan (tuhk) ja qalaj (põletus). Atrokeemia ajastul hakati leeliseid jagama "fikseeritud" ja "lenduvateks". 17. sajandil Seal on nimetused alkali fixum minerale (mineraalne fikseeritud leelis ehk seebikivi), alkali fixum. taimne (taimne fikseeritud leelis ehk kaalium ja kaalium), samuti lenduv leelis (lenduv leelis või NH3). Must tegi vahet söövitavate ja pehmete ehk süsivesinike leeliste vahel. Lihtkehade tabelis leelised ei esine, kuid tabeli märkuses viitab Lavoisier, et fikseeritud leelised (kaalium ja sooda) on tõenäoliselt kompleksained, kuigi nende koostisosi pole veel uuritud. 19. sajandi esimese veerandi vene keemiakirjanduses. kaaliumit nimetati kaaliumiks (Solovjev, 1824), kaliimiks (Strakhovoy, 1825), kaliumiks (Štšeglov, 1830); "Dvigubsky poes" leidub juba 1828. aastal koos nimetusega kaalium (kaaliumsulfaat) kaalium (kaustiline kaalium, soolakaalium jne). Nimetus kaalium sai üldtunnustatud pärast Hessi õpiku ilmumist.
| Aatomnumber | |
| Lihtsa aine välimus |
Hõbevalge pehme metall |
| Aatomi omadused | |
| Aatommass (moolmass) |
39,0983 a. e.m. (g/mol) |
| Aatomi raadius | |
| Ionisatsioonienergia (esimene elektron) |
418,5 (4,34) kJ/mol (eV) |
| Elektrooniline konfiguratsioon | |
| Keemilised omadused | |
| Kovalentne raadius | |
| Ioonide raadius | |
| Elektronegatiivsus (Paulingu järgi) |
|
| Elektroodi potentsiaal | |
| Oksüdatsiooniseisundid | |
| Lihtsa aine termodünaamilised omadused | |
| Tihedus | |
| Molaarne soojusmahtuvus |
29,6 J/(K mol) |
| Soojusjuhtivus |
79,0 W/(m K) |
| Sulamistemperatuur | |
| Sulamissoojus |
102,5 kJ/mol |
| Keemistemperatuur | |
| Aurustumissoojus |
2,33 kJ/mol |
| Molaarne maht |
45,3 cm³/mol |
| Lihtaine kristallvõre | |
| Võre struktuur |
kuubiku kehakeskne |
| Võre parameetrid | |
| c/a suhe | — |
| Debye temperatuur | |
| K | 19 |
| 39,0983 | |
| 4s 1 | |
- D.I.Mendelejevi keemiliste elementide perioodilise süsteemi esimese rühma põhialarühma element, aatomnumbriga 19. Tähistatakse sümboliga K (lat. Kalium). Lihtaine kaalium (CAS number: 7440-09-7) on pehme hõbevalge värvusega leelismetall. Looduses leidub kaaliumi ainult koos teiste elementidega, näiteks merevees, aga ka paljudes mineraalides. See oksüdeerub õhu käes väga kiiresti ja väga kergesti keemilistesse reaktsioonidesse, eriti veega, moodustades leelise. Kaaliumi keemilised omadused on paljuski väga sarnased naatriumile, kuid bioloogilise funktsiooni ja elusorganismide rakkude kasutuse poolest on need siiski erinevad. Kaaliumnimetuse ajalugu ja päritolu
Kaaliumit (täpsemalt selle ühendeid) on kasutatud juba iidsetest aegadest. Seega eksisteeris kaaliumkloriidi (mida kasutati pesuvahendina) tootmine juba 11. sajandil. Põhu või puidu põletamisel tekkinud tuhk töödeldi veega ja saadud lahus (leelis) aurustati pärast filtreerimist. Kuiv jääk sisaldas lisaks kaaliumkarbonaadile kaaliumsulfaati K2SO4, soodat ja kaaliumkloriidi KCl.
Inglise keemik Davy eraldas 1807. aastal tahke kaaliumhüdroksiidi (KOH) elektrolüüsi teel kaaliumi ja andis sellele nime "kaalium"(lat. kaalium; seda nimetust kasutatakse siiani inglise, prantsuse, hispaania, portugali ja poola keeles). Aastal 1809 pakkus L. V. Gilbert välja nime "kaalium" (lat. kaalium, araabia keelest. al-kali – kaaliumkloriid). See nimi sisenes saksa keelde, sealt enamikesse Põhja- ja Ida-Euroopa keeltesse (sh vene keelde) ja "võitis" selle elemendi sümboli valimisel - K.
Kaaliumi olemasolu looduses
Ei leitud vabas olekus. Kaalium on osa sylviniidist KCl NaCl, karnalliitist KCl MgCl 2 6H 2 O, kainiidist KCl MgSO 4 6H 2 O ning esineb ka osade taimede tuhas karbonaadi K 2 CO 3 (kaaliumkloriid) kujul. Kaaliumi leidub kõigis rakkudes (vt allolevat jaotist Bioloogiline roll).
Kaalium - kaaliumi saamine
Kaalium, nagu ka teised leelismetallid, saadakse sulatatud kloriidide või leeliste elektrolüüsil. Kuna kloriididel on kõrgem sulamistemperatuur (600–650 °C), teostatakse sirgendatud leeliste elektrolüüsi sagedamini sooda või kaaliumkloriidi lisamisega (kuni 12%). Sulanud kloriidide elektrolüüsi ajal eraldub katoodil sula kaalium ja anoodil kloor:
K + + e − → K
2Cl − − 2e − → Cl 2
Leeliste elektrolüüsi käigus eraldub katoodil ka sula kaalium ja anoodil hapnik:
4OH − − 4e − → 2H 2 O + O 2
Sulatusest tulev vesi aurustub kiiresti. Et kaalium ei suhtleks kloori või hapnikuga, on katood valmistatud vasest ja selle kohale asetatakse vasesilinder. Saadud kaalium kogutakse sula kujul silindrisse. Anood on valmistatud ka nikli silindri kujul (leeliste elektrolüüsiks) või grafiidist (kloriidide elektrolüüsiks).
Kaaliumi füüsikalised omadused
Kaalium on hõbedane aine, millel on värskelt moodustunud pinnal iseloomulik läige. Väga kerge ja sulav. See lahustub suhteliselt hästi elavhõbedas, moodustades amalgaame. Kui põleti leegile lisada kaaliumi (nagu ka selle ühendeid), värvib see leegi iseloomulikuks roosakasvioletseks värviks.
Kaaliumi keemilised omadused
Kaaliumil, nagu ka teistel leelismetallidel, on tüüpilised metallilised omadused ja see on keemiliselt väga aktiivne, annetades kergesti elektrone.
On tugev redutseerija. See ühineb hapnikuga nii aktiivselt, et moodustub mitte oksiid, vaid kaaliumsuperoksiid KO 2 (või K 2 O 4). Vesiniku atmosfääris kuumutamisel moodustub kaaliumhüdriid KH. See interakteerub hästi kõigi mittemetallidega, moodustades halogeniide, sulfiide, nitriide, fosfiide jne, aga ka keeruliste ainetega nagu vesi (reaktsioon toimub plahvatuslikult), erinevad oksiidid ja soolad. Sel juhul taandavad nad teised metallid vabasse olekusse.
Kaaliumi hoitakse petrooleumikihi all.
Kaaliumoksiidid ja kaaliumperoksiidid
Kui kaalium reageerib õhuhapnikuga, ei moodusta see mitte oksiidi, vaid peroksiidi ja superoksiidi:
kaaliumoksiid võib saada metalli kuumutamisel temperatuurini kuni 180 °C väga vähese hapnikusisaldusega keskkonnas või kaalium-superoksiidi ja kaaliummetalli segu kuumutamisel:
Kaaliumoksiididel on väljendunud aluselised omadused ja nad reageerivad ägedalt vee, hapete ja happeoksiididega. Praktilist tähtsust neil pole. Peroksiidid on kollakasvalged pulbrid, mis vees lahustuvad moodustavad leeliseid ja vesinikperoksiidi:
Süsinikdioksiidi hapniku vastu vahetamise võimalust kasutatakse gaasimaskide isoleerimisel ja allveelaevadel. Absorberina kasutatakse kaalium-superoksiidi ja naatriumperoksiidi ekvimolaarset segu. Kui segu ei ole ekvimolaarne, siis naatriumperoksiidi liia korral neeldub rohkem gaasi kui vabaneb (kahe mahuosa CO 2 neelamisel eraldub üks ruumala O 2) ja rõhk kinnises ruumis. langeb ja kaalium-superoksiidi liia korral (kahe mahuosa CO 2 neelamisel eraldub kolm mahtu O2) eraldub rohkem gaasi kui neeldub ja rõhk tõuseb.
Ekvimolaarse segu korral (Na 2 O 2:K 2 O 4 = 1:1) on neeldunud ja eralduvate gaaside mahud võrdsed (nelja mahuosa CO 2 neeldumisel vabaneb neli mahtu O 2 ).
Peroksiidid on tugevad oksüdeerijad, seetõttu kasutatakse neid tekstiilitööstuses kangaste pleegitamiseks.
Peroksiide saadakse metallide kaltsineerimisel süsinikdioksiidist vabastatud õhus.
Kaaliumhüdroksiidid
Kaaliumhüdroksiid (või söövitav kaaliumkloriid) on kõvad valged läbipaistmatud väga hügroskoopsed kristallid, mis sulavad temperatuuril 360 °C. Kaaliumhüdroksiid on leelis. See lahustub hästi vees ja eraldab suurel hulgal soojust. Kaaliumhüdroksiidi lahustuvus 20 °C juures 100 g vees on 112 g.
Kaaliumi kasutamine
- Toatemperatuuril vedelat kaaliumi ja naatriumi sulamit kasutatakse jahutusvedelikuna suletud süsteemides, näiteks kiirneutronite tuumaelektrijaamades. Lisaks kasutatakse laialdaselt selle vedelaid sulameid rubiidiumi ja tseesiumiga. Naatriumi 12%, kaaliumi 47%, tseesiumi 41% sulamil on rekordmadal sulamistemperatuur –78 °C.
- Kaaliumiühendid on kõige olulisem biogeenne element ja seetõttu kasutatakse neid väetisena.
- Kaaliumsoolasid kasutatakse galvaniseerimisel laialdaselt, kuna vaatamata nende suhteliselt kõrgele hinnale on nad sageli lahustuvamad kui vastavad naatriumisoolad ja tagavad seetõttu elektrolüütide intensiivse töö suurema voolutihedusega.
Olulised ühendused
Kaaliumiioonide lilla värvusega leek põleti leegis
- Kaaliumbromiidi kasutatakse meditsiinis ja närvisüsteemi rahustina.
- Kaaliumhüdroksiid (kaustiline kaaliumkloriid) – kasutatakse leelispatareides ja gaaside kuivatamisel.
- Kaaliumkarbonaat (kaaliumkloriid) – kasutatakse klaasi valmistamisel väetisena.
- Kaaliumkloriid (sylvin, "kaaliumsool") - kasutatakse väetisena.
- Kaaliumnitraat (kaaliumnitraat) on väetis, musta pulbri komponent.
- Kaaliumperkloraati ja kloraati (Bertholet soola) kasutatakse tikkude, raketipulbrite, valgustuslaengute, lõhkeainete tootmisel ja galvaniseerimisel.
- Kaaliumdikromaat (kromaatiline) on tugev oksüdeerija, mida kasutatakse “kroomisegu” valmistamiseks keemiliste nõude pesemiseks ja naha töötlemiseks (parkimiseks). Seda kasutatakse ka atsetüleeni puhastamiseks atsetüleenitehastes ammoniaagist, vesiniksulfiidist ja fosfiinist.
- Kaaliumpermanganaat on tugev oksüdeerija, mida kasutatakse antiseptikuna meditsiinis ja hapniku laboratoorseks tootmiseks.
- Naatriumkaaliumtartraat (Rochelle'i sool) piesoelektrilise ainena.
- Kaaliumdivesinikfosfaat ja dideuterofosfaat üksikute kristallide kujul lasertehnoloogias.
- Kaaliumperoksiidi ja kaalium-superoksiidi kasutatakse õhu regenereerimiseks allveelaevades ja isoleerivates gaasimaskides (absorbeerib süsinikdioksiidi hapniku vabastamiseks).
- Kaaliumfluoroboraat on oluline räbustik terase ja värviliste metallide jootmisel.
- Kaaliumtsüaniidi kasutatakse galvaniseerimisel (hõbedamine, kullamine), kulla kaevandamisel ja terase nitrokarburiseerimisel.
- Kaaliumi koos kaaliumperoksiidiga kasutatakse vee termokeemilisel lagundamisel vesinikuks ja hapnikuks (kaaliumtsükkel "Gaz de France", Prantsusmaa).
Bioloogiline roll
Kaalium on kõige olulisem biogeenne element, eriti taimemaailmas. Kui mullas on kaaliumipuudus, arenevad taimed väga halvasti, saagikus väheneb, seetõttu kasutatakse umbes 90% ekstraheeritud kaaliumisooladest väetisena.
Kaalium inimkehas
Kaaliumi leidub enamasti rakkudes, kuni 40 korda rohkem kui rakkudevahelises ruumis. Rakkude funktsioneerimisel väljub liigne kaalium tsütoplasmast, nii et kontsentratsiooni säilitamiseks tuleb see läbi naatrium-kaaliumpumba tagasi pumbata.
Kaalium ja naatrium on üksteisega funktsionaalselt seotud ja täidavad järgmisi funktsioone:
- Tingimuste loomine membraanipotentsiaali ja lihaste kontraktsioonide tekkeks.
- Vere osmootse kontsentratsiooni säilitamine.
- Happe-aluse tasakaalu säilitamine.
- Veetasakaalu normaliseerimine.
- Membraani transpordi tagamine.
- Erinevate ensüümide aktiveerimine.
- Südame rütmi normaliseerimine.
Soovitatav kaaliumi ööpäevane annus on lastele 600–1700 milligrammi ja täiskasvanutele 1800–5000 milligrammi. Kaaliumivajadus sõltub kogu kehakaalust, kehalisest aktiivsusest, füsioloogilisest seisundist ja elukoha kliimast. Oksendamine, pikaajaline kõhulahtisus, tugev higistamine ja diureetikumide kasutamine suurendavad organismi kaaliumivajadust.
Peamised toiduallikad on kuivatatud aprikoosid, melon, oad, kiivid, kartul, avokaadod, banaanid, spargelkapsas, maks, piim, pähklivõi, tsitrusviljad, viinamarjad. Kalas ja piimatoodetes on palju kaaliumi.
Imendumine toimub peensooles. Kaaliumi imendumist soodustab vitamiin B6 ja raskendab alkohol.
Kaaliumipuuduse korral areneb hüpokaleemia. Tekivad häired südame- ja skeletilihaste töös. Pikaajaline kaaliumipuudus võib põhjustada ägedat neuralgiat.
Kaalium on elementaarne aine, metall, mis on nii aktiivne, et seda ei esine looduses tükikeste kujul. Kaalium sisaldub mineraalides ja merevees, taimede ja loomade organismides ning on arvukuse poolest 7. kohal. Sellel on suur biogeenne tähtsus, kuna see on vajalik elusrakkude toimimiseks.
Kaaliumi füüsikalised ja keemilised omadused
Kaalium on pehme aine (noaga lõigatav), värvuselt hõbedane, hele (veest kergem), sulav. Põleb roosakasvioletse leegiga.
Leelismetall, mis reageerib aktiivselt hapniku, vee, halogeenide ja lahjendatud hapetega; reaktsioonidega kaasneb sageli plahvatus. Ei reageeri lämmastikuga. Reageerib leeliste ja alkoholidega.
Puhta kaaliumiga töötamine nõuab kaitsevahendite kasutamist, sest isegi kõige väiksemate osakestega kokkupuude nahal või silmadel põhjustab tõsiseid põletusi.
Kaaliumi tuleks hoida suletud raudanumates ainete kihi all, mis takistavad kokkupuudet õhuga: mineraalõli, silikoon, dehüdreeritud petrooleum.
Kaaliumi ja selle ühendite kasutamine
Puhta metalli kujul kasutatakse ainet piiratud valdkondades:
- sellest valmistatakse elektroodid mõnes vooluallikas;
- kasutatakse elektrontorudes gaasiadsorbendina, mis hoiab vaakumit; fotoelementides, gaaslahenduslampides ja -seadmetes, termomuundurites, fotokordistites;
- superoksiidi tootmiseks;
- isotoopi kaalium-40 kasutades arvutatakse kivimite vanus;
- tehisisotoopi kaalium-42 kasutatakse radioaktiivse märgistusainena meditsiinis ja bioloogias;
- kaaliumi ja naatriumi sulam - tavatingimustes vedel aine, mida kasutatakse tuumareaktorites jahutusvedelikuna. Kasutatakse ka muid vedelaid kaaliumisulameid.
 Erinevad kaaliumiühendid on palju nõudlikumad.
Erinevad kaaliumiühendid on palju nõudlikumad.
- Meditsiinipraktikas kasutatakse kaaliumkloriidi, kaaliumjodiidi, permanganaati ja kaaliumbromiidi. Kaalium sisaldub tingimata komplekssetes vitamiini-mineraalpreparaatides. Meie keha vajab seda lihaste, sealhulgas südame tööks; tasakaalus vere koostise, vee ja happe-aluse tasakaalu säilitamiseks.
- Lõviosa tööstuse saadavast kaaliumist (üle 90%) läheb taimede arenguks eluliselt vajalike kaaliumväetiste tootmiseks. Selleks kasutatakse põllumajanduses erinevaid kaaliumisooli. Kõige populaarsem on lämmastikhappe kaaliumsool, mida tuntakse kaaliumnitraadi, India või kaaliumnitraadi nime all.
- KOH-d (kaaliumhüdroksiidi) kasutatakse akudes gaaside kuivatamiseks.
- Kaaliumkarbonaati (kaaliumkarbonaati) kasutatakse kaaliumkloriidi optilise klaasi tootmiseks, väetiste tootmiseks, gaaside puhastamiseks, kuivatamiseks ja naha parkimiseks. 
- Kaaliumperoksiid ja superoksiid neelavad süsihappegaasi ja vabastavad hapnikku. Seda omadust kasutatakse hapniku regenereerimiseks gaasimaskides, miinides, allveelaevadel ja kosmoselaevadel.
- Kangaid pleegitatakse peroksiidide abil.
- Kaaliumiühendid on osa erinevatest lõhke- ja tuleohtlikest ainetest.
- Kaaliumpermanganaati kasutatakse O2 laboratoorseks tootmiseks.
- Kaaliumiühendeid kasutatakse galvaniseerimisel ja orgaanilises sünteesis, lasertehnoloogias ja fotograafias, atsetüleeni ja terase tootmisel ning piesoelektroonikas. Neid kasutatakse värviliste metallide ja teraste jootmiseks ning keemianõude pesemiseks.
Kaaliumjodiid, kaaliumnitraat, kaaliumkarbonaat on vaid väike osa kaaliumiühenditest, mida meie keemiliste reaktiivide pood pakub. Moskvas ja Moskva piirkonnas on Prime Chemicals Groupilt labori- ja tootmiskaupade ostmine mugav ja tulus. Meil on suurepärane teenindus, kohaletoimetamise ja järeletulemise võimalused.
KAALIUM (ladina Kalium), K, perioodilisuse süsteemi lühivormi I rühma (pika vormi 1. rühma) keemiline element; aatomnumber 19; aatommass 39,0983; kuulub leelismetallide hulka. Looduslik kaalium koosneb kolmest isotoobist: 39 K (93,2581%), 40 K (0,0117%; nõrgalt radioaktiivne, T 1/2 1,277 10 9 aastat, β-laguneb kuni 40 Ca), 41 K (6,7302 %). Radioisotoobid massinumbritega 32-54 on kunstlikult saadud.
Ajalooline viide. Mõningaid kaaliumiühendeid tunti juba iidsetel aegadel, näiteks eraldati puutuhast kaaliumkarbonaat K 2 CO 3 (nn. taimne leelis) ja kasutati seebi valmistamisel. Metallilise kaaliumi sai esmakordselt G. Davy 1807. aastal märja tahke KOH-hüdroksiidi elektrolüüsil ja nimetas selle kaaliumiks (inglise potassium inglise keelest potash – kaaliumkarbonaadi nimi). Aastal 1809 pakuti välja nimetus "kaalium" (araabia keelest al-kali - potash). Nimetus “kaalium” on säilinud Suurbritannias, USA-s, Prantsusmaal ja teistes riikides. Venemaal on alates 1840. aastast kasutatud nimetust "kaalium", mis on kasutusele võetud ka Saksamaal, Austrias ja Skandinaavia riikides.
Levimus looduses. Kaaliumisisaldus maakoores on 2,6 massiprotsenti. Looduses ei esine kaaliumi vabas olekus. Kaaliumi leidub märkimisväärses koguses nefeliin- ja leutsiidisilikaatides, päevakivides (näiteks ortoklaas) ja vilgukivides (näiteks muskoviidis). Omad kaaliummineraalid - silviit, silviniit, karnaliit, kainiit, langbeiniit K 2 SO 4 ∙2MgSO 4 moodustavad suuri looduslike kaaliumisoolade akumulatsioone. Vee ja süsihappegaasi toimel muutub kaalium lahustuvateks ühenditeks, mis kanduvad osaliselt merre ja jäävad osaliselt pinnasesse. Kaaliumsoolasid leidub ka soolajärvede soolvees ja maa-alustes soolvees.
Omadused. Kaaliumiaatomi välise elektronkihi konfiguratsioon on 4s 1; ühendites on oksüdatsiooniaste +1; ionisatsioonienergiad K 0 →K + →K 2+ on vastavalt 4,3407 ja 31,8196 eV; Paulingi elektronegatiivsus 0,82; aatomiraadius 220 pm, K + iooni raadius 152 pm (koordinatsiooninumber 6).
Kaalium on hõbevalge pehme metall; kehakeskne kuubikujuline kristallvõre; t sulamistemperatuur 63,38 °C, t keemistemperatuur 759 °C, tihedus 856 kg/m 3 (20 °C); soojusmahtuvus 29,60 J/(mol K) 298 K juures.
Kaaliumit saab pressida ja rullida, seda on lihtne noaga lõigata ja madalatel temperatuuridel säilitada plastilisus; Brinelli kõvadus 0,4 MPa.
Kaalium on kõrge keemilise aktiivsusega metall (kaaliumi hoitakse bensiini, petrooleumi või mineraalõli kihi all). Normaalsetes tingimustes interakteerub kaalium hapnikuga (K 2 O oksiid, K 2 O 2 peroksiid, moodustub superoksiid KO 2 - põhiprodukt), halogeenidega (vastavad kaaliumhalogeniidid), kuumutamisel - väävliga (K 2 S sulfiid), seleen (seleniid K 2 Se), telluur (K 2 Te telluriid), fosforiga lämmastiku atmosfääris (fosfiidid K 3 P ja K 2 P5), süsinik (kihilised ühendid koostisega KS 8 - KS 60), vesinik (KN hüdriid). Kaalium interakteerub lämmastikuga ainult elektrilahendusega kokkupuutel (KN 3 asiid ja K 3 N nitriid tekivad väikestes kogustes). Kaalium reageerib mõnede metallidega, moodustades metallidevahelisi ühendeid või tahkeid lahuseid (kaaliumsulamid). Suurima praktilise tähtsusega on naatriumiga sulamid, mida iseloomustab kõrge keemiline aktiivsus; saadakse metallide legeerimisel inertses atmosfääris või metallilise naatriumi toimel KOH hüdroksiidile või KCl kloriidile.
Kaaliummetall on tugev redutseerija: reageerib intensiivselt (normaalsetes tingimustes metalli plahvatuse ja süttimisega) veega (tekib kaaliumhüdroksiid KOH), reageerib ägedalt (mõnikord plahvatuslikult) hapetega (tekivad vastavad soolad, näiteks kaaliumdikromaat, kaaliumnitraat, kaaliumpermanganaat, kaaliumfosfaadid, kaaliumtsüaniid), redutseerib B, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti oksiidid elementideks; muude metallide sulfaadid, sulfitid, nitraadid, nitritid, karbonaadid ja fosfaadid - vastavate metallide oksiidideks. Kaaliummetall lahustub aeglaselt vedelas ammoniaagis, moodustades metallilise juhtivusega tumesinise lahuse; lahustunud metall reageerib järk-järgult ammoniaagiga, moodustades amiidi: 2K + 2NH3 = 2KNH2 + H2. Kaalium interakteerub erinevate orgaaniliste ühenditega: alkoholid (tekivad alkoholid, näiteks etülaat C 2 H 5 OK), atsetüleen (atsetüleniidid KS≡CH ja KS≡SK), alküülhalogeniidid (kaaliumalküülid, näiteks etüülkaalium C 2 H 5 K) ja arüülhalogeniidid (kaaliumarüülid, näiteks fenüülkaalium C6H5K). Kaaliummetall käivitab alkeenide ja dieenide polümerisatsioonireaktsioonid. N- ja O-doonori polütsükliliste ligandidega (krooneetrid, krüptandid ja muud ionofoorid) moodustab kaalium kompleksühendeid.
Kaaliumiga töötamisel tuleb arvestada selle kõrge reaktsioonivõimega, sealhulgas veega kokkupuutel süttimisvõimega. Ohutuse tagamiseks peate kasutama kummikindaid, kaitseprille või maski. Suures koguses kaaliumi tuleks töödelda spetsiaalsetes kambrites inertses atmosfääris (argoon, lämmastik). Põleva kaaliumi kustutamiseks kasutage lauasoola NaCl või sooda Na 2 CO 3.
Bioloogiline roll. Kaalium on biogeenne element. Inimese päevane kaaliumivajadus on umbes 2 g Elusorganismides on kaaliumiioonidel oluline roll ainevahetuse reguleerimise protsessides, eelkõige ioonide transportimisel läbi rakumembraanide (vt nt artiklit Ioonpumbad).
Kviitung. Tööstuses saadakse kaaliumi sula KOH-hüdroksiidi või KCl-kloriidi redutseerimisel naatriummetalliga vastuvoolukolonnis, millele järgneb kaaliumiauru kondensatsioon. Kaaliumi tootmiseks kasutatavad vaakumtermilised meetodid on paljutõotavad, mis põhinevad KCl kloriidi redutseerimisel kuumutamisel alumiiniumi või räni ja kaltsiumoksiidi seguga (6Kl + 2Al + 4CaO = 6K + 3CaCl 2 + CaO Al 2 O 3 või 4Kl + Si + 4CaO = 4K + 2CaCl 2 + 2CaO∙SiO 2), samuti meetod, mis põhineb pliiga kaaliumisulami valmistamisel K 2 CO 3 karbonaadi või KCl kloriidi elektrolüüsil sula pliikatoodiga ja sellele järgneval destilleerimisel. kaaliumisulam. Ülemaailmse kaaliumitoodangu maht on ca 28 tonni/aastas (2004).
Rakendus. Metalliline kaalium on keemiliste jõuallikate elektroodide materjal, katalüsaator sünteetilise kummi tootmisprotsessides. Laialdaselt kasutatakse erinevaid kaaliumiühendeid: peroksiid K 2 O 2 ja superperoksiid KO 2 - hapniku regenereerimise kompositsioonide komponendid (allveelaevades, kosmoselaevades ja muudes suletud ruumides), KN-hüdriid - redutseerija keemilises sünteesis, kaaliumi sulam naatriumiga (10-60% Na massist, vedel toatemperatuuril) - jahutusvedelik tuumareaktorites, redutseerija titaani tootmisel, reaktiiv gaaside puhastamiseks hapnikust ja veeaurust; Kaaliumsooli kasutatakse kaaliumväetiste ja pesuvahendite komponentidena. Kaaliumi kompleksid ionofooridega on mudelid kaaliumioonide transpordi uurimiseks läbi rakumembraanide. Radioisotoopi 42 K (T 1/2 12,36 h) kasutatakse radioaktiivse indikaatorina keemias, meditsiinis ja bioloogias.
Kirj.: naatrium ja kaalium. L., 1959; Stepin B. D., Tsvetkov A. A. Anorgaaniline keemia. M., 1994; Anorgaaniline keemia: elementide keemia / Toimetanud Yu. D. Tretjakov. M., 2004. T. 2.