inhibitor n-atfaze. Inhibitori protonske pumpe: prikaz skupine lijekova. Usporedba inhibitora protonske pumpe
Inhibitori protonske pumpe (sinonimi: inhibitori protonske pumpe, inhibitori protonske pumpe, inhibitori protonske pumpe; blokatori protonske pumpe, blokatori H+/K+-ATPaze, blokatori vodikove pumpe, PPI, PPI i dr.) – antisekretorni lijekovi namijenjeni liječenju bolesti gastrointestinalnog trakta ovisnih o kiselini smanjenjem proizvodnje klorovodične kiseline zbog blokiranja protonske pumpe u parijetalnim stanicama želučana sluznica – H+/K+-ATPaze.
Prema suvremenoj Anatomsko terapeutsko kemijskoj klasifikaciji lijekova (ATC) inhibitori protonske pumpe (IPP) uključeni su u odjeljak A 02B“Lijekovi protiv čira i lijekovi za liječenje gastroezofagealnog refluksa” u grupi A 02prije Krista"Inhibitori protonske pumpe." Navodi međunarodne nezaštićene nazive sedam inhibitora protonske pumpe (prvih šest odobreno je za uporabu u Sjedinjenim Državama i Ruskoj Federaciji; sedmi, deksrabeprazol, trenutno nije odobren za uporabu):
- A 02prije Krista 01 Omeprazol
- A 02prije Krista 02 Pantoprazol
- A 02prije Krista 03 Lansoprazol
- A 02prije Krista 04 Rabeprazol
- A 02prije Krista 05 Esomeprazol
- A 02prije Krista 06 Dekslansoprazol
- A 02prije Krista 07 Deksrabeprazol
U skupinu su uključeni i inhibitori protonske pumpe u kombinacijama s različitim antibioticima A 02BD„Kombinacije lijekova za eradikaciju Helicobacter pylori».
Također su objavljeni podaci o nizu novih inhibitora protonske pumpe, koji su trenutno u različitim fazama razvoja i kliničkih ispitivanja (tenatoprazol, D-lansoprazol, ilaprazol, itd.).
Inhibitori protonske pumpe trenutno su prepoznati kao najučinkovitiji lijekovi koji suzbijaju proizvodnju klorovodične kiseline.
Inhibitori protonske pumpe naširoko se koriste u kliničkoj praksi u liječenju bolesti gastrointestinalnog trakta ovisnih o kiselini (uključujući i kada je potrebna eradikacija Helicobacter pylori), kao što su:
– gastroezofagealna refluksna bolest (GERB);
– čir na želucu i/ili dvanaesniku;
– Zollinger-Ellisonov sindrom;
– oštećenje želučane sluznice uzrokovano uzimanjem nesteroidnih protuupalnih lijekova;
– gastrointestinalno krvarenje različitog podrijetla
– funkcionalna dispepsija;
– četverostruka ili trostruka terapija antibioticima.
Inhibitori protonske pumpe također su indicirani za sprječavanje ulaska kiselog želučanog sadržaja u respiratorni trakt tijekom opće anestezije (Mendelssohnov sindrom).
Inhibitori protonske pumpe dostupni su u obliku doznih oblika kao što su „obložene tablete“, „kapsule“, „enterične kapsule“ (PPI, osim esomeprazola, prilično su nestabilni na djelovanje kiselog želučanog sadržaja), kao i „liofilizat za pripremanje otopine za infuziju", "prašak za pripremu otopine za infuziju". Parenteralni oblici za intravensku primjenu posebno su indicirani za liječenje u slučajevima kada je oralna primjena lijeka otežana.
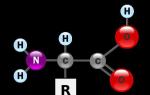
Prema kemijskoj strukturi, svi PPI su derivati benzimidazola i imaju jednu molekularnu jezgru.
Zapravo, svi se razlikuju samo po kemijskim radikalima na piridinskom i benzimidazolskom prstenu, koji određuju njihova individualna svojstva u pogledu trajanja latentnog razdoblja, trajanja djelovanja lijeka i karakteristika pH-selektivnost, interakcija s drugim lijekovima koji se uzimaju istodobno i sl.
Esomeprazol, dekslansoprazol i deksarabeprazol su optički izomeri omeprazola, lansoprazola i rabeprazola. Zbog ove modifikacije imaju veću biološku aktivnost.
Mehanizam djelovanja različitih inhibitora protonske pumpe je isti, a razlikuju se uglavnom u farmakokinetici i farmakodinamici.
Treba napomenuti da, iako svi inhibitori protonske pumpe imaju isti mehanizam djelovanja, što osigurava sličnost njihovih kliničkih učinaka, međutim, svaki od njih ima farmakokinetička svojstva (vidi tablicu), koja određuju njihova individualna svojstva i mogu poslužiti kao osnova izbora pri propisivanju i provođenju terapije, iako, ovisno o genetski uvjetovanom tipu metabolizma, farmakokinetika IPP-a i njihove koncentracije u krvi mogu značajno varirati u različitih bolesnika.
Stol. Farmakokinetika IPP
|
Mogućnosti |
Omeprazol 20 mg |
Esomeprazol 40 mg |
Lansoprazol 30 mg |
Pantoprazol 40 mg |
Rabeprazol 20 mg |
|
Bioraspoloživost, % |
|||||
|
S max, mg/A |
|||||
|
AUC, µmol/LxH |
|||||
|
T 1/2, h |
|||||
|
T max, h |
Na primjer, minimalna inhibitorna koncentracija za omeprazol je 25-50 mg / l, lansoprazol - 0,78-6,25 mg / l, pantoprazol - 128 mg / l.
Na temelju rezultata komparativnih studija treba obratiti pozornost na činjenicu da se za omeprazol i esomeprazol farmakokinetički pokazatelji povećavaju tijekom prvih dana primjene, nakon čega dolaze do platoa, dok se za lansoprazol, pantoprazol i rabeprazol ne mijenjaju. , ostaje stabilan.
Također treba obratiti pozornost na činjenicu da je glavni pokazatelj koji određuje brzinu razvoja učinka PPI njihova bioraspoloživost. Na primjer, pokazalo se da je najniža bioraspoloživost karakteristična za omeprazol (nakon 1. doze iznosi 30-40%, a do 7. doze raste na 60-65%). Nasuprot tome, bioraspoloživost početne doze lansoprazola je 80-90%, što određuje brži početak djelovanja ovog lijeka.
Stoga, kao što su primijetili mnogi istraživači, u ranim fazama terapije lansoprazol ima neke prednosti u brzini nastupa učinka, što potencijalno povećava pridržavanje pacijenta liječenju.
Međutim, treba napomenuti da se različiti IPP lijekovi koji se trenutno koriste u kliničkoj praksi razlikuju u brzini nastupa kliničkog učinka samo u prvim danima liječenja, a do 2-3. tjedna primjene te se razlike gube.
Važna točka za praksu je, na primjer, činjenica da uzimanje antacida, poput hrane, ne utječe na farmakokinetiku pantoprazola. Sukralfat i unos hrane mogu promijeniti apsorpciju lansoprazola. Farmakokinetika omeprazola može se promijeniti unosom hrane, ali na nju ne utječu tekući antacidi. Stoga se lansoprazol i omeprazol uzimaju 30 minuta prije jela, a pantoprazol i rabeprazol - neovisno o obrocima.
Utvrđeno je da za sve PPI trajanje antisekretornog učinka nije u korelaciji s koncentracijom lijeka u krvnoj plazmi, već s površinom ispod farmakokinetičke krivulje koncentracija-vrijeme ( AUC), odražavajući količinu lijeka koja dolazi do protonske pumpe. Usporedne studije su otkrile da je nakon 1. doze, od svih PPI, najveća stopa AUC Imala sam pantoprazol. Kod esomeprazola je bio manji, ali je, postupno rastući, do 7. doze neznatno premašio brojku AUC pantoprazol. Indeks AUC omeprazol je bio najniži među svim uspoređivanim PPI.
Stoga, - omeprazol treba propisati 2 puta dnevno, - i lijekove s najvišim AUC(pantoprazol i esomeprazol) za većinu bolesnika dovoljno je uzeti jednom. Napominje se da se za određeni broj pacijenata gore navedeno može odnositi na lansoprazol i rabeprazol.
Međutim, treba napomenuti da se klinički značaj ove činjenice uglavnom svodi na učestalost uzimanja različitih IPP-a, a učestalost uzimanja lijeka je pak povezana s problemom pridržavanja bolesnika liječenju.
Ali, u isto vrijeme, ipak treba uzeti u obzir da postoji značajan raspon u trajanju antisekretornog učinka, kako za različite inhibitore protonske pumpe, tako i pojedinačno od 1 do 12 dana. Stoga određivanje individualnog ritma uzimanja lijekova i doza lijekova za svakog bolesnika pojedinačno treba provoditi pod kontrolom intragastričnog pH-metrika.
Važna razlika između različitih PPI lijekova je njihova pH-selektivnost. Poznato je da do selektivne akumulacije i brze aktivacije svih PPI dolazi samo u kiseloj sredini. Stopa njihove pretvorbe u aktivnu tvar s povećanjem pH ovisi o vrijednosti R Ka za dušik u strukturi piridina. Utvrđeno je da za pantoprazol R Ka je 3,0 za omeprazol, esomeprazol i lansoprazol - 4, za rabeprazol - 4,9. To znači da kada pH 1,0-2,0 u lumenu sekretornih tubula, svi PPI se selektivno nakupljaju tamo, brzo prelaze u sulfenamid i djeluju jednako učinkovito. Prilikom povećanja pH Transformacija PPI usporava: brzina aktivacije pantoprazola smanjuje se 2 puta s pH 3.0 omeprazol, esomeprazol i lansoprazol – sa pH 4.0 rabeprazol – at pH 4.9. Pantoprazol se praktički ne pretvara u aktivni oblik kada pH 4.0 omeprazol, esomeprazol i lansoprazol – sa pH 5,0 kada još uvijek dolazi do aktivacije rabeprazola. Dakle, pantoprazol je najviše pH-selektivan, a najmanje rabeprazol pH-selektivni PPI.
S tim u vezi, zanimljivo je da neki autori imaju sposobnost rabeprazola da se aktivira u širokom rasponu pH smatra se njegovom prednošću, budući da je povezan s brzim antisekretornim učinkom. Prema drugima, nizak pH-selektivnost rabeprazola je njegov nedostatak. To se objašnjava činjenicom da su kemijski aktivni oblici PPI (sulfenamidi) potencijalno sposobni djelovati ne samo s SH- skupine cisteina protonske pumpe, ali i s bilo kojim SH- skupine tijela. Trenutno, uz parijetalne stanice, protonske pumpe ( N + /DO+ – ili N + /Na+ -ATPaze) otkrivaju se u stanicama drugih organa i tkiva: u epitelu crijeva, žučnog mjehura; bubrežnih tubula; epitel rožnice; u mišićima; stanice imunološkog sustava (neutrofili, makrofagi i limfociti); osteoklasti itd. To znači da ako se PPI aktiviraju izvan sekretornih tubula parijetalne stanice, mogu utjecati na sve te strukture. Tjelesne stanice imaju organele s kiselim okolišem (lizosomi, neurosekretorne granule i endosomi), gdje pH 4,5-5,0 - stoga mogu biti potencijalne mete za PPI (osobito rabeprazol).
Iz toga je zaključeno da za selektivnu akumulaciju upravo u sekretornim tubulima parijetalne stanice R Ka PPI bi optimalno trebao biti ispod 4,5.
To je razlika pH-selektivnost inhibitora protonske pumpe također se raspravlja kao patogenetski mehanizam mogućih nuspojava IPP-a pri dugotrajnoj primjeni. Dakle, mogućnost blokiranja vakuol N+ -ATPaza neutrofila, što može povećati pacijentovu osjetljivost na infekcije. Tako je, posebice, tijekom terapije IPP-a opisan povećani rizik od izvanbolničke upale pluća - međutim, valja napomenuti da takve komplikacije najvjerojatnije nema kod dugotrajnog liječenja, već samo tijekom početnog razdoblja uzimanja IPP-a. .
Također treba obratiti pozornost na činjenicu da terapijski učinak IPP-a značajno ovisi o brzini eliminacije lijekova iz organizma. Metabolizam inhibitora protonske pumpe odobrenih u Rusiji odvija se uglavnom u jetri uz sudjelovanje CYP 2C 9, CYP 2C 19, CYP 2D 6 i CYP 3A 4, – izoenzimi citokroma R 450. Polimorfizam gena citokromskog sustava CYP 2S 19 je odlučujući čimbenik da brzina početka i trajanje antisekretornog učinka IPP-a značajno varira među pacijentima.
Utvrđeno je da je u ruskoj populaciji prevalencija genskih mutacija CYP 2C 19, koji kodira metabolizam PPI (homozigoti, bez mutacija, brz metabolizam PPI; heterozigoti, jedna mutacija; dvije mutacije, spor metabolizam), za predstavnike bijele rase su 50,6%, 40,5% i 3,3%, za mongoloidnu rasu – 34,0%, 47,6% odnosno 18,4%. Tako se pokazalo da je od 8,3 do 20,5% pacijenata rezistentno na jednu dozu IPP-a.
Iznimka je rabeprazol, koji se metabolizira bez sudjelovanja izoenzima. CYP 2C 19 i CYP 3A 4, što je očito povezano s konstantnom vrijednošću njegove bioraspoloživosti nakon prve primjene, kao i minimalnom interakcijom s lijekovima koji se metaboliziraju putem citokromskog sustava. P 450 i najmanju ovisnost o polimorfizmu gena koji kodira izoformu 2 C 19, u usporedbi s drugim inhibitorima protonske pumpe. Rabeprazol ima manji učinak od drugih lijekova na metabolizam (razgradnju) drugih lijekova.
Klirens omeprazola i esomeprazola značajno je niži od klirensa drugih PPI, što uzrokuje povećanje bioraspoloživosti omeprazola i njegovog stereoizomera esomeprazola.
Takvi fenomeni kao što su "otpornost na inhibitore protonske pumpe", "noćni prodor kiseline" itd., opaženi u određenog broja pacijenata, mogu biti uzrokovani ne samo genetskim čimbenicima, već i drugim karakteristikama tjelesnog stanja.
Govoreći o liječenju inhibitorima protonske pumpe, treba, naravno, napomenuti problem sigurnosti njihove primjene. Ovaj problem ima dva aspekta: sigurnost IPP-a kao klase i sigurnost pojedinačnih lijekova.
Nuspojave kod primjene inhibitora protonske pumpe mogu se podijeliti u dvije skupine: nuspojave koje se javljaju pri kratkotrajnoj terapiji i one koje se javljaju kod dugotrajne primjene ovih lijekova.
Sigurnosni profil inhibitora protonske pumpe tijekom kratkih (do 3 mjeseca) terapije vrlo je visok. Najčešće se kod kratkih tečajeva terapije javljaju nuspojave od strane središnjeg živčanog sustava, poput glavobolje, umora, vrtoglavice, te od strane gastrointestinalnog trakta (proljev ili zatvor). U rijetkim slučajevima mogu se pojaviti alergijske reakcije (kožni osip, bronhospazam). Opisani su slučajevi oštećenja vida i sluha kod intravenske primjene omeprazola.
Utvrđeno je da kod dugotrajne (osobito višegodišnje) kontinuirane primjene blokatora protonske pumpe, poput omeprazola, lansoprazola i pantoprazola, dolazi do hiperplazije enterokromafinih stanica želučane sluznice ili progresije atrofičnog gastritisa. Uočeno je da rizik od razvoja nodularne hiperplazije ECL-stanica postaje osobito visoka u slučajevima kada razina serumskog gastrina prelazi 500 pg/ml.
Te su promjene obično izražene kod dugotrajne primjene visokih doza IPP (najmanje 40 mg omeprazola, 80 mg pantoprazola, 60 mg lansoprazola). Uz dugotrajnu upotrebu velikih doza, također je zabilježeno smanjenje razine apsorpcije vitamina B 12 .
Pošteno radi, valja napomenuti da u praksi potreba za dugotrajnom primjenom tako visokih doza inhibitora protonske pumpe obično postoji samo u bolesnika sa Zollinger-Ellisonovim sindromom i u bolesnika s teškim erozivno-ulcerativnim ezofagitisom. Prema zaključku Povjerenstva za lijekove u gastroenterologiji FDA (Uprava za hranu i prijevoz, SAD), "...nema značajnog povećanja rizika od razvoja atrofičnog gastritisa, intestinalne metaplazije ili želučanog adenokarcinoma s dugotrajnom primjenom IPP-a." Stoga sa sigurnošću možemo reći da općenito ovi lijekovi imaju dobar sigurnosni profil.
Važno pitanje u pogledu sigurnosti liječenja je mogućnost promjene učinaka lijekova kada se uzimaju zajedno s PPI. Utvrđeno je da među PPI pantoprazol ima najmanji afinitet prema citokromskom sustavu. P 450, budući da se nakon početnog metabolizma u ovom sustavu daljnja biotransformacija odvija pod utjecajem citosolne sulfatransferaze. To objašnjava manji potencijal za interakcije između lijekova pantoprazola u odnosu na druge PPI. Stoga se smatra da je, kada je potrebno uzimati više lijekova za istovremeno liječenje drugih bolesti, najsigurnija primjena pantoprazola.
Zasebna točka vrijedna pažnje su nuspojave pri prekidu liječenja inhibitorima protonske pumpe. Na primjer, brojne studije su naglasile da nakon prestanka uzimanja rabeprazola ne postoji "rebound" (povlačenje) sindrom, tj. nema kompenzacijskog oštrog povećanja razine kiselosti u želucu; izlučivanje klorovodične kiseline nakon liječenja ovim PPI polako se obnavlja (unutar 5-7 dana). "Sindrom ustezanja" je izraženiji kada se ukine esomeprazol, propisan bolesnicima u dozi od 40 mg.
Uzimajući u obzir sve gore navedene značajke različitih inhibitora protonske pumpe (metaboličke značajke povezane s genetikom, uzroci rezistencije, mogućnost noćnog „probijanja kiseline“ itd.), možemo zaključiti da ne postoji jedan „najbolji“ lijek za liječenje bolesti povezanih s kiselinom ne postoji. Stoga, kako bi se izbjegli neuspjesi u terapiji IPP-a, odabir i propisivanje inhibitora protonske pumpe treba individualno i odmah prilagoditi uzimajući u obzir odgovor na liječenje te, ako je potrebno, treba biti popraćeno individualnim odabirom lijekova i doza njihovih lijekova. koristiti pod nadzorom pH-metrika (dnevno pH-metrija) ili gastroskopija.
Tijekom dugotrajnog liječenja različitim inhibitorima protonske pumpe može se pojaviti stečena (sekundarna) rezistencija na pojedine PPI. Takva otpornost postaje vidljiva nakon dugotrajnog liječenja istim lijekom, kada je njegova učinkovitost u pozadini stalne uporabe godinu dana ili više značajno smanjena, ali prelazak pacijenata na liječenje drugim PPI poboljšava njihovo stanje.
Inhibitori protonske pumpe su lijekovi namijenjeni liječenju bolesti gastrointestinalnog trakta ovisnih o kiselini, smanjenjem stvaranja klorovodične kiseline blokiranjem protonske pumpe - H + /K + -ATPaze u parijetalnim stanicama želučane sluznice. Odnosi se na antisekretorne lijekove.|
Omeprazol je povijesno prvi inhibitor protonske pumpe |
|
 |
Esomeprazol – S-izomer omeprazola |
 |
pantoprazol |
 |
Lansoprazol |
 |
rabeprazol |
 |
Dekslansoprazol je optički izomer lansoprazola. |
 |
Tenatoprazol |
Prema kemijskoj strukturi, svi inhibitori protonske pumpe su derivati benzimidazola i imaju jednu molekularnu jezgru. Inhibitori protonske pumpe razlikuju se samo po kemijskim radikalima koji im daju individualna svojstva u pogledu trajanja latentnog razdoblja, trajanja djelovanja lijeka, karakteristika pH selektivnosti, interakcije s drugim istodobno uzimanim lijekovima itd.
1.4.1. Mehanizam djelovanja
Parijetalne stanice fundicalnih žlijezda odgovorne su za proizvodnju kiseline u želucu. Središnja karika u lučenju klorovodične kiseline je vodikovo-kalijeva adenozin trifosfataza (H + /K + -ATPaza) koja, ugrađena u apikalnu (usmjerenu u lumen želuca) membranu parijetalne stanice, djeluje kao protonska pumpa koja osigurava prijenos iona vodika H+ kroz membranu u prostor želuca u zamjenu za ione kalija K+ u smjerovima suprotnim od elektrokemijskog gradijenta za oba iona, koristeći energiju hidrolize molekule adenozin trifosforne kiseline (ATP) . Nakon toga se kalijev ion K + transportira natrag duž elektrokemijskog gradijenta, uzrokujući zajednički prijenos iona klora Cl − u lumen želuca.
Molekule inhibitora protonske pumpe, nakupljajući se u intracelularnim tubulima parijetalnih stanica u neposrednoj blizini molekula H + / K + -ATPaze, nakon nekih transformacija pretvaraju se u tetraciklički sulfenamid, koji je kovalentno ugrađen u cisteinske skupine H + /K + -ATPaza, čime potonja ne može sudjelovati u procesu transporta iona.
1.4.2. Lansoprazol
Strukturna formula:

Sastav i oblik otpuštanja. Lansoprazol. Kapsule (30 mg).
Farmakološki učinak. Sredstvo protiv čira. Specifični inhibitor H + -K + -ATPaze. Djelujući u završnoj fazi lučenja klorovodične kiseline u želucu, lijek smanjuje stvaranje kiseline, bez obzira na prirodu stimulirajućeg faktora.
Indikacije. Peptički ulkus duodenuma ili želuca u akutnoj fazi, refluksni ezofagitis.
Primjena. Dnevna doza je 30 mg u jednoj dozi. Tijek liječenja je 4 tjedna, ako je potrebno, liječenje se može nastaviti 2-4 tjedna. U bolesnika koji primaju teofilin, lansoprazol treba primjenjivati s oprezom i pod strogim liječničkim nadzorom. Lijek može izazvati indukciju različitih enzimskih sustava citokroma P 450. Antacide koji sadrže aluminij i magnezijev hidroksid treba uzeti 2 sata nakon uzimanja lansoprazola.
Nuspojava. Rijetko - proljev, zatvor; u izoliranim slučajevima - osip na koži.
1.4.3. pantoprazol
Strukturna formula:

Sastav i oblik otpuštanja. pantoprazol. Kapsule (40 mg).
Farmakološki učinak. Inhibitor H+-K+-ATPaze. Smanjuje razinu bazalne i stimulirane (bez obzira na vrstu podražaja) lučenja klorovodične kiseline u želucu. U slučaju duodenalnog ulkusa povezanog s Helicobacter pylori, ovo smanjenje želučane sekrecije povećava osjetljivost mikroorganizma na antibiotike. Pantoprazol ima intrinzično antimikrobno djelovanje protiv H. pylori.
Indikacije. Peptički ulkus želuca ili dvanaesnika u akutnoj fazi, Zollinger-Ellisonov sindrom, eradikacija Helicobacter pylori (u kombinaciji s antibakterijskom terapijom), refluksni ezofagitis.
Primjena. Prosječna terapijska doza je 40 mg/dan. Maksimalna doza je 80 mg/dan. Trajanje terapije određuje se ovisno o indikacijama, ali ne smije biti duže od 8 tjedana. Prije početka terapije potrebno je isključiti mogućnost maligne neoplazme u želucu i jednjaku, budući da primjena pantoprazola smanjuje težinu simptoma i može odgoditi postavljanje točne dijagnoze.
Nuspojava. Proljev, glavobolja; rijetko - mučnina, bol u gornjem dijelu trbuha, nadutost, osip, svrbež, slabost, vrtoglavica; u izoliranim slučajevima - oteklina, povišena tjelesna temperatura, početne manifestacije depresivnih stanja, zamagljen vid.
Interakcija s drugim lijekovima. Uz istodobnu primjenu pantoprazol može promijeniti apsorpciju lijekova čija apsorpcija ovisi o pH vrijednosti želučanog sadržaja (ketokonazol). Zbog činjenice da se pantoprazol metabolizira u jetri pomoću enzimskog sustava citokroma P 450, ne može se isključiti mogućnost interakcije lijeka s lijekovima koji se metaboliziraju pomoću istog enzimskog sustava. 1.4.4. Omeprazol
Strukturna formula:

Sastav i oblik otpuštanja. Omeprazol. Tablete (20 mg); kapsule (10 mg, 20 mg); liofilizirana suha tvar za infuziju (u 1 bočici – 40 mg).
Farmakološki učinak. Inhibitor H+-K+-ATPaze. Inhibira aktivnost H + -K + -ATPaze u parijetalnim egzokrinocitima želuca i time blokira završni stupanj izlučivanja klorovodične kiseline. To dovodi do smanjenja bazalne i stimulirane sekrecije, bez obzira na prirodu podražaja. Učinak lijeka nastupa brzo, ovisi o veličini uzete doze i traje 24 sata ili više nakon jedne doze od 20 mg omeprazola.
Indikacije. Peptički ulkus želuca i dvanaesnika u akutnoj fazi, refluksni ezofagitis, Zollinger-Ellisonov sindrom.
Primjena. Jedna doza je 20-40 mg. Dnevna doza - 20-40 mg, učestalost upotrebe 1-2 puta dnevno. U teškim slučajevima bolesti, 40 mg lijeka primjenjuje se intravenozno jednom dnevno. Trajanje liječenja - 2-8 tjedana. Prije početka terapije potrebno je isključiti prisutnost malignog procesa (osobito u bolesnika s želučanim ulkusom), budući da liječenje lijekom može prikriti simptome i odgoditi točnu dijagnozu. U slučaju pogoršanja želučanog i duodenalnog ulkusa, lijek se propisuje u dozi od 20 mg 1 puta dnevno ujutro na prazan želudac. Bolesnicima s lošim zacjeljivanjem duodenalnih ulkusa preporučuje se propisivanje omeprazola u dozi od 40 mg 1 puta dnevno, što omogućuje postizanje ozdravljenja unutar 4 tjedna. Kako bi se spriječili recidivi duodenalnog ulkusa, propisuje se 10 mg jednom dnevno. Ako je potrebno, doza se može povećati na 20-40 mg 1 puta dnevno. Kako bi se spriječilo ponavljanje želučanog ulkusa u bolesnika s lošim zacjeljivanjem, preporučuje se propisivanje 20 mg 1 puta dnevno. Za bolesnike s lošim cijeljenjem želučanog ulkusa preporuča se propisivanje omeprazola od 40 mg/dan, što će osigurati ožiljke unutar 8 tjedana. Za peptičke ulkuse povezane s Helicobacter pylori, omeprazol se propisuje u dozi od 40 mg/dan u kombinaciji s amoksicilinom (1,5-3 g u 2 doze) tijekom 2 tjedna.
Nuspojava. Na živčani sustav: rijetko - vrtoglavica, glavobolja, uznemirenost, pospanost, nesanica; parestezija; u nekim slučajevima - depresija i halucinacije. Na probavnom sustavu: rijetko - suha usta, poremećaj okusa, proljev ili zatvor, stomatitis, bol u trbuhu; povećana aktivnost jetrenih enzima u krvnoj plazmi. Na dišnom sustavu: rijetko - bronhospazam. Na mišićno-koštanom sustavu: artralgija, mišićna slabost, mialgija. Na hematopoetskom sustavu: rijetko - leukopenija, trombocitopenija. Kožne reakcije: osip, urtikarija, svrbež, multiformni eritem. Ostalo: zamagljen vid, periferni edem, pojačano znojenje, groznica.
Interakcija s drugim lijekovima. Omeprazol može usporiti eliminaciju lijekova koji se metaboliziraju oksidacijom u jetri (osobito varfarina, diazepama i fenitoina).
Omeprazol (Omeprasolum; 0,02 kapsule) - je racemična smjesa dva enantiomera, smanjuje lučenje kiseline zbog specifične inhibicije kiselinske pumpe parijetalnih stanica. Kada se primijeni jednokratno, lijek djeluje brzo i osigurava reverznu inhibiciju lučenja kiseline. Omeprazol je slaba alkalija, koja se koncentrira i pretvara u aktivni oblik u kiseloj sredini tubularnih stanica parijetalnog sloja želučane sluznice, gdje aktivira i inhibira H +, K + -ATPazu kiselinske pumpe. Lijek ima učinak ovisan o dozi na posljednju fazu sinteze kiseline, inhibira i bazalnu i stimulirajuću sekreciju, bez obzira na stimulirajući faktor. Intravenska primjena omeprazola dovodi do dozno ovisne supresije klorovodične kiseline u ljudi. Da bi se postiglo brzo smanjenje intragastrične kiselosti, preporučuje se intravenska primjena 40 mg omeprazola, nakon čega dolazi do brzog smanjenja intragastrične sekrecije, koja se održava 24 sata.
Stupanj supresije lučenja kiseline proporcionalan je površini ispod krivulje (AUC koncentracija-vrijeme) omeprazola i nije proporcionalan stvarnoj koncentraciji lijeka u krvi u određenom trenutku. Tijekom liječenja omeprazolom nije primijećena tahifilaksija. Smanjeno lučenje želučane kiseline inhibitorima protonske pumpe ili drugim tvarima za inhibiciju kiseline rezultira povećanim rastom normalne crijevne mikroflore, što zauzvrat može dovesti do blagog povećanja rizika od razvoja crijevnih infekcija uzrokovanih bakterijama kao što su Salmonella i Campylobacter.
Volumen distribucije u zdravih osoba je 0,3 l/kg, slična je brojka utvrđena u bolesnika sa zatajenjem bubrega. U starijih bolesnika i bolesnika sa zatajenjem bubrega volumen distribucije je blago smanjen. Stopa vezanja omeprazola za proteine plazme je oko 95%. Nakon primjene, prosječno poluvijek u terminalnoj fazi kreće se od 0,3 do 0,6 l/min. Tijekom liječenja nisu primijećene promjene u poluživotu. Omeprazol se u potpunosti metabolizira pomoću citokroma P-450 (CYP) u jetri. Metabolizam lijeka uglavnom ovisi o specifičnom izoenzimu CYP2C19 (S-mefiniton hidroksilaza), koji je odgovoran za stvaranje glavnog metabolita hidroksiomeprazola. Metaboliti utječu na lučenje želučane kiseline. Oko 80% intravenski primijenjene doze izlučuje se u obliku metabolita u urinu, a ostatak u fecesu. U bolesnika s oštećenom funkcijom bubrega, izlučivanje omeprazola nije podvrgnuto nikakvim promjenama. U bolesnika s oštećenom funkcijom jetre uočeno je produljenje poluvijeka, međutim, omeprazol se ne nakuplja. Indikacije za uporabu: duodenalni ulkus, peptički ulkus, refluksni ezofagitis, liječenje Zollinger-Ellisonovog sindroma.
Nuspojave: Omeprazol se općenito dobro podnosi. Zabilježene su nuspojave, ali u većini slučajeva stvarni odnos između učinka i liječenja nije utvrđen.
Koža - kožni osip i svrbež. U nekim slučajevima, reakcija fotosenzitivnosti, multiformni eritem, alopecija. Mišićno-koštani sustav - u nekim slučajevima, artralgija, slabost mišića, mialgija.
Centralni i periferni živčani sustav: glavobolja, hiponatrijemija, vrtoglavica, parestezija, pospanost, nesanica. U nekim slučajevima, bolesnici s teškim komorbiditetom mogu doživjeti depresiju, agitaciju, agresivnost i halucinacije.
Gastrointestinalni trakt: proljev, zatvor, bol u trbuhu, mučnina, povraćanje, nadutost. U nekim slučajevima, suha usta, stomatitis, gastrointestinalna kandidijaza.
Sustav jetre: u nekim slučajevima, povećana aktivnost jetrenih enzima; encefalopatija se može razviti u bolesnika s teškom bolešću jetre.
Endokrini sustav: u nekim slučajevima ginekomastija.
Cirkulacijski sustav: u nekim slučajevima leukopenija, trombocitopenija, agranulocitoza i pancitopenija.
Ostalo: opća slabost, reakcija preosjetljivosti u obliku urtikarije (rijetko), u nekim slučajevima angioedem, vrućica, bronhospazam, intersticijski nefritis, anafilaktički šok.
Antacidi. U ovu skupinu spadaju sredstva koja neutraliziraju solnu kiselinu i sredstva koja smanjuju kiselost želučanog soka. To su lijekovi protiv kiseline. Obično su to kemijski spojevi sa svojstvima slabih alkalija, neutraliziraju klorovodičnu kiselinu u lumenu želuca. Smanjenje kiselosti ima važnu terapijsku vrijednost, budući da o njegovoj količini ovisi djelovanje pepsina i njegov probavni učinak na želučanu sluznicu. Optimalna pH vrijednost za aktivnost pepsina kreće se od 1,5 do 4,0. Pri pH = 5,0 pepsin je aktivan. Stoga je poželjno da antacidi podižu pH ne više od 4,0 (optimalno je da kod uzimanja antacida pH želučanog soka bude 3,0 - 3,5), što ne ometa probavu hrane. Tipično, pH želučanog sadržaja normalno se kreće od 1,5 do 2,0. Bolni sindrom počinje jenjavati kada pH postane veći od 2.
Postoje sistemski i nesistemski antacidi. Sistemski antacidi su lijekovi koji se mogu apsorbirati, pa stoga imaju učinak ne samo u želucu, već mogu dovesti i do razvoja alkaloze u tijelu u cjelini. Nesistemski antacidi se ne apsorbiraju i stoga mogu neutralizirati kiselost samo u želucu, bez utjecaja na acidobazno stanje tijela. U antacide spadaju natrijev bikarbonat (soda bikarbona), kalcijev karbonat, aluminijev i magnezijev hidroksid, magnezijev oksid. Obično se ove tvari koriste u različitim oblicima doziranja iu različitim kombinacijama. Sistemski antacidi uključuju natrijev bikarbonat i natrijev citrat, svi ostali gore navedeni lijekovi su nesistemski.
Natrijev bikarbonat (soda bikarbona) je spoj koji je vrlo topiv u vodi i brzo reagira u želucu s klorovodičnom kiselinom. Reakcija se odvija stvaranjem natrijevog klorida, vode i ugljičnog dioksida. Lijek djeluje gotovo trenutno. Iako natrijev bikarbonat djeluje brzo, njegov učinak je kratkotrajan i slabiji od ostalih antacida. Ugljični dioksid koji nastaje tijekom reakcije rasteže želudac, uzrokujući nadutost i podrigivanje. Osim toga, uzimanje ovog lijeka može izazvati povratni sindrom. Potonje je da brzo povećanje pH u želucu dovodi do aktivacije parijetalnih G stanica u središnjem dijelu želuca, koje proizvode gastrin. Gastrin potiče lučenje klorovodične kiseline, što dovodi do razvoja hiperaciditeta nakon prestanka djelovanja antacida. Obično se sindrom "povlačenja" razvija nakon 20-25 minuta. Zbog dobre apsorpcije iz probavnog trakta, natrijev bikarbonat može uzrokovati sistemsku alkalozu koja se klinički očituje smanjenim apetitom, mučninom, povraćanjem, slabošću, bolovima u trbuhu, grčevima i grčevima u mišićima. Ovo je prilično opasna komplikacija koja zahtijeva hitan prekid lijeka i pomoć pacijentu. S obzirom na ozbiljnost ovih nuspojava, natrijev bikarbonat se izuzetno rijetko koristi kao antacid.
Nesistemski antacidi u pravilu su netopljivi, dugo djeluju u želucu, ne apsorbiraju se i učinkovitiji su. Njihovim trošenjem tijelo ne gubi ni katione (vodik) ni anione (klor), a nema ni promjena u acidobaznom stanju. Učinak nesistemskih antacida razvija se sporije, ali traje duže.
Aluminijev hidroksid (aluminium hydroxide; Aluminii hydroxydum) je lijek s umjerenim antacidnim učinkom, djeluje brzo i učinkovito, sa značajnim učinkom za oko 60 minuta.
Lijek veže pepsin, smanjuje njegovu aktivnost, potiskuje stvaranje pepsinogena i povećava izlučivanje sluzi. Jedan gram aluminijevog hidroksida neutralizira 250 ml decinormalne otopine klorovodične kiseline na pH = 4,0. Osim toga, lijek ima adstrigentno, omotajuće i adsorbirajuće djelovanje. Nuspojave: ne podnose svi bolesnici dobro adstringentno djelovanje lijeka, što se može manifestirati mučninom; uzimanje aluminijskih pripravaka prati zatvor, pa se pripravci koji sadrže aluminij kombiniraju s magnezijevim pripravcima. Aluminijev hidroksid potiče uklanjanje fosfata iz tijela. Lijek je indiciran za bolesti s povećanim lučenjem želučanog soka (klorovodične kiseline): čirevi, gastritis, gastroduodenitis, trovanje hranom, nadutost. Prepisati aluminijev hidroksid oralno u obliku 4% vodene suspenzije, 1-2 žličice po dozi (4-6 puta dnevno).
Magnezijev oksid (Magnesii oxydum; prašak, gel, suspenzija) - paljeni magnezij - jaki antacid, aktivniji od aluminijevog hidroksida, djeluje brže, duže i ima laksativni učinak. Svaki od navedenih antacida ima i prednosti i nedostatke. U tom smislu koriste se njihove kombinacije. Kombinacija aluminijevog hidroksida u obliku posebnog uravnoteženog gela, magnezijevog oksida i D-sorbitola omogućila je dobivanje jednog od trenutno najčešćih i najučinkovitijih antacida - Almagela (Almagel; 170 ml; lijek je dobio ime po riječi al-aluminij, ma-magnezij, gel-gel). Lijek ima antacidni, adsorbirajući i obavijajući učinak. Oblik doziranja gela potiče ravnomjernu raspodjelu sastojaka po površini sluznice i produljuje učinak. D-sorbitol potiče izlučivanje žuči i laksaciju.
Indikacije za uporabu: čir na želucu i dvanaesniku, akutni i kronični hiperacidni gastritis, gastroduodenitis, ezofagitis, refluksni ezofagitis, Zollinger-Ellisonov sindrom, trudnička žgaravica, kolitis, nadutost itd. Postoji lijek Almagel-A, koji dodatno sadrži almagel Anestezin je također dodan, koji daje i lokalni anestetički učinak i potiskuje lučenje gastrina.
Almagel se obično koristi 30-60 minuta prije jela, a također i unutar sat vremena nakon jela. Lijek se propisuje pojedinačno ovisno o mjestu procesa, kiselosti želučanog soka itd. Pripravci slični almagelu: - gastrogel; - fosfalugel sadrži aluminijev fosfat i koloidne gelove pektina i agar-agara, koji vežu i apsorbiraju toksine i plinove, kao i bakterije, smanjuju aktivnost pepsina; - megalac; - mylanta sadrži aluminijev hidroksid, magnezijev oksid i simetikon; - gastal - tablete, koje sadrže: 450 mg aluminijevog hidroksida - magnezijev karbonatni gel, 300 mg magnezijevog hidroksida.
Trenutno najpopularniji lijek iz skupine antacida je lijek Maalox. Sastav lijeka uključuje aluminijev hidroksid i magnezijev oksid. Maalox je dostupan u obliku suspenzije i tableta; 5 ml Maalox suspenzije sadrži 225 mg aluminijevog hidroksida, 200 mg magnezijevog oksida i neutralizira 13,5 mmol klorovodične kiseline; Tablete sadrže 400 mg aluminijevog hidroksida i magnezijevog oksida, pa imaju najveću aktivnost neutralizacije kiseline (do 18 mmol klorovodične kiseline). Maalox-70 je još aktivniji (do - 35 mmol klorovodične kiseline).
Lijek je indiciran za gastritis, duodenitis, peptički ulkus želuca i duodenuma, refluksni ezofagitis.
LIJEKOVI KOJI ŠTITE ŽELUDČANU SLUZNICU OD KISELO-PEPTIČNOG DJELOVANJA I POBOLJŠAVAJU PROCESE OBNAVLJANJA
1. Pripravci bizmuta (vikalin, vikair, de-nol).
2. Venter.
3. Pripravci prostaglandina.
4. Dalargin.
Pripravci bizmuta koriste se kao adstrigenti i antiseptici u liječenju bolesnika s peptičkim ulkusom. Najčešće su to kombinirane tablete - vikalin (bizmutov bazični nitrat, natrijev bikarbonat, prah rizoma calamusa, kora krkavine, rutin i kelina). Posljednjih godina u medicinsku praksu ušli su lijekovi koji bolje štite sluznicu od kiselo-peptičkog učinka. To su pripravci koloidnog bizmuta druge generacije, od kojih je jedan de-nol (De-nol; 3-kalijev dicitrat bizmutat; svaka tableta sadrži 120 mg koloidnog bizmut subcitrata). Ovaj lijek obavija sluznicu, stvarajući na njoj zaštitni koloidni proteinski sloj. Ne djeluje antacidno, ali ispoljava antipeptičko djelovanje vezanjem pepsina. Lijek također ima antimikrobni učinak, značajno je učinkovitiji od antacida koji sadrže bizmut u povećanju otpornosti sluznice. De-nol se ne može kombinirati s antacidima. Lijek se koristi za bilo koju lokaciju čira, visoko je učinkovit za: čireve želuca i dvanaesnika koji dugo ne ostavljaju ožiljke; peptički ulkus kod pušača; prevencija recidiva peptičkog ulkusa; kronični gastritis.
Propisati 1 tabletu tri puta dnevno pola sata prije jela i 1 tabletu prije spavanja. De-nol je kontraindiciran kod teškog zatajenja bubrega.
Venter (sukralfat; 0,5 tableta) je bazična aluminijeva sol saharoza oktasulfata. Antiulkusni učinak temelji se na vezivanju proteina mrtvog tkiva u složene komplekse koji čine snažnu barijeru. Lokalno se neutralizira želučani sok, usporava se djelovanje pepsina, a lijek apsorbira i žučne kiseline. Lijek je fiksiran na mjestu čira šest sati. Venter i de-nol uzrokuju ožiljke duodenalnog ulkusa nakon tri tjedna. Sukralfat se koristi 1,0 četiri puta dnevno prije jela, a također i prije spavanja. Nuspojave: zatvor, suha usta.
Solcoseryl je ekstrakt krvi goveda bez proteina. Štiti tkiva od hipoksije i nekroze. Koristi se za trofične čireve bilo koje lokacije. Primjenjujte 2 ml 2-3 puta dnevno, intravenski i intramuskularno, do zacjeljivanja čira.
Pripravci prostaglandina: misoprostol (Cytotec) itd. Pod utjecajem ovih lijekova smanjuje se kiselost želučanog soka, pojačava pokretljivost želuca i crijeva, utvrđuju se povoljni učinci na ulceroznu nišu u želucu. Lijekovi također imaju reparativni, hipoacidni (povećavanjem proizvodnje sluzi), hipotenzivni učinak. Misoprostol (tablica: 0,0002) je pripravak prostaglandina E2, koji se dobiva iz biljnog materijala. Sinonim: sitetech. Pripravci prostaglandina indicirani su za akutne i kronične čireve želuca i dvanaesnika. Nuspojave: prolazni proljev, blaga mučnina, glavobolja, bolovi u trbuhu.
Dalargin (Dalarginum; u amp. i bočici po 0,001) je lijek peptidne prirode, pospješuje zacjeljivanje čira na želucu i dvanaesniku, smanjuje kiselost želučanog soka, djeluje hipotenzivno. Lijek je indiciran za pogoršanje želučanog i duodenalnog ulkusa.
Na+/K+-ATPaza pripada P-tipu ATPaza, bliska Ca2+-ATPazi i H+-ATPazi
Na+/K+ ATPaza održava gradijent Na+ i K* kroz plazma membranu
Na+/K+ ATP-aza plazma membrane je generator električnog naboja: prenosi tri Na+ iona iz stanice za svaka dva K+ iona koja pumpa u stanicu
Radni ciklus Na+/K+-ATPaze opisan je Post-Albersovom shemom, prema kojoj enzim rotira između dvije glavne konformacije
U vezi sa sve stanice u okolinu negativno nabijen. To je zbog prisutnosti blagog viška pozitivno nabijenih molekula u izvanstaničnom prostoru i suprotne situacije u citosolu. Za normalno funkcioniranje stanice potreban je elektrokemijski gradijent duž stranica plazma membrane.
S tim u vezi ćelija nalikuje električnoj bateriji s odvojenim nabojima koji se mogu koristiti za obavljanje posla. U stanicama sisavaca koncentracijski gradijenti Na+ i K+ dvije su glavne komponente transmembranskog elektrokemijskog gradijenta. Unutar stanice, u usporedbi s izvanstaničnim okolišem, održava se niža koncentracija Na+ iona i viša koncentracija K+ iona.
Obrazovanje i održavanje elektrokemijski gradijent Ioni Na+ i K+ u životinjskim stanicama nastaju uz sudjelovanje Na+/K+-ATPaze, koja je ionska pumpa koja koristi energiju hidrolize ATP-a za prijenos kationa. Uz pomoć ovog enzima u stanici se uspostavlja negativni membranski potencijal mirovanja, uz pomoć kojeg se kontrolira potrebna razina osmotskog tlaka, koji ne dopušta lizu ili skupljanje stanice te osigurava Na+-ovisni sekundarni transport molekula.
Na+/K+-ATPaza pripada skupini P-tipa ATPaza, koja također uključuje Ca2+-ATPazu sarkoplazmatskog retikuluma, o čemu je bilo riječi u posebnom članku na stranici (preporučamo korištenje obrasca za pretraživanje na glavnoj stranici stranice).
ATPaze tipa P su enzima, koji nakon autofosforilacije ostatka asparaginske kiseline tijekom transporta iona stvaraju fosforilirani međuprodukt. Tijekom autofosforilacije P-tipa ATPaza, γ-fosfatna skupina ATP-a prenosi se na aktivno mjesto enzima. Za svaku hidroliziranu molekulu ATP-a izmjenjuju se tri iona Na+ iz citosola i dva iona K+ iz izvanstanične okoline. Na+/K+-ATPaza radi brzinom od 100 okretaja u 1 s.
Po u usporedbi s protokom iona kroz pore kanala, čini se da je takva brzina transporta niska. Transport kroz kanale odvija se brzinom od 107-108 iona po 1 s, tj. blizu brzine difuzije iona u vodi.
Post-Albersov dijagram za radni ciklus Na+/K+-ATFaze.Makroergička fosfatna veza označena je E1-P.
Slika u sredini prikazuje cijeli ciklus enzima.
Prikazani su gradijenti iona Na+ i K+ duž stranica plazma membrane životinjske stanice u mirovanju.
Glavne faze ciklusa enzimskog prijenosa iona koji se odvijaju uključujući Na+/K+ATPazu. Predstavljeni su u Post-Albersovom dijagramu. Ova je shema izvorno predložena za Na+/K+ ATPazu, a zatim je korištena za identifikaciju specifičnih molekularnih stanja svih P-tipa ATPaza. Prema Post-Albersovoj shemi, ATPaze P-tipa mogu usvojiti dvije različite konformacije, koje su označene kao enzim 1 (E1) i enzim 2 (E2). Budući da su u tim konformacijama, sposobni su vezati, uhvatiti i transportirati ione. Ove konformacijske promjene nastaju uslijed reakcije fosforilacije-defosforilacije:
U konformaciji se unutarstanični ioni ATP i Na+ vežu s visokim afinitetom za ATPazu. U tom slučaju enzim prelazi u stanje E1ATP(3Na+), dolazi do -ovisne fosforilacije ostatka asparaginske kiseline i hvatanja tri iona Na+ u E1 - P(3Na+) konformaciji.
Daljnja promjena konformacije dovodi do stvaranja E2-P stanja, smanjenja afiniteta za natrijeve ione i njihovog otpuštanja u izvanstanični prostor. Povećava se afinitet enzima za K+ ione.
Vezanje K+ iona smještenih u izvanstaničnom prostoru na ATPazu dovodi do defosforilacije E2-P(2K+) i hvatanja dva K+ iona uz prijelaz u E2(2K+) stanje.
Kada se unutarstanični ATP veže, konformacija se mijenja i ioni K+ se odvajaju. U tom slučaju nastaje stanje E1ATP, a vezanje unutarstaničnog natrija dovodi do konformacije E1ATP(3Na+).
Analiza primarna struktura proteina sugerira da sve ATPaze tipa P imaju istu prostornu strukturu i transportni mehanizam. Na+/K+-ATPaza sastoji se od dvije podjedinice, katalitičke a, koja je ista za sve ATPaze tipa P, i regulatorne podjedinice, b, koja je specifična za svaku ATPazu. Manja b podjedinica ima jednu transmembransku domenu koja stabilizira a podjedinicu i određuje orijentaciju ATPaze u membrani. U stanicama nekih tkiva aktivnost Na+/K+-ATPaze vjerojatno regulira drugi protein, γ podjedinica. Katalitička podjedinica a sadrži vezna mjesta za ATP, kao i za Na+ i K+ ione.
Ova podjedinica, kada je izolirana, sposobna je za transport iona, kao što je pokazano u eksperimentima heterologne ekspresije i elektrofiziološkim studijama.
Struktura podjedinice Na+/K+-ATPaze a, konstruiran na temelju podataka krioelektronske mikroskopije, nalikuje strukturi Ca2+-ATPaze SERCA. Kao i SERCA pumpa, ova se podjedinica sastoji od 10 transmembranskih α spirala. Unutarstanična P domena, smještena između transmembranskih segmenata 4 i 5, sadrži fosforilacijsko mjesto koje dijeli zajedničku strukturu sa svim P-tipom ATPaza. Ovo mjesto je predstavljeno ostatkom Asp376 u karakterističnom nizu Asp-Lys-Thr-Gly-Thr-Leu-Thr. Vezanje ATP i Na+ iona izaziva značajne promjene u konformaciji petlje koja povezuje N- i P-domenu. Ove promjene približavaju mjesto vezivanja ATP na N domeni mjestu fosforilacije na P domeni.
Na+/K+-ATPaza je ionska pumpa-generator. U normalnim fiziološkim uvjetima, slobodna energija hidrolize ATP-a (ΔGATP) troši se na prijenos tri iona Na+ iz stanice u zamjenu za dva iona kalija, a ioni se transportiraju suprotno svom koncentracijskom gradijentu. Time stanica gubi svoj ukupni pozitivni naboj. To potiče povećanje negativnog naboja citosola u usporedbi s izvanstaničnim okolišem. Kao rezultat, razlika potencijala i osmotski ionski gradijent nastaju na stranama stanične membrane.
ATPaze tipa P su ionske pumpe koje koriste energiju hidrolize ATP-a za održavanje transmembranskog ionskog gradijenta. Budući da je svaki korak enzimskog ciklusa reverzibilan, P-tip ATPaze može, u načelu, proizvesti ATP koristeći energiju transmembranskog potencijala. Dakle, Na+/K+-ATPaza ima određenu sposobnost funkcioniranja u suprotnom smjeru. U tom će slučaju ioni Na+ ući u stanicu, a ioni K+ izaći iz nje, što će dovesti do toga da će protok iona biti pretežno usmjeren u stanicu.
Obični transport iona Na+ iz stanice i iona K+ u stanicu se događa sve dok vrijednost ΔGATP premašuje elektrokemijsku energiju odgovarajućeg ionskog gradijenta. Kada energija potrebna za aktivni transport iona Na+ i K+ postane jednaka ΔGATP, protok iona prestaje. Ova vrijednost predstavlja potencijal za obrnuti rad Na+/K+-ATPaze, tj. vrijednost membranskog potencijala ispod kojeg enzim počinje djelovati u suprotnom smjeru. Reverzni potencijal je reda veličine -180 mV, što je puno negativnije od membranskog potencijala bilo koje stanice u fiziološkim uvjetima. Stoga je malo vjerojatno da protok iona Na+ može ući u stanicu, što ima opasne posljedice za nju.
Međutim, smanjenjem se sve može promijeniti zaliha krvi, na primjer, tijekom infarkta miokarda ili tijekom intoksikacija koje dovode do nedostatka ATP-a ili povećanja strmosti ionskih gradijenata. U konačnici, to može uzrokovati promjenu smjera transporta iona pomoću Na+/K+-ATPaze i smrt stanice.
Na+/K+-ATPaza meta je mnogih toksina i lijekova. Na primjer, biljni steroidi koji se nazivaju srčani glikozidi, kao što su ouabain i digitalis, specifični su inhibitori transporta iona koji provodi Na+/K+-ATPaza. Specifični inhibitori također uključuju druge toksine, poput palitoksina iz nekih morskih koralja i sangvinarina iz biljaka. Za razliku od srčanih glikozida, koji inhibiraju protok iona kroz Na+/K+-ATPazu, palitoksin i sangvinarin blokiraju ATPazu u otvorenoj konfiguraciji.
Time ioni mogu se transportirati u smjeru svojih koncentracijskih gradijenata, što dovodi do poremećaja elektrokemijskih gradijenata. Srčani glikozidi se reverzibilno vežu na mjesta Na+/K+-ATPaze smještena izvan stanice, čime inhibiraju hidrolizu ATP-a i transport iona. Pažljivo kontrolirana inhibicija Na+/K+-ATPaze stanica miokarda pomoću srčanih glikozida, kao što je digitalis, koristi se u liječenju zatajenja srca. Djelomična inhibicija subpopulacije Na+/K+-ATPaza srčanim glikozidima blago povećava unutarstaničnu koncentraciju Na+ iona, što dovodi do porasta koncentracije Ca2+ iona zbog transporta kroz Na+/Ca2+ antiporter. Poznato je da blagi porast intracelularne koncentracije kalcijevih iona povećava kontraktilnost srčanog mišića.
Protonska pumpa(sinonimi: protonska pumpa, H+/K+-ATPaza, vodik-kalij adenozin trifosfataza) je enzim koji ima ključnu ulogu u lučenju klorovodične kiseline u želucu.
Protonska pumpa se sastoji od dvije podjedinice: α-podjedinice, koja je polipeptidni lanac od 1033 aminokiselinske ostatke, i β-podjedinice, koja je glikoprotein koji sadrži 291 aminokiselinske ostatke, kao i citoplazmatske fragmente ugljikohidrata.Gornja slika (iz članka O.D. Lapina) prikazuje strukturu protonske pumpe: Polipeptidni lanacα -podjedinice deset puta prelaze membranu tvoreći 5 transmembranskih petlji. N- i C-krajeviα -podjedinice se nalaze u citoplazmi. Značajan dio polipeptidnog lanca (oko 800 aminokiselina) čini veliku citoplazmatsku domenu u kojoj se nalazi aktivno središte enzima, gdje se odvija hidroliza ATP-a. Kationi se kreću kroz membranu kroz kanal koji čine transmembranske petlje. N-krajβ -podjedinica se nalazi unutar citoplazme, njen polipeptidni lanac samo jednom prelazi membranu. Većina b-podjedinice nalazi se na izvanstaničnoj strani membrane. Sadrži područja koja su podvrgnuta glikozilaciji.
Prisutna u velikim količinama u parijetalnim stanicama želučane sluznice, protonska pumpa (H+/K+-ATPaza) prenosi vodikov ion H+ iz citoplazme u želučanu šupljinu kroz apikalnu membranu parijetalnih stanica u zamjenu za ion kalija K+, koji nosi unutar stanice. U tom se slučaju oba kationa transportiraju protiv elektrokemijskog gradijenta, a izvor energije za taj transport je hidroliza molekule ATP-a. Istovremeno s protonima vodika, anioni klora Cl - prenose se u lumen želuca protiv elektrokemijskog gradijenta. K + ioni koji ulaze u stanicu napuštaju je uz koncentracijski gradijent zajedno s Cl - ionima kroz apikalnu membranu parijetalnih stanica. H + ioni nastaju u ekvivalentnim količinama s HCO 3 - tijekom disocijacije ugljične kiseline H 2 CO 3 uz sudjelovanje karboanhidraze. HCO 3 - ioni pasivno se kreću u krv uz koncentracijski gradijent kroz bazolateralnu membranu u zamjenu za Cl - ion. Tako se klorovodična kiselina otpušta u lumen želuca uz sudjelovanje protonske pumpe u obliku H + i Cl - iona, a K + ioni se kreću kroz membranu natrag u parijetalnu stanicu.
Inhibitori protonske pumpe
Djelovanje inhibitora protonske pumpe (PPI), najučinkovitije antiulkusne skupine lijekova, temelji se na blokiranju protonske pumpe. Apsorbirani u tankom crijevu i ulazeći krvotokom u želučanu sluznicu, inhibitori protonske pumpe nakupljaju se u sekretornim tubulima parijetalnih stanica. Ovdje se PPI (pri kiselom pH) aktivira i, zahvaljujući transformaciji ovisnoj o kiselini, transformira u tetraciklički sulfenamid, koji je kovalentno ugrađen u glavne cisteinske skupine protonske pumpe, čime se isključuje mogućnost njegove konformacijske prijelaze i time blokira mogućnost proizvodnje klorovodične kiseline od strane parijetalne stanice.Svi inhibitori protonske pumpe (omeprazol, pantoprazol, lansoprazol, rabeprazol i esomeprazol) su derivati benzimidazola i imaju sličnu kemijsku strukturu, a razlikuju se samo u strukturi radikala na piridinskom i benzimidazolskom prstenu.
Kalij-kompetitivni blokatori
Poput inhibitora protonske pumpe, kalij-kompetitivni blokatori također blokiraju protonsku pumpu (H + /K + -ATPaza). Međutim, za razliku od inhibitora protonske pumpe, koji svoj učinak suzbijanja kiseline ostvaruju putem kovalentnog vezanja na cisteinske skupine H + /K + -ATPaze, K-KBA kompetitivno stupa u interakciju s ionskom K + -vezujućom domenom H + /K + -ATPaza.U 2006. prvi kalij-kompetitivni blokator