Arsen je opasna, ali neophodna supstanca. Šta je arsen? Karakteristike, svojstva i primena Arsen kojoj porodici pripada
Arsenic- mineral iz klase autohtonih elemenata, polumetala, hemijske formule As. Uobičajene nečistoće su Sb, S, Fe, Ag, Ni; rjeđe, Bi i V. Sadržaj As u prirodnom arsenu dostiže 98%. Hemijski element 15. grupe (prema zastarjeloj klasifikaciji - glavna podgrupa pete grupe) četvrtog perioda periodnog sistema; ima atomski broj 33. Arsen (sirovi arsen) je čvrsta supstanca ekstrahirana iz prirodnih arsenopirita. Postoji u dva glavna oblika: običnom, takozvanom "metalnom" arsenu, u obliku sjajnih kristala čelične boje, krhkog, nerastvorljivog u vodi, i žutog arsena, kristalnog, prilično nestabilnog. Arsen se koristi u proizvodnji arsenik disulfida, grube sačme, tvrde bronce i raznih drugih legura (kalaj, bakar itd.)
Vidi također:
STRUKTURA
 Kristalna struktura arsena je ditrigonalno-skaloedarska simetrija. Singonija trigonalna, c. With. L633L23PC. Kristali su izuzetno rijetki, imaju romboedarski ili pseudokubični habitus.
Kristalna struktura arsena je ditrigonalno-skaloedarska simetrija. Singonija trigonalna, c. With. L633L23PC. Kristali su izuzetno rijetki, imaju romboedarski ili pseudokubični habitus. Ustanovljeno je nekoliko alotropskih modifikacija arsena. U normalnim uslovima, metalni ili sivi arsen (alfa-arsen) je stabilan. Kristalna rešetka sivog arsena je romboedarska, slojevita, sa periodom a = 4,123 A, uglom a = 54° 10'. Gustina (na temperaturi od 20 ° C) 5,72 g / cm 3; temperaturni koeficijent. linearna ekspanzija 3,36 10 stepeni; specifični električni otpor (temperatura 0°C) 35 10 -6 ohm cm; HB = w 147; koeficijent kompresibilnost (na temperaturi od 30°C) 4,5 x 10 -6 cm 2 / kg. Tačka topljenja alfa-arsena je 816 °C pri pritisku od 36 atmosfera.
Pod bankomatom. pritiska, arsen sublimira na temperaturi od 615 ° C bez topljenja. Toplota sublimacije je 102 cal/g. Pare arsena su bezbojne, do temperature od 800 °C sastoje se od As 4 molekula, od 800 do 1700 °C - od mješavine As 4 i As 2, iznad temperature od 1700 °C - samo od As 2. Brzom kondenzacijom pare arsena na površini hlađenoj tečnim zrakom nastaje žuti arsen - prozirni mekani kristali kubnog sistema gustoće od 1,97 g / cm 3. Poznate su i druge metastabilne modifikacije arsena: beta-arsen - amorfno staklast, gama-arsen - žuto-smeđi i delta-arsen - smeđi amorfni sa gustoćom od 4,73, respektivno; 4,97 i 5,10 g/cm3. Iznad 270°C, ove modifikacije se pretvaraju u sivi arsen.
NEKRETNINE
 Boja na svježem prijelomu je cink-bijela, kalaj-bijela do svijetlo siva, brzo tamni zbog stvaranja tamnosive nijanse; crna na istrošenoj površini. Mohsova tvrdoća 3 - 3,5. Gustina 5,63 - 5,8 g/cm 3. Fragile. Dijagnosticira se karakterističnim mirisom bijelog luka pri udaru. Dekolte savršen prema (0001) i manje savršen prema (0112). Prijelom je zrnast. Oud. težina 5,63-5,78. Ploča je siva, kositar bijela. Metalni sjaj, jak (u svježem lomu), brzo blijedi i postaje mat na oksidiranoj, pocrnjeloj površini tokom vremena. Dijamagnetski je.
Boja na svježem prijelomu je cink-bijela, kalaj-bijela do svijetlo siva, brzo tamni zbog stvaranja tamnosive nijanse; crna na istrošenoj površini. Mohsova tvrdoća 3 - 3,5. Gustina 5,63 - 5,8 g/cm 3. Fragile. Dijagnosticira se karakterističnim mirisom bijelog luka pri udaru. Dekolte savršen prema (0001) i manje savršen prema (0112). Prijelom je zrnast. Oud. težina 5,63-5,78. Ploča je siva, kositar bijela. Metalni sjaj, jak (u svježem lomu), brzo blijedi i postaje mat na oksidiranoj, pocrnjeloj površini tokom vremena. Dijamagnetski je.
MORFOLOGIJA
 Arsen se obično opaža u obliku kora sa sinterovanom bubrežastom površinom, stalaktita, školjkastih formacija, koje otkrivaju kristalno-zrnastu strukturu u lomu. Prirodni arsen je prilično lako prepoznatljiv po obliku eksudata, pocrnjeloj površini, značajnoj specifičnoj težini, snažnom metalnom sjaju na svježem lomu i savršenom cijepanju. Ispod duvačke cijevi isparava bez topljenja (na temperaturi od oko 360°), ispuštajući karakterističan miris bijelog luka i formirajući bijeli premaz As 2 O 3 na uglju. U tečno stanje prelazi samo pri povećanom vanjskom pritisku. U zatvorenoj tubi formira ogledalo arsena. Oštrim udarcem čekićem emituje miris belog luka.
Arsen se obično opaža u obliku kora sa sinterovanom bubrežastom površinom, stalaktita, školjkastih formacija, koje otkrivaju kristalno-zrnastu strukturu u lomu. Prirodni arsen je prilično lako prepoznatljiv po obliku eksudata, pocrnjeloj površini, značajnoj specifičnoj težini, snažnom metalnom sjaju na svježem lomu i savršenom cijepanju. Ispod duvačke cijevi isparava bez topljenja (na temperaturi od oko 360°), ispuštajući karakterističan miris bijelog luka i formirajući bijeli premaz As 2 O 3 na uglju. U tečno stanje prelazi samo pri povećanom vanjskom pritisku. U zatvorenoj tubi formira ogledalo arsena. Oštrim udarcem čekićem emituje miris belog luka. PORIJEKLO
 Arsen se javlja u hidrotermalnim naslagama kao metakoloidne formacije u šupljinama, koje su očigledno nastale u poslednjim trenucima hidrotermalne aktivnosti. U vezi s njim mogu se javiti arsen, antimon, a rjeđe i sumporna jedinjenja nikla, kobalta, srebra, olova i dr., kao i nemetalni minerali, različitog sastava.
Arsen se javlja u hidrotermalnim naslagama kao metakoloidne formacije u šupljinama, koje su očigledno nastale u poslednjim trenucima hidrotermalne aktivnosti. U vezi s njim mogu se javiti arsen, antimon, a rjeđe i sumporna jedinjenja nikla, kobalta, srebra, olova i dr., kao i nemetalni minerali, različitog sastava.
U literaturi postoje indicije o sekundarnom poreklu arsena u zonama trošenja ležišta ruda arsena, što je, uopšteno govoreći, malo verovatno, s obzirom da je u ovim uslovima veoma nestabilan i, brzo oksidirajući, potpuno se raspada. Crne kore se sastoje od fine mešavine arsena i arsenolita (As 2 O 3). Na kraju se formira čisti arsenolit.
U zemljinoj kori koncentracija arsena je niska i iznosi 1,5 ppm. Javlja se u tlu i mineralima i može se osloboditi u zrak, vodu i tlo kroz vjetar i vodenu eroziju. Osim toga, element ulazi u atmosferu iz drugih izvora. Kao rezultat vulkanskih erupcija godišnje se u vazduh ispusti oko 3 hiljade tona arsena, mikroorganizmi formiraju 20 hiljada tona isparljivog metilarsina godišnje, a kao rezultat sagorevanja fosilnih goriva oslobađa se 80 hiljada tona isti period.
Na teritoriji SSSR-a, izvorni arsen je pronađen u nekoliko ležišta. Od njih izdvajamo hidrotermalno olovno-cink ležište Sadon, gdje je više puta uočeno u obliku bubrežnih masa na kristalnom kalcitu sa galenom i sfaleritom. Na lijevoj obali rijeke pronađene su velike bubrežaste akumulacije autohtonog arsena koncentrične strukture ljuske. Chikoya (Transbaikalia). U paragenezi s njim uočen je samo kalcit u obliku rubova na zidovima tankih vena koje seku drevne kristalne škriljce. U obliku fragmenata (sl. 76), arsen je pronađen i na području sv. Dzhalinda, Amurska željeznica itd. i na drugim mjestima.
U brojnim nalazištima u Saskoj (Freiberg, Schneeberg, Annaberg i dr.) uočen je samorodni arsen u kombinaciji sa arsenim jedinjenjima kobalta, nikla, srebra, autohtonog bizmuta itd. Svi ovi i drugi nalazi ovog minerala su bez praktični značaj.
PRIMJENA
 Arsen se koristi za legiranje olovnih legura koje se koriste za pripremu sačme, jer kada se sačma lijeva metodom tornja, kapljice legure arsena i olova poprimaju strogo sferni oblik, a osim toga, čvrstoća i tvrdoća olova se značajno povećavaju. Arsen visoke čistoće (99,9999%) koristi se za sintetizaciju niza korisnih i važnih poluvodičkih materijala - arsenida (na primjer, galijev arsenid) i drugih poluvodičkih materijala sa kristalnom rešetkom tipa cinkove mješavine.
Arsen se koristi za legiranje olovnih legura koje se koriste za pripremu sačme, jer kada se sačma lijeva metodom tornja, kapljice legure arsena i olova poprimaju strogo sferni oblik, a osim toga, čvrstoća i tvrdoća olova se značajno povećavaju. Arsen visoke čistoće (99,9999%) koristi se za sintetizaciju niza korisnih i važnih poluvodičkih materijala - arsenida (na primjer, galijev arsenid) i drugih poluvodičkih materijala sa kristalnom rešetkom tipa cinkove mješavine. Jedinjenja arsena sulfida - orpiment i realgar - koriste se u slikarstvu kao boje i u industriji kože kao sredstvo za uklanjanje dlačica s kože. U pirotehnici, realgar se koristi za proizvodnju "grčke" ili "indijske" vatre, koja nastaje kada izgori mješavina realgara sa sumporom i nitratom (formira svijetli bijeli plamen kada se izgori).
Neka organoelementna jedinjenja arsena su hemijski ratni agensi, na primer, lewizit.
Početkom 20. stoljeća neki derivati kakodila, kao što je salvarsan, korišćeni su za liječenje sifilisa, s vremenom su ovi lijekovi istisnuti iz medicinske upotrebe za liječenje sifilisa drugim, manje toksičnim i učinkovitijim lijekovima bez arsena. pripreme.
Mnoga od spojeva arsena u vrlo malim dozama koriste se kao lijekovi za suzbijanje anemije i niza drugih teških bolesti, jer imaju klinički primjetan stimulativni učinak na niz specifičnih tjelesnih funkcija, posebno na hematopoezu. Od neorganskih spojeva arsena, anhidrid arsena se može koristiti u medicini za pripremu pilula i u stomatološkoj praksi u obliku paste kao nekrotizirajući lijek. Ovaj lijek se kolokvijalno i žargonski nazivao "arsen" i korišten je u stomatologiji za lokalnu nekrozu zubnog živca. Trenutno se preparati arsena rijetko koriste u stomatološkoj praksi zbog svoje toksičnosti. Sada su razvijene i koriste se i druge metode bezbolne nekroze živca zuba u lokalnoj anesteziji.
Arsen - As
KLASIFIKACIJA
| Strunz (8. izdanje) | 1/B.01-10 |
| Nickel-Strunz (10. izdanje) | 1.CA.05 |
| Dana (7. izdanje) | 1.3.1.1 |
| Dana (8. izdanje) | 1.3.1.1 |
| Hej, CIM Ref. | 1.33 |
| As | 33 |
Arsenic |
|||||||
| t o kip. (o C) | Korak.oksid | +5 +3 -3 | |||||||
|
74,9215 |
t o rastopiti (o C) | 817 (pod pritiskom) | Gustina | 5727 (siva) 4900 (crna) | |||||
| 4s 2 4p 3 | OEO | 2,11 | u zemlji kora | 0,00017 % | |||||
Naša priča govori o elementu koji nije baš uobičajen, ali nadaleko poznat; o elementu čija su svojstva kontradiktorna do tačke nekompatibilnosti. Takođe je teško pomiriti uloge koje je ovaj element igrao i igra u životu čovečanstva. U različitim vremenima, u različitim okolnostima, u različitim oblicima, djeluje kao otrov i kao ljekovito sredstvo, kao štetan i opasan otpadni proizvod, kao sastavni dio najkorisnijih, nezamjenjivih tvari. Dakle, element sa atomskim brojem 33.
Istorija u apstraktima
Budući da je arsen jedan od elemenata čiji tačan datum otkrića nije utvrđen, ograničavamo se na navođenje samo nekoliko pouzdanih činjenica:
arsen je poznat od davnina;
u spisima Dioskorida (1. vek nove ere), spominje se kalcinacija supstance koja se danas zove arsenik sulfid;
u 3.-4. vijeku, u fragmentarnim zapisima koji se pripisuju Zozimu, spominje se metalni arsen; grčki pisac Olimpijodor (5. vek nove ere) opisuje proizvodnju belog arsena prženjem sulfida;
u 8. veku arapski alhemičar Geber je dobio arsenik trioksid;
u srednjem vijeku ljudi su počeli da se susreću sa arsenik trioksidom pri preradi ruda koje sadrže arsen, a bijeli dim plinovitog As2O3 nazvan je rudni dim;
proizvodnja slobodnog metalnog arsena pripisuje se njemačkom alhemičaru Albertu von Bolstedtu i pripisuje se oko 1250. godine, iako su grčki i arapski alkemičari nesumnjivo primili arsen (zagrijavanjem njegovog trioksida s organskim supstancama) prije Bolsteda;
1733. godine dokazano je da je bijeli arsen oksid metalnog arsena;
1760. godine, Francuz Louis Claude Cadé je dobio prvo organsko jedinjenje arsena, poznato kao Cadé tečnost ili "kakodil" oksid; formula ove supstance je [(CH3)2A]2O;
1775. Carl Wilhelm Scheele je dobio arsensku kiselinu i arsenov vodonik;
Godine 1789. Antoine Laurent Lavoisier je prepoznao arsen kao nezavisni hemijski element.
Elementarni arsen je srebrno-siva ili kalajno bijela supstanca, u svježem lomu ima
metalni sjaj. Ali brzo bledi u vazduhu. Kada se zagrije iznad 600°C, arsen sublimira bez topljenja, a pod pritiskom od 37 atm topi se na 818°C. Arsen je jedini metal čija tačka ključanja pri normalnom pritisku leži ispod tačke topljenja.
Arsen je otrov
U glavama mnogih, riječi "otrov" i "arsen" su identične. Tako se to istorijski desilo. Postoje priče o Kleopatrinim otrovima. Otrovi iz Locuste bili su poznati u Rimu. Otrov je također bio uobičajen alat za eliminaciju političkih i drugih protivnika u srednjovjekovnim talijanskim republikama. U Veneciji su, na primjer, vještaci za trovanje držani na sudu. A glavna komponenta gotovo svih otrova bio je arsen.
U Rusiji je zakon o zabrani prodaje „ulja vitriola i ćilibara, jake votke, arsena i cilibuhe“ privatnim licima izdan još u vrijeme vladavine Ane Ioannovne - u januaru 1733. godine. Zakon je bio izuzetno strog i glasio je: „Ko će ubuduće trgovati tim arsenom i drugim gore navedenim materijalima i biti s njim uhvaćen ili kome će biti prijavljen, taj će biti strogo kažnjen i prognan u progonstvo bez ikakve milosti, isto će biti naneseni onima koji prolaze pored apoteka i gradskih vijećnica od kojih će kupovati. A ako će neko, kupivši takve otrovne materije, popraviti štetu ljudima, oni za kojima se traga biće ne samo mučeni, već će i smrtno pogubljeni, zavisno od važnosti stvari.
Vekovima su jedinjenja arsena privlačila (i nastavljaju da privlače) pažnju farmaceuta, toksikologa i forenzičara.
Kriminalisti su naučili da nepogrešivo prepoznaju trovanje arsenom. Ako se u želucu otrovanog pronađu bijela zrnca nalik na porculan, onda je prvo posumnjati na anhidrid arsena As2O3. Ova zrna, zajedno sa komadićima uglja, stavljaju se u staklenu cev, zatvaraju i zagrevaju. Ako se u epruveti nalazi As2O3, tada se na hladnim dijelovima cijevi pojavljuje sivo-crni sjajni prsten od metalnog arsena.
Nakon hlađenja, kraj cijevi se odlomi, ugalj se uklanja, a sivo-crni prsten se zagrijava. U ovom slučaju, prsten se destilira do slobodnog kraja cijevi, dajući bijeli premaz anhidrida arsena. Ovdje su reakcije:
As2O3 + 3S == As2 + 3SO
ili
2As2O3 + 3S = 2AS2 + 3CO2;
2As2+3O2==2As2O3.
Dobiveni bijeli plak se stavlja pod mikroskop: čak i pri malom povećanju vidljivi su karakteristični sjajni kristali u obliku oktaedara.
Arsen ima sposobnost da dugo ostane na jednom mjestu. Zbog toga se tokom forenzičko-hemijskog istraživanja u laboratoriju dostavljaju uzorci zemlje sa šest lokaliteta u blizini mjesta ukopa osobe koja je mogla biti otrovana, kao i dijelovi njegove odjeće, nakita i daske lijesova.
Simptomi trovanja arsenom su metalni ukus u ustima, povraćanje, jak bol u stomaku. Kasnije konvulzije, paraliza, smrt. Najpoznatiji i najrasprostranjeniji antidot za trovanje arsenom je mlijeko, tačnije, glavni mliječni protein kazein, koji sa arsenom stvara nerastvorljivo jedinjenje koje se ne apsorbira u krv.
Arsen u obliku anorganskih preparata je smrtonosan u dozama od 0,05-0,1 g, a ipak je arsen prisutan u svim biljnim i životinjskim organizmima. (To je dokazao francuski naučnik Orfila još 1838.) Morski biljni i životinjski organizmi sadrže u prosjeku stotine hiljada, a slatkovodni i kopneni - milioniti dio procenta arsena. Mikročestice arsena apsorbuju i ćelije ljudskog tela, element br. 33 se nalazi u krvi, tkivima i organima; posebno mnogo u jetri - od 2 do 12 mg po 1 kg težine. Naučnici sugeriraju da mikrodoze arsena povećavaju otpornost organizma na djelovanje štetnih mikroba.
Arsen je lijek
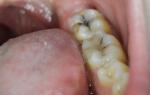
Doktori navode da je zubni karijes najčešća bolest našeg vremena. Teško je naći osobu koja nema bar jedan plombiran zub. Bolest počinje uništavanjem vapnenačkih soli zubne cakline, a potom patogeni mikrobi započinju svoj gadan posao. Prodirući kroz oslabljeni oklop zuba, napadaju njegovu mekšu unutrašnjost. Formira se “karijes”, a ako imate sreće da u ovoj fazi budete kod stomatologa, možete relativno lako izaći: karijesna šupljina će se očistiti i ispuniti materijalom za punjenje, a zub će ostati živ. Ali ako se na vrijeme ne obratite liječniku, karijesna šupljina dospijeva do pulpe, tkiva koje sadrži živce, krvne i limfne žile. Počinje njegova upala, a onda doktor, kako bi izbjegao najgore, odlučuje da ubije živac. Daje se naredba: „arsenik!“, i zrno paste veličine glave igle stavlja se na pulpu koju instrument otkriva. Arsenska kiselina, koja je dio ove paste, brzo difundira u pulpu (bol koji se osjeća u isto vrijeme nije ništa drugo do “posljednji krik” umiruće pulpe), a nakon 24-48 sati sve je gotovo - zub je mrtav. Sada doktor može bezbolno ukloniti pulpu i ispuniti pulpnu komoru i korijenske kanale antiseptičkom pastom i zapečatiti „rupu“.
Arsen i njegova jedinjenja koriste se ne samo u stomatologiji. Salvarsan, 606. preparat Paula Ehrlicha, njemačkog ljekara koji je otkrio prvo efikasno sredstvo za suzbijanje luesa početkom 20. vijeka, stekao je svjetsku slavu. Bio je to zaista 606. preparat arsena koji je testirao Ehrlich. Ovom žutom amorfnom prahu prvobitno je dodijeljena formula
Tek 50-ih godina, kada se salvarsan više nije koristio kao lijek protiv luskavice, malarije i povratne groznice, sovjetski naučnik M. Ya. Kraft ustanovio je njegovu pravu formulu. Pokazalo se da salvarsan ima polimernu strukturu
Vrijednost P ovisno o načinu dobivanja, može se kretati od 8 do 40.
Salvarsan je zamijenjen drugim lijekovima s arsenom, efikasnijim i manje toksičnim, posebno njegovim derivatima: novarsenolom, miarsenol, itd.
Neka neorganska jedinjenja arsena se takođe koriste u medicinskoj praksi. Arsenov anhidrid As2O3, kalijum arsenit KAsO2, natrijum hidrogen arsenat Na2HAsO4. 7H2O (u minimalnim dozama, naravno) inhibiraju oksidativne procese u tijelu, povećavaju stvaranje krvi. Iste supstance - kao i vanjske - propisane su za određene kožne bolesti. Naime, arsenu i njegovim spojevima pripisuje se ljekovito djelovanje nekih mineralnih voda.
Smatramo da su navedeni primjeri dovoljni da potvrde tezu sadržanu u naslovu ovog poglavlja.
Arsen je oružje za uništavanje
Opet se moramo vratiti na smrtonosna svojstva elementa br. 33. Nije tajna da je bio naširoko korišćen, a možda i dalje u upotrebi, u proizvodnji hemijskog oružja, ne manje kriminalnog od nuklearnog. O tome svjedoči iskustvo iz Prvog svjetskog rata. Informacije koje su procurile u štampu o upotrebi otrovnih supstanci od strane trupa imperijalističkih država u Abesiniji (Italija), Kini (Japan), Koreji i Južnom Vijetnamu (SAD) govore o istoj stvari.
Jedinjenja arsena su uključena u sve glavne grupe poznatih hemijskih ratnih agenasa (0V). Među 0V opšte toksičnog dejstva su arsin, arsenov vodonik AsH3 (usputno primećujemo da su otrovnija jedinjenja trovalentnog arsena, čija jedinjenja u kojima je arsen petovalentna). Ovo najotrovnije od svih jedinjenja arsena, dovoljno je da se pola sata udahne vazduh, čija litra sadrži 0,00005 g AsH3, da bi se za nekoliko dana otislo na onaj svet. Koncentracija AsH3 0,005g/l ubija odmah. Smatra se da je biohemijski mehanizam djelovanja AsH3 da njegovi molekuli "blokiraju" molekule enzima eritrocita - katalaze; zbog toga se vodikov peroksid nakuplja u krvi, uništavajući krv. Aktivni ugljen slabo upija arsin, tako da obična gas maska nije zaštita od arsina.
Tokom Prvog svjetskog rata bilo je pokušaja upotrebe arsina, ali je hlapljivost i nestabilnost ove tvari pomogla da se izbjegne njegova masovna upotreba. Sada, nažalost, postoje tehničke mogućnosti za dugotrajnu kontaminaciju područja arsinom. Nastaje reakcijom nekih metalnih arsenida s vodom. A sami arsenidi su opasni za ljude i životinje, to su dokazale američke trupe u Vijetnamu. . . Arsenide mnogih metala takođe treba klasifikovati kao agense opšteg delovanja.
Druga velika grupa toksičnih supstanci - nadražujuće supstance - sastoji se gotovo u potpunosti od jedinjenja arsena. Njegovi tipični predstavnici su difenilkloroarsin (C6H5)2AsCl i difenilcijanoarsin (C6H5)2AsCN.
Supstance ove grupe selektivno djeluju na nervne završetke sluznice - uglavnom na membrane gornjih dišnih puteva. To uzrokuje refleksnu reakciju tijela da se riješi nadražujuće tvari kihanjem ili kašljanjem. Za razliku od suzava, ove tvari, čak i kod blagog trovanja, djeluju i nakon što oboljela osoba pobjegne iz zatrovane atmosfere. U roku od nekoliko sati, osoba se trese od mučnog kašlja, pojavljuje se bol u grudima i glavi, suze počnu nehotice teći. Plus, povraćanje, otežano disanje, osjećaj straha; sve to dovodi do potpune iscrpljenosti. Osim toga, ove tvari uzrokuju opće trovanje tijela.
Među otrovne tvari s mjehurastim djelovanjem je lewisite, koji reagira sa sulfohidril SH-grupama enzima i remeti tok mnogih biohemijskih procesa. Apsorbiran kroz kožu, lewisite izaziva opće trovanje organizma. Ova okolnost je svojevremeno dala Amerikancima razlog da reklamiraju lewisite pod nazivom "rosa smrti".
Ali dosta o tome. Čovječanstvo živi u nadi da otrovne tvari o kojima smo govorili (i još mnogo sličnih) nikada više neće biti korištene.
Arsen - stimulans tehnološkog napretka
Najperspektivnije polje primjene arsena je nesumnjivo poluvodička tehnologija. U njemu su poseban značaj dobili galijum arsenidi GaAs i indijum arsenidi InAs. Galijum arsenid je važan i za novi pravac u elektronskoj tehnologiji - optoelektroniku, koji je nastao 1963-1965. godine na razmeđu fizike čvrstog stanja, optike i elektronike. Isti materijal je pomogao u stvaranju prvih poluvodičkih lasera.
Zašto se pokazalo da su arsenidi obećavajući za poluvodičku tehnologiju? Da bismo odgovorili na ovo pitanje, prisjetimo se ukratko nekih od osnovnih koncepata fizike poluprovodnika: "valentni pojas", "zabranjeni pojas" i "provodni pojas".
Za razliku od slobodnog elektrona, koji može imati bilo koju energiju, elektron zatvoren u atomu može imati samo određene, dobro definirane vrijednosti energije. Od mogućih vrijednosti energije elektrona u atomu, dodaju se energetski pojasevi. Na osnovu dobro poznatog Paulijevog principa, broj elektrona u svakoj zoni ne može premašiti određeni određeni maksimum. Ako je traka prazna, onda, naravno, ne može sudjelovati u stvaranju provodljivosti. U provodljivosti ne učestvuju ni elektroni potpuno ispunjenog pojasa: budući da nema slobodnih nivoa, vanjsko električno polje ne može izazvati preraspodjelu elektrona i time stvoriti električnu struju. Provodljivost je moguća samo u djelomično ispunjenoj zoni. Stoga se tijela s djelomično ispunjenim pojasom nazivaju metalima, a tijela u kojima se energetski spektar elektronskog stanja sastoji od ispunjenih i praznih traka nazivaju se dielektricima ili poluprovodnicima.
Podsjećamo i da se potpuno ispunjene trake u kristalima nazivaju valentnim pojasima, djelomično ispunjene i prazne trake nazivaju se provodne trake, a energetski interval (ili barijera) između njih naziva se pojas pojasa,
Glavna razlika između dielektrika i poluvodiča leži upravo u pojasu u pojasu: ako je potrebna energija veća od 3 elektron-volta da se ona savlada, tada se kristal naziva dielektricima, a ako je manja, poluvodičima.
U poređenju sa klasičnim poluprovodnicima grupe IV, germanijumom i silicijumom, arsenidi grupe III imaju dve prednosti. Pojasni razmak i mobilnost nosilaca naboja u njima mogu varirati u širem rasponu. I što su nosioci naboja mobilniji, poluvodički uređaj može raditi na višim frekvencijama. Razmak između pojasa se bira ovisno o namjeni uređaja. Dakle, za ispravljače i pojačala dizajnirane za rad na povišenim temperaturama koristi se materijal s velikim razmakom pojasa, a za hlađene prijemnike infracrvenog zračenja koristi se materijal s malim razmakom.
Galijev arsenid je stekao posebnu popularnost jer ima dobre električne karakteristike, koje zadržava u širokom temperaturnom rasponu - od minus do plus 500°C. Za poređenje ističemo da indijum arsenid, koji po električnim svojstvima nije inferioran GaAs, počinje da ih gubi na sobnoj temperaturi, jedinjenja germanija - na 70-80°, a silicijum - na 150-200°C.
Arsen se takođe koristi kao dopant, koji "klasičnim" poluprovodnicima (Si, Ge) daje određenu vrstu provodljivosti (vidi članak "Germanijum"). U tom slučaju u poluprovodniku se stvara takozvani prelazni sloj, koji se, u zavisnosti od namene kristala, dopira na način da se dobije sloj na različitim dubinama. U kristalima namijenjenim za proizvodnju dioda, "skriveno" je dublje; ako su solarne baterije napravljene od poluvodičkih kristala, tada dubina prijelaznog sloja nije veća od jednog mikrona.
Arsen se kao vrijedan aditiv koristi u obojenoj metalurgiji. Dakle, dodatak 0,2-1% As olova značajno povećava njegovu tvrdoću. Sačma je, na primjer, uvijek napravljena od olova legiranog arsenom - inače nećete dobiti strogo sferni oblik sačme.
Dodatak 0,15-0,45% arsena bakru povećava njegovu zateznu čvrstoću, tvrdoću i otpornost na koroziju pri radu u gasovitom okruženju. Osim toga, arsen povećava fluidnost bakra tokom livenja, olakšava proces izvlačenja žice.
Arsen se dodaje nekim vrstama bronze, mesinga, babita, štamparskih legura.
A u isto vrijeme, arsen vrlo često šteti metalurzima. U proizvodnji čelika i mnogih obojenih metala, oni namjerno idu na kompliciranje procesa - samo da bi uklonili sav arsen iz metala. Prisustvo arsena u rudi čini proizvodnju štetnom. Štetno dvaput:
prvo, za zdravlje ljudi, i drugo, za metal - značajne nečistoće arsena pogoršavaju svojstva gotovo svih metala i legura.
Ovo je element br. 33, koji zaslužuje lošu reputaciju, a opet je vrlo koristan u mnogim slučajevima.
* Dvije vrste provodljivosti su detaljno opisane u članku "Germanium".
Sadržaj članka
ARSEN- hemijski element V grupe periodnog sistema, pripada porodici azota. Relativna atomska masa 74,9216. U prirodi, arsen je predstavljen samo jednim stabilnim nuklidom, 75 As. Više od deset njegovih radioaktivnih izotopa s poluraspadom od nekoliko minuta do nekoliko mjeseci također je umjetno dobiveno. Tipična oksidaciona stanja u jedinjenjima su –3, +3, +5. Naziv arsena na ruskom jeziku povezan je s upotrebom njegovih spojeva za istrebljenje miševa i pacova; Latinski naziv Arsenicum dolazi od grčkog "Arsen" - snažan, moćan.
Istorijski podaci.
Arsen pripada pet "alhemijskih" elemenata otkrivenih u srednjem veku (iznenađujuće, četiri od njih - As, Sb, Bi i P su u istoj grupi periodnog sistema - peti). U isto vrijeme, spojevi arsena su poznati od davnina, korišteni su za proizvodnju boja i lijekova. Posebno je zanimljiva upotreba arsena u metalurgiji.
Prije nekoliko milenijuma kameno doba je ustupilo mjesto bronzanom dobu. Bronza je legura bakra i kalaja. Istoričari veruju da je prva bronca izlivena u dolini Tigra i Eufrata, negde između 30. i 25. veka. BC. U nekim krajevima se topila bronza s posebno vrijednim svojstvima - bila je bolje livena i lakše se kovala. Kako su moderni naučnici otkrili, radilo se o leguri bakra koja sadrži od 1 do 7% arsena i ne više od 3% kalaja. Vjerovatno je u početku, prilikom njegovog topljenja, bogata ruda bakra malahit pomiješana sa produktima trošenja nekih također zelenih sulfidnih minerala bakra i arsena. Pošto su cijenili izvanredna svojstva legure, drevni majstori su tada posebno tražili minerale arsena. Za pretrage su koristili svojstvo takvih minerala da pri zagrijavanju daju specifičan miris bijelog luka. Međutim, s vremenom je prestalo topljenje arseničke bronce. Najvjerovatnije se to dogodilo zbog čestih trovanja tokom pečenja minerala koji sadrže arsen.
Naravno, arsen je u dalekoj prošlosti bio poznat samo u obliku svojih minerala. Dakle, u staroj Kini, čvrsti mineralni realgar (sulfidni sastav As 4 S 4, realgar na arapskom znači „rudnička prašina“) koristio se za klesanje kamena, međutim, kada se zagrije ili izloži svjetlosti, „pokvari se“, kako se ispostavilo. u As 2 S 3 . U 4. st. BC. Aristotel je ovaj mineral opisao pod imenom sandarak. U 1. vijeku AD rimski pisac i naučnik Plinije Stariji i rimski lekar i botaničar Dioskorid opisali su mineralni orpiment (arsenik sulfid As 2 S 3). Prevedeno s latinskog, naziv minerala znači "zlatna boja": korištena je kao žuta boja. U 11. veku alhemičari su razlikovali tri "vrste" arsena: takozvani bijeli arsen (oksid As 2 O 3), žuti arsen (sulfid As 2 S 3) i crveni arsen (sulfid As 4 S 4). Bijeli arsen je dobijen sublimacijom nečistoća arsena tokom pečenja bakrenih ruda koje sadrže ovaj element. Kondenzirajući iz gasne faze, arsenov oksid se istaložio u obliku bijele prevlake. Beli arsen se od davnina koristio za uništavanje štetočina, kao i za...
U 13. veku Albert von Bolstedt (Albert Veliki) dobio je supstancu nalik metalu zagrijavanjem žutog arsena sapunom; ovo je možda bio prvi uzorak arsena u obliku jednostavne supstance, dobijen veštački. Ali ova supstanca je prekinula mističnu "vezu" sedam poznatih metala sa sedam planeta; to je vjerovatno razlog zašto su alhemičari smatrali arsen "nelegitimnim metalom". Istovremeno su otkrili njegovu osobinu da bakru daje bijelu boju, što je dalo razlog da ga nazovemo "sredstvom koje izbjeljuje Veneru (tj. bakar)".
Arsen je nedvosmisleno identificiran kao pojedinačna supstanca sredinom 17. stoljeća, kada ga je njemački ljekarnik Johann Schroeder dobio u relativno čistom obliku redukcijom oksida ugljenom. Kasnije je francuski hemičar i lekar Nicolas Lemery dobio arsen zagrijavanjem mješavine njegovog oksida sa sapunom i potašom. U 18. vijeku arsen je već bio poznat kao neobičan "polumetal". Godine 1775. švedski hemičar K.V. Scheele je dobio arsensku kiselinu i gasoviti arsen-vodik, a 1789. godine A.L. Lavoisier je konačno prepoznao arsen kao nezavisni hemijski element. U 19. vijeku otkrivena su organska jedinjenja koja sadrže arsen.
Arsen u prirodi.
U zemljinoj kori ima malo arsena - oko 5 10 -4% (tj. 5 g po toni), otprilike isto kao i germanijum, kalaj, molibden, volfram ili brom. Često se arsen u mineralima pojavljuje zajedno sa gvožđem, bakrom, kobaltom, niklom.
Sastav minerala koje formira arsen (a ima ih oko 200) odražava "polumetalna" svojstva ovog elementa, koji može biti u pozitivnom i negativnom oksidacionom stanju i kombinovati se sa mnogim elementima; u prvom slučaju, arsen može igrati ulogu metala (na primjer, u sulfidima), u drugom - nemetala (na primjer, u arsenidima). Kompleksni sastav jednog broja minerala arsena odražava njegovu sposobnost, s jedne strane, da djelimično zamijeni atome sumpora i antimona u kristalnoj rešetki (jonski radijusi S -2, Sb -3 i As -3 su blizu i iznose 0,182 0,208 i 0,191 nm, s druge strane su atomi metala. U prvom slučaju, atomi arsena imaju prilično negativno oksidacijsko stanje, u drugom - pozitivno.
Elektronegativnost arsena (2.0) je niska, ali viša od antimona (1.9) i većine metala, pa je oksidaciono stanje –3 zapaženo za arsen samo u metalnim arsenidima, kao i u SbAs stibarsenu i izraslinama ovog minerala. sa čistim kristalima, antimonom ili arsenom (mineral alemontit). Mnoga jedinjenja arsena sa metalima su, sudeći po njihovom sastavu, pre povezana sa intermetalnim jedinjenjima nego arsenidima; neke od njih karakteriše promenljiv sadržaj arsena. U arsenidima može biti prisutno nekoliko metala istovremeno, čiji atomi, na bliskom radijusu jona, zamjenjuju jedan drugog u kristalnoj rešetki u proizvoljnim omjerima; u takvim slučajevima, u mineralnoj formuli, simboli elemenata su navedeni odvojeni zarezima. Svi arsenidi imaju metalni sjaj, neprozirni su, teški minerali, niske tvrdoće.
Primjer prirodnih arsenida (poznato ih je oko 25) su minerali lolingit FeAs 2 (analog pirita FeS 2), skuterudit CoAs 2–3 i niklskuterudit NiAs 2–3, niklin (crveni nikl pirit) NiAs (rammelsberg). beli nikl pirit) NiAs 2 , saflorit (speis kobalt) CoAs 2 i klinosaflorit (Co,Fe,Ni)As 2, langizit (Co,Ni)As, sperilit PtAs 2, maučerit Ni 11 As 8, oregonit Ni2, FeAs algodonit Cu 6 As. Zbog njihove velike gustine (više od 7 g/cm3), geolozi mnoge od njih svrstavaju u grupu „superteških“ minerala.
Najčešći mineral arsena je arsenopirit (arsenski pirit) FeAsS se može smatrati proizvodom zamjene sumpora u piritu FeS 2 atomima arsena (obični pirit također uvijek sadrži nešto arsena). Takva jedinjenja nazivaju se sulfosoli. Minerali kobaltin (sjaj kobalta) CoAsS, glaukodot (Co,Fe)AsS, gersdorfit (sjaj nikla) NiAsS, enargit i luzonit istog sastava, ali različite strukture Cu 3 AsS 4 , proustit Ag 3 AsS 3 - važna ruda srebra , nastali su na sličan način, koji se ponekad naziva "rubinsko srebro" zbog svoje jarko crvene boje, često se nalazi u gornjim slojevima srebrnih vena, gdje se nalaze veličanstveni krupni kristali ovog minerala. Sulfosoli mogu sadržavati i plemenite metale grupe platine; ovi minerali su osarsit (Os,Ru)AsS, ruarsite RuAsS, irarsit (Ir,Ru,Rh,Pt)AsS, platarzit (Pt,Rh,Ru)AsS, hollingworthit (Rd,Pt,Pd)AsS. Ponekad ulogu atoma sumpora u takvim dvostrukim arsenidima igraju atomi antimona, na primjer, u seinjayokitu (Fe,Ni)(Sb,As) 2 , arsenopaladinitu Pd 8 (As, Sb) 3 , arsenpolibazitu (Ag, Cu) 16 (Ar,Sb) 2 S 11 .
Zanimljiva je struktura minerala u kojoj je arsen prisutan istovremeno sa sumporom, ali radije igra ulogu metala, grupišući se zajedno sa drugim metalima. To su minerali arsenosulvanit Cu 3 (As,V)S 4 , arsenohaučekornit Ni 9 BiAsS 8 , freibergit (Ag,Cu,Fe) 12 (Sb,As) 4 S 13 , tenantit (Cu,Fe) 12 As 4 S 1 , argentotenantit (Ag,Cu) 10 (Zn,Fe) 2 (As,Sb) 4 S 13, goldfieldit Cu 12 (Te,Sb,As) 4 S 13, žirodit (Cu,Zn,Ag) 12 (As,Sb ) 4 (Se,S) 13 . Može se zamisliti kakvu složenu strukturu ima kristalna rešetka svih ovih minerala.
Arsen ima jasno pozitivno oksidaciono stanje u prirodnim sulfidima - žutom orpimentu As 2 S 3, narandžasto žutom dimorfitu As 4 S 3, narandžasto crvenom realgaru As 4 S 4, karmin crvenom getelitu AsSbS 3, kao i u bezbojnom oksidu As 2 O 3, koji se javlja kao minerali arsenolit i klaudetit sa različitim kristalnim strukturama (nastaju kao rezultat trošenja drugih minerala arsena). Ovi minerali se obično javljaju kao male inkluzije. Ali 30-ih godina 20. vijeka. u južnom dijelu Verhojanskog lanca pronađeni su ogromni kristali orpimenta veličine do 60 cm i težine do 30 kg.
U prirodnim solima arsenske kiseline H 3 AsO 4 - arsenati (poznato ih je oko 90), oksidaciono stanje arsena je +5; primjeri su svijetlo ružičasti eritrin (boja kobalta) Co 3 (AsO 4) 2 8H 2 O, zeleni annabergit Ni 3 (AsO 4) 2 8H 2 O, skorodit Fe III AsO 4 2H 2 O i simpsite Fe II 3 (AsO 4) 2 8H 2 O, smeđe-crveni gasparit (Ce, La, Nd) ArO 4, bezbojni gernezit Mg 3 (AsO 4) 2 8H 2 O, ruzveltit BiAsO 4 i ketigit Zn 3 (AsO 4) 2 8H 2 O, takođe isto toliko bazičnih soli, na primjer, olivenit Cu 2 AsO 4 (OH), arsenobismit Bi 2 (AsO 4) (OH) 3. Ali prirodni arseniti - derivati arsenove kiseline H 3 AsO 3 su vrlo rijetki.
U središnjoj Švedskoj nalaze se poznati kamenolomi željeza i mangana Langban, u kojima je pronađeno i opisano više od 50 uzoraka minerala koji predstavljaju arsenate. Neki od njih se ne nalaze nigdje drugdje. Nekada su nastali kao rezultat reakcije arsenske kiseline H 3 AsO 4 sa pirokroitom Mn (OH) 2 na ne baš visokim temperaturama. Obično su arsenati produkti oksidacije sulfidnih ruda. Obično nemaju industrijsku primjenu, ali su neke od njih vrlo lijepe i krase mineraloške zbirke.
U nazivima brojnih minerala arsena mogu se pronaći toponimi (Lölling u Austriji, Freiberg u Saksoniji, Seinäjoki u Finskoj, Skutterud u Norveškoj, Allemon u Francuskoj, kanadski rudnik Langis i rudnik Getchell u Nevadi, Oregon u SAD-u itd. ), imena geologa, hemičara, političara itd. (njemački hemičar Karl Rammelsberg, minhenski trgovac mineralima William Maucher, vlasnik rudnika Johann von Gersdorff, francuski hemičar F. Claude, engleski hemičar John Proust i Smithson Tennant, kanadski hemičar F. L. Sperry, američki predsjednik Roosevelt, itd.), na primjer, imena biljaka (na primjer). , naziv minerala saflorit potiče od šafrana), početna slova naziva elemenata - arsenik, osmijum, rutenijum, iridijum, paladijum, platina, grčki koreni ("erythros" - crvena, "enargon" - vidljiva, " lithos" - kamen) i sl. i tako dalje.
Zanimljivo drevno ime za mineral nikel (NiAs) je kupfernikl. Srednjovjekovni njemački rudari nazivali su Nikl zlim planinskim duhom, a Kupfernikl (Kupfernickel, od njemačkog Kupfer - bakar) - "prokleti bakar", "lažni bakar". Bakarno-crveni kristali ove rude ličili su na bakarnu rudu; koristio se u proizvodnji stakla za bojenje stakla u zeleno. Ali niko od toga nije mogao dobiti bakar. Ovu rudu je proučavao švedski mineralog Aksel Kronsted 1751. godine i iz nje izolovao novi metal, nazvavši ga nikal.
Budući da je arsen hemijski prilično inertan, nalazi se iu svom izvornom stanju - u obliku spojenih iglica ili kockica. Takav arsen obično sadrži od 2 do 16% nečistoća - najčešće su to Sb, Bi, Ag, Fe, Ni, Co. Lako se melje u prah. U Rusiji, autohtoni arsen su pronašli geolozi u Transbaikaliji, u Amurskoj oblasti, a nalazi se iu drugim zemljama.
Arsen je jedinstven po tome što se nalazi svuda - u mineralima, stenama, zemljištu, vodi, biljkama i životinjama, ne uzalud se naziva "sveprisutni". Raspodjela arsena u različitim dijelovima svijeta u velikoj mjeri je određena u procesima formiranja litosfere hlapljivošću njegovih spojeva na visokim temperaturama, kao i procesima sorpcije i desorpcije u tlu i sedimentnim stijenama. Arsen lako migrira, čemu doprinosi prilično visoka rastvorljivost nekih njegovih jedinjenja u vodi. U vlažnim klimama, arsen se ispire iz tla i odnosi podzemnim vodama, a zatim rijekama. Prosječan sadržaj arsena u rijekama je 3 µg/l, u površinskim vodama - oko 10 µg/l, u vodama mora i okeana - samo oko 1 µg/l. To je zbog relativno brzog taloženja njegovih spojeva iz vode s akumulacijom u sedimentima dna, na primjer, u feromanganskim nodulama.
U tlu je sadržaj arsena obično između 0,1 i 40 mg/kg. Ali u području pojave ruda arsena, kao iu vulkanskim regijama, tlo može sadržavati puno arsena - do 8 g / kg, kao u nekim područjima Švicarske i Novog Zelanda. Na takvim mjestima vegetacija umire, a životinje obolijevaju. To je tipično za stepe i pustinje, gdje se arsen ne ispire iz tla. Glinene stijene su također obogaćene u poređenju sa prosječnim sadržajem - sadrže četiri puta više arsena od prosjeka. U našoj zemlji je maksimalno dozvoljena koncentracija arsena u zemljištu 2 mg/kg.
Arsen se može ukloniti iz tla ne samo vodom, već i vjetrom. Ali za to se prvo mora pretvoriti u hlapljiva organoarsena jedinjenja. Ova transformacija nastaje kao rezultat takozvane biometilacije - dodavanja metilne grupe sa formiranjem C–As veze; ovaj enzimski proces (poznat je po živinim jedinjenjima) odvija se uz učešće koenzima metilkobalamina, metiliranog derivata vitamina B 12 (ima ga i u ljudskom tijelu). Biometilacija arsena se dešava i u slatkoj i u morskoj vodi i dovodi do stvaranja organoarsenskih jedinjenja - metilarsenske kiseline CH 3 AsO (OH) 2, dimetilarsina (dimetilarsenske, ili kakodilne) kiseline (CH 3) 2 As (O)OH, trimetilarsina ( CH 3) 3 As i njegov oksid (CH 3) 3 As = O, koji se takođe nalaze u prirodi. Korištenjem 14 C-obilježenog metilkobalamina i 74 As-obilježenog natrijum hidrogen arsenata Na 2 HAsO 4, pokazano je da jedan od sojeva metanobakterija reducira i metilira ovu sol u isparljivi dimetilarsin. Kao rezultat toga, zrak u ruralnim područjima sadrži u prosjeku 0,001 - 0,01 μg/m 3 arsena, u gradovima gdje nema specifičnog zagađenja - do 0,03 μg/m 3, te u blizini izvora zagađenja (topljenje obojenih metala). postrojenja, elektrane, rad na uglju sa visokim sadržajem arsena itd.) koncentracija arsena u zraku može premašiti 1 µg/m 3 . Intenzitet padavina arsena u područjima industrijskih centara iznosi 40 kg/km 2 godišnje.
Formiranje isparljivih spojeva arsena (trimetilarsina, na primjer, ključa na samo 51°C) uzrokovano je u 19. stoljeću. brojna trovanja, jer je arsen bio sadržan u gipsu, pa čak i u boji zelenih tapeta. U obliku boje ranije su korišteni Scheele zeleni Cu 3 (AsO 3) 2. n H 2 O i parisko ili švajfurtsko zelje Cu 4 (AsO 2) 6 (CH 3 COO) 2. U uvjetima visoke vlažnosti i pojave plijesni, od takve boje nastaju hlapljivi derivati organoarsena. Smatra se da bi ovaj proces mogao biti uzrok Napoleonovog sporog trovanja u posljednjim godinama njegovog života (kao što je poznato, arsen je pronađen u Napoleonovoj kosi vek i po nakon njegove smrti).
Arsen se nalazi u značajnim količinama u nekim mineralnim vodama. Ruski standardi utvrđuju da arsenik u ljekovitim stolnim mineralnim vodama ne smije prelaziti 700 µg/l. IN Jermuk može biti nekoliko puta veća. Ispijanje jedne ili dvije čaše mineralne vode "arsena" neće naškoditi čovjeku: da biste se smrtno otrovali, morate popiti tri stotine litara odjednom ... Ali jasno je da takvu vodu ne možete piti cijelo vrijeme vrijeme umjesto obične vode.
Hemičari su otkrili da se arsen u prirodnim vodama može naći u različitim oblicima, što je značajno u smislu njegove analize, metoda migracije i različite toksičnosti ovih spojeva; tako su jedinjenja trovalentnog arsena 25-60 puta toksičnija od petovalentnih. As(III) spojevi u vodi su obično prisutni u obliku slabe arsenske kiseline H 3 AsO 3 ( RK a = 9,22), dok su jedinjenja As(V) u obliku mnogo jače arsenske kiseline H 3 AsO 4 ( RK a = 2,20) i njegovih deprotoniranih anjona H 2 AsO 4 – i HAsO 4 2–.
Živa materija arsena sadrži u proseku 6 10 -6%, odnosno 6 μg/kg. Neke morske alge mogu koncentrirati arsen do te mjere da postaju opasne za ljude. Štaviše, ove alge mogu rasti i razmnožavati se u čistim otopinama arsenske kiseline. Takve alge se u nekim azijskim zemljama koriste kao lijek za pacove. Čak iu čistim vodama norveških fjordova, alge mogu sadržavati do 0,1 g/kg arsena. Kod ljudi, arsen se nalazi u moždanom tkivu i mišićima, akumulira se u kosi i noktima.
Svojstva arsena.
Iako po izgledu arsen podsjeća na metal, ipak je prilično nemetal: ne stvara soli, na primjer, sa sumpornom kiselinom, već je sam element koji stvara kiselinu. Stoga se ovaj element često naziva polumetalom. Arsen postoji u nekoliko alotropnih oblika i u tom pogledu veoma podsjeća na fosfor. Najstabilniji od njih je sivi arsen, vrlo krhka supstanca koja ima metalni sjaj kada je svježe slomljena (otuda naziv "metalni arsen"); njegova gustina je 5,78 g/cm 3 . S jakim zagrijavanjem (do 615 °C), sublimira se bez topljenja (isto ponašanje je tipično za jod). Pod pritiskom od 3,7 MPa (37 atm), arsen se topi na 817°C, što je mnogo više od temperature sublimacije. Električna provodljivost sivog arsena je 17 puta manja od bakra, ali 3,6 puta veća od žive. S povećanjem temperature, njegova električna provodljivost, kao i kod tipičnih metala, opada - otprilike u istoj mjeri kao i bakra.
Ako se para arsena vrlo brzo ohladi na temperaturu tekućeg dušika (-196 ° C), dobiva se prozirna meka žuta tvar, nalik žutom fosforu, čija je gustoća (2,03 g / cm 3) mnogo niža od gustoće sivog arsena. Parovi arsena i žutog arsena sastoje se od As 4 molekula koji imaju oblik tetraedra - i ovdje analogija sa fosforom. Na 800°C počinje primjetna disocijacija pare formiranjem As 2 dimera, dok na 1700°C ostaju samo As 2 molekula. Kada se zagrije i pod djelovanjem ultraljubičastog zračenja, žuti arsen brzo prelazi u siv s oslobađanjem topline. Kada se para arsena kondenzuje u inertnoj atmosferi, nastaje još jedan amorfni crni oblik ovog elementa. Ako se para arsena taloži na staklo, formira se zrcalni film.
Struktura vanjske elektronske ljuske arsena je ista kao i dušika i fosfora, ali za razliku od njih, ima 18 elektrona u pretposljednjoj ljusci. Kao i fosfor, može formirati tri kovalentne veze (konfiguracija 4s 2 4p 3), ostavljajući usamljeni par na As atomu. Predznak naboja na atomu As u spojevima s kovalentnim vezama ovisi o elektronegativnosti susjednih atoma. Učešće usamljenog para u formiranju kompleksa je mnogo teže za arsen nego za azot i fosfor.
Ako su d orbitale uključene u atom As, 4s elektroni se mogu razdvojiti da formiraju pet kovalentnih veza. Ova mogućnost se praktično ostvaruje samo u kombinaciji sa fluorom - u pentafluoridu AsF 5 (poznat je i pentakloril AsCl 5, ali je izuzetno nestabilan i brzo se raspada čak i na –50°C).
Na suhom zraku arsen je stabilan, ali na vlažnom zraku tamni i postaje prekriven crnim oksidom. Tokom sublimacije, para arsena lako gori u vazduhu sa plavim plamenom i formira teške bele pare anhidrida arsena As 2 O 3 . Ovaj oksid je jedan od najčešćih reagensa koji sadrže arsen. Ima amfoterna svojstva:
Kao 2 O 3 + 6HCl ® 2AsCl 3 + 3H 2 O,
2 O 3 + 6NH 4 OH ® 2 (NH 4) 3 AsO 3 + 3H 2 O.
Kada se As 2 O 3 oksidira, nastaje kiseli oksid - anhidrid arsena:
As 2 O 3 + 2HNO 3 ® As 2 O 5 + H 2 O + NO 2 + NO.
Kada stupi u interakciju sa sodom, dobija se natrijum hidrogen arsenat, koji se koristi u medicini:
Kao 2 O 3 + 2Na 2 CO 3 + H 2 O ® 2Na 2 HAsO 4 + 2CO 2.
Čisti arsen je prilično inertan; na njega ne djeluju voda, alkalije i kiseline koje nemaju oksidirajuća svojstva. Razrijeđena dušična kiselina ga oksidira u orto-arsensku kiselinu H 3 AsO 3, a koncentrirana - u orto-arsensku H 3 AsO 4:
3As + 5HNO 3 + 2H 2 O ® 3H 3 AsO 4 + 5NO.
Arsen(III) oksid reaguje slično:
3As 2 O 3 + 4HNO 3 + 7H 2 O ® 6H 3 AsO 4 + 4NO.
Arsenska kiselina je kiselina srednje jačine, nešto slabija od fosforne. Nasuprot tome, arsenska kiselina je vrlo slaba, a po jačini odgovara bornoj kiselini H 3 BO 3. U njenim rastvorima postoji ravnoteža H 3 AsO 3 HAsO 2 + H 2 O. Arsenska kiselina i njene soli (arseniti) su jaki redukcioni agensi:
HAsO 2 + I 2 + 2H 2 O ® H 3 AsO 4 + 2HI.
Arsen reaguje sa halogenima i sumporom. AsCl 3 hlorid je bezbojna uljasta tečnost koja dimi na vazduhu; hidrolizuje sa vodom: AsCl 3 + 2H 2 O ® HAsO 2 + 3HCl. Poznati su bromid AsBr 3 i jodid AsI 3, koji se takođe razlažu vodom. U reakcijama arsena sa sumporom nastaju sulfidi različitih sastava - do Ar 2 S 5. Arsen sulfidi se otapaju u lužinama, u rastvoru amonijum sulfida i u koncentrovanoj dušičnoj kiselini, na primjer:
As 2 S 3 + 6KOH ® K 3 AsO 3 + K 3 AsS 3 + 3H 2 O,
2 S 3 + 3 (NH 4) 2 S ® 2 (NH 4) 3 AsS 3,
2 S 5 + 3 (NH 4) 2 S ® 2 (NH 4) 3 AsS 4,
As 2 S 5 + 40HNO 3 + 4H 2 O ® 6H 2 AsO 4 + 15H 2 SO 4 + 40NO.
U tim reakcijama nastaju tioarseniti i tioarsenati - soli odgovarajućih tiokiselina (slično tiosumpornoj kiselini).
U reakciji arsena sa aktivnim metalima nastaju arsenidi slični solima koji se hidroliziraju vodom.Reakcija se posebno brzo odvija u kiseloj sredini sa stvaranjem arsina: Ca 3 As 2 + 6HCl ® 3CaCl 2 + 2AsH 3. Arsenidi niskoaktivnih metala - GaAs, InAs, itd. imaju atomsku rešetku nalik dijamantu. Arsin je bezbojan, bez mirisa, veoma otrovan gas, ali mu nečistoće daju miris belog luka. Arsin se polako razlaže na elemente već na sobnoj temperaturi i brzo kada se zagrije.
Arsen stvara mnoga organoarsenska jedinjenja, na primjer, tetrametildiarsin (CH 3) 2 As–As(CH 3) 2 . Već 1760. godine, direktor srpske fabrike porculana, Louis Claude Cade de Gassicourt, destilacijom kalijum acetata sa arsenik (III) oksidom, neočekivano je dobio tečnost za pušenje koja je sadržavala arsen odvratnog mirisa, a nazvana je alarsin, ili Cade tečnost. Kako se kasnije pokazalo, ova tečnost je sadržavala prve dobijene organske derivate arsena: takozvani kakodil oksid, koji je nastao kao rezultat reakcije.
4CH 3 COOK + As 2 O 3 ® (CH 3) 2 As–O–As(CH 3) 2 + 2K 2 CO 3 + 2CO 2 , i dikakodil (CH 3) 2 As–As(CH 3) 2 . Kakodil (od grčkog "kakos" - loš) bio je jedan od prvih radikala otkrivenih u organskim jedinjenjima.
Godine 1854. pariški profesor hemije Auguste Kaur sintetizirao je trimetilarsin djelovanjem metil jodida na natrijum arsenid: 3CH 3 I + AsNa 3 ® (CH 3) 3 As + 3NaI.
Nakon toga, arsenik trihlorid je korišten za sinteze, npr.
(CH 3) 2 Zn + 2AsCl 3 ® 2(CH 3) 3 As + 3ZnCl 2 .
Godine 1882. aromatični arsini su dobijeni djelovanjem metalnog natrijuma na mješavinu aril halida i arsenik trihlorida: 3C 6 H 5 Cl + AsCl 3 + 6Na ® (C 6 H 5) 3 As + 6NaCl. Hemija organskih derivata arsena najintenzivnije se razvija 20-ih godina 20. vijeka, kada su neki od njih imali antimikrobno, kao i iritativno i stvaranje plikova. Trenutno je sintetizovano na desetine hiljada organoarsenskih jedinjenja.
Dobivanje arsena.
Arsen se uglavnom dobija kao nusproizvod prerade ruda bakra, olova, cinka i kobalta, kao i iskopavanja zlata. Neke polimetalne rude sadrže i do 12% arsena. Kada se takve rude zagriju na 650-700°C u nedostatku zraka, arsen sublimira, a kada se zagrije na zraku, nastaje isparljivi oksid As 2 O 3, "bijeli arsen". Kondenzira se i zagrijava ugljem, a arsen se reducira. Dobijanje arsena je štetna proizvodnja. Ranije, kada je riječ "ekologija" bila poznata samo uskim stručnjacima, "bijeli arsen" se ispuštao u atmosferu, te se naseljavao u susjednim poljima i šumama. Izduvni gasovi biljaka arsena sadrže između 20 i 250 mg/m 3 As 2 O 3 , dok vazduh obično sadrži oko 0,00001 mg/m 3 . Smatra se da je prosječna dnevna dozvoljena koncentracija arsena u zraku samo 0,003 mg / m 3. Paradoksalno, ni sada nisu postrojenja za njegovu proizvodnju ta koja zagađuju okolinu arsenom, već preduzeća obojene metalurgije i elektrane koje sagorevaju ugalj. Donji sedimenti u blizini topionica bakra sadrže ogromnu količinu arsena - do 10 g/kg. Arsen takođe može ući u tlo sa fosfatnim đubrivima.
I još jedan paradoks: dobijaju više arsena nego što im je potrebno; ovo je prilično retka pojava. U Švedskoj je "nepotreban" arsen čak bio prisiljen da bude zakopan u armirano-betonskim kontejnerima u dubokim napuštenim rudnicima.
Glavni industrijski mineral arsena je arsenopirit FeAsS. Postoje velika nalazišta bakra-arsena u Gruziji, Centralnoj Aziji i Kazahstanu, u SAD-u, Švedskoj, Norveškoj i Japanu, nalazišta arsena-kobalta u Kanadi, nalazišta arsena-kalaja u Boliviji i Engleskoj. Osim toga, nalazišta zlata i arsena poznata su u SAD-u i Francuskoj. Rusija ima brojna nalazišta arsena u Jakutiji, Uralu, Sibiru, Transbaikaliji i Čukotki.
Definicija arsena.
Kvalitativna reakcija na arsen je taloženje žutog sulfida As 2 S 3 iz rastvora hlorovodonične kiseline. Tragovi se određuju Marshovom reakcijom ili Gutzeit metodom: trake papira navlažene HgCl 2 potamne u prisustvu arsina, koji sublimira u živu.
Posljednjih desetljeća razvijene su različite osjetljive metode analize, pomoću kojih je moguće kvantificirati zanemarljive koncentracije arsena, na primjer, u prirodnim vodama. Tu spadaju plamena atomska apsorpciona spektrometrija, atomska emisiona spektrometrija, masena spektrometrija, atomska fluorescentna spektrometrija, neutronska aktivaciona analiza... Ako je u vodi vrlo malo arsena, može biti potrebna predkoncentracija uzoraka. Koristeći ovu koncentraciju, grupa harkovskih naučnika iz Nacionalne akademije nauka Ukrajine razvila je 1999. godine metodu rendgenske ekstrakcije za određivanje arsena (kao i selena) u vodi za piće sa osjetljivošću do 2,5-5 µg. /l.
Za odvojeno određivanje jedinjenja As(III) i As(V), prvo se odvajaju jedno od drugog korišćenjem dobro poznatih ekstrakcionih i hromatografskih metoda, kao i korišćenjem selektivne hidrogenacije. Ekstrakcija se obično izvodi natrijum ditiokarbamatom ili amonijum pirolidin ditiokarbamatom. Ova jedinjenja formiraju u vodi netopive komplekse sa As(III), koji se mogu ekstrahovati hloroformom. Arsen se zatim može vratiti u vodenu fazu oksidacijom dušičnom kiselinom. U drugom uzorku arsenat se pretvara u arsenit uz pomoć redukcionog agensa, a zatim se vrši slična ekstrakcija. Tako se određuje „ukupni arsen“, a zatim se As (III) i As (V) određuju odvojeno oduzimanjem prvog rezultata od drugog. Ako u vodi ima organskih spojeva arsena, oni se obično pretvaraju u metildiodarzin CH 3 AsI 2 ili dimetiljodarzin (CH 3) 2 AsI, koji se određuju jednom ili drugom hromatografskom metodom. Dakle, nanogramske količine supstance mogu se odrediti pomoću tečne hromatografije visokih performansi.
Mnoga jedinjenja arsena mogu se analizirati takozvanom hidridnom metodom. Sastoji se od selektivne redukcije analita u isparljivi arsin. Dakle, neorganski arseniti se redukuju u AsH 3 pri pH 5 - 7 i pri pH
Metoda neutronske aktivacije je također osjetljiva. Sastoji se od ozračivanja uzorka neutronima, dok jezgra 75 As hvataju neutrone i pretvaraju se u radionuklid 76 As, koji se detektuje karakterističnom radioaktivnošću sa poluživotom od 26 sati. Na ovaj način se može detektovati do 10-10% arsena u uzorku, tj. 1 mg na 1000 tona supstance
Upotreba arsena.
Oko 97% iskopanog arsena koristi se u obliku njegovih jedinjenja. Čisti arsen se rijetko koristi. Samo nekoliko stotina tona metalnog arsena se proizvodi i koristi godišnje širom svijeta. U količini od 3% arsena poboljšava kvalitet legura ležajeva. Aditivi arsena olovu značajno povećavaju njegovu tvrdoću, koja se koristi u proizvodnji olovnih baterija i kablova. Mali dodaci arsena povećavaju otpornost na koroziju i poboljšavaju termička svojstva bakra i mesinga. Visoko pročišćeni arsen se koristi u proizvodnji poluvodičkih uređaja, u kojima je legiran sa silicijumom ili germanijumom. Arsen se takođe koristi kao dopant, koji "klasičnim" poluprovodnicima (Si, Ge) daje određenu vrstu provodljivosti.
Arsen kao vrijedan aditiv koristi se i u obojenoj metalurgiji. Dakle, dodatak 0,2 ... 1% As olova značajno povećava njegovu tvrdoću. Odavno je primijećeno da ako se u rastopljeno olovo doda malo arsena, tada se pri bacanju sačme dobivaju kuglice ispravnog sfernog oblika. Dodatak 0,15 ... 0,45% arsena bakru povećava njegovu zateznu čvrstoću, tvrdoću i otpornost na koroziju pri radu u gasovitom okruženju. Osim toga, arsen povećava fluidnost bakra tokom livenja, olakšava proces izvlačenja žice. Arsen se dodaje nekim vrstama bronze, mesinga, babita, štamparskih legura. A u isto vrijeme, arsen vrlo često šteti metalurzima. U proizvodnji čelika i mnogih obojenih metala, namjerno se ide na kompliciranje procesa - samo da bi uklonili sav arsen iz metala. Prisustvo arsena u rudi čini proizvodnju štetnom. Štetno dvaput: prvo, po zdravlje ljudi; drugo, za metal, značajne nečistoće arsena pogoršavaju svojstva gotovo svih metala i legura.
Razna jedinjenja arsena, koja se godišnje proizvode u desetinama hiljada tona, imaju širu primenu. Oksid As 2 O 3 se koristi u proizvodnji stakla kao bistrilo stakla. Još su stari staklari znali da bijeli arsen čini staklo „gluvim“, tj. neproziran. Međutim, mali dodaci ove tvari, naprotiv, posvjetljuju staklo. Arsen je još uvijek uključen u formulacije nekih čaša, na primjer, "bečko" staklo za termometre.
Jedinjenja arsena koriste se kao antiseptik za zaštitu od kvarenja i očuvanja kože, krzna i prepariranih životinja, za impregnaciju drveta, kao sastavni dio antivegetativnih boja za dno brodova. U tom svojstvu koriste se soli arsena i arsenske kiseline: Na 2 HAsO 4, PbHAsO 4, Ca 3 (AsO 3) 2 itd. Biološka aktivnost derivata arsena zainteresovala je veterinare, agronome i specijaliste sanitarne i epidemiološke usluga. Kao rezultat toga, pojavili su se stimulatori rasta i produktivnosti stoke koji sadrže arsen, antihelmintici, lijekovi za prevenciju bolesti mladih životinja na stočnim farmama. Jedinjenja arsena (As 2 O 3 , Ca 3 As 2 , Na 3 As, pariški zeleni) koriste se za suzbijanje insekata, glodara, a takođe i korova. U prošlosti je takva upotreba bila široko rasprostranjena, posebno u uzgoju voćaka, zasada duhana i pamuka, za uklanjanje uši i buva, za podsticanje rasta u živinarstvu i svinjskoj proizvodnji i za sušenje pamuka prije berbe. Još u staroj Kini usjevi pirinča su tretirani arsenik oksidom kako bi se zaštitili od pacova i gljivičnih bolesti i tako povećali prinos. A u Južnom Vijetnamu, američke trupe su koristile kakodilnu kiselinu (Agent Blue) kao defolijant. Sada je, zbog toksičnosti spojeva arsena, njihova upotreba u poljoprivredi ograničena.
Važna područja primjene jedinjenja arsena su proizvodnja poluvodičkih materijala i mikro krugova, optička vlakna, uzgoj monokristala za lasere i filmska elektronika. Za uvođenje malih, strogo odmjerenih količina ovog elementa u poluvodiče, koristi se plinoviti arsin. Galijev arsenidi GaAs i indijum InAs se koriste u proizvodnji dioda, tranzistora i lasera.
Arsen takođe nalazi ograničenu upotrebu u medicini. . Izotopi arsena 72 As, 74 As i 76 As sa pogodnim poluživotom za istraživanje (26 h, 17,8 dana i 26,3 h, respektivno) koriste se za dijagnozu različitih bolesti.
Ilya Leenson
Arsen (ime dolazi od riječi miš, koja se koristi za progon miševa) je trideset treći element periodnog sistema. Odnosi se na polumetale. U kombinaciji s kiselinom, ne stvara soli, budući da je supstanca koja stvara kiselinu. Može formirati alotropske modifikacije. Arsen ima tri trenutno poznate strukture kristalne rešetke. Žuti arsen ispoljava svojstva tipičnog nemetala, amorfno - crne i najstabilnije metalne, sive. U prirodi se najčešće nalazi u obliku spojeva, rjeđe u slobodnom stanju. Najčešći su spojevi arsena sa metalima (arsenidi), kao što su: arsenično gvožđe (arsenopirit, otrovni pirit), niklin (kupfernikl, nazvan tako zbog sličnosti sa rudom bakra). Arsen je neaktivan element, nerastvorljiv u vodi, a njegovi spojevi su slabo rastvorljive supstance. Oksidacija arsena se javlja tokom zagrijavanja, na sobnoj temperaturi ova reakcija teče vrlo sporo.
Sva jedinjenja arsena su veoma jaki toksini koji negativno utiču ne samo na gastrointestinalni trakt, već i na nervni sistem. Istorija poznaje mnoge senzacionalne slučajeve trovanja arsenom i njegovim derivatima. Jedinjenja arsena su se koristila kao otrov ne samo u srednjovjekovnoj Francuskoj, već su bila poznata i u starom Rimu i Grčkoj. Popularnost arsena kao snažnog otrova objašnjava se činjenicom da ga je gotovo nemoguće otkriti u hrani, nema ni miris ni okus. Kada se zagrije, pretvara se u arsenov oksid. Dijagnosticiranje trovanja arsenom je prilično teško, jer ima slične simptome s raznim bolestima. Najčešće se trovanje arsenom miješa s kolerom.
Gdje se koristi arsen?
Uprkos njihovoj toksičnosti, derivati arsena koriste se ne samo za mamac miševa i štakora. Pošto čisti arsen ima visoku električnu provodljivost, koristi se kao dopant, koji poluvodičima kao što su germanijum, silicijum daje provodljivost traženog tipa. U obojenoj metalurgiji, arsen se koristi kao aditiv koji daje legurama čvrstoću, tvrdoću i otpornost na koroziju u plinovitom okruženju. U staklarstvu se dodaje u malim količinama za posvjetljivanje stakla, osim toga, dio je čuvenog "bečkog stakla". Nikelin se koristi za bojenje stakla u zeleno. U proizvodnji kože, sulfatna jedinjenja arsena koriste se u preradi kože za uklanjanje dlačica. Arsen se nalazi u lakovima i bojama. U industriji obrade drveta arsen se koristi kao antiseptik. U pirotehnici, „grčka vatra“ se proizvodi od spojeva arsena sulfida, a koristi se u proizvodnji šibica. Neka jedinjenja arsena koriste se kao hemijska ratna sredstva. Toksična svojstva arsena koriste se u stomatološkoj praksi za uništavanje zubne pulpe. U medicini se preparati arsena koriste kao lijek koji povećava ukupni tonus organizma, da stimuliše povećanje broja crvenih krvnih zrnaca. Arsen djeluje inhibirajuće na stvaranje leukocita, pa se koristi u liječenju određenih oblika leukemije. Poznat je ogroman broj lijekova na bazi arsena, ali su u posljednje vrijeme postupno zamijenjeni manje toksičnim lijekovima.
Uprkos svojoj toksičnosti, arsen je jedan od najvažnijih elemenata. Prilikom rada s njegovim spojevima potrebno je pridržavati se sigurnosnih propisa, što će pomoći u izbjegavanju neželjenih posljedica.
Jedinjenja arsena (engleski i francuski Arsenic, njemački Arsen) poznata su jako dugo. U III - II milenijumu pre nove ere. e. već je znao kako da dobije legure bakra sa 4 - 5% arsena. Aristotelov učenik, Teofrast (IV - III vek pne), prirodni crveni arsen sulfid naziva se realgar; Plinije žuti arsen sulfid naziva As 2 S 3 orpiment (Auripigmentum) - obojen u zlatnu boju, a kasnije je nazvan orpiment (orpiment). Starogrčka riječ arsenik, kao i sandarak, odnose se uglavnom na jedinjenja sumpora. U 1. vijeku Dioskorid je opisao sagorevanje orpimenta i rezultirajućeg proizvoda - bijelog arsena (As 2 O 3). U alhemijskom periodu razvoja hemije smatralo se nespornim da arsen (Arsenik) ima sumpornu prirodu, a pošto je sumpor (Sumpor) bio poštovan kao "otac metala", arseniku su se pripisivala muška svojstva. Ne zna se tačno kada je prvi put dobijen metalni arsen. Obično se ovo otkriće pripisuje Albertu Velikom (XIII vijek). Bojenje bakra dodatkom arsena u bijelu srebrnastu boju alkemičari su smatrali transformacijom bakra u srebro i takvu "transmutaciju" pripisivali su moćnoj moći arsena. U srednjem vijeku iu prvim stoljećima modernog doba postala su poznata otrovna svojstva arsena. Međutim, čak je i Dioskorid (Iv.) preporučio da pacijenti sa astmom udišu pare proizvoda dobijenih zagrijavanjem realgara sa smolom. Paracelsus je već uveliko koristio bijeli arsen i druga jedinjenja arsena za liječenje. Hemičari i rudari 15. - 17. stoljeća. znao za sposobnost arsena da sublimira i formira parne proizvode sa specifičnim mirisom i toksičnim svojstvima.Vasilij Valentin pominje poznate metalurge iz 16. veka. dim visoke peći (Huttenrauch) i njegov specifičan miris. Grčki (i latinski) naziv za arsen, koji se odnosi na arsen sulfide, dolazi od grčkog muškog roda. Postoje i druga objašnjenja za porijeklo ovog imena, na primjer, od arapskog arsa paki, što znači "otrov koji prodire duboko u tijelo"; vjerovatno su Arapi ovo ime posudili od Grka. Ruski naziv arsen poznat je od davnina. U literaturi se pojavljuje još od vremena Lomonosova, koji je arsen smatrao polumetalom. Uz ovaj naziv u HMVIII vijeku. korištena je riječ arsen, a arsen je nazvan As 2 O 3. Zaharov (1810) je predložio naziv arsen, ali ono nije zaživjelo. Riječ arsenik vjerojatno su posudili ruski zanatlije od turskih naroda. U azerbejdžanskom, uzbečkom, perzijskom i drugim orijentalnim jezicima, arsen se zvao margumuš (mar - ubiti, kaša - miš); Ruski arsen, vjerovatno izobličeni mišji otrov, ili mišji otrov.