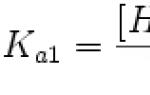Определяне на киселинни константи на слаби киселини. Киселинност и основност във водата Индикатор за киселинната константа на млечната киселина
Самойонизация на водата
Водата, дори след многократна дестилация, запазва способността да провежда електричество. Тази способност на водата се дължи на нейната самойонизация.
$2H_2O ↔ H_3O^+ + OH^-$
Константата на термодинамичното равновесие има формата:
Снимка 1.
където $a_X^(rel)=\frac(a_X^(equal))(a_X^0)$ е относителната активност на частицата $X$ в равновесната система;
$aX^(equal)$ - абсолютна активност на частицата $X$ в равновесната система;
$(a_x)^0$ - абсолютна активност $X$ в термодинамичното състояние на системата.
Относителната активност на водата в равновесие е практически равна на единица, тъй като степента на реакция е много малка (ако теоретично нейонизираната вода се приеме за стандартно състояние.
Коефициентите на активност на $OH^-$ и $H_3O^+$ йони ще бъдат близки до единица в чиста вода. Равновесието на реакцията е силно изместено наляво. Относителните активности на $OH^-$ и $H_3O^+$ са практически равни на техните моларни концентрации. Където
$(K_a)^0 \sim K_(автоматично) = $
където $ и $ са моларни концентрации;
$K_(auto)$ - константа на воден автопрополис, равна на $1,00\cdot 10^(-14) \ mol^2/l^2$ при $25^\circ \ C.$
В чиста вода концентрациите на $ и $ ще бъдат равни, така че
$==\sqrt(10^(-14))=10^(-7)$ за $25^\circ \ C.$
За по-лесно изчисление концентрацията е посочена като отрицателен логаритъм, означен като $pH$:
$pH=-lg $
Стойностите на $pH$ за чиста вода са $7$, в киселинни разтвори $pH $7$.
Киселинна дисоциация и киселинна константа
За киселината $AH$ дисоциацията може да се изрази с уравнението:
$AH + H_2O ↔ A^- + H_3O^+$
В състояние на равновесие относителната плътност на водата се променя незначително при преминаване от една киселина към друга и при безкрайно разреждане се доближава до нула. Следователно се използва термодинамичната киселинна константа $K_a^0$ ($AH$).
Съотношението на коефициентите на активност е еднакво за всички киселини и е равно на единица, ако процесите протичат в разредени разтвори.
След това, в разреден воден разтвор, киселинната константа $Ka (AH$) се използва като мярка за силата на киселината, която може да се определи по формулата:
$Ka (AH)=\frac()()$
Формулата показва моларната концентрация на частици при фиксирана температура $(25^\circ \ C)$ в равновесно състояние.
Колкото по-висока е киселинната константа, толкова по-висока е степента на дисоциация, толкова по-силна е киселината. За изчисления и характеристики на киселинността се използва отрицателният логаритъм на константата на киселинността $pKa$.
$pKa (AH)= -lgKa (AH)$
Колкото по-голяма е стойността на киселинната константа, толкова по-слаба е киселината.
Стойността на киселинната константа е равна на $pH$ стойността на разтвора, при която киселината ще се йонизира наполовина:
$pKa (AH) = pH - lg \frac()()$
Стойността, характеризираща киселинността на водните молекули във воден разтвор е:
$Ka=\frac()()=\frac(Ka_(auto))()=\frac(10^(-14))(55,5)$
Така при температура от $25^\circ C$, $pKa (H_2O) = 15,7$. Тази стойност характеризира киселинността на водните молекули в разтвора.
За хидроксониев йон $pKa (H_3O^+) = pK_(auto) - pKa = 14-15,7 = -1,7.$
Стойностите $pKa$ са таблични данни. Въпреки това, за киселини с $pKa 0$ данните в таблицата ще бъдат неточни.
Възможно е да се определят киселинните константи във водата чрез директно измерване на концентрациите на $A^-$ и $AH$ само когато киселинната дисоциация настъпи поне до известна степен, дори едва забележима.
Ако киселината е много слаба, която практически не се дисоциира, тогава концентрацията на $A^-$ не може да бъде точно измерена. Ако, напротив, киселината е толкова силна, че се дисоциира почти напълно, тогава е невъзможно да се измери концентрацията на $AH$. В този случай ще се използват косвени методи за определяне на киселинността.
Основна йонизационна константа
За да изразим константата на дисоциация на база във вода, използваме уравнението:
$B + H_2O ↔ BH^+ + OH^-$
Константата на основност е:
$Kb=\frac()([B])$
Напоследък константите на основност практически не се използват в изчисленията, тъй като константата на киселинността на спрегнатата киселина може да се използва за получаване на цялата необходима информация за основата $BH^+.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
Киселинната константа на киселина ще бъде мярка за сила:
- $AH$ или $BH^+$ като донори на протони;
- $A^-$ или $B$ като акцептори на протони;
- силна киселина $AH$ или $BH^+$ съответства на слаба спрегната основа $A^-$ или $B$ и тогава $pKa$ е малък или отрицателен;
- силна основа $A^-$ или $B$ съответства на слаба киселина $AH$ или $BH^+$ и константата на киселинност ще бъде положителна
Възможно е директно измерване на силата на киселините или основите само в тесен диапазон от $pKa (BH^+).$ Извън интервала основността ще се определя чрез косвени методи. $pka (BH^+)$ стойности извън диапазона $-2$ до $17$ ще бъдат неточни.
Връзка между структурата и силата на киселините
Относителната сила на киселините може да се предвиди въз основа на естеството на централния атом и структурата на киселинната молекула.
Силата на безкислородната киселина $HX$ и $H_2X$ (където $X$ е халоген) е толкова по-висока, колкото по-слаба е връзката $X-H$, тоест колкото по-голям е радиусът на атома $X$.
В сериите $HF - HCl - HBr - HI$ и $H_2S - H_2Se - H_2Te$ силата на киселините нараства.
За киселини, съдържащи кислород, колкото по-силна е стойността на m в съединението $E(OH)nOm$, толкова по-силна е киселината.
Така според тази теория Киселина е всяко вещество, чиито молекули (включително йони) са способни да отдадат протон, т.е. да бъде донор на протони; Основа е всяко вещество, чиито молекули (включително йони) са способни да прикрепят протон, т.е. да бъде акцептор на протони; Амфолит е всяко вещество, което е едновременно донор и акцептор на протони.
Тази теория обяснява киселинно-алкалните свойства не само на неутралните молекули, но и на йоните. Една киселина, отдавайки протон, се превръща в основа, която е свързана с тази киселина. Понятията "киселина" и "основа" са относителни понятия, тъй като едни и същи частици - молекули или йони - могат да проявяват както основни, така и киселинни свойства, в зависимост от партньора.
При протолитично равновесие се образуват киселинно-алкални двойки. Според протонната теория реакциите на хидролиза, йонизация и неутрализация не се считат за специално явление, а се считат за обичаен преход на протони от киселина към основа.
Частицата А се образува след отделянето на водородния йон
pH стойност
Водата като слаб електролит се подлага на йонизация в малка степен:
H 2 O ↔ H + + OH -.
Йоните във воден разтвор претърпяват хидратация (воден)
Водата се характеризира с протолитична амфотерност. Реакцията на самойонизация (автопротолиза) на водата, по време на която протон от една водна молекула (киселина) преминава към друга водна молекула (основа), се описва с уравнението:
H 2 O + H 2 O ↔ H 3 O + + OH -.
Равновесната константа на водната автопротолиза е равна на:
Законът за действието на масите се прилага за йонизационната константа:
където a е дейност.
За краткост вместо H 3 O + в киселинно-алкално равновесие пишем
Тъй като водата е в разтвор в голям излишък и се подлага на йонизация в малка степен, може да се отбележи, че нейната концентрация е постоянна и равна на 55,6 mol (1000 g: 18 g / mol \u003d 56 mol) на литър вода.
Следователно, продуктът на K и (H 2 O) и концентрацията на вода е 1,8 10 -16 mol / l 55,6 mol / l \u003d 10 -14 mol 2 / l 2. По този начин \u003d 10 -14 (при 25 ° C) е постоянна стойност, означен Kwи се обади константа на водна автопротолиза. Понякога те използват остаряло име - йонен продукт на водата.
Разтвори, в които концентрацията на водородни йони и хидроксидни йони е еднаква, се наричат неутрални разтвори = = = 10 -7 mol / l. В киселинни разтвори > , > 10 -7 mol / l, а в алкални > , > 10 -7 mol / l.
За простота стойността на рН се приема като основа - десетичният логаритъм от концентрацията на водородни йони, взет с противоположния знак: pH \u003d -lg.
Интересни факти:
Нарушаване на състоянието на изохидрия (постоянство на pH) наблюдава се при сърдечно-съдови заболявания, с исхемия, захарен диабет (развива се ацидоза). Киселинно-алкалното равновесие се поддържа чрез дишане, уриниране, изпотяване. Тези системи работят бавно и незабавната неутрализация на киселинните и алкалните метаболитни продукти се извършва от буферните системи на тялото. Състоянието на изохидрия се осигурява от съвместното действие на редица физикохимични и физиологични механизми. Буферното действие се осигурява чрез комбиниране на няколко протолитични равновесия.
Силата на киселините се определя от способността им да отдават протон.Мярката за тази способност е киселинна константа (Ка).
Колкото по-голяма е киселинната константа, толкова по-силна е киселината.Например, оцетната киселина е по-силна от циановодородната киселина, тъй като Ka (CH 3 COOH) \u003d 1,74 10 -5, Ka (HCN) \u003d 1 10 -9. За удобство на изчисленията и записването те често използват не самите константи, а техните отрицателни десетични логаритми: pKa = -lgKa. Извиква се стойността на pKa киселинна сила.Колкото по-голяма е стойността на pKa, толкова по-слаба е киселината.
Силните киселини почти напълно даряват своя протон на водните молекули, така че присъстващата киселина в разтвора всъщност е хидрониевият йон.
В тази връзка, когато се изчислява рН на разтвор на силна едноосновна киселина, концентрацията на протоните се приравнява на концентрацията на киселината
° С(H 3 O +) = ° С(HB).
В разтвори на слаби киселини концентрацията на хидрониеви йони е много по-ниска от концентрацията на киселината. Изчислява се въз основа на
двете части на това уравнение дават формула за изчисляване на pH на разтвори на слаби киселини: pH = 0,5 (pKa - lg ° С(HB)).
29. Слаби електролити. Константа на киселинност и основност. Законът на Осуалд за разреждането.
Слабите електролити са химични съединения, чиито молекули, дори в силно разредени разтвори, са леко дисоциирани на йони, които са в динамично равновесие с недисоциирани молекули. Слабите електролити включват повечето органични киселини и много органични основи във водни и неводни разтвори.
Слабите електролити са:
почти всички органични киселини и вода;
някои неорганични киселини: HF, HClO, HClO 2, HNO 2, HCN, H 2 S, HBrO, H 3 PO 4, H 2 CO 3, H 2 SiO 3, H 2 SO 3 и други;
някои слабо разтворими метални хидроксиди: Fe (OH) 3, Zn (OH) 2 и др.
Константа на киселинна дисоциация (Ka) - равновесната константа на реакцията на дисоциация на киселина на водороден йон и анион на киселинен остатък. За многоосновните киселини, чиято дисоциация протича на няколко етапа, те оперират с отделни константи за различните етапи на дисоциация, като ги обозначават като K a1, K a2 и т.н.
Пример за изчисляване на диабазова киселина:

![]()
По-често, вместо самата константа на дисоциация K, се използва стойността на pK, която се определя като отрицателен десетичен логаритъм на самата константа:
Базата е химично съединение, способно да образува ковалентна връзка с протон (база на Брьонстед) или със свободна орбитала на друго химично съединение (база на Люис). В тесен смисъл основите се разбират като основни хидроксиди - сложни вещества, по време на дисоциацията на които във водни разтвори се отделя само един вид анион - хидроксидни йони OH-.
Теорията на Бронстед-Лоури дава възможност да се определи количествено силата на основите, тоест способността им да отделят протон от киселини. Това обикновено се прави с помощта на константата на основност Kb - равновесната константа на реакцията на основа с референтна киселина, за която е избрана вода. Колкото по-висока е константата на основност, толкова по-голяма е силата на основата и толкова по-голяма е нейната способност да отделя протон. Често константата на основност се изразява като индекс на константата на основност pKb. Например за амоняк като основа на Брьонстед може да се напише:

Законът за разреждане на Оствалд е съотношение, изразяващо зависимостта на еквивалентната електрическа проводимост на разреден разтвор на бинарен слаб електролит от концентрацията на разтвора: ![]()
Тук K е константата на дисоциация на електролита, c е концентрацията, λ и λ∞ са стойностите на еквивалентната електрическа проводимост, съответно при концентрация c и при безкрайно разреждане. Съотношението е следствие от закона за действието на масите и равенството, където α е степента на дисоциация.
30. Водата е слаб електролит. Йонно произведение на вода. Ph. POh
Йонният продукт на водата е продуктът на концентрациите на водородни йони H+ и хидроксилни йони OH− във вода или във водни разтвори, константата на автопротолизата на водата.
Водата, въпреки че е слаб електролит, се дисоциира в малка степен:
Равновесието на тази реакция е силно изместено наляво. Константата на дисоциация на водата може да се изчисли по формулата:
![]()
Концентрация на хидрониеви йони (протони);
Концентрация на хидроксидни йони;
Концентрацията на вода (в молекулярна форма) във вода;
Концентрацията на вода във водата, предвид ниската й степен на дисоциация, е практически постоянна и е (1000 g/l)/(18 g/mol) = 55,56 mol/l.
При 25 °C константата на дисоциация на водата е 1,8·10−16 mol/l. Уравнение (1) може да бъде пренаписано като:
Нека обозначим продукта K· \u003d K в = 1,8 10 -16 mol / l 55,56 mol / l \u003d 10 -14 mol² / l² \u003d (при 25 ° C).
Константата K in, равна на произведението на концентрациите на протони и хидроксидни йони, се нарича йонен продукт на водата. Тя е постоянна не само за чиста вода, но и за разредени водни разтвори на вещества. С повишаване на температурата дисоциацията на водата се увеличава, следователно Kv също се увеличава, с намаляване на температурата, обратно.
Водороден индекс, pH - мярка за активността на водородните йони в разтвор и количествено изразяване на неговата киселинност, се изчислява като отрицателен (взет с противоположния знак) десетичен логаритъм на активността на водородните йони, изразен в молове на литър:
Реципрочната стойност на pH е станала малко по-малко разпространена - индикатор за основността на разтвора, pOH, равен на отрицателния десетичен логаритъм на концентрацията в разтвора на OH йони -:
Свързващо уравнение:
В общия случай, в съответствие с протолитичната теория на Бронстед-Лоури, съгласно уравнение (4.2), имаме за дисоциацията на слаба едноосновна киселина:
Истинската термодинамична константа ДА СЕтози баланс ще
където всички дейности са равновесни. Нека представим това съотношение във формата:
Означаваме, както в предишния случай, произведението на две константи ДА СЕи a (H 2 O) през (H 2 O) \u003d const at Т=конст. Тогава
или приблизително:
където всички концентрации са равновесни. Ето стойността ДА СЕ АНаречен константа на киселинна дисоциация (йонизация) или просто киселинна константа.
За много слаби киселини числените стойности ДА СЕ Аса много малки, така че вместо ДА СЕ АПриложи индикатор за сила (или просто индикатор):
РК А =- lg ДА СЕ А .
Колкото повече ДА СЕ А(т.е. по-малката p ДА СЕ А ), толкова по-силна е киселината.
Нека началната концентрация на едноосновна киселина HB е равна на степента на нейната дисоциация (йонизация) в разтвор. Тогава равновесните концентрации на йони [Н 3 О + ] и [В - ] ще бъдат равни на [Н 3 О + ] = [В - ] = αс А , равновесна киселинна концентрация [HB] = с А - α с А = с А(1 - α). Замествайки тези стойности на равновесните концентрации в израза за равновесната константа (4.10), получаваме:
Ако вместо концентрация с Аизползвайте неговата реципрочност V- разреждане (разреждане), изразено в l / mol, V=1/с А , след това формулата за ДА СЕ Аще изглежда така:
Това съотношение, както и изразът
описвам закон за разреждане (или закон за разреждане) на Оствалдза слаб бинарен електролит. За a1 (типичен случай в много аналитични системи)
Лесно е да се покаже, че в общия случай за слаб електролит от всякакъв състав K n A m , разлагащ се на йони съгласно схемата
K n A m = ПДА СЕ t+ +тА н -
Законът за разреждане на Оствалд се описва от връзката
Където с- първоначалната концентрация на слаб електролит, например слаба киселина. И така, за ортофосфорна киселина H 3 RO 4 (П = 3,
T= 1), който се разпада общо на йони съгласно схемата

![]() .
.
За бинарен електролит връзката се превръща в (4.11). За a1 имаме:
Нека намерим равновесната стойност на pH на разтвор на едноосновна киселина HB. Равновесна концентрация на водородни йони
Използвайки нотацията и получаваме:
pH = 0,5 (стр ДА СЕ А+стр с А). (4.12)
По този начин, за да се изчисли равновесната стойност на рН на разтвор на слаба едноосновна киселина, е необходимо да се знае киселинната константа на тази киселина ДА СЕ Аи първоначалната му концентрация с А .
Изчислете pH на разтвор на оцетна киселина с начална концентрация 0,01 mol/L.
При стайна температура за оцетна киселина ДА СЕ А = 1.74 10 -5 и p ДА СЕ А = 4,76.
Съгласно формула (4.12) можем да запишем:
pH = 0,5 (стр ДА СЕ А+стр с А) = 0,5(476-0,01) = 0,5(4,76+2) = 3,38.
Подобно разглеждане може да се направи за равновесия в разтвор на всяка слаба многоосновенкиселини.
Многоосновните киселини се дисоциират на йони стъпаловидно, на няколко етапа, всеки от които се характеризира със собствена равновесна константа константа на стъпаловидна киселинна дисоциация.Така например в разтвори на ортоборна киселина H 3 BO 3 се установяват равновесия (стойностите на константите са дадени за 25 ° C):
H 3 BO 3 + H 2 O \u003d H 3 O + +, ДА СЕ 1
= ![]()
H 2 O \u003d H 3 O + +, ДА СЕ 2
= ![]()
H 2 O \u003d H 3 O + +, ДА СЕ 3 =
Константата на киселинна дисоциация на всеки следващ етап е по-малка от константата на дисоциация на предходния етап - обикновено с няколко порядъка.
Произведението на всички стъпкови константи на дисоциация е равно на общата константа на киселинна дисоциация K:
ДА СЕ 1 ДА СЕ 2 ...ДА СЕ П =К.
По този начин е лесно да се види, че за ортоборната киселина стойността
ДА СЕ 1
ДА СЕ 2
ДА СЕ 3
=K= ![]()
е общата константа на киселинна дисоциация по схемата:
4.3.2 Константа на основност и pH на разтвори на слаби основи
В съответствие с протолитичната теория на киселините и основите на Брьонстед-Лоури, в общия случай, за йонизацията на една киселинна слаба основа В във водни разтвори, може да се напише:
B + H 2 O \u003d HB + + OH -
Ако степента на йонизация на основата е a1, тогава константата на концентрацията може да се приеме като константа на това химично равновесие
Продължавайки подобно на предишния, получаваме:
ДА СЕ = =К b = const когато T= конст
като произведение на две константи ДА СЕ\u003d const и [H 2 O] \u003d const.
Да извикаме количеството К b , равен, следователно,
К b = , (4.13)
константа на дисоциация (йонизация) на слаба единична киселинна основаилипросто константа на базисносттази база и стойността
стр К b = К b ,
Индикатор за сила (или просто индикатор) на константата на основност.
Съгласно закона за разреждане на Оствалд в разглеждания случай (подобно на връзката (4.11))
К b =,
където е степента на йонизация на една слаба киселинна основа и е нейната начална концентрация. Тъй като за слаба основа a1, тогава
Нека намерим равновесната стойност на pH на воден разтвор на разглежданата монокиселинна основа при стайна температура. В съответствие с формула (4.7) имаме:
pH = p ДА СЕ w - rOH = 14 - rOH.
Нека определим стойността на pOH = [OH - ]. очевидно
[OH -] = = ![]()
Използване на индикатори pON = [OH - ], p ДА СЕ b =К bИ
p = , получаваме: pOH = 0,5 (p ДА СЕ b+ p). Като заместим този израз в горната формула за pH, стигаме до връзката
pH \u003d 14 - pOH \u003d 14 - 0,5 (p ДА СЕ b+ p).
И така, равновесната стойност на pH в разтвор на слаба единична киселинна основа може да се изчисли по формулата (4.15):
рН = 14 - 0,5 (стр ДА СЕ b+ p). (4.15)
Изчислете рН в 0,01 mol/l воден разтвор на амоняк, за който при стайна температура ДА СЕ b= и p ДА СЕ b = 4,76.
Във воден разтвор на амоняк се установява равновесие:
което е изместено предимно наляво, така че степента на йонизация на амоняка е . Следователно, за да изчислите стойността на pH, можете да използвате връзката (4.15):
рН = 14 - 0,5 (стр ДА СЕ b+ p) =
Подобно разглеждане може да се извърши за всеки слаб поликиселинаоснования. Вярно е, че в този случай се получават по-тромави изрази.
Слабите поликиселинни основи, като слабите многоосновни киселини, се дисоциират на стъпки и всяка стъпка на дисоциация също има своя собствена константа на стъпаловидна дисоциация на основата - константата на стъпаловидна основност.
Така например оловен хидроксид Pb (OH) 2 във водни разтвори се разлага на йони на два етапа:
![]()
Същите равновесия могат да бъдат записани по друг начин, придържайки се (в рамките на протолитичната теория) към дефиницията на основа като вещество, което прикрепя протон, в този случай го приема от водна молекула:
В този случай поетапните константи на основност могат да бъдат представени като:
![]()
![]()
При такъв запис на тези равновесия се приема, че протонът от водната молекула преминава към хидроксилната група с образуването на водната молекула (), в резултат на което броят на водните молекули в близост до оловния (II) атом се увеличава с една, а броят на хидроксилните групи, свързани с оловния (II) атом), също намалява с една при всяка стъпка на дисоциация.
работа ДА СЕ 1 ДА СЕ 2 =K=[Pb 2+] [OH -] 2 / [Pb (OH) 2] =
2.865 където ДА СЕ- константа на пълна дисоциация по схемата
или по друга схема
което в крайна сметка води до същия резултат.
Друг пример е органичната основа етилендиамин, подложена на йонизация във воден разтвор в два етапа. Първи етап:
![]()
Втора стъпка:
![]()
работа ![]() -
-
обща константа на дисоциация. Съвпада с баланса
Числените стойности на равновесните константи са дадени по-горе за стайна температура.
Както в случая на многоосновни киселини, за слаба поликиселинна основа константата на дисоциация на всеки следващ етап обикновено е с няколко порядъка по-малка от константата на дисоциация на предишния етап.
В табл. 4.2 показва числените стойности на константите на киселинност и основност на някои слаби киселини и основи.
Таблица 4.2. Истински термодинамични йонизационни константи във водни разтвори на някои киселини и основи.
ДА СЕ А- киселинна константа, ДА СЕ b- константа на основност,
ДА СЕ 1 - константа на дисоциация за първия етап,
ДА СЕ 2
- константа на дисоциация за втория етап и др.
| Константи на дисоциация на слаби киселини |
||
| киселина | ДА СЕ А | Р ДА СЕ А=-lg ДА СЕ А |
| азотен Аминооцетна бензоена Борна (ортоборна) Тетраборная Видове протолитични реакции. МУ "Решения" стр. 52-55 Автопротолиза на вода. Йонно произведение на вода.МУ „Решения» страница 56 Малка част от водните молекули винаги е в йонно състояние, въпреки че е много слаб електролит. Йонизацията и по-нататъшната дисоциация на водата, както вече беше споменато, се описва от уравнението на протолитичната реакция на киселинно-базово диспропорциониране или автопротолиза. Водата е много слаб електролит, следователно получената спрегната киселина и спрегната основа са силни. Следователно равновесието на тази протолитична реакция е изместено наляво. Константата на това равновесие K е равна на = Количествената стойност на произведението на концентрацията на водни йони × е йонен продукт на вода. То е равно на: × = K равно. × 2 = 1 × 10 - 14 Следователно: K H 2O \u003d × = 10 - 14 или опростено K H 2O \u003d × \u003d 10 - 14 K H 2 O е йонният продукт на водата, константата на автопротолизата на водата или просто константата на водата. K H 2 O зависи от температурата. С повишаването на t°C тя се увеличава. В химически чиста вода = = = 1×10 – 7 . Това е неутрална среда. В разтвора може да има > - средата е кисела или< – среда щелочная = ; = pH стойност За да определите количествено киселинността на разтворите, използвайте индикатор за концентрация на водородни йони pH. Водородният индекс е стойност, равна на отрицателния десетичен логаритъм от концентрацията на свободни водородни йони в разтвор. pH = – lg ⇒ = 10 – pH В неутрална среда pH = 7 При кисело pH< 7 При алкално pH > 7 За характеризиране на основността на средата се използва хидроксилният индекс pOH. pOH \u003d - lg [OH -] ⇒ [OH -] \u003d 10 - pOH pH + pOH = 14 Þ pH = 14 - pOH и pOH = 14 - pH Формули за изчисляване на рН за разтвори на киселини и основи. pH = – lg
Изчислете рН на разтвор на HCl с С(HCl) = 0,1 mol/l при условие на пълната му дисоциация. C(HCl) = 0,1 mol/l; pH \u003d - lg 0,1 \u003d 1 2. Силни основи: [OH -] \u003d C (1 / z бази) Изчислете pH на разтвора на NaOH при същите условия. C(NaOH) = 0,1 mol/l; = = 10 – 13; pH \u003d - lg 10 - 13 \u003d 13 3. Слаби киселини Изчислете pH на разтвор на оцетна киселина с моларна концентрация 0,5 mol/l. Към CH 3COOH \u003d 1,8 × 10 - 5. 3×10 - 3 pH \u003d - lg 3 × 10 - 3 \u003d 2,5 4. Слаби бази Изчислете pH на разтвор на амоняк с моларна концентрация 0,2 mol/L. K NH 3 \u003d 1,76 × 10 - 5 1,88×10 - 3 0,53 × 10 - 11; pH \u003d - lg 0,53 × 10 - 11 \u003d 11,3 5. C (H +) \u003d [H +] \u003d 10 - pH При pH = 7, [H + ] = 10 - 7 Има различни методи за определяне на pH: с помощта на индикатори и йономерни устройства. рН стойност за химични реакции и биохимични процеси в организма. Много реакции, за да протичат в определена посока, изискват строго определена стойност на pH на средата. Обикновено в здраво тяло реакцията на околната среда на повечето биологични течности е близка до неутрална. Кръвно - 7,4 Слюнка - 6,6 Чревен сок - 6,4 Жлъчка - 6,9 Урина - 5,6 Стомашен сок: а) в покой - 7.3 б) в състояние на храносмилане - 1,5-2 Отклонението на pH от нормата има диагностична (определяне на заболяването) и прогностична (протичане на заболяването) стойност. Ацидозата е изместване на рН към киселинната страна, рН намалява, концентрацията на водородни йони се увеличава. Алкалоза - изместване на рН към алкална област, рН се повишава, концентрацията на водородни йони намалява. Временното отклонение на рН на кръвта от нормата с десети води до сериозни смущения в организма. Продължителните колебания в pH на кръвта могат да бъдат фатални. Отклоненията в pH на кръвта могат да бъдат 6,8 - 8, промените извън този интервал във всяка посока са несъвместими с живота. Комбинирани и изолирани протолитични равновесия. Протолитичните процеси са обратими реакции. Протолитичните равновесия са склонни към образуването на по-слаби киселини и основи. Те могат да се разглеждат като конкуренция между основи с различна сила за притежаване на протон. Те говорят за изолирани и комбинирани равновесия. Ако няколко едновременно съществуващи равновесия са независими едно от друго, те се наричат изолирани. Изместването на равновесието в едно от тях не води до промяна в положението на равновесие в другото. Ако промяната в равновесието на едно от тях води до промяна на равновесието на другото, тогава говорим за комбинирани (спрегнати, конкурентни) равновесия. Преобладаващият процес в системите с комбинирано равновесие е този, който се характеризира с по-голяма стойност на равновесната константа. Вторият процес ще бъде преобладаващ, т.к неговата равновесна константа е по-голяма от равновесната константа на първия процес. Равновесието във втория процес е изместено в по-голяма степен надясно, т.к метиламинът е по-силна основа от амоняка, NH 4 + е по-силна киселина от CH 3 NH 3 +. Заключение: По-силната основа потиска йонизацията на по-слабата основа. Следователно, когато малко количество солна киселина се добави към смес от амоняк и метиламин, метиламинът ще претърпи главно протониране. И още: най-силната киселина потиска йонизацията на слабите киселини. И така, солната киселина, намираща се в стомашния сок, инхибира йонизацията на оцетна киселина (идва с храна) или ацетилсалицилова киселина (лекарство). ______________________________________________________________ Подобни публикации
| ||