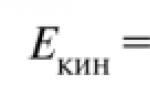Molekulide struktuuri uurimiseks. Molekulide struktuuri uurimise meetodid. Looduslugu ja molekulaarsed omadused
1. peatükk. 8.-11. klassi keemiakursuse sisu analüüs aine ehitusest ja visuaalse modelleerimise vahenditega varustamine 14-54.
1.1. Aine struktuuri uurimise eesmärgid ja tunnused kooli keemiakursusel. 14
1.2. Modelleerimine kui teadusliku uurimise meetod ja selle roll mateeria struktuuri puudutava tervikliku teadmise kujunemisel. 27
1.3. Loodusõpetuses kasutatavad traditsioonilised aatomite ja molekulide mudelid. 45 - 54 1. peatüki järeldused. 55
Peatükk 2. Pedagoogilised ja ergonoomilised nõuded aine ehituse uurimise mudelite loomisele ja kasutamisele. 57
2.1. Teaduse põhimõte ja uute teadusandmete kohandamine õppetööks. Kaasaegsed suundumused modelleerimise arendamisel. 57
2.2. Pedagoogilised ja ergonoomilised nõuded aatomite ja molekulide mudelitele ning nende uutele didaktilistele võimalustele. 75
2.3. Ainete struktuuri uurimise mudelite kogumi tunnused. 104 -
2. peatüki järeldused. 110
Peatükk 3. Mudelite komplekti kasutamise korraldus aine ehituse uurimisel gümnaasiumi keemiakursusel. 112
3.1. Ringpoolsete mudelite kaasamisega kompleksi kasutamise metoodilised võimalused ainete struktuuri uurimisel gümnaasiumi keemiakursusel. 112
3.2. Anorgaanilise ja orgaanilise keemia anorgaanilise ja orgaanilise keemia praktilise töö demonstreerimiseks ja läbiviimiseks kasutatavate mudelite komplekti, sealhulgas külgmudelite metoodilised meetodid. 122
3.3 Aatomite ja molekulide mudelite kompleksi pedagoogilise efektiivsuse eksperimentaalne testimine aine ehituse uurimiseks gümnaasiumi keemiakursusel. 156
3. peatüki järeldused. 168
Soovitatav lõputööde loetelu
Metoodika keemia põhimõistete kujundamiseks algkursusel aine ehituse mudelkontseptsioonide alusel 1984, pedagoogikateaduste kandidaat Kuznetsova, Lilija Mihhailovna
Keemiaalaste süsteemsete teadmiste kujundamise metoodilised alused keskkoolis 1984, pedagoogikateaduste doktor Tyldsepp, Aarne Albert-Romanovich
Aatomi ja aatomituuma teoreetiliste mudelite õppimine põhikooli füüsikakursusel 2002, pedagoogikateaduste kandidaat Pekšjeva, Irina Vladimirovna
Keemia õpetamise materiaalsete vahendite süsteemi loomise ja kasutamise teoreetilised alused keskkoolis 1988, pedagoogikateaduste doktor Nazarova, Tatjana Sergeevna
Metoodilised võimalused õpilastele orgaanilise keemia ja füüsika interdistsiplinaarsete seoste rakendamise õpetamiseks 1985, pedagoogikateaduste kandidaat Dyusyupova, Lidia Zeynelovna
Lõputöö tutvustus (osa referaadist) teemal “Aatomite ja molekulide mudelite kompleksi loomine ja kasutamine aine ehituse uurimiseks gümnaasiumi keemiakursusel”
Uurimistöö asjakohasus
Kaasaegses keskkoolis eeldab keemiliste protsesside teadlik mõistmine aatomite, molekulide ehituse, kehade kristallstruktuuride ja keemiliste sidemete olemuse süvitsi õppimist. Gümnaasiumi keemiakursus tugineb aatomi-molekulaarteooriale, Avogadro seadusele, aine koostise püsivuse ja massi jäävuse seadustele, D. I. Mendelejevi perioodilisele keemiliste elementide süsteemile ning ainete ehituse teooriale.
Aine struktuuri käsitlevate mõistete kujundamine on keemia õpetamise üks olulisemaid ülesandeid.
Modelleerimine on meetod objekti uuritavate omaduste mõistmiseks mudelite kaudu: toimingud mudelitega, mis võimaldavad uurida meid huvitava objekti või prototüübi individuaalseid omadusi, aspekte või omadusi.
Haridusmudelid moodustavad kasvatusliku ja metoodilise komplekti olulise komponendi, mille kesksel kohal on õpikud ja õppekirjandus.
Mudelid on defineeritud kui hariduslikud visuaalsed abivahendid, mis asendavad loodusobjekte ja annavad edasi nende struktuuri, olulisi omadusi, seoseid ja seoseid.
Eriti oluline on mudelite kasutamine selliste protsesside uurimisel, mida ei ole võimalik jälgida suurte aja- või ruumiliste skaalade erinevuste tõttu. Mudel osutub ainsaks objektiks, mis on protsessi või nähtuse kohta informatsiooni kandja. Sellises olukorras on mudelkatsel suur tähtsus. Mudelkatse on eksperimendi erivorm, mida iseloomustab olemasolevate materjalimudelite kasutamine eksperimentaaluuringute erivahenditena. Mudelkatset, mille käigus uuritakse objekti enda asemel asendusmudelit, kasutatakse juhtudel, kui uuritav objekt on visuaalseks mõtisklemiseks ligipääsmatu, nagu mikromaailma objekt. Seetõttu on modelleerimise probleem eriti aktuaalne loodusteadustes. Füüsikas ja keemias on see probleem mikroobjektide, st aatomite ja molekulide modelleerimisel.
Inimene saab suurima hulga teavet nägemise kaudu, seega tuleks kõigepealt esitada "ilmselged" mudelid. Eelistatav on, et need oleksid ka käegakatsutavad, st materiaalsed. Mitmeaastane mudelite kasutamise kogemus keemia õpetamise protsessis on näidanud nende suurt rolli õppeprotsessis ja õpetaja mõju õpilasele nende abiga. Visuaalsete mudelite kasutamise vajadus, nende jätkuv täiustamine ja uute mudelite esilekerkimine on tingitud keemia kui teaduse arengust ja õppetehnoloogia meetodite jätkuvast arendamisest.
Oluline tegur, mis takistab pedagoogilistele ja ergonoomilistele nõuetele vastavate mudelite loomist, on tänapäevaste teaduslike kontseptsioonide sobimatus enamiku modelleerimisel kasutatavate lihtsate ja visuaalsete kujunditega. Katse kohandada teaduslikke andmeid koolis õppeprotsessiga viib lihtsustatud mudelite loomiseni ja on seotud teatud vigadega omaduste kuvamisel. Tegelikult taandub haridusmudelite loomine optimaalse valiku probleemile erineva keerukuse ja erineva visuaalse võimsusega mudelite vahel. Didaktilisest vaatenurgast toob see paratamatult kaasa vajaduse moodustada omavahel seotud mudelite kogum, mille kirjeldavad omadused peavad rahuldama kõik visuaalse modelleerimise vajadused.
Esimese katse süstematiseerida õppevahendeid ja selle põhjendamist keemiateaduse spetsiifika ja õpetamise visualiseerimise didaktilise printsiibi seisukohalt viisid läbi A. A. Grabetsky ja K. Ya. Parmenov raamatus „Keemia koolitusseadmed. ” Autorid järeldavad, et visuaalseid vahendeid tuleks õppeprotsessis kasutada läbimõeldult, teatud süsteemis, et need on väärtuslikud olulise didaktilise vahendina, mis aitab saavutada kasvatuslikke eesmärke.
Traditsiooniliselt kasutatavatest mudelitest ei piisa aga koolitusmudelite komplekti moodustamiseks. Nende abil modelleeritud omaduste selektiivsus, mudelite vastastikune sobimatus ning struktuursete ja loogiliste seoste puudumine nende vahel loob takistusi õppimisele ja raskendab teabe assimilatsiooni protsessi. Soovitatavate mudelite loetelu on vaja täiendada selliste kaasaegsete mudelitega, mis võimaldaksid siduda aatomite ajaloolisi mudeleid, mis peegeldavad aatomialaste teadmiste arengut (Democritus, Thomson, Rutherford), mudelid, mis on juba traditsiooniliseks muutunud. keemia (pall-ja-pulk, Stewart-Brigleb või Pauling) uurimine, arvutusteaduslikes meetodites kasutatavad mudelid (M.O. meetod). Vajalik on luua hierarhiline mudelite süsteem, mille raames saaks ehitada erinevaid mudeleid ja selgitada aatomi ehituslikke iseärasusi, illustreerides vastavalt vajadusele teatud modelleeritud aspekte.
Kvantkeemia põhitõdede esitamise keerukuse tõttu ei anna kaheksanda ja üheksanda klassi õpikud vajalikku selgitust elektronide paiknemise põhjuste kohta tuumade ümber ning elektronide arvu määramise võimalus energiakihis puudub. kaalus. See raskendab ideede kujundamist aatomite, molekulide ja kristalsete kehade elektroonilise struktuuri kohta. Ja see kehtib keemiakursuse õppimise põhiülesannete kohta, alates keskkooli kaheksandast klassist.
Perioodilise seaduse ja keemiliste elementide perioodilise süsteemi uurimisel jäävad oluliseks mudelite ja simulatsiooni probleemid D.I. Mendelejev: on vaja demonstreerida stabiilsete elektronkihtide mudeleid, mis määravad keemiliste elementide tabeli tüübi. Keemiliste sidemete uurimisel on vaja ka lihtsaid pilte aatomite vastasmõjust ühise molekulaarse kesta moodustumisega. Sellise nähtusega peab kaasnema visuaalne kujund, mitte ainult sümboolne tähistus.
Vajadus visuaalsete mudelite järele on nii suur, et koolid on tootnud palju visuaalseid mudeleid elektrooniliste valemite kuvamiseks. Elektronide ühelt aatomilt teisele nihkumise demonstreerimiseks kasutatakse erinevaid lähenemisi: magnettahvel punkti (elektroni) kujutisega; kastid mitmevärviliste kiibidega, mis tähistavad elektrone ja ringid, mis tähistavad erinevate ainete ja ioonide aatomeid; värviliste plastfiguuride komplekt, mis kujutab erinevat tüüpi elektronpilvi, poolkerasid, mis kujutavad magnetiliselt aatomeid või ioone. Ülaltoodud ja sarnased visuaalsed abivahendid on samaväärsed elektrooniliste vooluringide joonistamisega tahvlile. Erinevus seisneb selles, et mudelid, jäädes ikooniks, omandavad mõningaid materiaalsuse jooni – muutuvad käegakatsutavaks ja dünaamiliseks, kuid see ei suurenda nende infomahtu.
Kiireloomuline probleem on uute, teaduslikega sarnaste ja didaktiliste omadustega haridusmudelite loomine. Metoodikud pööravad sellele probleemile suurt tähelepanu kogu teaduslike mudelite täiustamise ajal. A.I. Shpak soovitas kasutada elektroni esimese mudeli kujul kaheksandas klassis, arvestades selle asukohta ruumis ja elektronipilve kuju. S. N. Drozdov soovitas selleks kasutada pehmest vasest või alumiiniumtraadist valmistatud mudeleid.
B.C. Küsimuse esitamiseks elektronpilvede suuna kohta kosmoses kasutas Polosin kuulide ja õhupallide mudeleid, aga ka erinevat värvi värvitud traadist kokkupandavaid s- ja p-orbitaalide mudeleid. Koolilastega töötamise tulemuste põhjal järeldas ta, et mikromaailma nähtusi uurides ei saa piirduda ainult ühte tüüpi visuaalsete vahenditega, vaja on kasutada erinevate mudelite ja muude visuaalsete vahendite kompleksi.
Yu. I. Bulavin tegi ettepaneku kasutada mehaanilisi ja elektrilisi seadmeid, et pöörata erinevaid elektronpilvede vorme reprodutseerivaid osi.
S. S. Berdonosov, väites, et traditsiooniliselt keskkoolis kasutatav lähenemine isegi kõige lihtsamate molekulide (CHC, NH3, HgO jt) struktuuri selgitamisele ei ole kuigi visuaalne ja väga keeruline, tuginedes mitmetele kunstlikele eeldustele. , soovitab ta põhjendatult kasutada R. Gillespie mudeleid, mis on väga lihtsad ja võimaldavad seletada mitte ainult lihtsate sidemetega molekulide, vaid ka palju keerulisema koostisega ainete struktuuri, mis moodustavad kaksik- ja kolmiksidemeid.
Haridusmudelid, nagu ka uurimuslikud, peavad olema informatiivsed, st nende kasutamine peab looma pildi, mis on vajalik ja piisav, et kujundada modelleeritavast objektist kontseptsioon. Samas ei tohiks õpetamismudelite informatiivne (teaduslik) rikkus olla vastuolus nende kohanemisvõimega õppeprotsessi spetsiifikaga. Erinevalt ühe objekti või nähtuse uurimisõppe mudelitest ei tohiks need olla vastuolus maailma seadustega ja peaksid olema üksteisega ühilduvad. Ühilduvuse all mõistetakse sellist mudelite vahelist suhet, mille puhul on võimalik asendada üks mudel teisega, ilma et see kahjustaks uuritava nähtuse teaduslikku üldpilti. Ühilduva mudeli kasutamine soovitatud mudeli asemel ei tohiks kaasa tuua vastuolusid, vaid kas seletusmeetodi komplitseerimist või äärmisel juhul objekti modelleeritud külje kadumist.
Üldiselt seletatakse erinevate mudelite tekkimist modelleeritavate nähtuste erineva keerukuse tasemega ja nende erinevate rakendusvaldkondadega. Seetõttu peavad erinevate mudelite rakenduspiirid tingimata ristuma. Peab olema ristumisala, kus saab kasutada vähemalt kahte mudelit. Ideaalis peaks iga keeruline mudel ühilduma mis tahes lihtsama mudeliga, mis erineb ainult kasutusala poolest. Vastasel juhul võib reaalse objekti või nähtuse kohta teadmiste õppimise ja assimileerimise protsess liikuda mudelite endi tunnuste ja nende suhete uurimise valdkonda erinevates tingimustes. Infomahu poolest erinevad ühilduvad mudelid saab ühendada õpetamismudelite süsteemiks või moodustada õpetamismudelite kompleksi, mille kasutamine väldib info assimilatsiooni killustumist ja killustumist, tagades sidususe ja süstemaatilise teadmise.
Uurimisprobleem seisneb vastuolus õpilaste informeerimise vajaduse vahel vastavalt teaduse kaasaegsele arengutasemele ja traditsiooniliste didaktiliste vahendite - aatomite ja molekulide mudelite - vähese infovõimekuse vahel; suhteliselt uue õppevormi – mudeleksperimendi – juurutamise vajaduse ja selguse puudumise ning sageli kasutatavate mudelite omavahelise sobimatuse vahel.
Õppeobjektiks on aine ehituse uurimise protsess aatomite ja molekulide mudelite abil gümnaasiumi keemiakursusel. Uurimisaine: aatomite ja molekulide mudelite komplekti loomise ja kasutamise teooria ja praktika aine struktuuri uurimiseks gümnaasiumi keemiakursusel.
Uuringu eesmärk: määrata kindlaks moodsate aatomite ja molekulide mudelite komplekti loomise ja kasutamise viisid ja vahendid ainete struktuuri, nende füüsikaliste ja keemiliste omaduste uurimiseks. Uurimishüpotees: kui aatomite ja molekulide haridusmudelite kompleks, mis on loodud traditsioonilistel ja uutel mudelitel põhinevaid kaasaegseid modelleerimissuundi arvestades, vastab kõrge infomahu nõuetele, on laialdaste didaktiliste võimalustega ja seda kasutatakse uue õppevormi juurutamiseks. - mudeleksperiment, siis see aitab kaasa: õpilastes tervikliku ja teadliku teadmise kujunemisele mateeria struktuuri kohta; ainete omaduste mõistmine; teadmiste süvendamine ja pikaajaline säilitamine; interdistsiplinaarsete sidemete tugevdamine ja ühtse teadusliku maailmapildi loomine. Uurimistöö eesmärgid
1. Viia läbi aine ehituse ja visuaalse modelleerimise vahenditega varustatuse 8.-11. klassi keemiakursuse sisu analüüs.
2. Sõnastada mudelitele pedagoogilised ja ergonoomilised nõuded ning moodustada ühtne vastastikku järjepidev teaduspõhiste haridusmudelite kogum (sh nii traditsiooniliselt kasutatud kui ka uued rõngakujulised mudelid), tagades pedagoogiliste eesmärkide saavutamise kõige efektiivsemal viisil. 3. Töötada välja metoodilised võtted haridusmudelite komplekti, sealhulgas rõngakujuliste mudelite kasutamiseks, kontrollida nende abil mudelkatsete läbiviimise võimalust ja hinnata selle kasutamise pedagoogilist efektiivsust koolipraktikas. Uurimistöö metodoloogiliseks aluseks on fundamentaaluuringud didaktika, psühholoogia, erinevat tüüpi õppevahendite ja nende komplekside loomise ja kasutamise teoorias (A.A. Grabetsky, L.S. Zaznobina, A.A. Makarenya, E.E. Minchenkov, T.S. Nazarova, S. G. Šapovalenko), keemia õpetamise meetodid (O. S. Zaitsev, N. E. Kuznetsova, L. A. Tsvetkov, G. M. Tšernobelskaja, I. N. Tšertkov), psühholoogilised ja pedagoogilised ja ergonoomilised teooriad (V. V. Davõdov, V. P. Zinchenko teaduslik analüüs, V. M. Muntšenko, V. tehnilisi saavutusi elementaarosakeste, aatomite ja nende keemiliste ühendite mudelite loomise alal. Uurimismeetodid
Teadmisteooria ja teadmiste omandamise protsessi juhtimise pedagoogilise, metoodilise, keemia-, psühholoogia- ja pedagoogilise kirjanduse analüüs, õppevahendite kavandamine ja loomine aine ehituse, mudelite loomise ja kasutamise probleemide uurimisel. aine struktuur.
Koolitundide pedagoogilise kogemuse, edasijõudnud õpetajate ja metoodikute, pedagoogiliste uuenduste, aga ka õpilaste koolivälise klubilise töö kogemuse vaatlemine ja üldistamine.
Üksikute mudelite ja kompleksi kui terviku mõju hariduse kvaliteedile võrdleva pedagoogilise efektiivsuse eksperimentaalne testimine.
Uurimise etapid
Esimeses etapis (1996–1998) tuvastati probleemid ja raskused, millega õpetajad ja õpilased gümnaasiumi keemiakursuse aine struktuuri uurides silmitsi seisavad, mis on seotud aatomi keerulise ehitusega ja tungiva vajadusega teada seadusi. selle struktuurist. On kindlaks tehtud meetod õppematerjali valdamise probleemide lahendamiseks ja teadmiste kvaliteedi parandamiseks tingimuste loomiseks, kasutades mudelite komplekti, mida iseloomustab kõigi komponentide omavaheline seotus ja uued didaktilised võimalused.
Teises etapis (1999-2001) vaadeldi kaasaegse modelleerimise suundumusi, mudelitele esitatavaid pedagoogilisi ja ergonoomilisi nõudeid, pakuti välja haridusmudelite komplekt, sealhulgas uued rõngakujulised mudelid, ning kompleksi didaktilisi võimalusi.
Kolmandas etapis (2002-2003) määrati kindlaks mudelite komplekti kasutamise tehnikad ja meetodid aine struktuuri uurimiseks, koostati metoodilised soovitused ning testiti selle kasutamise pedagoogilist efektiivsust.
Uurimuse teaduslik uudsus ja teoreetiline tähendus
Aine struktuuri uurimiseks on välja töötatud kontseptsioon aatomite ja molekulide õppemudelite komplekti loomiseks ja kasutamiseks, mis sisaldab põhilisi ja spetsiifilisi pedagoogilisi ja ergonoomilisi nõudeid kasutatavatele mudelitele, arvestades tänapäevaseid modelleerimissuundi.
Pakutakse välja rida uusi haridusmudeleid, mis on vajalikud komponendid kaasaegsetele pedagoogilistele ja ergonoomilistele nõuetele vastava visuaalse modelleerimise tööriistade komplekti loomiseks.
Välja on töötatud metoodilised võtted mudelite komplekti, sh ringpoolsete, kasutamiseks keemia õpetamisel gümnaasiumis, tagades õpilaste teadmiste omandamise tulemuslikkuse.
Uurimistulemuste praktiline tähtsus
Moodustatud on aatomite ja molekulide õpetlike mudelite komplekt, sealhulgas uued ringipoolsed mudelid.
Välja on töötatud ja tootmisse võetud rõngakujuliste mudelite komplektid ning rõngakujuliste mudelitega tutvumiseks loodud arvutigraafika programmid.
Koolides rakendamiseks on koostatud rida tabeleid teemal “Aine struktuur”, mis on välja töötatud aatomite ja molekulide õppemudelite komplekti alusel, kaasates ka rõngapoolseid.
Katsetatud on võimalus kasutada õppetöös uusi mudeleid arvutigraafika programmide näol, mis tagavad ja kontrollivad õpilaste teadmiste omastamise efektiivsust aine ehituse küsimuste uurimisel.
Sarnased väitekirjad erialal “Õpetamise ja kasvatuse teooria ja meetodid (haridusvaldkondade ja tasemete lõikes)”, kood 13.00.02 HAC
Metoodilised lähenemisviisid elektrooniliste õppevahendite integreeritud kasutamiseks keskkoolis: matemaatika õpetamise näide 5.-6. 2007, pedagoogikateaduste kandidaat Nikonova, Natalja Vasilievna
Meediaõpetuse lõimimine keskkooli keemiakursusega 2004, pedagoogikateaduste doktor Žurin, Aleksei Anatoljevitš
Ekraanmeediumi pedagoogiline efektiivsus kombinatsioonis keemilise eksperimendiga gümnaasiumi orgaanilise keemia kursusel 1984, pedagoogikateaduste kandidaat Nuguen Man Dung, 0
Metoodilised alused füüsika süvakursuse koostamiseks algkoolis 1997, pedagoogikateaduste doktor Dammer, Manana Dmitrievna
Arvutimodelleerimise kasutamine õppeprotsessis: Keskkoolis molekulaarfüüsika õppimise näitel 2002, pedagoogikateaduste kandidaat Rozova, Natalia Borisovna
Lõputöö kokkuvõte teemal “Koolituse ja kasvatuse teooria ja metoodika (haridusvaldkondade ja tasemete kaupa)”, Koževnikov, Dmitri Nikolajevitš
3. peatüki järeldused.
1. Lõhe üldharidusklasside õpetamise aktsepteeritud algtaseme ja olemasoleva füüsika ja keemia õppimise vajaduse vahel tänapäevaste teaduslike ideede valguses aatomi ehituse kohta, molekulaarorbiidi mudelite ideoloogiline kokkusobimatus lihtsamate traditsiooniliste mudelitega toob kaasa. vajadusele viia sisu kooskõlla mitte ainult ajaloolisuse, vaid ka teadusliku, fundamentaalse, kohandatava ja tehnoloogilise põhimõtetega. Mudelite vastastikune ebakõla põhihariduses viib paradoksaalsete teadmisteni. Rõngaste servadega elektronkestade mudel võib olla erineva keerukusega teadmiste kandja aatomi struktuuri ja selle omaduste kohta. Selle metoodiline lihtsus ja juurdepääsetavus võimaldab seda kasutada keskkoolides, sh inimeseõpetuse tundides ning selle varieeruvus ja võimalus kasutada keerulisi mudeleid (äratuntavalt rõngakujulised: lainelise servaga või suletud spiraalidest) võimaldab seda kasutada klasside süvaõpet.
2. Rõngakujulisi mudeleid saab kasutada kogu keemiakursuse õpetamise ajal, alates perioodilise seaduse õppimise algusest. Visuaalsete mudelite kasutamine on ette nähtud väga erinevatel teemadel: "D.I. Mendelejevi perioodiline seadus ja keemiliste elementide perioodiline süsteem. Aatomi struktuur. Ainete struktuur."
3. Traditsiooniliselt kasutatavate mudelite keerukusest ja liigsest ebaühtlusest tingitud koolitussisu alaväärsuse probleemi saab lahendada uute mudelite koolitusse juurutamisega seotud sisu killustatud muutmisega.
4. Pakutakse välja erinevad metoodilised võtted uute mudelite kasutamiseks 8.-11. klassi keemiakursuse põhiteemades: nähakse ette uute mudelite kasutamine demonstratsioonidel; tutvustavate videomaterjalide kasutamine ja arvutitundide läbiviimine; Tehakse ettepanek teha nii frontaaltööd kui ka labori- ja praktilisi töid mudelkatsete vormis, mida õpilased viivad läbi iseseisvalt või meeskonnana.
5. Rõngapoolsed mudelid, mis ühendavad endas nii elektroonikalülituste kui ka orbiidimudelite eeliseid, pakuvad uusi didaktilisi võimalusi mudelkatsete näol, mille jaoks on välja töötatud õpilastele mõeldud tehnoloogiliste kaartide näidised, samuti tabelid teemal „Struktuur ainest” ja metoodilisi soovitusi õpetajatele .
6. Arvestatakse programmimaterjalide orienteeruvat temaatilist planeerimist, korraldusvormid ja metoodilised võtted esitatakse tabelina.
7. Sel viisil ettevalmistatud uute - rõngakujuliste mudelite kasutamine võimaldab teil viia õppimise teabe tajumise uuele tasemele: kujundlik-visuaalne-efektiivne.
Valminud uurimustöö on teoreetilise ja praktilise iseloomuga ning suunatud probleemi lahendamisele teaduslikult põhjendatud haridusmudelite süsteemi ja selle tulemusliku kasutamise viiside loomisest koolis.
1. Viidi läbi 8.-11. klassi keemiakursuse sisuanalüüs ning selgitati välja suundumused aatomite ja molekulide õppemudelite loomisel ja kasutamisel gümnaasiumi keemiakursuse jaoks. Näidatakse mudelite rolli õpetaja ja õpilase tegevuse vahendina rubriigi „Aine struktuur” uurimisel. Iseseisva töö näidisõppevahendite ja õppevahendite fondi analüüsi põhjal on tuvastatud vajadus luua uue põlvkonna mudelid, mis väldivad info omastamise killustumist ja killustumist, tagades sidususe ja süsteemse teadmise, mudelid, mis loovad. selge pilt elektronide jaotusest igas aatomis või molekulis elektronkihtide vahel.
2. Sõnastatud on keemia õpetamise haridusmudelite süsteemi loomise ja rakendamise teoreetilised põhimõtted, mis esitatakse mudelitele esitatavate pedagoogiliste ja ergonoomiliste nõuete vormis. Välja on töötatud haridusmudelite komplekt, sealhulgas uued rõngakujulised mudelid, mis täiendavad traditsiooniliselt keskkooli keemiakursustes kasutatavaid mudeleid. Sektsioonis “Aine struktuur” on määratud keemiakursuse õppimise mudelite komponentkoostis. Keemiline side." Teaduslike teadmiste kohandamiseks on välja pakutud erinevat tüüpi rõngakujulisi mudeleid, mida kasutatakse õpilaste tegevuse vahendina, ilma milleta on raske õppematerjali tajuda ja selle teaduslikku sisu omastada.
3. Gümnaasiumi keemiakursusel on välja töötatud metoodika visuaalsete mudelite komplekti (ka rõngakujuliste) kasutamiseks, mille abil on võimalik läbi viia näidiskatseid, laboratoorseid ja praktilisi töid. Uute tööriistade ja tehnoloogiate sisseehitatud komponentidega mudelite kompleksi mugavuse ja kasutamise hõlbustamiseks pakutakse õpilastele esmast tutvumist videoesitluste ja arvutitundide kaudu. Välja on töötatud didaktilised videomaterjalid ja arvutiprogrammid uute rõngakujuliste mudelite abil treenimiseks mitte ainult demonstratsioonideks, vaid ka modelleerimisprotsesside läbiviimiseks õpilaste poolt erinevates klasside organisatsioonilistes vormides (individuaal- ja rühmatöö), mis võimaldab koolitust üle viia uude klassi. info tajumise tase – piltlikult-visuaalselt.efektiivne. Eksperimentaalne test aatomite ja molekulide mudelite kompleksi kasutamise pedagoogilise efektiivsuse kohta koolipraktikas kinnitas selle uuringu hüpoteesi.
Doktoritöö uurimistöö viidete loetelu Pedagoogikateaduste kandidaat Koževnikov, Dmitri Nikolajevitš, 2004
1. Bergman D.L. Elementaarosakeste pöörleva laengu rõnga mudel // Galilei elektrodünaamika, 1991. kd. 2. - nr 2. - Lk 30-32.
2. Bergman David.L. ja Lucas J., Charles W. Elementaarosakeste, aatomite ja tuumade füüsikalised mudelid / Presentedat IVth International Conference: Problem of Space, Time and Motion. St. Peterburis, september 1997.
3. Lucas J. A Physical Model for Atoms and Nuclei //Galilean Electrodynamics, jaanuar/veebruar 1996. vol.7, - nr 1, lk 3-12.
4. Snelson K. Aatomi portree / Näitusevihik. Baltimore'i Marylandi teaduskeskus, 1981.
5. Arkavenko L. N. Valikkursuse “Keemia tööstuses” instrumentide ja installatsioonide süsteemi loomise ja kasutamise metoodilised alused: Ph.D. (13.00.02) Moskva 1991. -218s.
6. Atsjukovski V. A. Üldine eetri dünaamika. M.: Energoatomizdat, 1990. -70 lk.
7. Bekliamišev V.O. Vaakumiteooria. 1. osa. - Peterburi: 000 "Kongress", 1998. -104 lk.
8. Berdonosov S.S. Kuidas selgitab R. Gillespie mudel molekulide struktuuri? //Keemia koolis, 1996. nr 2. - lk 16-21.
9. Berdonosov S.S. Keemiaõpikud: traditsioonilised väärarusaamad ja modernsus // Keemia koolis, 2000. Nr 5. - Lk 22-27.
10. Yu. Boltyansky V. G. Selguse, isomorfismi ja lihtsuse valem // Sov. Pedagoogika, 1970. - nr 5.
11. Borodin P.V. Meie lähenemine metaani, etüleeni ja atsetüleeni struktuuri uurimisele // Keemia koolis, 1991. Nr 6. - Lk 40-41.
12. Bulavin Yu. I. Elektronpilvede dünaamilised mudelid // Keemia koolis, 1995. Nr 4. - lk 69-70.
13. Bunin V. A. Matemaatika ja füüsika raskused // Teadvus ja füüsiline reaalsus. M.: toim. Folium, 1997. - kd 2. - nr 2. - lk 71-79.
14. Vanyugina T.V., Milliaresi E.E. Valikuline erikursus “Orgaaniliste ühendite ruumiline ja elektrooniline struktuur” // Keemia koolis, 1988. Nr 4. - Lk 43-44.
15. Verhovski V. N. ja Smirnov A. D. Keemilise katse tehnika. Käsiraamat õpetajatele. 1. köide, toim. 6., parandatud - M., Haridus, 1975.-368lk.
16. Verhovski V. N. ja Smirnov A. D. Keemilise katse tehnika. Käsiraamat õpetajatele. 2. köide, toim. 6., parandatud - M., Haridus, 1975.-383lk.
17. Vinogradova N.K. Hariduskompleksi “lasteaedkool” ainekujulise keskkonna kujundamise organisatsioonilised ja pedagoogilised alused: doktoritöö tekst. (13.00.02) - Moskva 1999.-313s.
18. Vlasov A.D. Schrödingeri aatom // UFN, 1993. nr 2. - t 163. - lk 97-103.
19. Vlasov A. D. Klassikaline suund kvantmehaanikas. M.: MRTI RAS, 1993.-229 lk.
20. Gabrielyan O. S., Smirnova T. V. Keemia õppimine 8. klassis: õpiku Gabrielyan O. S. Keemia 8 metoodiline juhend õpilastele ja õpetajatele. Didaktilised materjalid. / Kindrali all toim. T.V. Smirnova. - M.: Blik Plus, 1997. - 224 lk.
21. Galiulin R.V. Loengud kristallograafia geomeetrilistest alustest: Loengute tekst. Tšeljabinsk: Uural. osariik Ülikool, Chelyab. olek ülikool, 1989. - 81 lk.
22. Gapich G. P. Integreeritud kordamise ja teadmiste üldistamise tund // Keemia koolis, 1998. Nr 7. - Lk 26-28.
23. Garkunov V.P. Keemia õpetamise meetodid / Toim. N. E. Kuznetsova. M.: Haridus, 1984. -415 lk.
24. Heisenberg V. Füüsika ja filosoofia. M.: Nauka, 1989. -400 lk.
25. Glinka N. L. Üldine keemia: õpik ülikoolidele. 21. väljaanne / Toim. Rabinovitš V. A. - L.: Keemia, 1980. - 720 lk.
26. Golubev I.M., Averin A.V. Pilt a- ja z-ühendustest ühel pildil // Keemia koolis, 1990. Nr 2. - Lk39.
27. Golubev I.M. Mõistest “elektronpilv” // Keemia koolis, 1980. - nr 5. P.36.
28. Grabetsky A. A., Zaznobina L. S., Nazarova T. S. Õppevahendite kasutamine keemiatundides. M.: Haridus, 1988. - 160 lk.
29. Grabetsky A.A., Nazarova T.S., Lavrova V.N. Keemiline katse koolis. M.: Haridus, 1987. -240 lk.
30. Guzey, L. S., Sorokin V. V., Surovtseva R. P. Aatomi struktuur ja keemiline side // Keemia koolis, 1988. Nr 2. - Lk 46-51.
31. Guzey, L. S., Sorokin V. V., Surovtseva R. P. Aatomi struktuur ja keemiline side // Keemia koolis, 1988. Nr 3. - lk 42-48.
32. Guzik N.P. Orgaanilise keemia õpetamine: Raamat õpetajatele: Töökogemusest. M.: Haridus, 1988. - 224 lk.
33. Davõdov V.V. Üldistuste tüübid õpetamisel. Õppeainete konstrueerimise loogilised ja psühholoogilised probleemid. M.: Pedagoogika, 1972. -424 lk.
34. Davõdov V.V. Arengukoolituse probleemid: teoreetilise ja eksperimentaalse psühholoogilise uurimistöö kogemus. M.: Pedagoogika, 1986.-240 lk.
35. Davõdov V.V. Arenduskoolituse teooria. M.: INTOR, 1996. -544 lk.
36. Davõdov V.V., Vardanjan A.U. Õppetegevused ja simulatsioonid. -Jerevan: Luys, 1981. -220 lk.
37. Daineko V.I. Loeng „Struktuuriteooria. Süsivesinikud: struktuuri ja omaduste seos” // Keemia koolis, 1988. Nr 1. - Lk.36-43.
38. Didyk Yu.K., Urazakov E.I. Füüsika probleemsete loengute kogumik: Õpik. VVVSKU: Dubna, 1990. - 62 lk.
39. Drizovskaja T.M. Keemia õpetamise meetodid 9. klassis. Käsiraamat õpetajatele. -M.: Haridus, 1965.-224 lk.
40. Drozdov S.N. Tetraeedri mudel ja selle kasutamine // Keemia koolis, 1982. Nr 3. - P.52-54.
41. Dukov V.M. Kaks sajandit tööd koolifüüsika õpiku kallal // Kooliõpiku probleeme. M.: Valgustus, 1990. - number. 19, koost. V.R. Rokitjanski. - lk 236-269.
42. Egorova A. A. Loodusõpetuse ja keemiakursuste vahekorrast // Keemia koolis, 1995.-nr 1.-P.30-31.
43. Zagorsky V.V. “Waldorfi” keemiaõpetus //Keemia koolis, 1995. -Nr 3. P.10-13. 44. Zaitsev O. S. Üldine keemia. Ainete olek ja keemilised reaktsioonid.
44. Õpik ülikoolidele. M.: Keemia, 1990. - 352 lk. 45. Zaitsev O. S. Keemia õpetamise meetodid. - M.: VLADOS, 1999. - 384 lk.: ill. 46.3ankov L.V. Valitud pedagoogilised tööd. - M.: Uus Kool, 1996. -426 lk.
45. Zelinsky A.N. Akadeemik N.D.Zelinsky (Uut elus, teaduses, tehnikas. Sari “Keemia”, nr 11). M.: Znanie, 1981.-64p.48.3inchenko V.P., Munipov V.M. Ergonoomika põhitõed. M.: Moskva Riikliku Ülikooli Kirjastus, 1979.- 343 lk.
46. Zorina L.Ya. Teadmiste süstemaatiline kvaliteet. - M.: Teadmised 1976. - 64 lk.
47. Ivanova R. G. Keemiaõppest 7. ja 8. klassis // Keemia koolis, 1981.- nr 4. Lk.24-29.
48. Ivanova R. G. Keemiaõpetuse ajakohastamise põhisuundadest üleminekul kaheteistkümneaastasele koolile // Keemia koolis, 2000. Nr 3. - Lk 2-5.
49. Kanarev F.M. Teoreetilise füüsika kriis. Krasnodari KSAU, 1998. -200 lk.
50. Kachalova O. I. Metoodilised põhimõtted kooli üldkeemia töötoa korraldamiseks (11. klass): kokkuvõte Ph.D. (13.00.02) Omsk: OGPU, 1998.-20 lk.
51. Kidd R., Ardini J., Anton A. Comptoni efekti kujutamine kahekordse Doppleri nihkena // Physics Foreign: Teaching. M.: Mir, 1988. - lk 68-79. Artikli tõlge Kidd R., Ardini J., Anton A.-Amer. J. Phys., 1985-v 53,-nr 7-lk 641.
52. Kiiranen K. Aatomi molekulaarmudelid // Keemia koolis, 1995. - nr 5. - Lk 55-56.
53. Kozhevnikov D.N. Molekulide rõngaspoolsed mudelid // Journal of Physical Chemistry, 1996. v. 70. - nr 6. - lk 1134-1137.
54. Kuznetsova L. M. Meie kogemused teema „Keemiline sidumine. Aine struktuur 8. klassi keemiakursuses” // Keemia koolis, 1982. Nr 6. - Lk 3942.
55. Kuznetsova N. E. Mõistesüsteemide kujunemine keemia õpetamisel. M.: Haridus, 1989. - 144 lk.
56. Leonov V. S. Elastse kvantiseeritud keskkonna teooria. 2. osa. - Minsk: kirjastus "PolyBig", 1997. - 122 lk.
57. Lorenz G. A. Elektronide teooria ja selle rakendamine valguse ja soojuskiirguse nähtustele. M.: Gostekhizdat, 1953. -472 lk.
58. Lorenz G.A. Füüsika vanad ja uued probleemid. M.: Nauka, 1970. - 264 lk.
59. Lyashenkov E.I., Gataulin A.G. Süsinikuaatomi elektronpilvede hübridisatsiooniskeemide kasutamine // Keemia koolis, 1982. Nr 5. - Lk 41-42.
60. Makarenya A.A. Keemia õpetamise teooria ja meetodid. Valitud teosed. -T. 2. Tjumen: TOGIRRO, 2000. - 335 lk.
61. Maurina I. Ya., Lipina G.N. Mõned tehnikad mudelite kasutamiseks klassiruumis // Keemia koolis, 1986. Nr 3. - Lk 51-53.
62. Medvedev Yu. N. Sekundaarse perioodilisuse nähtus // Keemia koolis, 1998. Nr 3. - Lk 9-19.
65. Minchenkov E.E. Keemiaõpetuse kontseptsioon koolis // Keemia koolis, 1993. Nr 4. - Lk 7-11.
66. Mihhailova I. B. Sensoorne refleksioon tänapäevastes teaduslikes teadmistes. M.: Mysl, 1972. - 277s
67. Nazarova T. S. Keemia õpetamise materiaalsete vahendite süsteemi loomise ja kasutamise teoreetilised alused keskkoolis. Väitekiri pedagoogikateaduste doktori teadusliku kraadi saamiseks. (13.00.02) Moskva: NIISMO, 1988.-42lk.
68. Nazarova T.S., Polat E.S. Õppevahendid: loomise ja kasutamise tehnoloogia. M.: Kirjastus URAO, 1998. - 204 lk.
69. Neyland O.Ya. Orgaaniline keemia: õpik. keemia jaoks. spetsialist. ülikoolid. M.: Kõrgem. Kool, 1990. -751 lk.
70. Uued pedagoogilised ja infotehnoloogiad haridussüsteemis: Õpik pedagoogikaülikoolide üliõpilastele ja õppejõudude täiendõppe süsteemid / Toim. E. S. Polat. M.: Kirjastus. Keskuse Akadeemia, 1999. - 224 lk.
71. Nurminsky I.I. Füüsika 11. Füüsika süvaõppega õpik koolidele ja klassidele. - M.: NT-keskus, 1993. - 160 lk.
72. Nurminsky I. I., Gladysheva N. K. Füüsika 9: Õpik õppeasutuste 9. klassile. - M.: Haridus, 1998. -256 lk.
73. Keemia õpetamine 7. klassis: Käsiraamat õpetajatele./A. S. Koroštšenko, P. N. Žukov, M. V. Zueva jt / Toim. A. S. Koroštšenko. M.: Haridus, 1988.-160 lk.
74. Orgaaniline keemia / Toim. Tyukavkina N. A. M.: Meditsiin, 1989. -432 lk 82, Osidak V.N. Elektron: sisemine struktuur//Venemaa füüsiline mõte, - M.: RIA "Krechet", 1996. Nr 2. - Lk 49-59.
75. Pedagoogika: Õpik pedagoogikaüliõpilastele. Inst / Yu. K. Babansky, V. A. Slastenin, N. A. Sorokin jne / Toim. Yu. K. Babansky. 2. väljaanne, lisa. ja töödeldud - M.: Haridus, 1988. - 479 lk.
76. Venemaa haridusasutuste õppevahendite nimekirjad. N. Novgorod: Nižpoligraf, 1994. - 309 lk.
77. Pidkasisty P.I. Kooliõpilaste iseseisev kognitiivne tegevus hariduses: teoreetilised ja eksperimentaalsed uuringud. -M.: Pedagoogika, 1980.-240 lk.
78. Pidkasisty P.I., Portnov M.L. Õpetamise kunst: teine trükk. Õpetaja esimene raamat. M.: Venemaa Pedagoogika Selts, 1999.-212 lk.
79. Plakhov I. A. Flanelgraafi kasutamine teema “Algused keemilised mõisted” uurimisel // Keemia koolis, 1995. nr 2. -S. 46-47.
80. Polosin V. S., Shirina L. K. Dünaamiliste visuaalsete abivahendite kasutamise teooria ja praktika keemia õpetamisel / Keemia õpetamise meetodite probleemid keskkoolis. Ed. M. P. Kashina ja L. A. Tsvetkova. M.: Pedagoogika, 1973. - 272 lk.
81. Polosin B.C. Väitekirjad keemia õpetamise meetoditest //Keemia koolis, 1980. Nr 1. - Lk 74-77.
82. Potapov Yu. S., Fominsky L. P. Keerisenergia ja külm tuumasünteesi liikumisteooria vaatenurgast. Chişinău - Tšerkasõ: “OKO-Plus”, 2000, 387 lk.
83. Pugal N.A. Bioloogia õppevahendite süsteemi loomine ja kasutamine keskkoolis. Väitekiri, 1994.
84. Röntgenmikroskoobid // Teadusmaailmas. M.: Mir, 1991. - nr 4. - P.36-43.
85. Rodina N.A. Füüsika õpilaste iseseisev töö keskkooli 7-8 klassis: didaktilised materjalid / Gutnik U.M., Kirillov I.G., Rodina. N.A / toim. ON. Kodumaa. 2. väljaanne - M.: Haridus, 1994. -126 lk.
86. Romazanov B. I. Eetri füüsika ja jõudude olemus / Ruumi, aja, gravitatsiooni probleemid: Kolmanda Int. materjalid. konf. 22-27. 05.94. -SPb.: Kirjastus Politehnika, 1995. Lk 175-185.
87. Romashina T. N., Tšernobelskaja G. M. Orgaanilise keemia teadmiste kinnistamine võrdlusskeemide ja koolitusharjutuste abil // Keemia koolis, 1985. Nr 4. - Lk 39-40.
88. Eb.Rudzitis G.E., Feldman F.G. Keemia: anorgaaniline keemia. Õpik 8. klassile. keskm. kool M.: Haridus, 1993. - 158 lk.
89. Rudzitis G.E., Feldman F.G. Keemia: anorgaaniline keemia. Õpik 9. klassile. keskm. kool M.: Haridus, 1990. - 176 lk.
90. Rudzitis G.E., Feldman F.G. Keemia: Orgaaniline keemia: Üldkeemia alused (Teadmiste üldistamine ja süvendamine). Õpik 10. klassile. Kolmapäev, kool M.: Haridus, 1991. - 160 lk.
91. Sadovskaja I. L. Teadmiste omandamise korrigeerimise metoodika bioloogia õpetamise protsessis pedagoogikaülikoolis: Ph.D väitekirja tekst. (13.00.02) - Krasnojarsk: KSPU, 2000. 151 lk.
92. Sapogin L. G. Visuaalne mikromaailm. Noortetehnoloogia, 1989. - nr 1. -S. 40-45.
93. Simon R. Eksperiment keemiateadmistes // Eksperiment, mudel, teooria. Vaatlus, katse, harjutamine. Moskva-Berliin: Nauka kirjastus, 1982.-P. 76-87.
94. Skatkin M. N. Pedagoogilise uurimistöö metoodika ja meetodid. Et aidata alustavat teadlast. M.: Pedagoogika, 1986. - 152 lk.
95. Skatkin M. N. Tänapäeva didaktika probleemid. 2. väljaanne M.: Pedagoogika, 1984. - 96 lk.
96. Smirnova Zh. I. Kuul-varraste mudelite valmistamine // Keemia koolis, 1984. Nr 1. - Lk 61.
97. Smirnova T. V. Õpilaste teadusliku maailmapildi kujunemine keemia õppimisel: Käsiraamat õpetajatele. M.: Haridus, 1984.-175 lk.
98. Smirnova. T.V. Sektsiooni "Üldine keemia" õppimise metoodikast // Keemia koolis, 1989. Nr 4. - Lk 35-44.
99. Sologub A.I. Magnetmudelite tootmine ja rakendamine // Keemia koolis, 1985. Nr 3. - Lk 55-56.
100. Solomon D. N., Stepanov E. Yu. Magnettahvli didaktiline materjal // Keemia koolis, 1982. Nr 1. - Lk 65.
101. Surovtseva R.P. Iseseisva töö ülesanded keemias 9. klassis: Raamat õpetajatele. - M.: Haridus, 1995. 64 lk.
102. Surovtseva R. P., Sofronov S. V. Iseseisva töö ülesanded keemias 8. klassis: Raamat õpetajatele. M.: Haridus, 1993. - 96 lk.
103. Surovtseva. R.P.; Mintšenkov E. E.; Gabrielyan O. S. Keemia õppematerjali ligikaudne temaatiline planeerimine 8. klassi jaoks // Keemia koolis, 2000. Nr 3. - Lk 37-46.
104. Tikavy V. F. Mõnede lihtsate ja keerukate anorgaaniliste ainete struktuuri tunnused // Keemia koolis, 1991. Nr 6. - Lk 5-12.
105. Tyumentseva E. Yu. Ettevalmistava osakonna üliõpilaste abistamise eristamine keemia õpetamise protsessis: Ph.D väitekirja tekst. (13.00.02) Omsk: OGPU, 1999. - 213 lk.
106. Keemiaõpetuse polütehnilise suunitluse tugevdamine. Raamat õpetajatele: töökogemusest / käepärane. Kaverina A. A. M.: Haridus, 1987.-127lk.
107. Füüsika ja astronoomia. Prooviõpik 8. klassi üldharidusele. asutamine / Toim. A. A. Pinsky, V. G. Razumovski. M.: Haridus, 1995.-303 lk.
108. Freemantle M. Keemia tegevuses. 2 osas Osa 1: Tõlk. inglise keelest - M.: Mir, 1991.-528 lk.
109. Freemantle M. Keemia tegevuses. 2 osas Osa 2: Tõlk. inglise keelest - M.: Mir, 1991.-622 lk.
110. Hager N. Mudeli kujunemise etapid // Eksperiment, mudel, teooria. Mudelid tunnetuse struktuuris. Moskva-Berliin: Teadus, 1982. - lk 128-142.
111. Keemia ja elu (Solteri keemia). 1. osa. Keemia mõisted: Trans. inglise keelest -M.: RKhTU im. DI. Mendelejeva, 1997. 337 lk, ill.
112. Keemia ja elu (Solteri keemia). 2. osa. Keemiaromaanid: Trans. inglise keelest M.: RKhTU im. DI. Mendelejeva, 1997. -437 lk, ill.
113. Keemia ja elu (Solteri keemia). Osa 3. Töötuba: Trans. inglise keelest M.: RKhTU im. DI. Mendelejeva, 1997. -406 lk, ill.
114. Keemia ja elu (Solteri keemia). Osa 4. Juhend õpetajatele: Trans. inglise keelest M.: RKhTU im. DI. Mendelejeva, 1998. - 331 lk, ill.
115. Khomchenko G.P. Graafilistest ja struktuurivalemitest // Keemia koolis, 1983. -№3.- Lk 61-63.
116. Tsvetkov J1. A. Keemia algõpetuse sisu põhjendamiseks // Keemia koolis, 1999. Nr 5. - Lk 17-22.
117. Tsvetkov L. A. Õpilaste teadmiste üldistamine orgaanilises keemias // Keemia koolis, 1981. Nr 6. - Lk 17-24.
118. Tsvetkov L. A. Orgaaniline keemia: Õpik gümnaasiumi 10. klassile. 25. väljaanne, parandatud. - M.: Haridus, 1988. - 240 lk.
119. Tsvetkov L. A. Orgaanilise keemia õpetamine keskkoolis: käsiraamat õpetajatele. 3. väljaanne, muudetud. - M.: Haridus, 1984. -256 lk.
120. Tšernobelskaja G.M. Keemia õppemeetodite alused. M.: Haridus, 1987.-256 lk.
121. Tšernobelskaja G.M. Keemia õpetamise meetodid keskkoolis. M.: VLADOS, 2000. - 336 lk.
122. Tšertkov I. N. Veel kord orgaanilise keemia oksüdatsiooniastme mõistest // Keemia koolis, 1998. - nr 7.-S. 31-32.
123. Tšertkov I. N. A. M. Butlerovi tööde tähtsus keemia õpetamise meetodite väljatöötamisel // Keemia koolis, 1991. Nr 6. - Lk 13-19.
124. Shamilishvili O. Kh. Selguse küsimusest elektrooniliste kestade hübridisatsiooni uurimisel // Keemia koolis, 1982. Nr 5. - Lk 43.
125. Šapovalenko S.G. Õppemeetodid kaheksa- ja keskkoolis. M.: Riik. Haridus-Ped. Kirjastus min. RSFSRi haridus, 1963. -668 lk.
126. Shelinsky G.I. Milline peaks olema kooli keemiakursus? // Keemia koolis, 1985.-№4.-P. 45-48.
127. Shpak A.I. Abivahendite komplekt aine ehituse uurimiseks üldhariduskooli kaheksanda klassi keemiakursuses: kokkuvõte doktorikraadile. (731)-Saratov: SGPI, 1971.-26lk.
128. Schrödinger E. Valitud töid kvantmehaanika kohta. M.: Nauka, 1976.
129. Shtoff V. A. Teaduslike teadmiste metodoloogia probleemid. Monograafia. -M.: Kõrgkool, 1978. 269 lk.
130. Shtoff V.A. Modelleerimine ja filosoofia. M.: Nauka, 1966.
131. Atkins P. Kord ja korratus looduses: Tõlk. inglise keelest / Eessõna Yu. G. Rudogo. M.: Mir, 1987. - 224 lk, ill.
132. Yuzvishin I. I. Informoloogia. 3. väljaanne, rev. ja täiendav - M.: Raadio ja side, 1996. -215 lk.
133. Jaroslavskaja G. P. Keemiliste sidemete ja aatomistruktuuride modelleerimise komplekt // Keemia koolis, 1986. Nr 3. - Lk 54-55.
134. Yatsuto M. A. Keemia didaktiliste võimaluste kasutamine õpilaste eluks ettevalmistamiseks: Ph.D väitekirja tekst. (13.00.02) Omsk: OGPU, 1999. - 192 lk.
Pange tähele, et ülaltoodud teaduslikud tekstid on postitatud ainult informatiivsel eesmärgil ja need saadi algse väitekirja tekstituvastuse (OCR) abil. Seetõttu võivad need sisaldada ebatäiuslike tuvastamisalgoritmidega seotud vigu. Meie poolt edastatavate lõputööde ja kokkuvõtete PDF-failides selliseid vigu pole.
Tänaseks on välja töötatud sadu erinevaid meetodeid, mida kasutatakse aktiivselt molekulide struktuuri ja omaduste uurimiseks. Paljud neist nõuavad keeruliste füüsikateooriate valdamist ja kallite seadmete kasutamist. Selles jaotises käsitleme ainult mõningaid kõige sagedamini kasutatavaid meetodeid molekulide struktuuri uurimiseks ja püüame anda nende meetodite aluseks olevate füüsikaliste nähtuste olemuse lihtsa tõlgenduse. Kuid kõigepealt käsitleme aatomite ja molekulide liikumist ruumis ning seotud aatomite liikumist molekulides. Selle põhjuseks on asjaolu, et paljud meetodid, mida kasutatakse molekulide struktuuri uurimiseks, põhinevad elektronide ja aatomite liikumise uurimisel molekulides ning molekulide endi liikumisel.
VABADUSASTMED
Punktosakel on kolm geomeetrilist vabadusastet: ta võib liikuda kolmes vastastikku risti olevas suunas. Osakesel on väidetavalt kolm vabadusastet.
Under vabaduse aste energiavahetusega protsessides mõistame osakese vabadusastet, mis võib osaleda energiavahetuse protsessis.
Vaatleme aatomite kineetilist käitumist. Ühe mooli aatomi keskmist kineetilist energiat on lihtne hinnata, kasutades näitena heeliumi. On hästi teada, et ühe mooli heeliumi soojusmahtuvus on 12,47 J/(mol K). See tähendab, et ühe mooli heeliumi kuumutamine ühe kraadi võrra nõuab 12,47 J energiat.
Kuumutamisel hakkavad heeliumi aatomid ruumis kiiremini liikuma mööda kõiki kolme telge, mis on võrdsed. Tõepoolest, heeliumi aatomitel on ainult kineetiline energia, mida saab esitada kolme telje suhtes ekvivalentsel kujul
See tähendab, et soojusliikumise kiirendamiseks piki üht telge koos temperatuuri tõusuga ühe kraadi võrra on vaja ainult 4,15 J. Viimane väärtus on täpselt võrdne R/2-ga, kus R on universaalne gaasikonstant, mis on võrdne 8,314472(15) J/ (mol -TO). Laiendame seda järeldust kõikidele aatomitele ja molekulidele, mis on kooskõlas katsega: osakese translatsioonisoojusmaht ühe translatsioonivabadusastme kohta on võrdne R/2.
Siiani oleme ignoreerinud aatomite ja molekulide sisemist struktuuri. Nüüd mõelgem, millist rolli mängivad elektronid ja aatomituumad energiavahetusprotsessides.
Temperatuuridel umbes 300 K on ühe mooli aatomite ja molekulide keskmine kineetiline energia vastavalt väljendile
![]()
ligikaudu 3740 J/mol. Ühe molekuli keskmine kineetiline energia arvutatakse võrrandi abil
![]()
kus k on Boltzmanni konstant, mis on võrdne R/L/d = 1,38 10 -23 J/K.
Ühe molekuli keskmine kineetiline energia 300 K juures on 6,2 10 -21 J ehk 0,039 eV molekuli kohta. Kokkupõrke ajal kandub üle ligikaudu sama palju energiat. Oleme varem näidanud, et elektrooniliste energiatasemete ergastusenergia vajab umbes 3-10 eV. Seega energia, mida keskmiselt saab ühelt molekulilt teise üle kanda, on täiesti ebapiisav, et ergutada elektroonilisi energiatasemeid. Seetõttu ei aita aatomites ja molekulides olevad elektronid, hoolimata iga elektroni kolme translatsioonivabadusastme olemasolust, reeglina kogu soojusmahtuvusele kaasa. Erandid on võimalikud ainult madala elektroonilise energiataseme korral.
Pöördugem molekulide osaks olevate aatomite tuumade poole. Igal tuumal on kolm translatsioonivabadusastet. Kuid molekulide koostises on tuumad omavahel ühendatud keemiliste sidemetega ja seetõttu ei saa nende liikumine toimuda täiesti kaootiliselt. Keemiliste sidemete olemasolu tõttu saab tuumade liikumine üksteise suhtes toimuda vaid teatud piirides, vastasel juhul toimuksid molekulides keemilised transformatsioonid. Kui kõik tuumad liiguvad kooskõlastatult, võivad sellised liikumised olla märkimisväärsed. Näiteks toimub see molekuli kui terviku translatsioonilise liikumise ajal. Sel juhul on kõigil molekuli tuumadel translatsioonilise liikumise suunas sama kiiruskomponent.
Lisaks translatsioonilisele liikumisele on tuumade sünkroonse liikumise avaldumiseks veel üks võimalus - see on molekulide kui terviku pöörlemine. Üldjuhul on mittelineaarsete molekulide puhul kolm pöörlemisvabadusastet ümber kolme massikeskpunkti läbiva üksteisega risti oleva telje. Massikese peab tingimata asuma pöörlemisteljel, kuna vastasel juhul nihkuks see molekuli pöörlemisel, mis välisjõudude puudumisel on võimatu.
Varem on näidatud, et pöörlemisenergia kvantifitseeritakse ja pöörlemisenergia kvanti määrab pöörlemiskonstandi, mis on võrdne H 2 /(2/). Molekulide pöörlemiskonstandid on tavaliselt oluliselt väiksemad kui k T(tavatemperatuuril umbes 300 K väärtus k T on umbes 200 cm -1 või 0,026 eV või 400 10 -23 J või 2500 J/mol) ja on ligikaudu 10 cm -1 (120 J/mol või 0,0012 eV molekuli kohta). Seetõttu on molekulaarsed pöörlemised tavatemperatuuridel kergesti ergastuvad. Soojusvõimsus ühe pöörlemisvabadusastme kohta on samuti võrdne R/2-ga.
Erinevalt mittelineaarsetest molekulidest on lineaarsetel molekulidel ainult kaks pöörlemisvabadusastet kahe vastastikku risti asetseva telje suhtes, mis on risti molekuli teljega. Kas molekuli teljega ühtiva telje ümber on pöörlemisvabadusaste? Rangelt võttes on selline vabadusaste olemas, kuid ümber molekuli telje pöörlemise ergastamine tähendab tuumade pöörlemise ergastamist ümber tuumade keskpunkte läbiva telje. Tuumade pöörlemisenergia kvantid määratakse ka pöörlemiskonstandid h 2 /(2 1), Kus 1 - nüüd südamiku inertsimoment. Tuumade pöörlemiskonstant on suurusjärgus (1,054) 2 10 _68 /(2 1,7 10 -27 Yu -30) = 3,2 10 -12 J, mis on palju suurem kui k T. Järelikult ei saa ka tuumade pöörlemisliikumise ergastumine toimuda tavalistes tingimustes.
Üldiselt saab molekulil olla ainult 3N vabadusastmed, kus N- südamike arv. Nendest 3 N Translatsiooniliste jaoks on kolm vabadusastet ja mittelineaarsete molekulide jaoks kolm või lineaarsete molekulide jaoks kaks vabadusastet pöörleva vabadusastme jaoks. Ülejäänud vabadusastmed on vibratsioonilised. Mittelineaarsetel molekulidel on 3 N-6 vibratsioonilist vabadusastet ja lineaarne -3N-5.
Erinevalt pöörlemis- ja translatsioonivabadusastmetest on iga vibratsioonilise vabadusastme soojusmahtuvus võrdne R, mitte R/2-ga. See on tingitud asjaolust, et vibratsioonilise liikumise ergastamise korral kulutatakse energiat mitte ainult tuumade kineetilise energia suurendamiseks, vaid ka vibratsioonilise liikumise potentsiaalse energia suurendamiseks.
Tuleb märkida, et vibratsioonilise vabadusastmega on olukord palju keerulisem kui translatsiooni ja rotatsiooniga. Fakt on see, et tüüpilised vibratsioonisageduste väärtused jäävad vahemikku 1000-3000 cm -1. (1 cm -1 ~ 1,24 10 -4 eV.) Järelikult on vibratsiooni ergastuse kvantid umbes 0,1-0,3 eV, mis on vaid mitu korda suurem kui soojusliikumise energia (0,04 eV 300 K juures). Seetõttu on toatemperatuurist madalamal temperatuuril (300 K) vibratsiooniline liikumine molekulides nõrgalt ergastatud, toatemperatuurist kõrgemal aga on vibratsioonid, eriti polüatomilistes molekulides, juba tõhusalt ergastatud. Ruumitemperatuurid langevad vahepealsesse vahemikku.
Kõik molekulides esinevad vibratsioonid võib jagada venitamiseks ja painutamiseks. Venitusvibratsiooni korral muutub peamiselt keemilise sideme pikkus ja deformatsioonivibratsiooni korral sidemetevahelised nurgad. Venitusvibratsioonil on kõrgem sagedus kui painutusvibratsioonil, kuna nurga muutmiseks kulub vähem energiat. Venitusvibratsioonide arv võrdub molekulis olevate aatomitevaheliste sidemete arvuga (kaksik- ja kolmiksidemeid käsitletakse sel juhul kui üht sidet aatomite vahel!). Venitusvibratsiooni sagedused on C-H, O-H jne sidemete jaoks. umbes 3000-3400 cm" 1, C-C - umbes 1200 cm" 1, C=C - 1700 cm 4, OS - 2200 cm 4, C=0 - 1700 cm 1, deformatsioonivibratsioonid jäävad tavaliselt vahemikku 1000 cm" 1 Esitatud andmetest on selge, et C-C sideme venitusvibratsiooni sagedus suureneb, kui sideme kordsus suureneb. Seda võib seletada sideme tugevuse suurenemisega.
Arutame seda nähtust üksikasjalikumalt. Joonisel fig 2 näidatud ostsillaatori sagedus. 2.7, määratakse avaldisega

Kus T- võnkuva osakese mass. Ostsillaatori puhul (joon. 2.7) võnkuva mass T kinnitatud vedruga seina külge, mille mass on väga suur ja seetõttu ei osale sein võnkeliikumises. Molekulide puhul on iga vibreeriv aatom ühendatud keemiliste sidemetega, toimides vedrudena, teiste aatomitega, mille mass ei ole lõpmatult suur. Seetõttu osalevad vibratsioonilises liikumises kõik keemiliste sidemetega ühendatud aatomid. Näiteks HC1 molekulis vibreerivad nii vesinikuaatom kui ka klooriaatom. Nagu võnkeliikumise teooriast tuleneb, peaks HC1 tüüpi ostsillaatorite võnkesageduse valem olema kujul
kus p on vähendatud mass, võrdne
![]()
Kus t ( ,t 2 - keemilises sidemes osalevate aatomite mass ja k on sideme tugevust iseloomustav jõukonstant. Üksiku C-C sideme energia on umbes 410 kJ/mol, kahekordse sideme energia -
710 kJ/mol, kolmekordne - 960 kJ/mol. C-C ostsillaatori vähendatud mass ei sõltu ühenduse olemusest. Seega võiks üksiksidemelt kolmiksidemele üleminekul oodata ostsillaatori sageduse suurenemist 1,5 korda, mida on katseliselt täheldatud.
C-C sidemete sagedused on ligikaudu 2,5 korda väiksemad kui C-H sidemete sagedused. See on tingitud asjaolust, et C-C sideme vibratsiooni vähendatud mass on suurem kui C-H sideme puhul ja C-C sideme energia on väiksem.
Vaatame mõningaid näiteid konkreetsetest molekulidest, mille vibratsioonirežiimid on näidatud joonisel fig. 7.1.
Vee molekul. Sellel on 9 vabadusastet, millest kolm on translatsioonilised, kolm pöörlevad, kolm võnkuvad. Kolmest võnkesagedusest kaks esimest on venitusvibratsioonid ja kolmas painutamine.
Molekul C0 2. Sellel on 9 vabadusastet: kolm - translatsiooniline, kaks - pöörlev, neli - võnkuv. Neljast võnkesagedusest kaks on venitusvibratsioonid ja kaks deformatsioonivõnked.

Riis. 7.1. Täpse teooria alusel saadud molekulide H 2 0, C0 2, H 2 CO vibratsioonivormid
Märgid “+” ja “-” näitavad vibratsiooni suundi risti lehe tasapinnaga. Mõlemad deformatsioonivõnked erinevad ainult vastastikku risti asetsevate tasandite poolest, milles vibratsioonid esinevad. Nendel võnkumistel on sama sagedus ja neid nimetatakse degenereerunud.
Mittelineaarne formaldehüüdi molekul on 12 vabadusastet: kolm - translatsiooniline, kolm - pöörlev, kuus - võnkuv. Kuuest vibratsioonist kolm on venitusvibratsioonid ja kolm painutusvibratsioonid.
Jooniselt fig. 7.1 näitab, et venitusvibratsioonid ulatuvad tavaliselt tervele molekulile: ainult ühe sideme vibratsioonid on väga haruldased. Samamoodi mõjutavad deformatsioonivõnked ühel või teisel määral kõiki nurki.
Pöördume nüüd tagasi molekulide soojusmahtuvuse arvutamise juurde. Aatomite (monatoomiliste molekulide) translatsioonisoojusmaht on peamiselt võrdne (3/2)R. Kaheaatomilistel molekulidel on kolm translatsioonivabadusastet, kaks pöörlevat ja üks vibratsiooniline. Siis madalate (toa)temperatuuride korral saame vibratsioonilisi vabadusastmeid arvesse võtmata C = (3 / 2 + 3 / 2)R = (5 / 2)R. Kõrgete temperatuuride korral on soojusmahtuvus (7 / 2)R.
Veemolekulis on kolm translatsiooni-, kolm pöörlemis- ja kolm vibratsioonilist vabadusastet. Madalate temperatuuride korral ilma vibratsioonilise vabadusastmega arvestamata C = (3 / 2 + 3 / 2)R = 3R. Kõrgete temperatuuride korral peate sellele väärtusele lisama veel 3R. Tulemuseks on 6R.
Molekulaarne struktuur
Molekul on aine väikseim osake, mis koosneb identsetest või erinevatest aatomitest, mis on omavahel ühendatud keemiliste sidemetega, ning on selle põhiliste keemiliste ja füüsikaliste omaduste kandja. Keemilised sidemed tekivad aatomite väliste valentselektronide vastasmõjul. Molekulides leidub kõige sagedamini kahte tüüpi sidemeid: iooniline ja kovalentne.
Iooniline side (näiteks NaCl, KBr molekulides) toimub aatomite elektrostaatilise interaktsiooni teel elektroni üleminekul ühelt aatomilt teisele, st positiivsete ja negatiivsete ioonide moodustumisel. Kovalentne side (näiteks H2, C2, CO molekulides) tekib siis, kui valentselektrone jagavad kaks naaberaatomit (valentselektronide spinnid peavad olema antiparalleelsed). Kovalentset sidet selgitatakse identsete osakeste, näiteks vesiniku molekulis olevate elektronide eristamatuse põhimõtte alusel. Osakeste eristamatus toob kaasa nendevahelise spetsiifilise interaktsiooni, nn vahetus interaktsioon. See on puhtalt kvantefekt, millel puudub klassikaline seletus, kuid seda võib ette kujutada nii, et vesinikumolekuli iga aatomi elektron veedab mõnda aega teise aatomi tuumas ja järelikult ka ühenduses. esinevad mõlemad molekuli moodustavad aatomid. Kui kaks vesinikuaatomit ühinevad Bohri raadiuse suurusjärgus vahemaadega, tekib nende vastastikune külgetõmme ja moodustub stabiilne vesiniku molekul.
Molekul on kvantsüsteem; seda kirjeldab Schrödingeri võrrand, mis võtab arvesse elektronide liikumist molekulis, molekuli aatomite vibratsioone ja molekuli pöörlemist. Selle võrrandi lahendamine on väga keeruline ülesanne, mis tavaliselt jaguneb kaheks: elektronide ja tuumade jaoks.
Eraldatud molekuli energia
EE el +E arv +E pöörlemine, (1)
kus E el on elektronide liikumise energia tuumade suhtes, E arv - vibratsiooni energia
tuumad (mille tulemusena tuumade suhteline asend perioodiliselt muutub), E rotatsioon on tuumade pöörlemisenergia (mille tulemusena muutub perioodiliselt molekuli orientatsioon ruumis). Valem (1) ei võta arvesse molekuli massikeskme translatsioonilise liikumise energiat ja molekulis olevate aatomituumade energiat. Esimene neist ei ole kvantifitseeritud, seega ei saa selle muutused kaasa tuua molekulaarspektri tekkimist ja teist võib ignoreerida, kui ei arvestata hüperpeenstruktuuri
spektrijooned. Seosed E el:E arv:E rotatsioon =1: m/M , Kus T- elektroni mass, M- suurusjärku aatomituumade massi suurus molekulis, m/M10 -5 10 -3. Seetõttu E el >> E count >> E rotatsioon. On tõestatud, et E el 1 10 eV, E koll 10 -2 10 -1 eV, E pöörlemine 10 -5 10 -3 eV.
Kõik avaldises (1) sisalduvad energiad on kvantiseeritud (see vastab diskreetsete energiatasemete komplektile) ja määratakse kvantarvudega. Üleminekul ühest energiaolekust teise neeldub või eraldub energia E=h. Selliste üleminekute käigus muutuvad samaaegselt elektronide liikumise energia, vibratsiooni ja pöörlemise energia. Teooriast ja katsest järeldub, et pöörlemisenergia tasemete vaheline kaugus E rot on palju väiksem kui kaugus võnketasemete vahel E coll, mis omakorda on väiksem kui kaugus elektrooniliste tasemete vahel E el. Joonisel fig. Joonisel 1 on skemaatiliselt kujutatud kaheaatomilise molekuli energiatasemed (näiteks võetakse arvesse ainult kahte elektroonilist taset – näidatud paksude joontega).
Molekulaarspektrid. Ramani hajumine
Molekulide struktuur ja nende energiatasemete omadused avalduvad selles molekulaarsed spektrid- molekulide energiatasemete vaheliste kvantüleminekute käigus tekkivad emissiooni (absorptsiooni) spektrid. Molekuli emissioonispektri määrab selle energiatasemete struktuur ja vastavad valikureeglid (näiteks nii võnke- kui ka pöörlevale liikumisele vastav kvantarvude muutus peab olema võrdne ± 1).
Seega tekivad erinevat tüüpi tasanditevahelised üleminekud erinevat tüüpi molekulaarspektrid. Molekulide kiirgavate spektrijoonte sagedused võivad vastata üleminekutele ühelt elektrooniliselt tasemelt teisele (elektroonilised spektrid) või ühelt vibratsiooni (rotatsiooni) tasandilt teisele (võnke (pöörlemise) spektrid). Lisaks on võimalikud ka üleminekud samade E-arvu väärtustega ja E pööratakse tasemetele, millel on kõigi kolme komponendi erinevad väärtused, mille tulemuseks on elektrooniline-vibratsiooni- ja vibratsiooni-pöörlemisspekter. Seetõttu on molekulide spekter üsna keeruline.
Tüüpilised molekulaarspektrid on triibulised, esindades ultraviolett-, nähtava- ja infrapunapiirkonnas rohkem või vähem kitsaid ribasid. Kõrge eraldusvõimega spektraalinstrumente kasutades on näha, et ribad on nii tihedalt asetsevad jooned, et neid on raske lahendada. Molekulaarspektrite struktuur on erinevate molekulide puhul erinev ja muutub keerulisemaks koos aatomite arvu suurenemisega molekulis (täheldatud ainult kindlad laiad triibud). Ainult polüaatomilistel molekulidel on võnke- ja pöörlemisspektrid, kaheaatomilistel aga need puuduvad. Seda seletatakse asjaoluga, et kaheaatomilistel molekulidel ei ole dipoolmomente (võnke- ja pöörlemissiirete ajal ei muutu dipoolmoment, mis on vajalik tingimus, et ülemineku tõenäosus erineks nullist).
1928. aastal avastasid nähtuse akadeemikud G. S. Landsberg (1890-1957) ja L. I. Mandelstam ning samal ajal India füüsikud C. Raman (1888-1970) ja K. Krishnan (s. 1911). Ramani valguse hajumine. Kui ainele (gaas, vedelik, läbipaistev kristall) langeb rangelt monokromaatiline valgus, siis hajutatud valguse spektris tuvastatakse lisaks nihutamata spektrijoonele uusi jooni, mille sagedusteks on sageduse summad või erinevused. langeva valguse ja sageduste kohta i hajutava keskkonna molekulide loomulikud vibratsioonid (või pöörlemised).
Ramani spektri jooned sagedustega - i , madalamad sagedused
langevat valgust nimetatakse Stokesi (või punased) satelliidid, read sagedustega + i, suur ,- anti-Stokes (või violetsed) satelliidid. Ramani spektrite analüüs viib järgmiste järeldusteni: 1) satelliidiliinid paiknevad sümmeetriliselt mõlemal pool nihutamata joont; 2) sagedused i ei sõltu ainele langeva valguse sagedusest, vaid on määratud ainult hajuva ainega, st iseloomustavad selle koostist ja struktuuri; 3) satelliitide arvu määrab hajutav aine; 4) Stokesi vastaste satelliitide intensiivsus on väiksem kui Stokesi satelliitide intensiivsus ja suureneb hajutava aine temperatuuri tõustes, samas kui Stokesi satelliitide intensiivsus praktiliselt ei sõltu temperatuurist.
Kvantteooria selgitab Ramani valguse hajumise seadusi. Selle teooria kohaselt on valguse hajumine protsess, mille käigus molekul neeldub ühe footoni ja ühe footoni kiirgab. Kui footonite energiad on samad, siis hajutatud valguses täheldatakse nihutamata joont. Küll aga on võimalikud hajumisprotsessid, mille puhul neelduvate ja emiteeritud footonite energiad on erinevad. Footonite energia erinevus on seotud molekuli üleminekuga normaalolekust ergastatud olekusse (eraldatud footoni sagedus on madalam – ilmub Stokesi satelliit) või ergastatud olekust normaalolekusse (eraldatud footon läheb on kõrgema sagedusega – ilmub Stokesi vastane satelliit).
Valguse hajumisega kaasnevad molekuli üleminekud erinevate vibratsiooni- või pöörlemistasandite vahel, mille tulemusena tekib hulk sümmeetriliselt paiknevaid satelliite. Satelliitide arvu määrab seega molekulide energiaspekter, st see sõltub ainult hajutava aine olemusest. Niisiis Kuna ergastatud molekulide arv on palju väiksem kui ergastamata molekulide arv, on Stokesi vastaste satelliitide intensiivsus väiksem kui Stokesi satelliitidel. Temperatuuri tõustes suureneb ergastatud molekulide arv, mille tulemusena suureneb ka Stokesi vastaste satelliitide intensiivsus.
Molekulaarspektreid (sh Ramani spektreid) kasutatakse molekulide struktuuri ja omaduste uurimiseks, kasutatakse molekulaarspektraalanalüüsis, laserspektroskoopias, kvantelektroonikas jne.
Röntgendifraktsioonianalüüs: 1) Röntgenkiire kristalli läbimisel saadud difraktsioonimustrite põhjal määratakse aatomitevahelised kaugused ja määratakse kristalli struktuur; 2) Laialdaselt rakendatud valkude ja nukleiinhappemolekulide struktuuri määramiseks; 3) Väikeste molekulide jaoks täpselt kindlaks määratud sideme pikkusi ja nurki kasutatakse standardväärtustena eeldusel, et need jäävad keerukamates polümeerstruktuurides samaks; 4) Valkude ja nukleiinhapete struktuuri määramise üks etappe on polümeeride molekulaarmudelite konstrueerimine, mis on kooskõlas röntgenikiirguse andmetega ja säilitavad sideme pikkuste ja sidemete nurkade standardväärtused.
Tuumamagnetresonants: 1) Keskmes - elektromagnetlainete neeldumine raadiosagedusalas aatomituumade poolt millel on magnetmoment; 2) Energiakvanti neeldumine toimub siis, kui tuumad on NMR-spektromeetri tugevas magnetväljas; 3) Erineva keemilise keskkonnaga tuumad neelavad energiat veidi erineva pingega magnetväljas (või konstantse pinge korral veidi erineva sagedusega raadiosageduslikud võnked); 4) Tulemuseks on NMR spekter aine, milles magnetiliselt asümmeetrilisi tuumasid iseloomustavad teatud signaalid - "keemilised nihked" mis tahes standardi suhtes ; 5) NMR spektrid võimaldavad määrata antud elemendi aatomite arvu ühendis ning teiste antud elementi ümbritsevate aatomite arvu ja olemust.
Elektronide paramagnetresonants (EPR): 1) Kasutatakse kiirguse resonantsneeldumist elektronide poolt
elektronmikroskoopia:1) Nad kasutavad elektronmikroskoopi, mis suurendab objekte miljoneid kordi; 2) Esimesed elektronmikroskoobid ilmusid 1939. aastal; 3) ~0,4 nm eraldusvõimega elektronmikroskoop võimaldab "näha" valkude ja nukleiinhapete molekule, samuti raku organellide struktuuri üksikasju; 4) 1950. aastal kujundati need mikrotoomid Ja noad , mis võimaldab teha üliõhukesi (20–200 nm) kudede lõikeid, mis on eelnevalt plastikusse põimitud
Valkude eraldamise ja puhastamise meetodid: Kui valguallikas on valitud, on järgmine samm selle koest eraldamine. Kui ekstrakt, mis sisaldab olulist osa huvipakkuvast valgust, on saadud ning osakesed ja mittevalguline materjal on eemaldatud, võib alata valgu puhastamine. Keskendumine . Seda saab läbi viia valgu sadestamisel, millele järgneb sademe lahustamine väiksemas mahus. Tavaliselt kasutatakse ammooniumsulfaati või atsetooni. Valgu kontsentratsioon alglahuses peab olema vähemalt 1 mg/ml. Termiline denatureerimine . Puhastamise algfaasis kasutatakse mõnikord valkude eraldamiseks kuumtöötlust. See on efektiivne, kui valk on kuumutamisel suhteliselt stabiilne, samal ajal kui kaasnevad valgud on denatureeritud. Sel juhul muudetakse lahuse pH-d, ravi kestust ja temperatuuri. Optimaalsete tingimuste valimiseks viiakse esmalt läbi rida väikeseid katseid. Pärast esimesi puhastamisetappe pole valgud homogeensest olekust kaugel. Saadud segus erinevad valgud üksteisest lahustuvuse, molekulmassi, molekuli kogulaengu, suhtelise stabiilsuse jms poolest. Valkude sadestamine orgaaniliste lahustitega. See on üks vanu meetodeid. See mängib olulist rolli valkude puhastamisel tööstuslikus mastaabis. Enimkasutatavad lahustid on etanool ja atsetoon, harvem isopropanool, metanool ja dioksaan. Protsessi põhimehhanism: orgaanilise lahusti kontsentratsiooni suurenedes väheneb vee võime solveerida laetud hüdrofiilseid ensüümi molekule. Valkude lahustuvus väheneb tasemeni, mille juures algab agregatsioon ja sadestumine. Oluline sadenemist mõjutav parameeter on valgu molekuli suurus. Mida suurem on molekul, seda madalam on orgaanilise lahusti kontsentratsioon, mis põhjustab valgu sadestumist. Geelfiltreerimine Geelfiltratsiooni meetodil saab makromolekule kiiresti nende suuruse järgi eraldada. Kromatograafia kandja on geel, mis koosneb ristseotud kolmemõõtmelisest molekulaarsest võrgustikust, mis on moodustatud helmeste (graanulite) kujul kolonnide hõlpsaks täitmiseks. Niisiis Sefadeksid on ristseotud dekstraanid (mikroobse päritoluga α-1 → 6-glükaanid), millel on kindlaksmääratud pooride suurus. Dekstraaniahelad on ristseotud kolme süsiniku sildadega, kasutades epiklorohüdriini. Mida rohkem ristsidemeid, seda väiksemad on augud. Nii saadud geel täidab molekulaarsõela rolli. Kui ainete segu lahus lastakse läbi paisunud Sephadexi graanulitega täidetud kolonni, liiguvad Sephadexi pooride suurusest suuremad osakesed kiiresti. Väikesed molekulid, näiteks soolad, liiguvad graanulite sees liikudes aeglaselt. Elektroforees
Elektroforeesimeetodi füüsikaline põhimõte on järgmine. Valgumolekulil lahuses mis tahes isoelektrilisest punktist erineva pH juures on teatav keskmine laeng. See põhjustab valgu liikumise elektriväljas. Liikuva jõu määrab elektrivälja tugevuse suurus E korrutatuna osakese kogulaenguga z. Sellele jõule vastanduvad viskoossuskoefitsiendiga võrdelised keskkonna viskoossed jõud η , osakeste raadius r(Stokesi raadius) ja kiirus v.; E ·z = 6πηrv.
Valgu molekulmassi määramine. Massispektromeetria (massispektroskoopia, massispektrograafia, massispektranalüüs, massispektromeetriline analüüs) on meetod aine uurimiseks massi ja laengu suhte määramise teel. Valgud on võimelised omandama mitmeid positiivseid ja negatiivseid laenguid. Keemiliste elementide aatomitel on konkreetne mass. Seega võimaldab analüüsitava molekuli massi täpne määramine määrata selle elemendilise koostise (vt: elementaaranalüüs). Massispektromeetria annab ka olulist teavet analüüsitavate molekulide isotoopkoostise kohta.
Ensüümide eraldamise ja puhastamise meetodid Ensüümide eraldamine bioloogilisest materjalist on ainus reaalne viis ensüümide saamiseks . Ensüümi allikad: kangad; sobivat substraati sisaldaval söötmel kasvatatud bakterid; rakulised struktuurid (mitokondrid jne). Bioloogilisest materjalist on vaja esmalt välja valida vajalikud objektid.
Ensüümide eraldamise meetodid: 1) Ekstraheerimine(tõlge lahuseks): puhverlahus (hoiab ära hapestumise); kuivatamine atsetooniga ; materjali töötlemine butanooli ja vee seguga ; ekstraheerimine erinevate orgaaniliste lahustitega, detergentide vesilahused ; materjali töötlemine perkloraadi, hüdrolüütiliste ensüümidega (lipaasid, nukleaasid, proteolüütilised ensüümid)
Butanool hävitab lipoproteiinide kompleksi ja ensüüm läheb vesifaasi.
Pesuainega töötlemine põhjustab ensüümi tõelise lahustumise.
Fraktsioneerimine. Tulemusi mõjutavad tegurid: pH, elektrolüütide kontsentratsioon. Ensüümide aktiivsust on vaja pidevalt mõõta.
Fraktsionaalne sadestumine pH muutustega
Fraktsionaalne denatureerimine kuumutamise teel
Fraktsionaalne sadestamine orgaaniliste lahustitega
· sooladega fraktsioneerimine – väljasoolamine
fraktsionaalne adsorptsioon (A. Ja. Danilevski): ensüümilahusele lisatakse adsorbent, seejärel eraldatakse iga osa tsentrifuugimisega
§ kui ensüüm on adsorbeeritud, eraldatakse see ja seejärel elueeritakse adsorbendist
§ kui ensüüm ei ole adsorbeeritud, siis kasutatakse ballastainete eraldamiseks töötlemist adsorbendiga
ensüümilahus lastakse läbi adsorbendiga kolonni ja kogutakse fraktsioonid
Ensüümid adsorbeeritakse selektiivselt: kolonnkromatograafia, elektroforees; kristalliseerimine – kõrgelt puhastatud ensüümide saamine.
Rakk kui elu minimaalne ühik.
Kaasaegne rakuteooria sisaldab järgmisi põhisätteid: Rakk on kõigi elusorganismide ehituse ja arengu põhiüksus, elusate väikseim üksus. Kõikide ühe- ja mitmerakuliste organismide rakud on ehituselt, keemiliselt koostiselt ja elutähtsate funktsioonide põhiilmingutelt sarnased (homoloogsed). ja ainevahetust. Rakkude paljunemine toimub nende jagamisel, s.o. iga uus rakk. Komplekssetes hulkrakselistes organismides on rakud spetsialiseerunud funktsioonidele, mida nad täidavad ja kudesid moodustavad; Elundid koosnevad kudedest. Cl on elementaarne elusüsteem, mis on võimeline ise uuenema, isereguleeruma ja ise tootma.
Raku struktuur. prokarüootsete rakkude keskmine suurus on 0,5-5 mikronit, eukarüootsete rakkude keskmine suurus on 10 kuni 50 mikronit.
Mobiilsideorganisatsioone on kahte tüüpi: prokarüootne ja eukarüootsed. Prokarüootsetel rakkudel on suhteliselt lihtne struktuur. Neil ei ole morfoloogiliselt eraldiseisvat tuuma, ainsa kromosoomi moodustab tsirkulaarne DNA ja see asub tsütoplasmas. Tsütoplasma sisaldab arvukalt väikseid ribosoome; Mikrotuubuleid pole, seega on tsütoplasma liikumatu ning ripsmetel ja lipudel on eriline struktuur. Bakterid liigitatakse prokarüootidena. Enamik tänapäevaseid elusorganisme kuulub ühte kolmest kuningriigist – taimed, seened või loomad, mis on ühendatud eukarüootide superkuningriiki. Organismid jagunevad ühe- ja mitmerakulisteks. Üherakulised organismid koosnevad ühest rakust, mis täidab kõiki funktsioone. Kõik prokarüootid on üherakulised.
Eukarüootid- organismid, millel on erinevalt prokarüootidest moodustunud rakutuum, mis on tsütoplasmast piiritletud tuumamembraaniga. Geneetiline materjal sisaldub mitmes lineaarses kaheahelalises DNA molekulis (olenevalt organismi tüübist võib nende arv tuuma kohta ulatuda kahest kuni mitmesajani), mis on seestpoolt kinnitunud raku tuuma membraanile ja moodustavad kompleksi valdavas enamuses histooni valgud, mida nimetatakse kromatiiniks. Eukarüootsetel rakkudel on sisemembraanide süsteem, mis lisaks tuumale moodustab ka mitmeid teisi organelle (endoplasmaatiline retikulum, Golgi aparaat jne). Lisaks on valdaval enamusel püsivad intratsellulaarsed prokarüootsed sümbiondid – mitokondrid ning ka vetikatel ja taimedel on plastiidid.
Bioloogilised membraanid, nende omadused ja funktsioonid Kõigi eukarüootsete rakkude üks peamisi tunnuseid on sisemembraanide struktuuri rohkus ja keerukus. Membraanid piiritlevad tsütoplasma keskkonnast ning moodustavad ka tuumade, mitokondrite ja plastiidide kestad. Need moodustavad labürindi endoplasmaatilisest retikulumist ja lamestatud vesiikulitest, mis moodustavad Golgi kompleksi. Membraanidest moodustuvad lüsosoomid, taime- ja seenerakkude suured ja väikesed vakuoolid ning algloomade pulseerivad vakuoolid. Kõik need struktuurid on sektsioonid (kambrid), mis on ette nähtud teatud spetsiifiliste protsesside ja tsüklite jaoks. Seetõttu on raku olemasolu ilma membraanideta võimatu. plasmamembraan, või plasmalemma,- kõige püsivam, põhiline, universaalne membraan kõikide rakkude jaoks. See on õhuke (umbes 10 nm) kile, mis katab kogu raku. Plasmalemma koosneb valgu molekulidest ja fosfolipiididest. Fosfolipiidmolekulid on paigutatud kahte ritta – hüdrofoobsete otstega sissepoole, hüdrofiilsete peadega sisemise ja välise vesikeskkonna poole. Mõnes kohas tungivad fosfolipiidide kaksikkiht (kaksikkiht) läbi ja läbi valgumolekulid (integraalsed valgud). Selliste valgu molekulide sees on kanalid - poorid, mille kaudu vees lahustuvad ained läbivad. Teised valgumolekulid tungivad ühelt või teiselt poolt läbi lipiidide kaksikkihi (poolintegraalsed valgud). Eukarüootsete rakkude membraanide pinnal on perifeersed valgud. Lipiidide ja valgu molekulid hoitakse koos hüdrofiilse-hüdrofoobse interaktsiooni tõttu. Membraanide omadused ja funktsioonid. Kõik rakumembraanid on liikuvad vedelikustruktuurid, kuna lipiidide ja valgu molekulid ei ole omavahel kovalentsete sidemetega seotud ja on võimelised membraani tasapinnal üsna kiiresti liikuma. Tänu sellele võivad membraanid muuta oma konfiguratsiooni, st neil on voolavus. Membraanid on väga dünaamilised struktuurid. Nad taastuvad kiiresti kahjustustest ning ka venivad ja tõmbuvad kokku rakuliigutustega. Erinevat tüüpi rakkude membraanid erinevad oluliselt nii keemilise koostise kui ka neis sisalduvate valkude, glükoproteiinide, lipiidide suhtelise sisalduse ja sellest tulenevalt ka neis sisalduvate retseptorite olemuse poolest. Seetõttu iseloomustab iga rakutüüpi individuaalsus, mis määratakse peamiselt glükoproteiinid. Osalevad rakumembraanist väljaulatuvad hargnenud ahelaga glükoproteiinid tegurite äratundmine väliskeskkonnas, samuti seotud rakkude vastastikuses tunnustamises. Näiteks tunnevad munarakk ja seemnerakk teineteist ära rakupinna glükoproteiinide järgi, mis sobivad kokku terve struktuuri eraldi elementidena. Selline vastastikune tunnustamine on viljastamisele eelnev vajalik etapp. Seotud äratundmisega transpordi reguleerimine molekulid ja ioonid läbi membraani, samuti immunoloogiline reaktsioon, milles glükoproteiinid mängivad antigeenide rolli. Seega võivad suhkrud toimida infomolekulidena (nagu valgud ja nukleiinhapped). Membraanid sisaldavad ka spetsiifilisi retseptoreid, elektronide kandjaid, energiamuundureid ja ensüümvalke. Valgud on seotud teatud molekulide transportimise tagamisega rakku või sealt välja, loovad struktuurse ühenduse tsütoskeleti ja rakumembraanide vahel või toimivad retseptoritena keskkonnast tulevate keemiliste signaalide vastuvõtmiseks ja muundamiseks. selektiivne läbilaskvus. See tähendab, et molekulid ja ioonid läbivad seda erineva kiirusega ning mida suuremad on molekulid, seda aeglasemalt läbivad nad membraani. See omadus määratleb plasmamembraani kui osmootne barjäär . Vesi ja selles lahustunud gaasid on maksimaalse läbitungimisvõimega; Ioonid läbivad membraani palju aeglasemalt. Vee difusiooni läbi membraani nimetatakse osmoosi teel.Ainete transportimiseks läbi membraani on mitu mehhanismi.
Difusioon- ainete tungimine läbi membraani piki kontsentratsioonigradienti (alast, kus nende kontsentratsioon on suurem, piirkonda, kus nende kontsentratsioon on madalam). Hõlbustatud difusiooniga spetsiaalsed membraanitransportvalgud seonduvad valikuliselt ühe või teise iooni või molekuliga ja transpordivad need kontsentratsioonigradienti mööda läbi membraani.
Aktiivne transport hõlmab energiakulusid ja aitab transportida aineid vastu nende kontsentratsioonigradienti. Ta viivad läbi spetsiaalsed kandevalgud, mis moodustavad nn ioonpumbad. Enim uuritud on loomarakkudes Na - / K - pump, mis pumpab aktiivselt Na + ioone välja, samal ajal neelates K - ioone. Tänu sellele säilib rakus keskkonnaga võrreldes kõrgem K - ja madalam Na + kontsentratsioon. See protsess nõuab ATP energiat. Membraanpumba abil rakus toimuva aktiivse transpordi tulemusena reguleeritakse ka Mg 2- ja Ca 2+ kontsentratsiooni.
Kell endotsütoos (endo...- sissepoole) teatud plasmalemma piirkond hõivab ja justkui ümbritseb rakuvälist materjali, sulgedes selle membraani sissetungimise tagajärjel tekkivasse membraani vakuooli. Seejärel ühendub selline vakuool lüsosoomiga, mille ensüümid lagundavad makromolekulid monomeerideks.
Endotsütoosi pöördprotsess on eksotsütoos (ekso...- välja). Tänu sellele eemaldab rakk rakusisesed tooted või seedimata jäägid, mis on suletud vakuoolidesse või vesiikulitesse. Vesiikul läheneb tsütoplasmaatilisele membraanile, ühineb sellega ja selle sisu satub keskkonda. Nii eemaldatakse seedeensüümid, hormoonid, hemitselluloos jne.
Seega ei toimi bioloogilised membraanid kui raku peamised struktuurielemendid mitte ainult füüsiliste piiridena, vaid on dünaamilised funktsionaalsed pinnad. Organellide membraanidel toimub arvukalt biokeemilisi protsesse, nagu ainete aktiivne imendumine, energia muundamine, ATP süntees jne.
Bioloogiliste membraanide funktsioonid järgmised: need piiritlevad raku sisu väliskeskkonnast ja organellide sisu tsütoplasmast. Need tagavad ainete transpordi rakku ja sealt välja, tsütoplasmast organellidesse ja vastupidi Toimivad retseptoritena (keemiliste ainete vastuvõtmine ja muundumine keskkonnast, rakuainete äratundmine jne). Need on katalüsaatorid (pakkudes membraanilähedasi keemilisi protsesse). Osaleda energia muundamisel.
"Kus iganes me leiame elu, leiame selle seotuna mõne valgulise kehaga ja kus iganes leiame valgulise keha, mis on lagunemisjärgus, leiame eranditult elu fenomeni."
Valgud on kõrgmolekulaarsed lämmastikku sisaldavad orgaanilised ühendid, mida iseloomustab rangelt määratletud elementide koostis ja mis lagunevad hüdrolüüsi käigus aminohapeteks.
Omadused, mis eristavad neid teistest orgaanilistest ühenditest
1. Ammendamatu struktuuri mitmekesisus ja samas selle kõrge spetsiifiline unikaalsus
2. Suur hulk füüsikalisi ja keemilisi muutusi
3. Võime pööratavalt ja üsna loomulikult muuta molekuli konfiguratsiooni vastusena välismõjudele
4. Kalduvus moodustada teiste keemiliste ühenditega supramolekulaarseid struktuure ja komplekse
Valkude struktuuri polüpeptiiditeooria
ainult E. Fisher (1902) sõnastas polüpeptiiditeooria hooned. Selle teooria kohaselt on valgud komplekssed polüpeptiidid, milles üksikud aminohapped on omavahel seotud peptiidsidemetega, mis tekivad α-karboksüül-COOH ja α-NH2 aminohapete rühmade interaktsioonist. Alaniini ja glütsiini interaktsiooni näitel võib peptiidsideme ja dipeptiidi moodustumist (koos veemolekuli vabanemisega) kujutada järgmise võrrandiga:
Peptiidide nimetus koosneb esimese vaba NH2 rühmaga N-terminaalse aminohappe nimest (atsüülidele tüüpiline lõpuga -üül), järgnevate aminohapete nimedest (samuti lõppudega -üül) ja vaba COOH rühmaga C-terminaalse aminohappe täisnimi. Näiteks võib 5 aminohappest koosnevat pentapeptiidi tähistada selle täisnimega: glütsüülalanüül-serüül-tsüsteinüül-alaniin või lühendatult Gly-Ala-Ser-Cys-Ala.
polüpeptiidi teooria eksperimentaalsed tõendid valgu struktuur.
1. Looduslikud valgud sisaldavad suhteliselt vähe tiitritavaid vabu COOH ja NH 2 rühmi, kuna absoluutne enamus neist on seotud olekus, osaledes peptiidsidemete moodustamises; Tiitrimiseks on saadaval peamiselt vabad COOH- ja NH2-rühmad peptiidi N- ja C-terminaalsetes aminohapetes.
2. Happelise või aluselise hüdrolüüsi protsessis orav Moodustuvad stöhhiomeetrilised kogused tiitritavaid COOH ja NH 2 rühmi, mis näitab teatud arvu peptiidsidemete lagunemist.
3. Proteolüütiliste ensüümide (proteinaaside) toimel jagunevad valgud rangelt määratletud fragmentideks, mida nimetatakse peptiidideks, mille terminaalsed aminohapped vastavad proteinaaside toime selektiivsusele. Mõnede nende mittetäieliku hüdrolüüsi fragmentide struktuuri tõestas nende hilisem keemiline süntees.
4. Biureedi reaktsiooni (sinakasvioletne värvumine vasksulfaadi lahuse juuresolekul aluselises keskkonnas) annavad nii peptiidsidet sisaldav biureet kui ka valgud, mis on samuti tunnistuseks sarnaste sidemete olemasolust valkudes.
5. Valgukristallide röntgendifraktsioonimustrite analüüs kinnitab valkude polüpeptiidstruktuuri. Seega võimaldab röntgendifraktsioonianalüüs eraldusvõimega 0,15–0,2 nm mitte ainult arvutada C-, H-, O- ja N-aatomite vaheliste aatomitevahelisi kaugusi ja sidenurkade suurusi, vaid ka "näha" üldist pilti. aminohappejääkide paigutus polüpeptiidahelas ja selle ruumiline orientatsioon (konformatsioon).
6. Polüpeptiidi teooria oluline kinnitus valgu struktuur on võimalus sünteesida puhtkeemiliste meetoditega juba teadaoleva struktuuriga polüpeptiide ja valke: insuliin - 51 aminohappejääki, lüsosüüm - 129 aminohappejääki, ribonukleaas - 124 aminohappejääki. Sünteesitud valkude füüsikalis-keemilised omadused ja bioloogiline aktiivsus sarnanesid looduslikele valkudele.
1852. aastal esitas inglise keemik Edward Frankland teooria, mida hiljem hakati nimetama valentsusteooriaks, mille kohaselt on igal aatomil teatud küllastusvõime (või valents). Esiteks oli "valentsi" mõiste kasutuselevõtuga võimalik mõista erinevust aatommassi ja elementide ekvivalentmassi vahel. Isegi 19. sajandi keskel ajasid paljud keemikud neid mõisteid ikka veel segamini.
Aatomi ekvivalentmass võrdub selle aatommassiga jagatuna valentsiga.
Valentsiteoorial oli otsustav roll keemiateooria ja eriti orgaanilise keemia arendamisel. Pärast esimese orgaanilise molekuli ehitamist sai täiesti selgeks, miks orgaanilised molekulid kipuvad olema palju suuremad ja keerukamad kui anorgaanilised molekulid.
Kekule ideede kohaselt saavad süsinikuaatomid üksteisega ühendada, kasutades ühte või mitut nende neljast valentssidemest, moodustades pikki ahelaid. Ilmselt pole ühelgi teisel aatomil seda tähelepanuväärset võimet niivõrd, kuivõrd seda omab süsinik.
Struktuurivalemite kasulikkus oli nii ilmne, et paljud orgaanilised keemikud võtsid need kohe kasutusele. Nad kuulutasid täiesti iganenuks kõik katsed kujutada orgaanilisi molekule radikaalidest ehitatud struktuuridena. Selle tulemusena leiti, et ühendi valemi kirjutamisel on vaja näidata selle aatomi struktuuri.
Vene keemik Aleksandr Mihhailovitš Butlerov kasutas seda uut struktuurivalemite süsteemi oma orgaaniliste ühendite struktuuri teoorias. 19. sajandi 60ndatel näitas ta, kuidas struktuurivalemite abil saab selgelt selgitada isomeeride olemasolu põhjuseid.
Butlerov visandas keemilise struktuuri teooria põhiideed aruandes “Aine keemilise struktuuri kohta”, mida loeti Speyeris toimunud Saksa loodusuurijate ja arstide kongressi keemiaosakonnas (september 1861). Selle teooria põhialused on sõnastatud järgmiselt:
- 1) Aatomid molekulides on omavahel seotud teatud järjestuses vastavalt nende valentsusele. Aatomitevaheliste sidemete järjestust molekulis nimetatakse selle keemiliseks struktuuriks ja seda peegeldab üks struktuurvalem (struktuurivalem).
- 2) Keemilist struktuuri saab määrata keemiliste meetoditega. (Praegu kasutatakse ka tänapäevaseid füüsilisi meetodeid).
- 3) Ainete omadused sõltuvad nende keemilisest struktuurist.
- 4) Antud aine omaduste põhjal saab määrata selle molekuli struktuuri ning molekuli struktuuri põhjal saab omadusi ennustada.
- 5) Molekulis olevad aatomid ja aatomirühmad mõjutavad üksteist vastastikku.
Butlerovi teooria aluseks on idee aatomite keemilise interaktsiooni järjestusest molekulis. See keemilise interaktsiooni järjekord ei sisalda ideid keemilise sideme mehhanismi ja aatomite füüsilise paigutuse kohta. See keemilise struktuuri teooria oluline tunnus võimaldab molekuli füüsikalise mudeli koostamisel alati sellele tugineda.
Olles kehtestanud keemilise struktuuri mõiste, A.M. Butlerov andis aine olemuse uue definitsiooni: "keerulise osakese keemilise olemuse määrab selle elementaarsete koostisosade olemus, nende kogus ja keemiline struktuur."
Seega A.M. Butlerov tegi esimesena kindlaks, et igal molekulil on kindel keemiline struktuur, et struktuur määrab aine omadused ning aine keemilisi muundumisi uurides saab kindlaks teha selle struktuuri.
Vaated A.M. Butlerovi arusaam keemiliste struktuurivalemite tähendusest tuleneb tema teooria põhisätetest. Butlerov uskus, et need valemid ei tohiks olla "tüüpilised", "reageerivad", vaid põhiseaduslikud. Selles mõttes on iga aine kohta võimalik ainult üks ratsionaalne valem, mille põhjal saab hinnata selle keemilisi omadusi.
Butlerov selgitas esimesena isomeeria nähtust sellega, et isomeerid on ühesuguse elementaarkoostise, kuid erineva keemilise struktuuriga ühendid. Isomeeride ja üldiselt orgaaniliste ühendite omaduste sõltuvust nende keemilisest struktuurist omakorda seletatakse sidemeid mööda edasi kanduva "aatomite vastastikuse mõju" olemasoluga, mille tulemusena aatomid olenevalt nende struktuurist. keskkonda, omandavad erinevad "keemilised tähendused". Butlerov ise ja eriti tema õpilased V.V. Markovnikov ja A.N. Popov konkretiseeris selle üldise seisukoha arvukate "reeglite" vormis. Juba 20. sajandil. need reeglid, nagu kogu aatomite vastastikuse mõju kontseptsioon, said elektroonilise tõlgenduse.
Nii avas Butlerov tee orgaaniliste ühendite süstemaatilisele loomisele, mille järel orgaaniline keemia hakkab võitma üksteise järel võitu loodusega konkureerimisel materiaalsete väärtuste loomisel, et rahuldada inimeste vajadusi.
Molekulaarstruktuuri olulised edusammud hõlmavad Pasteuri optiliste isomeeride avastamist ja molekuli kolmemõõtmelise mudeli kasutuselevõttu.