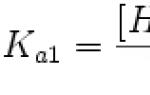Određivanje konstanti kiselosti slabih kiselina. Kiselost i bazičnost u vodi Indeks konstante kiselosti mliječne kiseline
Samojonizacija vode
Voda, čak i nakon višekratne destilacije, zadržava sposobnost provođenja električne struje. Ova sposobnost vode je posledica njene samojonizacije.
$2H_2O ↔ H_3O^+ + OH^-$
Konstanta termodinamičke ravnoteže ima oblik:
Slika 1.
gdje je $a_X^(rel)=\frac(a_X^(equal))(a_X^0)$ relativna aktivnost $X$ čestice u ravnotežnom sistemu;
$aX^(equal)$ je apsolutna aktivnost čestice $X$ u ravnotežnom sistemu;
$(a_x)^0$ je apsolutna aktivnost $X$ u termodinamičkom stanju sistema.
Relativna aktivnost vode u ravnoteži je praktički jednaka jedinici, jer je stupanj reakcije vrlo mali (ako kao standardno stanje uzmemo teoretski nejoniziranu vodu.
Koeficijenti aktivnosti $OH^-$ i $H_3O^+$ jona će biti blizu jedinice u čistoj vodi. Ravnoteža reakcije je snažno pomaknuta ulijevo. Relativna aktivnost $OH^-$ i $H_3O^+$ je skoro jednaka njihovim molarnim koncentracijama. Gdje
$(K_a)^0 \sim K_(auto) = $
gdje su $ i $ molarne koncentracije;
$K_(auto)$ - konstanta autoprolize vode jednaka $1.00\cdot 10^(-14) \mol^2/l^2$ na $25^\circ \C.$
Prema tome, u čistoj vodi koncentracije $ i $ će biti jednake
$==\sqrt(10^(-14))=10^(-7)$ na $25^\circ \ C.$
Radi lakšeg izračuna, koncentracija je označena kao negativan logaritam, označen kao $pH$:
$pH= -lg $
Indikatori $pH$ za čistu vodu su $7$, u kiselim rastvorima $pH$ 7$.
Disocijacija kiseline i konstanta kiselosti
Za kiselinu $AH$, disocijacija se može izraziti jednadžbom:
$AH + H_2O ↔ A^- + H_3O^+$
U stanju ravnoteže, relativna gustina vode se neznatno mijenja kada prelazi iz jedne kiseline u drugu, a uz beskonačno razrjeđivanje približava se nuli. Stoga se koristi konstanta termodinamičke kiselosti $K_a^0$ ($AH$).
Omjer koeficijenata aktivnosti je isti za sve kiseline i jednak je jedinici ako se procesi odvijaju u razrijeđenim otopinama.
Zatim, u razrijeđenoj vodenoj otopini, konstanta kiselosti $Ka (AH$) se koristi kao mjera jačine kiseline, koja se može odrediti formulom:
$Ka (AH)=\frac()()$
Formula prikazuje molarnu koncentraciju čestica na fiksnoj temperaturi $(25^\circ \C)$ u stanju ravnoteže.
Što je veća konstanta kiselosti, što je veći stepen disocijacije, to je kiselina jača. Za proračune i karakterizaciju kiselosti koristi se negativni logaritam konstante kiselosti $pKa$.
$pKa (AH)= -lgKa (AH)$
Što je veća vrijednost konstante kiselosti, to je kiselina slabija.
Vrijednost konstante kiselosti jednaka je $pH$ vrijednosti otopine pri kojoj će kiselina biti napola ionizirana:
$pKa (AH) = pH - log \frac()()$
Vrijednost koja karakterizira kiselost molekula vode u vodenoj otopini jednaka je:
$Ka=\frac()()=\frac(Ka_(auto))()=\frac(10^(-14))(55.5)$
Dakle, na temperaturi od $25^\circ C$, $pKa (H_2O) = 15,7$. Ova vrijednost karakterizira kiselost molekula vode u otopini.
Za hidronijum jon $pKa (H_3O^+) = pK_(auto) - pKa = 14-15.7 = -1.7.$
Vrijednosti $pKa$ su tabelarni podaci. Međutim, za kiseline sa $pKa 0$ tabelarni podaci će biti netačni.
Moguće je odrediti konstante kiselosti u vodi direktnim mjerenjem koncentracija $A^-$ i $AH$ samo kada se disocijacija kiseline dogodi barem u određenoj mjeri, čak i jedva primjetna.
Ako je kiselina vrlo slaba, tako da se praktično ne disocira, tada se koncentracija $A^-$ ne može precizno izmjeriti. Ako je, naprotiv, kiselina toliko jaka da se gotovo potpuno disocira, tada je nemoguće izmjeriti koncentraciju $AH$. U ovom slučaju će se koristiti indirektne metode za određivanje kiselosti.
Baza ionizacijske konstante
Da bismo izrazili konstantu disocijacije baze u vodi, koristimo jednačinu:
$B + H_2O ↔ BH^+ + OH^-$
Konstanta bazičnosti je:
$Kb=\frac())([B])$
Nedavno se konstante bazičnosti praktično ne koriste u proračunima, jer se iz konstante kiselosti konjugirane kiseline mogu dobiti sve potrebne informacije o bazi $BH^+.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
Konstanta kiselosti kiseline će biti mjera jačine:
- $AH$ ili $BH^+$ kao donori protona;
- $A^-$ ili $B$ kao akceptori protona;
- jaka kiselina $AH$ ili $BH^+$ odgovara slaboj konjugiranoj bazi $A^-$ ili $B$, a tada je vrijednost $pKa$ mala ili negativna;
- jaka baza $A^-$ ili $B$ odgovara slaboj kiselini $AH$ ili $BH^+$ i konstanta kiselosti će biti pozitivna
Jačina kiselina ili baza može se direktno izmjeriti samo u uskom rasponu od $pKa (BH^+).$ Izvan tog opsega, bazičnost će se odrediti indirektnim metodama. Vrijednosti $pka (BH^+)$ izvan intervala od $-2$ do $17$ će biti netačne.
Povezanost strukture i jačine kiselina
Relativna jačina kiselina može se predvidjeti na osnovu prirode centralnog atoma i strukture molekula kiseline.
Jačina kiselina bez kiseonika $HX$ i $H_2X$ (gde je $X$ halogen) je veća, što je slabija veza $X-H$, odnosno, što je veći poluprečnik atoma $X$.
U serijama $HF - HCl - HBr - HI$ i $H_2S - H_2Se - H_2Te$, jačina kiselina se povećava.
Za kiseline koje sadrže kiseonik, što je veća vrednost m u jedinjenju sastava $E(OH)nOm$, to je veća jačina kiselina.
Dakle, prema ovoj teoriji Kiselina je svaka tvar čiji molekuli (uključujući ione) mogu donirati proton, tj. biti donor protona; Baza je svaka tvar čiji molekuli (uključujući ione) mogu vezati proton, tj. biti akceptor protona; Amfolit je svaka supstanca koja je i donor i akceptor protona.
Ova teorija objašnjava kiselinsko-bazna svojstva ne samo neutralnih molekula, već i jona. Kiselina, odustajući od protona, pretvara se u bazu, koja je konjugat ove kiseline. Izrazi "kiselina" i "baza" su relativni koncepti, jer iste čestice - molekule ili joni - mogu pokazati i bazična i kisela svojstva, ovisno o partneru.
Tokom protolitičke ravnoteže formiraju se kiselinsko-bazni parovi. Prema teoriji protona, reakcije hidrolize, ionizacije i neutralizacije ne smatraju se posebnim fenomenom, već se smatraju uobičajenim prijenosom protona iz kiseline u bazu.
Čestica A nastala nakon odvajanja vodikovog jona
pH vrijednost
Voda, kao slab elektrolit, podliježe jonizaciji u maloj mjeri:
H 2 O ↔ H + + OH - .
Joni u vodenom rastvoru podležu hidrataciji (aq.)
Vodu karakterizira protolitička amfoternost. Reakcija samojonizacije (autoprotoliza) vode, tokom koje proton iz jedne molekule vode (kiseline) prelazi na drugu molekulu vode (bazu) opisuje se jednadžbom:
H 2 O + H 2 O ↔ H 3 O + + OH - .
Konstanta ravnoteže autoprotolize vode jednaka je:
Zakon djelovanja mase primjenjuje se na konstantu ionizacije:
gdje je a aktivnost.
Radi kratkoće, umjesto H 3 O + u kiselinsko-baznoj ravnoteži pišemo
Budući da je voda u rastvoru u velikom višku i da je podložna jonizaciji u maloj meri, može se primetiti da je njena koncentracija konstantna i jednaka 55,6 mola (1000 g: 18 g/mol = 56 mol) po litru vode.
Dakle, proizvod K i (H 2 O) i koncentracija vode jednaki su 1,8 10 -16 mol/l 55,6 mol/l = 10 -14 mol 2 /l 2. Dakle, = 10 -14 (na 25 °C) je konstantna vrijednost, označeno sa Kw i zove se konstanta autoprotolize vode. Ponekad se koristi zastarjeli naziv - jonski proizvod vode.
Otopine u kojima je ista koncentracija jona vodonika i hidroksidnih jona nazivaju se neutralnim rastvorima = = = 10 -7 mol/l. U kiselim rastvorima > , > 10 -7 mol/l, au alkalnim rastvorima > , > 10 -7 mol/l.
Da pojednostavimo, uzimamo kao osnovu indikator vodonika pH - decimalni logaritam koncentracije vodikovih iona, uzet sa suprotnim predznakom: pH = -lg.
Zanimljivosti:
Kršenje izohidričnog stanja ( pH konstantnost) uočeno kod kardiovaskularnih bolesti, ishemije, dijabetes melitusa (razvija se acidoza). Kiselinsko-bazna ravnoteža se održava disanjem, mokrenjem i znojenjem. Ovi sistemi rade sporo, a trenutnu neutralizaciju kiselih i alkalnih metaboličkih proizvoda vrše pufer sistemi organizma. Stanje izohidrije osigurava se kombinovanim djelovanjem niza fizičko-hemijskih i fizioloških mehanizama. Puferski efekat se postiže kombinovanjem nekoliko protolitičkih ravnoteža.
Jačina kiselina određena je njihovom sposobnošću da doniraju proton. Mjera ove sposobnosti je konstanta kiselosti (Ka).
Što je viša konstanta kiselosti, to je kiselina jača. Na primjer, sirćetna kiselina je jača od cijanovodonične kiseline, jer je Ka(CH 3 COOH) = 1,74 10 -5, Ka(HCN) = 1 10 -9. Za praktičnost izračunavanja i snimanja, često koriste ne same konstante, već njihove negativne decimalne logaritme: pKa = -lgKa. Poziva se pKa vrijednost indikator jačine kiseline.Što je veća pKa vrijednost, to je kiselina slabija.
Jake kiseline gotovo u potpunosti doniraju svoj proton molekulima vode, tako da je kiselina prisutna u otopini zapravo hidronijev ion.
S tim u vezi, pri izračunavanju pH otopine jake jednobazne kiseline, koncentracija protona se izjednačava s koncentracijom kiseline
c(H3O+) = c(HB).
U otopinama slabih kiselina koncentracija hidronijevih jona je znatno niža od koncentracije kiseline. Izračunava se na osnovu
obje strane ove jednadžbe daju formulu za izračunavanje pH otopine slabih kiselina: pH = 0,5(pKa - log c(HB)).
29. Slabi elektroliti. Konstanta kiselosti i bazičnosti. Oswaldov zakon razblaženja.
Slabi elektroliti su hemijska jedinjenja čiji su molekuli, čak i u jako razblaženim rastvorima, blago disocirani na ione koji su u dinamičkoj ravnoteži sa nedisociranim molekulima. Slabi elektroliti uključuju većinu organskih kiselina i mnoge organske baze u vodenim i nevodenim otopinama.
Slabi elektroliti su:
gotovo sve organske kiseline i voda;
neke neorganske kiseline: HF, HClO, HClO 2, HNO 2, HCN, H 2 S, HBrO, H 3 PO 4, H 2 CO 3, H 2 SiO 3, H 2 SO 3 itd.;
neki slabo rastvorljivi metalni hidroksidi: Fe(OH) 3, Zn(OH) 2 itd.
Konstanta disocijacije kiseline (Ka) je konstanta ravnoteže reakcije disocijacije kiseline na ion vodonika i anjon kiselinskog ostatka. Za višebazne kiseline, čija se disocijacija odvija u nekoliko faza, koriste se zasebne konstante za različite faze disocijacije, označavajući ih kao K a1, K a2 itd.
Primjer izračuna dvobazne kiseline:

![]()
Češće se umjesto same konstante disocijacije K koristi vrijednost pK, koja se definira kao negativni decimalni logaritam same konstante:
Baza je hemijsko jedinjenje koje može formirati kovalentnu vezu sa protonom (Brønstedova baza) ili sa slobodnom orbitalom drugog hemijskog jedinjenja (Lewisova baza). U užem smislu, baze označavaju bazične hidrokside - složene supstance, pri čijoj se disocijaciji u vodenim rastvorima odvaja samo jedna vrsta anjona - hidroksidni joni OH-.
Brønsted-Lowryjeva teorija nam omogućava da kvantifikujemo snagu baza, odnosno njihovu sposobnost da apstrahuju proton iz kiselina. To se obično radi pomoću konstante bazičnosti Kb - konstante ravnoteže reakcije baze sa referentnom kiselinom, za koju se bira voda. Što je konstanta bazičnosti veća, to je veća snaga baze i veća je njena sposobnost da apstrahuje proton. Često se konstanta bazičnosti izražava kao eksponent konstante bazičnosti pKb. Na primjer, za amonijak kao Brønstedovu bazu možemo napisati:

Ostwaldov zakon razrjeđenja je odnos koji izražava ovisnost ekvivalentne električne provodljivosti razrijeđene otopine binarnog slabog elektrolita o koncentraciji otopine: ![]()
Ovdje je K konstanta disocijacije elektrolita, c je koncentracija, λ i λ∞ su vrijednosti ekvivalentne električne provodljivosti, respektivno, pri koncentraciji c i pri beskonačnom razrjeđivanju. Odnos je posljedica zakona djelovanja mase i jednakosti gdje je α stepen disocijacije.
30. Voda je slab elektrolit. Jonski proizvod vode. PH. POh
Jonski proizvod vode je proizvod koncentracija vodonikovih jona H+ i hidroksilnih jona OH− u vodi ili vodenim rastvorima, konstanta autoprotolize vode.
Voda, iako je slab elektrolit, disocira u maloj mjeri:
Ravnoteža ove reakcije je snažno pomaknuta ulijevo. Konstanta disocijacije vode može se izračunati pomoću formule:
![]()
Koncentracija hidronijevih jona (protona);
Koncentracija jona hidroksida;
Koncentracija vode (u molekularnom obliku) u vodi;
Koncentracija vode u vodi, uzimajući u obzir njen nizak stepen disocijacije, praktično je konstantna i iznosi (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Na 25 °C konstanta disocijacije vode je 1,8·10-16 mol/l. Jednačina (1) se može prepisati kao:
Označimo proizvod K· = K in = 1,8·10−16 mol/l·55,56 mol/l = 10−14 mol²/l² = · (na 25 °C).
Konstanta K in, jednaka proizvodu koncentracija protona i hidroksidnih iona, naziva se ionski proizvod vode. Ona je konstantna ne samo za čistu vodu, već i za razrijeđene vodene otopine tvari. Sa povećanjem temperature, disocijacija vode se povećava, pa se povećava i Kv, sa padom temperature - obrnuto.
Vodikov indeks, pH - mjera aktivnosti vodikovih jona u otopini, i kvantitativno izražavanje njegove kiselosti, izračunava se kao negativan (uzet sa suprotnim predznakom) decimalni logaritam aktivnosti vodikovih jona, izražen u molovima po litru:
Inverzna pH vrijednost je nešto manje rasprostranjena - pokazatelj bazičnosti otopine, pOH, jednak negativnom decimalnom logaritmu koncentracije OH - jona u otopini:
Nivo povezivanja:
U opštem slučaju, u skladu sa protolitičkom teorijom Bronsted-Lowryja, prema jednačini (4.2) imamo za disocijaciju slabe monoprotinske kiseline:
Prava termodinamička konstanta TO ovaj balans će biti
gde su sve aktivnosti u ravnoteži. Zamislimo ovaj omjer u obliku:
Označimo, kao iu prethodnom slučaju, proizvod dvije konstante TO i a(H 2 O) do (H 2 O) = const at T= konst. Onda
ili otprilike:
gdje su sve koncentracije ravnotežne. Evo vrijednosti TO A pozvao konstanta disocijacije (jonizacije) kiseline ili jednostavno konstanta kiselosti.
Za mnoge slabe kiseline numeričke vrijednosti TO A su vrlo male, pa umjesto veličine TO A primijeniti indikator snage (ili jednostavno indikator):
rK A =- lg TO A .
Više TO A(tj. što je manje str TO A ), što je kiselina jača.
Neka je početna koncentracija monobazne kiseline HB jednaka stepenu njene disocijacije (jonizacije) u rastvoru. Tada će ravnotežne koncentracije jona [H 3 O + ] i [B - ] biti jednake [H 3 O + ] = [B - ] = αs A , ravnotežna koncentracija kiseline [NV] = With A - α With A = With A(1 - α). Zamjenom ovih vrijednosti ravnotežnih koncentracija u izraz za konstantu ravnoteže (4.10) dobijamo:
Ako umjesto koncentracije With A koristite njegov inverz V- razrjeđivanje (razrjeđivanje), izraženo u l/mol, V=1/With A , zatim formula za TO A izgledat će ovako:
Ovaj odnos i takođe izraz
opisati Ostwaldov zakon razblaženja (ili zakon razblaženja) za slab binarni elektrolit. Na a1 (tipičan slučaj u mnogim analitičkim sistemima)
Lako je pokazati da, u općem slučaju, za slab elektrolit bilo kojeg sastava K n A m, koji se razlaže na ione prema shemi
K n A m = P TO t+ +t A n -
Ostwaldov zakon razvodnjenja opisuje se relacijom
Gdje With- početna koncentracija slabog elektrolita, na primjer, slabe kiseline. Dakle, za ortofosfornu kiselinu H 3 PO 4 (P = 3,
T= 1), koji se potpuno raspada na jone prema šemi

![]() .
.
Za binarni elektrolit, relacija postaje (4.11). Za a1 imamo:
Nađimo ravnotežnu pH vrijednost otopine jednobazne kiseline NV. Ravnotežna koncentracija vodikovih jona
Koristeći notaciju i dobijamo:
pH = 0,5 (r TO A+p With A). (4.12)
Dakle, da bi se izračunala ravnotežna pH vrijednost otopine slabe monoprotinske kiseline, potrebno je znati konstantu kiselosti te kiseline TO A i njegovu početnu koncentraciju With A .
Izračunajmo pH otopine octene kiseline početne koncentracije od 0,01 mol/l.
Na sobnoj temperaturi za sirćetnu kiselinu TO A = 1,74·10 -5 i str TO A = 4,76.
Prema formuli (4.12) možemo napisati:
pH = 0,5 (str TO A+p With A) = 0,5(476-0,01) = 0,5(4,76+2) = 3,38.
Slično razmatranje može se provesti za ravnoteže u rješenju bilo kojeg slabog polybasic kiseline.
Polibazične kiseline disociraju na ione postupno, u nekoliko faza, od kojih svaki karakterizira vlastita konstanta ravnoteže postepena konstanta disocijacije kiseline. Na primjer, u otopinama ortoborne kiseline H 3 BO 3 uspostavljene su ravnoteže (konstantne vrijednosti su date za 25 °C):
H 3 VO 3 + H 2 O = H 3 O + +, TO 1
= ![]()
H 2 O = H 3 O + +, TO 2
= ![]()
H 2 O = H 3 O + +, TO 3 =
Konstanta disocijacije kiseline svakog sljedećeg koraka manja je od konstante disocijacije prethodnog koraka - obično za nekoliko redova veličine.
Proizvod svih konstanti postupne disocijacije jednak je ukupnoj konstanti disocijacije kiseline K:
TO 1 TO 2 ...TO P =K.
Dakle, lako je vidjeti da je za ortobornu kiselinu vrijednost
TO 1
TO 2
TO 3
=K= ![]()
postoji potpuna konstanta disocijacije kiseline prema shemi:
4.3.2 Konstanta baznosti i pH rastvora slabih baza
U skladu sa Brønsted-Lowryjevom protolitičkom teorijom kiselina i baza, u opštem slučaju, za ionizaciju jednokiselinske slabe baze B u vodenim rastvorima možemo napisati:
B + H 2 O = HB + + OH -
Ako je stepen jonizacije baze a1, tada se konstanta koncentracije može uzeti kao konstanta ove hemijske ravnoteže
Postupajući slično prethodnom, dobijamo:
TO = =K b = const when T= konst
kao proizvod dvije konstante TO=konst i [H 2 O] = konst.
Nazovimo količinu K b , jednaka, dakle,
K b = , (4.13)
konstanta disocijacije (jonizacije) slabe jednokiselinske bazeilisamo osnovna konstanta ovu bazu i veličinu
str K b = K b ,
Indikator snage (ili jednostavno indikator) konstante bazičnosti.
Prema Ostwaldovom zakonu o razrjeđivanju u predmetu koji se razmatra (slično odnosu (4.11))
K b =,
gdje je stepen jonizacije jednokiselinske slabe baze, i njena početna koncentracija. Pošto je za slabu bazu a1, onda
Nađimo ravnotežnu pH vrijednost vodenog rastvora dotične monokiseline baze na sobnoj temperaturi. U skladu sa formulom (4.7) imamo:
pH = p TO w - pOH = 14 - pOH.
Odredimo vrijednost pOH = [OH - ]. Očigledno
[OH - ] = = ![]()
Koristeći indikatore pOH = [OH - ], str TO b =K b I
p = , dobijamo: pOH = 0,5(p TO b+ p). Zamjenom ovog izraza u gornju formulu za pH dolazimo do relacije
pH = 14 - pOH = 14 – 0,5 (str TO b+ p).
Dakle, ravnotežna pH vrijednost u otopini slabe jednokiselinske baze može se izračunati pomoću formule (4.15):
pH = 14 - 0,5 (str TO b+ p). (4.15)
Izračunajmo pH u 0,01 mol/l vodenom rastvoru amonijaka, za koji na sobnoj temperaturi TO b= i str TO b = 4,76.
U vodenom rastvoru amonijaka uspostavlja se ravnoteža:
koji je uglavnom pomaknut ulijevo, tako da je stepen jonizacije amonijaka . Stoga, da biste izračunali pH vrijednost, možete koristiti relaciju (4.15):
pH = 14 - 0,5 (str TO b+ p) =
Slično razmatranje se može provesti za sve slabe polikiselina osnove. Istina, ovo rezultira glomaznijim izrazima.
Slabe polikiseline baze, kao i slabe polibazične kiseline, disociraju postupno, a svaki korak disocijacije ima i svoju konstantu stepenaste disocijacije baze - stepwise bazičnu konstantu.
Na primjer, olovni hidroksid Pb(OH) 2 u vodenim otopinama se razlaže na ione u dva stupnja:
![]()
Ista ravnoteža se može napisati i na drugi način, pridržavajući se (u okviru protolitičke teorije) definicije baze kao supstance koja vezuje proton, u ovom slučaju, prihvatajući ga od molekula vode:
Konstante bazičnosti koraka mogu se predstaviti u obliku:
![]()
![]()
Ovim zapisom naznačenih ravnoteža, pretpostavlja se da proton iz molekule vode prelazi u hidroksilnu grupu sa formiranjem molekule vode (), usled čega se broj molekula vode u blizini atoma olova (II) povećava se za jedan, a broj hidroksilnih grupa povezanih sa olovnim (II) atomom ), također se smanjuje za jedan u svakom koraku disocijacije.
Posao TO 1 TO 2 =K=[Pb 2+ ][OH - ] 2 /[Pb(OH) 2 ] =
2.865, gdje TO- ukupna konstanta disocijacije prema šemi
ili prema drugoj zapisanoj shemi
što na kraju dovodi do istog rezultata.
Drugi primjer je organska baza etilendiamin, koja se podvrgava jonizaciji u vodenoj otopini u dva stupnja. prva faza:
![]()
druga faza:
![]()
Posao ![]() -
-
konstanta totalne disocijacije. Odgovara ravnoteži
Numeričke vrijednosti konstanti ravnoteže date su gore za sobnu temperaturu.
Kao iu slučaju polibaznih kiselina, za slabu polikiselinsku bazu konstanta disocijacije svakog sljedećeg koraka je obično nekoliko redova veličine manja od konstante disocijacije prethodne faze.
U tabeli U tabeli 4.2 prikazane su numeričke vrijednosti konstanti kiselosti i bazičnosti nekih slabih kiselina i baza.
Tabela 4.2. Istinske termodinamičke ionizacijske konstante u vodenim otopinama nekih kiselina i baza.
TO A- konstanta kiselosti, TO b- konstanta bazičnosti,
TO 1 - konstanta disocijacije za prvi korak,
TO 2
- konstanta disocijacije za drugi korak, itd.
| Konstante disocijacije slabih kiselina |
||
| Kiselina | TO A | R TO A=-lg TO A |
| Nitrogenous Aminoacetat Benzoinaya Boric (ortoboric) Tetraboric Vrste protolitičkih reakcija. MU "Rješenja" str. 52-55 Autoprotoliza vode. Jonski proizvod vode.GJ "Rešenja"» strana 56 Mali dio molekula vode je uvijek u jonskom stanju, iako je to vrlo slab elektrolit. Ionizacija i dalja disocijacija vode, kao što je već spomenuto, opisuje se jednadžbom protolitičke reakcije kiselinsko-bazne disproporcije ili autoprotolize. Voda je vrlo slab elektrolit, stoga su formirana konjugirana kiselina i konjugirana baza jake. Stoga je ravnoteža ove protolitičke reakcije pomjerena ulijevo. Konstanta ove ravnoteže K je jednaka = Kvantitativna vrijednost proizvoda koncentracije vodenih jona × je jonski proizvod vode. Jednako je: × = K jednako. × 2 = 1×10 – 14 Dakle: KH 2O = × = 10 – 14 ili pojednostavljeno KH 2O = × = 10 – 14 KH2O je jonski proizvod vode, konstanta autoprotolize vode ili jednostavno konstanta vode. KH2O zavisi od temperature. Povećava se sa povećanjem temperature. U hemijski čistoj vodi = = = 1×10 – 7. Ovo je neutralno okruženje. Rastvor može sadržavati > – medij je kisel ili< – среда щелочная = ; = pH vrijednost Za kvantitativno izražavanje kiselosti otopina koristite indikator koncentracije vodikovih jona pH. Vodikov indeks je vrijednost jednaka negativnom decimalnom logaritmu koncentracije slobodnih vodikovih jona u otopini. pH = – log ⇒ = 10 – pH U neutralnom okruženju pH = 7 Kod kiselog pH< 7 U alkalnom pH > 7 Za karakterizaciju bazičnosti medija koristi se hidroksilni indikator pOH rON = – log [OH - ] ⇒ [OH - ] = 10 – rON pH + pOH = 14 Þ pH = 14 – pOH i pOH = 14 – pH Formule za izračunavanje pH za rastvore kiselina i baza. pH = – log
Izračunajte pH rastvora HCl sa C(HCl) = 0,1 mol/l pod uslovom njegove potpune disocijacije. C(HCl) = 0,1 mol/l; pH = – log 0,1 = 1 2. Jake baze: [OH - ] = S(1/z baza) Izračunajte pH rastvora NaOH pod istim uslovima. C(NaOH) = 0,1 mol/l; = = 10 – 13 ; pH = – log 10 – 13 = 13 3. Slabe kiseline Izračunajte pH otopine octene kiseline molarne koncentracije od 0,5 mol/L. K CH 3COOH = 1,8×10 – 5. 3×10 – 3 pH = – log 3×10 – 3 = 2,5 4. Slabi temelji Izračunajte pH otopine amonijaka molarne koncentracije od 0,2 mol/L. K NN 3 = 1,76×10 – 5 1,88×10 – 3 0,53×10 – 11; pH = – log 0,53×10 – 11 = 11,3 5. C(H +) = [H + ] = 10 – pH Pri pH = 7, [H + ] = 10 – 7 Postoje različite metode za određivanje pH: pomoću indikatora i jonomernih uređaja. Vrijednost pH vrijednosti za hemijske reakcije i biohemijske procese u organizmu. Mnoge reakcije zahtijevaju strogo definiranu pH vrijednost da bi se odvijale u određenom smjeru. Normalno, u zdravom tijelu, reakcija okoline većine bioloških tekućina je bliska neutralnoj. Krv – 7.4 Pljuvačka – 6.6 Crevni sok – 6.4 Žuč – 6.9 Urin – 5.6 Želudačni sok: a) u mirovanju – 7.3 b) u stanju varenja – 1,5-2 Odstupanje pH od norme ima dijagnostički (definicija bolesti) i prognostički (tok bolesti) značaj. Acidoza je pomak pH u kiselu stranu, pH se smanjuje, koncentracija vodikovih iona raste. Alkaloza je pomak pH u alkalni region, pH se povećava, a koncentracija vodikovih jona opada. Privremeno odstupanje pH krvi od norme za desetine dovodi do ozbiljnih poremećaja u tijelu. Dugotrajna odstupanja u pH krvi mogu biti fatalna. Odstupanja u pH krvi mogu biti 6,8 - 8; promjene izvan ovog raspona u bilo kojem smjeru su nespojive sa životom. Kombinovane i izolirane protolitičke ravnoteže. Protolitički procesi su reverzibilne reakcije. Protolitičke ravnoteže se pomjeraju prema stvaranju slabijih kiselina i baza. Oni se mogu smatrati nadmetanjem između baza različite jačine za posjedovanje protona. Oni govore o izolovanim i kombinovanim ravnotežama. Ako je nekoliko istovremeno postojećih ravnoteža neovisno jedna od druge, one se nazivaju izolovane. Promena ravnoteže u jednom od njih ne povlači za sobom promenu ravnotežnog položaja u drugom. Ako promjena ravnoteže u jednom od njih dovodi do promjene ravnoteže u drugom, onda govorimo o kombinovanim (konjugiranim, konkurentskim) ravnotežama. U sistemima sa kombinovanom ravnotežom dominira proces koji karakteriše veća vrednost konstante ravnoteže. Drugi proces će biti dominantan, jer njegova konstanta ravnoteže je veća od konstante ravnoteže prvog procesa. Ravnoteža u drugom procesu je u većoj mjeri pomjerena udesno, jer metilamin je jača baza od amonijaka, NH 4 + je jača kiselina od CH 3 NH 3 +. Zaključak: Jača baza potiskuje ionizaciju slabije baze. Stoga, kada se mješavini amonijaka i metilamina doda mala količina hlorovodonične kiseline, protonira se uglavnom metilamin. I još: najjača kiselina potiskuje jonizaciju slabih kiselina. Dakle, hlorovodonična kiselina koja se nalazi u želučanom soku potiskuje ionizaciju octene kiseline (koja dolazi iz hrane) ili acetilsalicilne kiseline (ljekovite supstance). ______________________________________________________________ Povezane publikacije
| ||