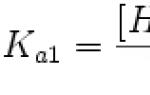चीट शीट हार्मोन एंजाइम। एक कोशिका में चयापचय गतिविधि को विनियमित करने के लिए लेह्निंगर की जैव रसायन विधियों के मूल सिद्धांत
गतिशील जैव रसायन
अध्यायचतुर्थ.8.
चयापचय और ऊर्जा
उपापचय या चयापचय - शरीर में रासायनिक प्रतिक्रियाओं का एक सेट जो इसे जीवन के लिए आवश्यक पदार्थ और ऊर्जा प्रदान करता है। चयापचय में, दो मुख्य चरणों को प्रतिष्ठित किया जा सकता है: प्रारंभिक - जब आहार मार्ग के माध्यम से प्राप्त पदार्थ रासायनिक परिवर्तनों से गुजरता है, जिसके परिणामस्वरूप यह रक्त में प्रवेश कर सकता है और फिर कोशिकाओं में प्रवेश कर सकता है, और चयापचय स्वयं, यानी। कोशिकाओं में प्रवेश कर चुके यौगिकों का रासायनिक परिवर्तन।
चयापचय मार्ग - यह शरीर में किसी विशेष पदार्थ के रासायनिक परिवर्तनों की प्रकृति और क्रम है। चयापचय प्रक्रिया के दौरान बनने वाले मध्यवर्ती उत्पादों को मेटाबोलाइट्स कहा जाता है, और चयापचय पथ का अंतिम यौगिक अंतिम उत्पाद होता है।
जटिल पदार्थों को सरल पदार्थों में तोड़ने की प्रक्रिया कहलाती है अपचय. इस प्रकार, भोजन में प्रोटीन, वसा और कार्बोहाइड्रेट पाचन तंत्र में एंजाइमों की कार्रवाई के तहत सरल घटकों (अमीनो एसिड, फैटी एसिड और मोनोसेकेराइड) में टूट जाते हैं। इससे ऊर्जा निकलती है. विपरीत प्रक्रिया, अर्थात सरल यौगिकों से जटिल यौगिकों का संश्लेषण कहलाता है उपचय . यह ऊर्जा के व्यय के साथ आता है। पाचन के परिणामस्वरूप बनने वाले अमीनो एसिड, फैटी एसिड और मोनोसेकेराइड से कोशिकाओं में नए सेलुलर प्रोटीन, झिल्ली फॉस्फोलिपिड और पॉलीसेकेराइड का संश्लेषण होता है।
एक अवधारणा है उभयचरवाद जब एक यौगिक नष्ट हो जाता है, लेकिन दूसरा संश्लेषित हो जाता है।
चयापचय चक्र एक चयापचय मार्ग है जिसमें अंतिम उत्पादों में से एक इस प्रक्रिया में शामिल यौगिकों में से एक के समान होता है।
एक विशेष चयापचय मार्ग एक विशिष्ट यौगिक (कार्बोहाइड्रेट या प्रोटीन) के परिवर्तनों का एक सेट है। सामान्य चयापचय मार्ग तब होता है जब दो या दो से अधिक प्रकार के यौगिक शामिल होते हैं (कार्बोहाइड्रेट, लिपिड और आंशिक रूप से प्रोटीन ऊर्जा चयापचय में शामिल होते हैं)।
मेटाबोलिक सबस्ट्रेट्स - भोजन के साथ आपूर्ति किये जाने वाले यौगिक। इनमें मुख्य पोषक तत्व (प्रोटीन, कार्बोहाइड्रेट, लिपिड) और गौण पोषक तत्व होते हैं, जो कम मात्रा में आते हैं (विटामिन, खनिज)।
चयापचय की तीव्रता कोशिका की कुछ पदार्थों या ऊर्जा की आवश्यकता से निर्धारित होती है; विनियमन चार तरीकों से किया जाता है:
1) किसी विशेष चयापचय मार्ग की कुल प्रतिक्रिया दर इस मार्ग में प्रत्येक एंजाइम की एकाग्रता, पर्यावरण के पीएच मान, मध्यवर्ती उत्पादों में से प्रत्येक की इंट्रासेल्युलर एकाग्रता, और कॉफ़ैक्टर्स और कोएंजाइम की एकाग्रता से निर्धारित होती है।
2) नियामक (एलोस्टेरिक) एंजाइमों की गतिविधि, जो आमतौर पर चयापचय मार्गों के प्रारंभिक चरणों को उत्प्रेरित करती है। उनमें से अधिकांश इस मार्ग के अंतिम उत्पाद द्वारा बाधित होते हैं और इस प्रकार के अवरोध को "प्रतिक्रिया" कहा जाता है।
3) आनुवंशिक नियंत्रण जो किसी विशेष एंजाइम के संश्लेषण की दर निर्धारित करता है। एक उल्लेखनीय उदाहरण संबंधित सब्सट्रेट की आपूर्ति के जवाब में कोशिका में प्रेरक एंजाइमों की उपस्थिति है।
4) हार्मोनल विनियमन. कई हार्मोन चयापचय मार्गों में कई एंजाइमों को सक्रिय या बाधित कर सकते हैं।
जीवित जीव थर्मोडायनामिक रूप से अस्थिर प्रणाली हैं। उनके गठन और कामकाज के लिए, बहुमुखी उपयोग के लिए उपयुक्त रूप में ऊर्जा की निरंतर आपूर्ति की आवश्यकता होती है। ऊर्जा प्राप्त करने के लिए, ग्रह पर लगभग सभी जीवित प्राणियों ने एटीपी के पाइरोफॉस्फेट बांडों में से एक को हाइड्रोलाइज करने के लिए अनुकूलित किया है। इस संबंध में, जीवित जीवों के बायोएनेरजेटिक्स का एक मुख्य कार्य एडीपी और एएमपी से प्रयुक्त एटीपी की पुनःपूर्ति है।
कोशिका में ऊर्जा का मुख्य स्रोत वायुमंडलीय ऑक्सीजन के साथ सब्सट्रेट्स का ऑक्सीकरण है। यह प्रक्रिया तीन तरीकों से होती है: कार्बन परमाणु में ऑक्सीजन का जुड़ना, हाइड्रोजन का पृथक्करण, या एक इलेक्ट्रॉन का नुकसान। कोशिकाओं में, ऑक्सीकरण सब्सट्रेट से ऑक्सीजन तक हाइड्रोजन और इलेक्ट्रॉनों के अनुक्रमिक हस्तांतरण के रूप में होता है। इस मामले में, ऑक्सीजन एक कम करने वाले यौगिक (ऑक्सीकरण एजेंट) की भूमिका निभाता है। ऑक्सीडेटिव प्रतिक्रियाएं ऊर्जा की रिहाई के साथ होती हैं। जैविक प्रतिक्रियाओं की विशेषता ऊर्जा में अपेक्षाकृत छोटे परिवर्तन हैं। यह ऑक्सीकरण प्रक्रिया को कई मध्यवर्ती चरणों में विभाजित करके प्राप्त किया जाता है, जो इसे उच्च-ऊर्जा यौगिकों (एटीपी) के रूप में छोटे भागों में संग्रहीत करने की अनुमति देता है। प्रोटॉन और इलेक्ट्रॉनों की एक जोड़ी के साथ बातचीत करते समय ऑक्सीजन परमाणु की कमी से पानी के अणु का निर्माण होता है।
ऊतक श्वसन
यह शरीर के ऊतकों की कोशिकाओं द्वारा ऑक्सीजन की खपत की प्रक्रिया है, जो जैविक ऑक्सीकरण में शामिल होती है। इस प्रकार का ऑक्सीकरण कहलाता है एरोबिक ऑक्सीकरण . यदि हाइड्रोजन स्थानांतरण श्रृंखला में अंतिम स्वीकर्ता ऑक्सीजन नहीं है, बल्कि अन्य पदार्थ (उदाहरण के लिए, पाइरुविक एसिड) है, तो इस प्रकार के ऑक्सीकरण को कहा जाता है अवायवीय.
वह। जैविक ऑक्सीकरण मध्यवर्ती हाइड्रोजन वाहक और उसके अंतिम स्वीकर्ता की मदद से एक सब्सट्रेट का डिहाइड्रोजनीकरण है।
श्वसन शृंखला (ऊतक श्वसन एंजाइम) ऑक्सीकृत सब्सट्रेट से ऑक्सीजन तक प्रोटॉन और इलेक्ट्रॉनों के वाहक होते हैं। ऑक्सीकरण एजेंट एक यौगिक है जो इलेक्ट्रॉनों को स्वीकार कर सकता है। यह क्षमता मात्रात्मक रूप से विशेषता है रेडॉक्स संभावित एक मानक हाइड्रोजन इलेक्ट्रोड के सापेक्ष जिसका पीएच 7.0 है। किसी यौगिक की क्षमता जितनी कम होगी, उसके अपचायक गुण उतने ही मजबूत होंगे और इसके विपरीत।
वह। कोई भी यौगिक केवल उच्च रेडॉक्स क्षमता वाले यौगिक को इलेक्ट्रॉन दान कर सकता है। श्वसन श्रृंखला में, प्रत्येक बाद की कड़ी में पिछली कड़ी की तुलना में अधिक क्षमता होती है।
श्वसन श्रृंखला में शामिल हैं:
1. एनएडी-निर्भर डिहाइड्रोजनेज;
2. एफएडी-निर्भर डिहाइड्रोजनेज;
3. यूबिकिनोन (को क्यू);
4. साइटोक्रोम बी, सी, ए + ए 3.
एनएडी-निर्भर डिहाइड्रोजनेज . एक कोएंजाइम के रूप में होता है ऊपरऔर एनएडीपी. निकोटिनमाइड की पाइरीडीन रिंग इलेक्ट्रॉनों और हाइड्रोजन प्रोटॉन को स्वीकार करने में सक्षम है।
एफएडी और एफएमएन-निर्भर डिहाइड्रोजनेज इसमें कोएंजाइम के रूप में विटामिन बी 2 का फॉस्फोरस एस्टर होता है ( सनक).
उबिकिनोन (को क्यू ) फ्लेवोप्रोटीन से हाइड्रोजन छीन लेता है और में बदल देता है उदकुनैन.
साइटोक्रोम - क्रोमोप्रोटीन प्रोटीन अपनी संरचना में कृत्रिम समूहों के रूप में लौह पोर्फिरिन की उपस्थिति के कारण इलेक्ट्रॉन प्राप्त करने में सक्षम हैं। वे ऐसे पदार्थ से एक इलेक्ट्रॉन स्वीकार करते हैं जो थोड़ा मजबूत कम करने वाला एजेंट है और इसे एक मजबूत ऑक्सीकरण एजेंट में स्थानांतरित करता है। लोहे का परमाणु पोर्फिरिन रिंग के तल के एक तरफ हिस्टिडीन अमीनो एसिड के इमिडाज़ोल रिंग के नाइट्रोजन परमाणु से और दूसरी तरफ मेथियोनीन के सल्फर परमाणु से जुड़ा होता है। इसलिए, साइटोक्रोम में लौह परमाणु की ऑक्सीजन को बांधने की संभावित क्षमता दब जाती है।
में साइटोक्रोम सी पोर्फिरिन तल दो सिस्टीन अवशेषों के माध्यम से सहसंयोजक रूप से प्रोटीन से जुड़ा होता है साइटोक्रोमेक्सबी और , यह सहसंयोजक बंधित नहीं है प्रोटीन के साथ.
में साइटोक्रोम ए+ए 3 (साइटोक्रोम ऑक्सीडेज) में प्रोटोपॉर्फिरिन के बजाय पोर्फिरिन ए होता है, जो कई संरचनात्मक विशेषताओं में भिन्न होता है। लोहे की पांचवीं समन्वय स्थिति पर अमीनो चीनी अवशेषों से संबंधित एक अमीनो समूह का कब्जा है जो प्रोटीन का ही हिस्सा है।
हीम, हेमोलगोबिन के विपरीत, साइटोक्रोम में लौह परमाणु विपरीत रूप से दो से त्रिसंयोजक अवस्था में परिवर्तित हो सकता है, जो इलेक्ट्रॉन परिवहन सुनिश्चित करता है (अधिक विवरण के लिए परिशिष्ट 1 "हेमोप्रोटीन की परमाणु और इलेक्ट्रॉनिक संरचना" देखें)।
इलेक्ट्रॉन परिवहन श्रृंखला के संचालन का तंत्र
माइटोकॉन्ड्रियन की बाहरी झिल्ली (चित्र 4.8.1) अधिकांश छोटे अणुओं और आयनों के लिए पारगम्य है, आंतरिक झिल्ली लगभग सभी आयनों (एच प्रोटॉन को छोड़कर) और अधिकांश अनावेशित अणुओं के लिए पारगम्य है।
श्वसन श्रृंखला के उपरोक्त सभी घटक आंतरिक झिल्ली में अंतर्निहित होते हैं। श्वसन श्रृंखला के साथ प्रोटॉन और इलेक्ट्रॉनों का परिवहन इसके घटकों के बीच संभावित अंतर से सुनिश्चित होता है। इस मामले में, क्षमता में 0.16 वी की प्रत्येक वृद्धि एडीपी और एच 3 पीओ 4 से एक एटीपी अणु के संश्लेषण के लिए पर्याप्त ऊर्जा जारी करती है। जब O2 के एक अणु का उपभोग किया जाता है, तो 3 बनता है एटीपी.
ADP और फॉस्फोरिक एसिड से ATP के ऑक्सीकरण और निर्माण की प्रक्रियाएँ। फास्फोराइलेशन माइटोकॉन्ड्रिया में होता है। आंतरिक झिल्ली कई तह बनाती है - क्राइस्टे। अंतरिक्ष एक आंतरिक झिल्ली - मैट्रिक्स से घिरा है। आंतरिक और बाहरी झिल्लियों के बीच के स्थान को इंटरमेम्ब्रेन कहा जाता है।
ऐसे अणु में तीन उच्च-ऊर्जा बंधन होते हैं। मैक्रोएर्जिक या ऊर्जा-समृद्ध एक रासायनिक बंधन है, जो टूटने पर 4 किलो कैलोरी/मोल से अधिक निकलता है। एटीपी से एडीपी और फॉस्फोरिक एसिड के हाइड्रोलाइटिक टूटने से 7.3 किलो कैलोरी/मोल निकलता है। एडीपी और फॉस्फोरिक एसिड अवशेषों से एटीपी बनाने के लिए बिल्कुल समान मात्रा खर्च की जाती है, और यह शरीर में ऊर्जा संग्रहीत करने के मुख्य तरीकों में से एक है।
श्वसन श्रृंखला के साथ इलेक्ट्रॉनों के परिवहन के दौरान, ऊर्जा निकलती है, जो एटीपी के एक अणु और पानी के एक अणु को बनाने के लिए एडीपी में फॉस्फोरिक एसिड अवशेषों को जोड़ने पर खर्च होती है। श्वसन श्रृंखला के साथ इलेक्ट्रॉनों की एक जोड़ी के स्थानांतरण के दौरान, 21.3 किलो कैलोरी/मोल निकलता है और तीन एटीपी अणुओं के रूप में संग्रहीत होता है। यह इलेक्ट्रॉन परिवहन के दौरान निकलने वाली ऊर्जा का लगभग 40% है।
किसी कोशिका में ऊर्जा भंडारण की इस विधि को कहा जाता है ऑक्सीडेटिव फाृॉस्फॉरिलेशन या युग्मित फास्फारिलीकरण।
इस प्रक्रिया के आणविक तंत्र को मिशेल के केमोस्मोटिक सिद्धांत द्वारा पूरी तरह से समझाया गया है, जिसे 1961 में सामने रखा गया था।
ऑक्सीडेटिव फास्फारिलीकरण का तंत्र (चित्र 4.8.2.):
1) एनएडी-निर्भर डिहाइड्रोजनेज आंतरिक माइटोकॉन्ड्रियल झिल्ली की मैट्रिक्स सतह पर स्थित होता है और एफएमएन-निर्भर डिहाइड्रोजनेज को हाइड्रोजन इलेक्ट्रॉनों की एक जोड़ी दान करता है। इस मामले में, प्रोटॉनों की एक जोड़ी भी मैट्रिक्स से एफएमएन में गुजरती है और परिणामस्वरूप, एफएमएन एच 2 बनता है। इस समय, NAD से संबंधित प्रोटॉनों की एक जोड़ी को इंटरमेम्ब्रेन स्पेस में धकेल दिया जाता है।
2) FAD-निर्भर डिहाइड्रोजनेज Co को इलेक्ट्रॉनों की एक जोड़ी दान करता हैक्यू और कुछ प्रोटॉन को अंतरझिल्ली स्थान में धकेलता है। इलेक्ट्रॉन प्राप्त करने के बाद कंपनीक्यू मैट्रिक्स से प्रोटॉनों की एक जोड़ी को स्वीकार करता है और Co में बदल जाता हैक्यूएच 2.
3)को प्र H2 प्रोटॉन की एक जोड़ी को इंटरमेम्ब्रेन स्पेस में धकेलता है, और इलेक्ट्रॉनों की एक जोड़ी को पानी के अणु बनाने के लिए साइटोक्रोम और फिर ऑक्सीजन में स्थानांतरित किया जाता है।
परिणामस्वरूप, जब इलेक्ट्रॉनों की एक जोड़ी को मैट्रिक्स से इंटरमेम्ब्रेन स्पेस में एक श्रृंखला के साथ स्थानांतरित किया जाता है, तो 6 प्रोटॉन (3 जोड़े) को पंप किया जाता है, जिससे आंतरिक सतहों के बीच एक संभावित अंतर और पीएच अंतर पैदा होता है। झिल्ली.
4) संभावित अंतर और पीएच अंतर प्रोटॉन चैनल के माध्यम से मैट्रिक्स में वापस प्रोटॉन की गति सुनिश्चित करते हैं।
5) प्रोटॉन की यह विपरीत गति एटीपी सिंथेज़ के सक्रियण और एडीपी और फॉस्फोरिक एसिड से एटीपी के संश्लेषण की ओर ले जाती है। इलेक्ट्रॉनों की एक जोड़ी (यानी प्रोटॉन के तीन जोड़े) को स्थानांतरित करते समय, 3 एटीपी अणु संश्लेषित होते हैं (चित्र 4.7.3.)।

श्वसन और ऑक्सीडेटिव फास्फारिलीकरण की प्रक्रियाओं का पृथक्करण तब होता है जब प्रोटॉन माइटोकॉन्ड्रिया की आंतरिक झिल्ली में प्रवेश करना शुरू करते हैं। इस मामले में, पीएच ग्रेडिएंट समतल हो जाता है और फॉस्फोराइलेशन के लिए प्रेरक शक्ति गायब हो जाती है। रासायनिक अनकप्लर्स को प्रोटोनोफोर्स कहा जाता है; वे एक झिल्ली के पार प्रोटॉन को ले जाने में सक्षम होते हैं। इसमे शामिल है 2,4 Dinitrophenol, थायराइड हार्मोन, आदि (चित्र 4.8.3.)।
मैट्रिक्स से परिणामी एटीपी को ट्रांसलोकेस एंजाइम द्वारा साइटोप्लाज्म में स्थानांतरित किया जाता है, जबकि विपरीत दिशा में एडीपी के एक अणु और फॉस्फोरिक एसिड के एक अणु को मैट्रिक्स में स्थानांतरित किया जाता है। यह स्पष्ट है कि एडीपी और फॉस्फेट परिवहन में व्यवधान एटीपी संश्लेषण को रोकता है।
ऑक्सीडेटिव फास्फारिलीकरण की दर मुख्य रूप से एटीपी सामग्री पर निर्भर करती है; जितनी तेजी से इसका उपभोग किया जाता है, उतना अधिक एडीपी जमा होता है, ऊर्जा की आवश्यकता उतनी ही अधिक होती है और इसलिए, ऑक्सीडेटिव फास्फारिलीकरण की प्रक्रिया उतनी ही अधिक सक्रिय होती है। एडीपी की सेलुलर सांद्रता द्वारा ऑक्सीडेटिव फास्फारिलीकरण की दर के नियमन को श्वसन नियंत्रण कहा जाता है।

अध्याय के लिए संदर्भचतुर्थ.8.
1. बिशेव्स्की ए. श., टेरसेनोव ओ. ए. डॉक्टर के लिए बायोकैमिस्ट्री // येकातेरिनबर्ग: उरलस्की राबोची, 1994, 384 पीपी.;
2. नॉर्रे डी.जी., मायज़िना एस.डी. जैविक रसायन विज्ञान। – एम.: उच्चतर. विद्यालय 1998, 479 पीपी.;
3. लेनिन्जर ए. जैव रसायन। कोशिका संरचना और कार्यों का आणविक आधार // एम.: मीर, 1974, 956 पीपी.;
4. पुस्टोवालोवा एल.एम. जैव रसायन पर कार्यशाला // रोस्तोव-ऑन-डॉन: फीनिक्स, 1999, 540 पीपी.;
5. स्टेपानोव वी.एम. आण्विक जीव विज्ञान। प्रोटीन की संरचना और कार्य // एम.: हायर स्कूल, 1996, 335 पीपी.;
पृथ्वी पर रहने वाले जीवों की संपूर्ण विविधता को विभिन्न ऊर्जा स्रोतों के उपयोग के आधार पर दो मुख्य समूहों में विभाजित किया जा सकता है - स्वपोषी और विषमपोषी जीव। पहले (ऑटोट्रॉफ़) मुख्य रूप से हरे पौधे हैं जो प्रकाश संश्लेषण की प्रक्रिया में सीधे सूर्य की उज्ज्वल ऊर्जा का उपयोग करने में सक्षम हैं, अकार्बनिक से कार्बनिक यौगिक (कार्बोहाइड्रेट, अमीनो एसिड, फैटी एसिड, आदि) बनाते हैं। अन्य जीवित जीव तैयार कार्बनिक पदार्थों को आत्मसात करते हैं, उन्हें अपने शरीर के निर्माण के लिए ऊर्जा या प्लास्टिक सामग्री के स्रोत के रूप में उपयोग करते हैं। यह ध्यान दिया जाना चाहिए कि अधिकांश सूक्ष्मजीव भी हेटरोट्रॉफ़ हैं। हालाँकि, वे संपूर्ण खाद्य कणों को अवशोषित करने में सक्षम नहीं हैं। वे अपने वातावरण में विशेष पाचन एंजाइमों का स्राव करते हैं जो खाद्य पदार्थों को तोड़ते हैं, उन्हें छोटे, घुलनशील अणुओं में बदल देते हैं और ये अणु कोशिकाओं में प्रवेश करते हैं। चयापचय के परिणामस्वरूप, भोजन के साथ खाए गए पदार्थ कोशिका के अपने पदार्थों और संरचनाओं में परिवर्तित हो जाते हैं और इसके अलावा, शरीर को बाहरी कार्य करने के लिए ऊर्जा प्रदान की जाती है। स्व-प्रजनन, यानी, शरीर की संरचनाओं और प्रजनन का निरंतर नवीनीकरण, जीवित जीवों में चयापचय की सबसे विशिष्ट विशेषता है, जो इसे निर्जीव प्रकृति में चयापचय से अलग करती है। |
चयापचय, जो ऊर्जा विनिमय के साथ अटूट रूप से जुड़ा हुआ है, जीवित प्रणालियों में पदार्थ और ऊर्जा के परिवर्तन का एक प्राकृतिक क्रम है, जिसका उद्देश्य उनके संरक्षण और आत्म-प्रजनन है। एफ. एंगेल्स ने चयापचय को जीवन की सबसे महत्वपूर्ण संपत्ति के रूप में नोट किया, जिसके समाप्त होने से जीवन स्वयं समाप्त हो जाता है। उन्होंने इस प्रक्रिया की द्वंद्वात्मक प्रकृति पर जोर दिया और बताया
लगातार भौतिकवादी दृष्टिकोण से, रूसी शरीर विज्ञान के संस्थापक, आई.एम. सेचेनोव ने जीवों के जीवन में चयापचय की भूमिका पर विचार किया। के. ए. तिमिर्याज़ेव ने लगातार इस विचार का अनुसरण किया कि जीवित जीवों की विशेषता वाली मुख्य संपत्ति जीव को बनाने वाले पदार्थ और पर्यावरण के पदार्थ के बीच एक निरंतर सक्रिय आदान-प्रदान है, जिसे जीव लगातार मानता है, आत्मसात करता है, इसे कुछ समान में बदल देता है, फिर से बदलता है और विच्छेदन की प्रक्रिया में अंतर करता है। आई.पी. पावलोव ने चयापचय को जीवन गतिविधि की अभिव्यक्ति का आधार, शरीर के शारीरिक कार्यों का आधार माना। जीवन प्रक्रियाओं के रसायन विज्ञान के ज्ञान में एक महत्वपूर्ण योगदान ए.आई. ओपरिन द्वारा किया गया था, जिन्होंने पृथ्वी पर जीवन के उद्भव और विकास के दौरान चयापचय के विकास के बुनियादी पैटर्न का अध्ययन किया था।
बुनियादी अवधारणाएँ और शर्तें
या चयापचय शरीर में रासायनिक प्रतिक्रियाओं का एक सेट है जो इसे जीवन के लिए आवश्यक पदार्थ और ऊर्जा प्रदान करता है: आत्म-संरक्षण और आत्म-प्रजनन। स्व-प्रजनन को बाहर से आने वाले पदार्थ के शरीर के पदार्थों और संरचनाओं में परिवर्तन के रूप में समझा जाता है, जिसके परिणामस्वरूप निरंतर ऊतक नवीकरण, विकास और प्रजनन होता है।
चयापचय में हैं:
- बाह्य विनिमय- इसमें शरीर में प्रवेश के रास्ते पर पदार्थों का बाह्य कोशिकीय परिवर्तन और इससे चयापचय उत्पादों को निकालना शामिल है [दिखाओ]
.
शरीर में पदार्थों का सेवन और चयापचय उत्पादों की रिहाई मिलकर पर्यावरण और जीव के बीच पदार्थों के आदान-प्रदान का गठन करती है, और इसे बाहरी विनिमय के रूप में परिभाषित किया जाता है।
पदार्थों (और ऊर्जा) का बाहरी आदान-प्रदान लगातार होता रहता है।
बाहरी वातावरण से मानव शरीर को कोशिकाओं और ऊतकों के संरचनात्मक तत्वों के निर्माण और नवीनीकरण और ऊर्जा के निर्माण के लिए आवश्यक ऑक्सीजन, पानी, खनिज लवण, पोषक तत्व, विटामिन प्राप्त होते हैं। इन सभी पदार्थों को खाद्य उत्पाद कहा जा सकता है, जिनमें से कुछ जैविक मूल (पौधे और पशु उत्पाद) के हैं और एक छोटा हिस्सा गैर-जैविक (पानी और खनिज लवण इसमें घुले हुए) हैं।
भोजन के साथ आपूर्ति किए गए पोषक तत्व अमीनो एसिड, मोनोसेकेराइड, फैटी एसिड, न्यूक्लियोटाइड और अन्य पदार्थों के निर्माण के साथ विघटित होते हैं, जो कोशिका के संरचनात्मक और कार्यात्मक घटकों के निरंतर टूटने के दौरान बनने वाले समान पदार्थों के साथ मिश्रित होने पर, कुल पूल का निर्माण करते हैं। शरीर के चयापचयों का. यह निधि दो दिशाओं में खर्च की जाती है: भाग का उपयोग कोशिका के क्षयग्रस्त संरचनात्मक और कार्यात्मक घटकों को नवीनीकृत करने के लिए किया जाता है; दूसरा भाग चयापचय के अंतिम उत्पादों में परिवर्तित हो जाता है, जो शरीर से उत्सर्जित हो जाते हैं।
जब पदार्थ अंतिम चयापचय उत्पादों में विघटित होते हैं, तो ऊर्जा निकलती है; एक वयस्क में, प्रति दिन 8,000-12,000 kJ (2,000-3,000 kcal)। इस ऊर्जा का उपयोग शरीर की कोशिकाओं द्वारा विभिन्न प्रकार के कार्य करने के साथ-साथ शरीर के तापमान को स्थिर स्तर पर बनाए रखने के लिए किया जाता है।
- मध्यवर्ती विनिमय- इसमें जैविक कोशिकाओं के अंदर पदार्थों के प्रवेश के क्षण से लेकर अंतिम उत्पादों के निर्माण तक (उदाहरण के लिए, अमीनो एसिड चयापचय, कार्बोहाइड्रेट चयापचय, आदि) का परिवर्तन शामिल है।
चयापचय चरण. क्रमिक तीन चरण हैं।
पर और अधिक पढ़ें
- सेवन (पोषण चयापचय का एक अभिन्न अंग है (पर्यावरण से शरीर में पदार्थों का सेवन))
- पाचन (पाचन की जैव रसायन (पोषक तत्वों का पाचन))
- अवशोषण (पाचन की जैव रसायन (पोषक तत्वों का अवशोषण))
द्वितीय. शरीर में पदार्थों की गति और परिवर्तन (मध्यवर्ती चयापचय) |
मध्यवर्ती चयापचय (या चयापचय) शरीर में पदार्थों का कोशिकाओं में प्रवेश करने के क्षण से लेकर अंतिम चयापचय उत्पादों के निर्माण तक होने वाला परिवर्तन है, यानी, रासायनिक प्रतिक्रियाओं का एक सेट जो जीवित कोशिकाओं में होता है और शरीर को पदार्थ और ऊर्जा प्रदान करता है। इसकी महत्वपूर्ण गतिविधि, वृद्धि और प्रजनन के लिए। यह मेटाबोलिज्म का सबसे जटिल हिस्सा है।
एक बार कोशिका के अंदर, पोषक तत्व का चयापचय होता है - एंजाइमों द्वारा उत्प्रेरित रासायनिक परिवर्तनों की एक श्रृंखला से गुजरता है। ऐसे रासायनिक परिवर्तनों के विशिष्ट अनुक्रम को चयापचय पथ कहा जाता है, और परिणामी मध्यवर्ती उत्पादों को मेटाबोलाइट्स कहा जाता है। चयापचय मार्गों को चयापचय मानचित्र के रूप में दर्शाया जा सकता है।
| पोषक तत्व चयापचय | ||
| कार्बोहाइड्रेट | लिपिड | Belkov |
कार्बोहाइड्रेट के कैटोबोलिक मार्ग
कार्बोहाइड्रेट के अनाबोलिक मार्ग
|
लिपिड कैटोबोलिक मार्ग
अनाबोलिक लिपिड मार्ग
|
प्रोटीन कैटोबोलिक मार्ग
अमीनो एसिड का एनाबॉलिक मार्ग
|
सामान्य सब्सट्रेट्स के लिए फॉस्फोलिपिड और ट्राईसिलग्लिसरॉल संश्लेषण मार्गों के बीच प्रतिस्पर्धा के कारण, फॉस्फोलिपिड संश्लेषण को बढ़ावा देने वाले सभी पदार्थ ऊतकों में ट्राईसिलग्लिसरॉल के जमाव को रोकते हैं। इन पदार्थों को लिपोट्रोपिक कारक कहा जाता है। इनमें फॉस्फोलिपिड्स की संरचनाएं और घटक शामिल हैं: कोलीन, इनोसिटोल, सेरीन; एक पदार्थ जो सेरीन फॉस्फेटाइड्स के डीकार्बाक्सिलेशन की सुविधा देता है - पाइरिडोक्सल फॉस्फेट; मिथाइल समूह दाता - मेथिओनिन; फोलिक एसिड और सायनोकोबालामिन, मिथाइल ग्रुप ट्रांसफर कोएंजाइम (टीएचएफए और मिथाइलकोबालामिन) के निर्माण में शामिल हैं। उनका उपयोग दवाओं के रूप में किया जा सकता है जो ऊतकों में ट्राईसिलग्लिसरॉल के अत्यधिक जमाव (फैटी घुसपैठ) को रोकते हैं।
|
||
| तालिका 24. मानव दैनिक चयापचय (गोल मान; शरीर का वजन लगभग 70 किलोग्राम वाला वयस्क) | |||
| पदार्थों | शरीर में सामग्री, जी | दैनिक खपत, जी | दैनिक आवंटन |
| O2 | - | 850 | - |
| सीओ 2 | - | - | 1000 |
| पानी | 42 000 | 2200 | 2600 |
| कार्बनिक पदार्थ: | |||
| गिलहरी | 15 000 | 80 | - |
| लिपिड | 10 000 | 100 | - |
| कार्बोहाइड्रेट | 700 | 400 | - |
| न्यूक्लिक एसिड | 700 | - | - |
| यूरिया | - | - | 30 |
| खनिज लवण | 3 500 | 20 | 20 |
| कुल | 71 900 | 3650 | 3650 |
चयापचय गतिविधि के परिणामस्वरूप, शरीर के सभी भागों में हानिकारक पदार्थ बनते हैं, जो रक्त में प्रवेश करते हैं और उन्हें हटा दिया जाना चाहिए। यह कार्य गुर्दे द्वारा किया जाता है, जो हानिकारक पदार्थों को अलग करते हैं और उन्हें मूत्राशय में भेजते हैं, जहां से वे शरीर से बाहर निकल जाते हैं। अन्य अंग भी चयापचय प्रक्रिया में भाग लेते हैं: यकृत, अग्न्याशय, पित्ताशय, आंतें, पसीने की ग्रंथियां।
एक व्यक्ति चयापचय के मुख्य अंतिम उत्पादों को मूत्र, मल, पसीना और साँस छोड़ने वाली हवा में उत्सर्जित करता है - सीओ 2, एच 2 ओ, यूरिया एच 2 एन - सीओ - एनएच 2। कार्बनिक पदार्थों का हाइड्रोजन एच 2 ओ के रूप में उत्सर्जित होता है, और शरीर उपभोग की तुलना में अधिक पानी छोड़ता है (तालिका 24 देखें): कार्बनिक पदार्थों के हाइड्रोजन और साँस के ऑक्सीजन से शरीर में प्रति दिन लगभग 400 ग्राम पानी बनता है। वायु (चयापचय जल)। कार्बनिक पदार्थों का कार्बन एवं ऑक्सीजन CO2 के रूप में तथा नाइट्रोजन यूरिया के रूप में निकल जाता है।
इसके अलावा, एक व्यक्ति कई अन्य पदार्थों को स्रावित करता है, लेकिन कम मात्रा में, ताकि शरीर और पर्यावरण के बीच चयापचय के समग्र संतुलन में उनका योगदान छोटा हो। हालाँकि, यह ध्यान दिया जाना चाहिए कि ऐसे पदार्थों की रिहाई का शारीरिक महत्व महत्वपूर्ण हो सकता है। उदाहरण के लिए, हीम ब्रेकडाउन उत्पादों या दवाओं सहित विदेशी यौगिकों के चयापचय उत्पादों की रिहाई में व्यवधान, गंभीर चयापचय संबंधी विकारों और शरीर के कार्यों का कारण बन सकता है।
मेटाबोलिक सबस्ट्रेट्स- भोजन से निकलने वाले रासायनिक यौगिक। उनमें से, दो समूहों को प्रतिष्ठित किया जा सकता है: मुख्य पोषक तत्व (कार्बोहाइड्रेट, प्रोटीन, लिपिड) और छोटे, कम मात्रा में आपूर्ति किए जाने वाले (विटामिन, खनिज यौगिक)।
यह प्रतिस्थापन योग्य और अपूरणीय पोषक तत्वों के बीच अंतर करने की प्रथा है। आवश्यक पोषक तत्व वे हैं जिन्हें शरीर में संश्लेषित नहीं किया जा सकता है और इसलिए, उन्हें भोजन के साथ आपूर्ति की जानी चाहिए।
चयापचय मार्ग- यह शरीर में किसी विशेष पदार्थ के रासायनिक परिवर्तनों की प्रकृति और क्रम है। परिवर्तन प्रक्रिया के दौरान बनने वाले मध्यवर्ती उत्पादों को मेटाबोलाइट्स कहा जाता है, और चयापचय पथ का अंतिम यौगिक अंतिम उत्पाद होता है।
शरीर में रासायनिक परिवर्तन निरंतर होते रहते हैं। शरीर के पोषण के परिणामस्वरूप, प्रारंभिक पदार्थ चयापचय परिवर्तनों से गुजरते हैं; चयापचय के अंतिम उत्पाद लगातार शरीर से निकाले जाते हैं। इस प्रकार, जीव एक थर्मोडायनामिक रूप से खुला रासायनिक तंत्र है। चयापचय प्रणाली का सबसे सरल उदाहरण एकल अशाखित चयापचय श्रृंखला है:




-->ए -->बी -->सी -->डी -->
ऐसी प्रणाली में पदार्थों के निरंतर प्रवाह के साथ, एक गतिशील संतुलन स्थापित होता है जब प्रत्येक मेटाबोलाइट के गठन की दर उसके उपभोग की दर के बराबर होती है। इसका मतलब है कि प्रत्येक मेटाबोलाइट की सांद्रता स्थिर रहती है। प्रणाली की इस अवस्था को स्थिर कहा जाता है, और इस अवस्था में पदार्थों की सांद्रता को स्थिर सांद्रता कहा जाता है।
किसी भी क्षण एक जीवित जीव स्थिर अवस्था की दी गई परिभाषा को पूरा नहीं करता है। हालाँकि, अपेक्षाकृत बड़ी अवधि में इसके मापदंडों के औसत मूल्य पर विचार करते हुए, कोई उनकी सापेक्ष स्थिरता को नोट कर सकता है और इस तरह जीवित जीवों के लिए एक स्थिर प्रणाली की अवधारणा के आवेदन को उचित ठहरा सकता है। [दिखाओ] .

चित्र में. 64 एक अशाखित चयापचय श्रृंखला का एक हाइड्रोडायनामिक मॉडल प्रस्तुत करता है। इस उपकरण में, सिलेंडर में तरल स्तंभ की ऊंचाई क्रमशः मेटाबोलाइट्स ए-डी की सांद्रता को मॉडल करती है, और सिलेंडर के बीच कनेक्टिंग ट्यूबों का थ्रूपुट संबंधित एंजाइमी प्रतिक्रियाओं की दर को मॉडल करता है।
सिस्टम में तरल के प्रवेश की एक स्थिर दर पर, सभी सिलेंडरों में तरल स्तंभ की ऊंचाई स्थिर रहती है: यह एक स्थिर स्थिति है।
यदि द्रव प्रवेश की दर बढ़ जाती है, तो सभी सिलेंडरों में तरल स्तंभ की ऊंचाई और पूरे सिस्टम के माध्यम से द्रव प्रवाह की दर बढ़ जाएगी: सिस्टम एक नई स्थिर स्थिति में चला गया है। इसी प्रकार के परिवर्तन जीवित कोशिका में चयापचय प्रक्रियाओं में होते हैं।
मेटाबोलाइट सांद्रता का विनियमन
आमतौर पर, चयापचय श्रृंखला में एक प्रतिक्रिया होती है जो अन्य सभी प्रतिक्रियाओं की तुलना में बहुत धीमी गति से आगे बढ़ती है - यह मार्ग में दर-सीमित कदम है। चित्र में, ऐसा चरण पहले और दूसरे सिलेंडर के बीच एक संकीर्ण कनेक्टिंग ट्यूब द्वारा तैयार किया गया है। दर-सीमित चरण चयापचय श्रृंखला के अंतिम उत्पाद में प्रारंभिक पदार्थ के रूपांतरण की समग्र दर निर्धारित करता है। अक्सर जो एंजाइम दर-सीमित प्रतिक्रिया को उत्प्रेरित करता है वह एक नियामक एंजाइम होता है: इसकी गतिविधि सेलुलर अवरोधकों और सक्रियकर्ताओं के प्रभाव में बदल सकती है। इस प्रकार, चयापचय मार्ग का नियमन सुनिश्चित होता है। चित्र में. 64, पहले और दूसरे सिलेंडर के बीच एक वाल्व के साथ एक संक्रमण ट्यूब एक नियामक एंजाइम को मॉडल करती है: वाल्व को ऊपर या नीचे करके, सिस्टम को एक अलग समग्र द्रव प्रवाह दर और अन्य तरल स्तर के साथ एक नई स्थिर स्थिति में स्थानांतरित किया जा सकता है। सिलेंडर.
शाखित चयापचय प्रणालियों में, नियामक एंजाइम आमतौर पर शाखा स्थल पर पहली प्रतिक्रियाओं को उत्प्रेरित करते हैं, जैसे कि प्रतिक्रियाएँ b -> c और b -> i चित्र में। 65. यह चयापचय प्रणाली की प्रत्येक शाखा के स्वतंत्र विनियमन की संभावना सुनिश्चित करता है।

कई चयापचय प्रतिक्रियाएं प्रतिवर्ती होती हैं; जीवित कोशिका में उनके प्रवाह की दिशा बाद की प्रतिक्रिया में उत्पाद की खपत या प्रतिक्रिया क्षेत्र से उत्पाद को हटाने से निर्धारित होती है, उदाहरण के लिए, उत्सर्जन द्वारा (चित्र 65)।
जब शरीर की स्थिति बदलती है (भोजन का सेवन, आराम से शारीरिक गतिविधि में संक्रमण, आदि), तो शरीर में मेटाबोलाइट्स की एकाग्रता बदल जाती है, यानी, एक नई स्थिर स्थिति स्थापित हो जाती है। हालाँकि, समान परिस्थितियों में, उदाहरण के लिए, रात की नींद के बाद (नाश्ते से पहले), वे सभी स्वस्थ लोगों में लगभग समान होते हैं; नियामक तंत्र की कार्रवाई के कारण, प्रत्येक मेटाबोलाइट की एकाग्रता उसके विशिष्ट स्तर पर बनी रहती है। इन सांद्रता के औसत मूल्य (उतार-चढ़ाव की सीमा का संकेत) मानक की विशेषताओं में से एक के रूप में कार्य करते हैं। बीमारियों में, मेटाबोलाइट्स की स्थिर-अवस्था सांद्रता बदल जाती है, और ये परिवर्तन अक्सर किसी विशेष बीमारी के लिए विशिष्ट होते हैं। रोगों के प्रयोगशाला निदान के लिए कई जैव रासायनिक विधियाँ इसी पर आधारित हैं।
चयापचय पथ में दो दिशाएँ होती हैं - उपचय और अपचय (चित्र 1)।
- एनाबॉलिक प्रतिक्रियाओं का उद्देश्य सरल पदार्थों को अधिक जटिल पदार्थों में परिवर्तित करना है जो कोशिका के संरचनात्मक और कार्यात्मक घटकों जैसे कोएंजाइम, हार्मोन, प्रोटीन, न्यूक्लिक एसिड इत्यादि का निर्माण करते हैं। ये प्रतिक्रियाएं मुख्य रूप से रिडक्टिव होती हैं, साथ में मुक्त रासायनिक ऊर्जा का व्यय भी होता है। (एंडर्जोनिक प्रतिक्रियाएं)। उनके लिए ऊर्जा का स्रोत अपचय की प्रक्रिया है। इसके अलावा, कोशिका (मोटर और अन्य) की कार्यात्मक गतिविधि सुनिश्चित करने के लिए कैटोबोलिक ऊर्जा का उपयोग किया जाता है।
- कैटोबोलिक परिवर्तन जटिल अणुओं के टूटने की प्रक्रिया है, जो भोजन के साथ प्राप्त होते हैं और कोशिका में शामिल होते हैं, सरल घटकों (कार्बन डाइऑक्साइड और पानी) में; ये प्रतिक्रियाएं आम तौर पर ऑक्सीडेटिव होती हैं और मुक्त ऊर्जा (एक्सर्जोनिक प्रतिक्रियाओं) की रिहाई के साथ होती हैं।
उभयचर मार्ग(दोहरा) - एक पथ जिसके दौरान कैटोबोलिक और एनाबॉलिक परिवर्तन संयुक्त होते हैं, अर्थात। एक यौगिक के नष्ट होने के साथ-साथ दूसरे यौगिक का संश्लेषण भी होता है।
उभयचर पथ पदार्थों के टर्मिनल, या अंतिम, ऑक्सीकरण प्रणाली से जुड़े होते हैं, जहां वे बड़ी मात्रा में ऊर्जा के निर्माण के साथ अंतिम उत्पादों (सीओ 2 और एच 2 ओ) में जलते हैं। इनके अलावा, चयापचय के अंतिम उत्पाद यूरिया और यूरिक एसिड होते हैं, जो अमीनो एसिड और न्यूक्लियोटाइड के आदान-प्रदान की विशेष प्रतिक्रियाओं में बनते हैं। एटीपी-एडीपी प्रणाली के माध्यम से चयापचय और चयापचयों के उभयचर चक्र के बीच संबंध को चित्र में योजनाबद्ध रूप से दिखाया गया है। 2.
एटीपी-एडीपी प्रणाली(एटीपी-एडीपी चक्र) एक चक्र है जिसमें एटीपी अणुओं का निरंतर निर्माण होता है, जिसकी हाइड्रोलिसिस ऊर्जा का उपयोग शरीर द्वारा विभिन्न प्रकार के कार्यों में किया जाता है।
यह एक चयापचय मार्ग है जिसमें अंतिम उत्पादों में से एक इस प्रक्रिया में शामिल यौगिकों में से एक के समान होता है (चित्र 3)।
एनाप्लेरोटिक मार्ग- चयापचय, जिसका अंतिम उत्पाद किसी भी चक्रीय मार्ग के मध्यवर्ती उत्पादों में से एक के समान है। चित्र के उदाहरण में एनाप्लेरोटिक मार्ग। 3 उत्पाद एक्स (एनाप्लेरोसिस - पुनःपूर्ति) के साथ चक्र की भरपाई करता है।
आइए इस उदाहरण का उपयोग करें. ब्रांड X, Y, Z की बसें शहर में चलती हैं। उनके मार्ग चित्र (चित्र 4) में दिखाए गए हैं।
इस उदाहरण के आधार पर, हम निम्नलिखित को परिभाषित करते हैं।
- एक विशेष चयापचय मार्ग केवल एक विशिष्ट यौगिक (उदाहरण के लिए, कार्बोहाइड्रेट, लिपिड या अमीनो एसिड) की विशेषता वाले परिवर्तनों का एक सेट है।
- सामान्य चयापचय मार्ग परिवर्तनों का एक समूह है जिसमें दो या दो से अधिक प्रकार के यौगिक शामिल होते हैं (उदाहरण के लिए, कार्बोहाइड्रेट और लिपिड या कार्बोहाइड्रेट, लिपिड और अमीनो एसिड)।
चयापचय मार्गों का स्थानीयकरण
यूकेरियोटिक व्यक्तियों में कैटोबोलिक और एनाबॉलिक मार्ग कोशिका में उनके स्थानीयकरण में भिन्न होते हैं (तालिका 22.)।
यह विभाजन एंजाइम प्रणालियों को कोशिका के कुछ क्षेत्रों तक सीमित रखने (कम्पार्टमेंटलाइज़ेशन) के कारण होता है, जो इंट्रासेल्युलर कार्यों के पृथक्करण और एकीकरण, साथ ही उचित नियंत्रण दोनों को सुनिश्चित करता है।
वर्तमान में, इलेक्ट्रॉन सूक्ष्म और हिस्टोकेमिकल अध्ययनों के साथ-साथ विभेदक सेंट्रीफ्यूजेशन की विधि के लिए धन्यवाद, एंजाइमों के इंट्रासेल्युलर स्थानीयकरण को निर्धारित करने में महत्वपूर्ण प्रगति हुई है। जैसे कि चित्र से देखा जा सकता है। 74, एक कोशिका में आप एक सेलुलर, या प्लाज्मा, झिल्ली, नाभिक, माइटोकॉन्ड्रिया, लाइसोसोम, राइबोसोम, नलिकाओं और पुटिकाओं की एक प्रणाली पा सकते हैं - एंडोप्लाज्मिक रेटिकुलम, लैमेलर कॉम्प्लेक्स, विभिन्न रिक्तिकाएं, इंट्रासेल्युलर समावेशन, आदि। का मुख्य अविभाज्य भाग द्रव्यमान के संदर्भ में कोशिका साइटोप्लाज्म हाइलोप्लाज्म (या साइटोसोल) है।
यह स्थापित किया गया है कि आरएनए पोलीमरेज़, यानी, एंजाइम जो एमआरएनए के गठन को उत्प्रेरित करते हैं, नाभिक में स्थानीयकृत होते हैं (अधिक सटीक रूप से, न्यूक्लियोलस में)। नाभिक में डीएनए प्रतिकृति और कुछ अन्य की प्रक्रिया में शामिल एंजाइम होते हैं (तालिका 23)।

| तालिका 23. कोशिका के अंदर कुछ एंजाइमों का स्थानीयकरण | |
| साइटोसोल | ग्लाइकोलाइटिक एंजाइम पेन्टोज़ पाथवे एंजाइम अमीनो एसिड सक्रियण एंजाइम फैटी एसिड संश्लेषण एंजाइम phosphorylase ग्लाइकोजन सिंथेज़ |
| माइटोकॉन्ड्रिया | पाइरूवेट डिहाइड्रोजनेज कॉम्प्लेक्स क्रेब्स चक्र एंजाइम फैटी एसिड ऑक्सीकरण चक्र के एंजाइम जैविक ऑक्सीकरण और ऑक्सीडेटिव फास्फारिलीकरण के एंजाइम |
| लाइसोसोम | एसिड हाइड्रॉलिसिस |
| माइक्रोसोमल अंश | प्रोटीन संश्लेषण के राइबोसोमल एंजाइम फॉस्फोलिपिड्स, ट्राइग्लिसराइड्स के संश्लेषण के लिए एंजाइम, साथ ही कोलेस्ट्रॉल के संश्लेषण में शामिल कई एंजाइम हाइड्रॉक्सिलेज़ |
| प्लाज्मा झिल्ली | एडिनाइलेट साइक्लेज़, Na+-K+-निर्भर ATPase |
| मुख्य | डीएनए प्रतिकृति आरएनए पोलीमरेज़ एनएडी सिंथेटेज़ की प्रक्रिया में शामिल एंजाइम |
एंजाइमों और कोशिका संरचनाओं के बीच संबंध:
- माइटोकॉन्ड्रिया। जैविक ऑक्सीकरण (ऊतक श्वसन) और ऑक्सीडेटिव फास्फारिलीकरण की श्रृंखला के एंजाइम, साथ ही पाइरूवेट डिहाइड्रोजनेज कॉम्प्लेक्स के एंजाइम, ट्राईकारबॉक्सिलिक एसिड चक्र, यूरिया संश्लेषण, फैटी एसिड ऑक्सीकरण, आदि माइटोकॉन्ड्रिया से जुड़े हुए हैं।
- लाइसोसोम। लाइसोसोम में मुख्य रूप से 5 के क्षेत्र में इष्टतम पीएच के साथ हाइड्रोलाइटिक एंजाइम होते हैं। यह एंजाइमों की हाइड्रोलाइटिक प्रकृति के कारण है कि इन कणों को लाइसोसोम कहा जाता है।
- राइबोसोम. प्रोटीन संश्लेषण के एंजाइम राइबोसोम में स्थानीयकृत होते हैं; इन कणों में, एमआरएनए का अनुवाद किया जाता है और अमीनो एसिड प्रोटीन अणुओं को बनाने के लिए पॉलीपेप्टाइड श्रृंखलाओं में जुड़े होते हैं।
- अन्तः प्रदव्ययी जलिका। एंडोप्लाज्मिक रेटिकुलम में लिपिड संश्लेषण के लिए एंजाइम होते हैं, साथ ही हाइड्रॉक्सिलेशन प्रतिक्रियाओं में शामिल एंजाइम भी होते हैं।
- प्लाज्मा झिल्ली। ATPase, जो Na+ और K+ का परिवहन करता है, एडिनाइलेट साइक्लेज और कई अन्य एंजाइम मुख्य रूप से प्लाज्मा झिल्ली से जुड़े होते हैं।
- साइटोसोल. साइटोसोल (हाइलोप्लाज्म) में ग्लाइकोलाइसिस के एंजाइम, पेंटोस चक्र, फैटी एसिड और मोनोन्यूक्लियोटाइड का संश्लेषण, अमीनो एसिड की सक्रियता, साथ ही ग्लूकोनियोजेनेसिस के कई एंजाइम होते हैं।
तालिका में 23 विभिन्न उपकोशिकीय संरचनाओं में सबसे महत्वपूर्ण एंजाइमों और व्यक्तिगत चयापचय चरणों के स्थानीयकरण पर डेटा का सारांश देता है।
मल्टीएंजाइम सिस्टम को ऑर्गेनेल की संरचना में इस तरह से स्थानीयकृत किया जाता है कि प्रत्येक एंजाइम प्रतिक्रियाओं के दिए गए अनुक्रम में अगले एंजाइम के करीब स्थित होता है। इसके कारण, प्रतिक्रिया मध्यवर्ती के प्रसार के लिए आवश्यक समय कम हो जाता है, और प्रतिक्रियाओं का पूरा क्रम समय और स्थान में सख्ती से समन्वित होता है। यह सच है, उदाहरण के लिए, पाइरुविक एसिड और फैटी एसिड के ऑक्सीकरण में शामिल एंजाइमों के लिए, प्रोटीन संश्लेषण में, साथ ही इलेक्ट्रॉन स्थानांतरण और ऑक्सीडेटिव फास्फारिलीकरण के एंजाइमों के लिए।
कंपार्टमेंटलाइज़ेशन यह भी सुनिश्चित करता है कि रासायनिक रूप से असंगत प्रतिक्रियाएं एक ही समय में होती हैं, यानी। अपचय और उपचय के मार्गों की स्वतंत्रता। इस प्रकार, एक कोशिका में, लंबी श्रृंखला वाले फैटी एसिड का एसिटाइल-सीओए चरण में ऑक्सीकरण और विपरीत प्रक्रिया, एसिटाइल-सीओए से फैटी एसिड का संश्लेषण, एक साथ हो सकता है। ये रासायनिक रूप से असंगत प्रक्रियाएं कोशिका के विभिन्न भागों में होती हैं: माइटोकॉन्ड्रिया में फैटी एसिड का ऑक्सीकरण, और माइटोकॉन्ड्रिया के बाहर हाइलोप्लाज्म में उनका संश्लेषण। यदि ये रास्ते मेल खाते हैं और केवल प्रक्रिया की दिशा में भिन्न होते हैं, तो विनिमय में तथाकथित बेकार, या व्यर्थ, चक्र उत्पन्न होंगे। पैथोलॉजी में ऐसे चक्र होते हैं, जब मेटाबोलाइट्स का बेकार संचलन संभव होता है।
पौधों, जानवरों और सूक्ष्मजीवों के विभिन्न वर्गों में चयापचय के व्यक्तिगत लिंक की व्याख्या से जीवित प्रकृति में जैव रासायनिक परिवर्तनों के मार्गों की एक मौलिक समानता का पता चलता है।
चयापचय विनियमन के बुनियादी प्रावधान
सेलुलर और उपसेलुलर स्तर पर चयापचय का विनियमन किया जाता है
- एंजाइमों के संश्लेषण और उत्प्रेरक गतिविधि को विनियमित करके।
ऐसे नियामक तंत्रों में शामिल हैं
- चयापचय पथ के अंतिम उत्पादों द्वारा एंजाइम संश्लेषण का दमन,
- सबस्ट्रेट्स द्वारा एक या अधिक एंजाइमों के संश्लेषण को प्रेरित करना,
- पहले से मौजूद एंजाइम अणुओं की गतिविधि का मॉड्यूलेशन,
- कोशिका में चयापचयों के प्रवेश की दर का विनियमन। यहां अग्रणी भूमिका प्रोटोप्लाज्म और नाभिक, माइटोकॉन्ड्रिया, लाइसोसोम और इसमें स्थित अन्य उपकोशिकीय जीवों के आसपास की जैविक झिल्लियों द्वारा निभाई जाती है।
- हार्मोन के संश्लेषण और गतिविधि को विनियमित करके। इस प्रकार, प्रोटीन चयापचय थायरॉयड हार्मोन - थायरोक्सिन से प्रभावित होता है; वसा चयापचय अग्न्याशय और थायरॉयड ग्रंथियों, अधिवृक्क ग्रंथियों और पिट्यूटरी ग्रंथि के हार्मोन से प्रभावित होता है; कार्बोहाइड्रेट चयापचय अग्न्याशय (इंसुलिन) और अधिवृक्क ग्रंथियों के हार्मोन से प्रभावित होता है ( एड्रेनालाईन)। हार्मोन की क्रिया के तंत्र में एक विशेष भूमिका चक्रीय न्यूक्लियोटाइड्स (सीएमपी और सीजीएमपी) की होती है।
जानवरों और मनुष्यों में, चयापचय का हार्मोनल विनियमन तंत्रिका तंत्र की समन्वय गतिविधि से निकटता से संबंधित है। कार्बोहाइड्रेट चयापचय पर तंत्रिका तंत्र के प्रभाव का एक उदाहरण क्लाउड बर्नार्ड का तथाकथित चीनी इंजेक्शन है, जो हाइपरग्लेसेमिया और ग्लाइकोसुरिया की ओर जाता है।
- चयापचय एकीकरण की प्रक्रियाओं में सबसे महत्वपूर्ण भूमिका सेरेब्रल कॉर्टेक्स की होती है। जैसा कि आई. पी. पावलोव ने बताया: "किसी पशु जीव का तंत्रिका तंत्र जितना अधिक परिपूर्ण होता है, वह जितना अधिक केंद्रीकृत होता है, उसका विभाग उतना ही अधिक होता है और जीव की सभी गतिविधियों का प्रबंधक और वितरक होता है... इस उच्च विभाग में शामिल है शरीर में घटित होने वाली सभी घटनाएँ इसके अधिकार क्षेत्र में आती हैं।
इस प्रकार, एक विशेष संयोजन, सख्त समन्वय और चयापचय प्रतिक्रियाओं की दर मिलकर एक प्रणाली बनाती है जो प्रतिक्रिया तंत्र (सकारात्मक या नकारात्मक) के गुणों को प्रकट करती है।

मध्यवर्ती चयापचय का अध्ययन करने की विधियाँ
चयापचय का अध्ययन करने के लिए दो दृष्टिकोणों का उपयोग किया जाता है:
- संपूर्ण जीव पर अध्ययन (विवो प्रयोगों में) [दिखाओ]
इस सदी की शुरुआत में किए गए पूरे जीव पर शोध का एक उत्कृष्ट उदाहरण नूप प्रयोग है। उन्होंने शरीर में फैटी एसिड के टूटने के तरीके का अध्ययन किया। ऐसा करने के लिए, नूप ने कुत्तों को सम (I) और विषम (II) संख्या में कार्बन परमाणुओं के साथ विभिन्न फैटी एसिड खिलाए, जिसमें मिथाइल समूह में एक हाइड्रोजन परमाणु को फिनाइल रेडिकल C6H5 द्वारा प्रतिस्थापित किया गया था:
पहले मामले में, फेनिलएसेटिक एसिड C 6 H 5 -CH 2 -COOH हमेशा कुत्तों के मूत्र में उत्सर्जित होता था, और दूसरे में - बेंजोइक एसिड C 6 H 5 -COOH। इन परिणामों के आधार पर, नूप ने निष्कर्ष निकाला कि शरीर में फैटी एसिड का टूटना कार्बोक्सिल अंत से शुरू होने वाले दो-कार्बन टुकड़ों के क्रमिक उन्मूलन के माध्यम से होता है:
सीएच 3 -सीएच 2 -|-सीएच 2 -सीएच 2 -|-सीएच 2 -सीएच 2 -|-सीएच 2 -सीएच 2 -|-सीएच 2 - सीओओएच
इस निष्कर्ष की बाद में अन्य तरीकों से पुष्टि की गई।
अनिवार्य रूप से, इन अध्ययनों में, नूप ने अणुओं को लेबल करने की विधि का उपयोग किया: उन्होंने एक फिनाइल रेडिकल का उपयोग किया, जो एक लेबल के रूप में शरीर में परिवर्तन से नहीं गुजरता है। XX सदी के 40 के दशक के आसपास शुरू। उन पदार्थों का उपयोग व्यापक हो गया है जिनके अणुओं में रेडियोधर्मी या तत्वों के भारी समस्थानिक होते हैं। उदाहरण के लिए, प्रायोगिक जानवरों को रेडियोधर्मी कार्बन (14 सी) युक्त विभिन्न यौगिक खिलाकर, यह स्थापित किया गया कि कोलेस्ट्रॉल अणु में सभी कार्बन परमाणु एसीटेट के कार्बन परमाणुओं से आते हैं:

आमतौर पर, या तो तत्वों के स्थिर आइसोटोप जो शरीर में आमतौर पर पाए जाने वाले तत्वों से द्रव्यमान में भिन्न होते हैं (आमतौर पर भारी आइसोटोप) या रेडियोधर्मी आइसोटोप का उपयोग किया जाता है। स्थिर आइसोटोप में से, सबसे अधिक इस्तेमाल किए जाने वाले आइसोटोप 2 (ड्यूटेरियम, 2 एच) के द्रव्यमान के साथ हाइड्रोजन, 15 (15 एन) के द्रव्यमान के साथ नाइट्रोजन, 13 (13 सी) के द्रव्यमान के साथ कार्बन और ऑक्सीजन हैं। 18 (18 सी) का. रेडियोधर्मी समस्थानिकों में से, हाइड्रोजन (ट्रिटियम, 3 एच), फॉस्फोरस (32 पी और 33 पी), कार्बन (14 सी), सल्फर (35 एस), आयोडीन (131 आई), लौह (59 Fe), सोडियम के समस्थानिक हैं। (54 Na) का प्रयोग किया जाता है ) इत्यादि।
एक स्थिर या रेडियोधर्मी आइसोटोप का उपयोग करके अध्ययन के तहत यौगिक के एक अणु को लेबल करने और इसे शरीर में पेश करने के बाद, लेबल किए गए परमाणुओं या रासायनिक समूहों को निर्धारित किया जाता है और, उन्हें कुछ यौगिकों में खोजकर, तरीकों के बारे में एक निष्कर्ष निकाला जाता है। जिसे लेबल किया हुआ पदार्थ शरीर में परिवर्तित कर देता है। आइसोटोप लेबल का उपयोग करके, आप शरीर में किसी पदार्थ के निवास समय को भी निर्धारित कर सकते हैं, जो एक निश्चित अनुमान के अनुसार, जैविक आधे जीवन की विशेषता बताता है, यानी, वह समय जिसके दौरान आइसोटोप या लेबल यौगिक की मात्रा आधी हो जाती है, या व्यक्तिगत कोशिकाओं की झिल्लियों की पारगम्यता के संबंध में सटीक जानकारी प्राप्त करें। आइसोटोप का उपयोग यह निर्धारित करने के लिए भी किया जाता है कि क्या कोई दिया गया पदार्थ किसी अन्य यौगिक का अग्रदूत या टूटने वाला उत्पाद है, और ऊतक कारोबार की दर निर्धारित करने के लिए भी उपयोग किया जाता है। अंत में, जब कई चयापचय मार्ग मौजूद होते हैं, तो यह निर्धारित करना संभव है कि कौन सा प्रमुख है।
संपूर्ण जीवों पर अध्ययन में, शरीर की पोषण संबंधी आवश्यकताओं का भी अध्ययन किया जाता है: यदि आहार से किसी पदार्थ के उन्मूलन से शरीर की वृद्धि और विकास या शारीरिक कार्यों में व्यवधान होता है, तो यह पदार्थ एक आवश्यक पोषण कारक है। पोषक तत्वों की आवश्यक मात्रा इसी प्रकार निर्धारित की जाती है।
- और शरीर के अलग-अलग हिस्सों पर अध्ययन - विश्लेषणात्मक-विघटनकारी तरीके (इन विट्रो प्रयोग, यानी शरीर के बाहर, एक टेस्ट ट्यूब या अन्य प्रयोगशाला वाहिकाओं में)। इन विधियों का सिद्धांत व्यक्तिगत प्रक्रियाओं को अलग करने के लिए एक जटिल जैविक प्रणाली का क्रमिक सरलीकरण, या बल्कि विघटन है। यदि हम इन विधियों को अवरोही क्रम में, अर्थात् अधिक जटिल से सरल प्रणालियों की ओर विचार करें, तो इन्हें निम्नलिखित क्रम में व्यवस्थित किया जा सकता है:
- व्यक्तिगत अंगों को हटाना [दिखाओ]
जब अंगों को हटा दिया जाता है, तो अध्ययन की दो वस्तुएं होती हैं: एक जीव जिसमें कोई अंग नहीं निकाला जाता है और एक अलग अंग होता है।
पृथक अंग. यदि किसी पदार्थ का घोल किसी पृथक अंग की धमनी में इंजेक्ट किया जाता है और नस से बहने वाले तरल में पदार्थों का विश्लेषण किया जाता है, तो यह स्थापित करना संभव है कि यह पदार्थ अंग में क्या परिवर्तन करता है। उदाहरण के लिए, इस प्रकार यह पाया गया कि यकृत कीटोन बॉडी और यूरिया के निर्माण के मुख्य स्थल के रूप में कार्य करता है।
इसी तरह के प्रयोग अंगों को शरीर से अलग किए बिना (धमनीशिरा अंतर विधि) पर किए जा सकते हैं: इन मामलों में, विश्लेषण के लिए रक्त अंग की धमनी और शिरा में डाली गई नलिका का उपयोग करके या एक सिरिंज का उपयोग करके लिया जाता है। इस प्रकार, उदाहरण के लिए, यह स्थापित किया जा सकता है कि कामकाजी मांसपेशियों से बहने वाले रक्त में, लैक्टिक एसिड की एकाग्रता बढ़ जाती है, और यकृत के माध्यम से बहने पर, रक्त लैक्टिक एसिड से मुक्त हो जाता है।
- ऊतक अनुभाग विधि [दिखाओ]
अनुभाग ऊतक के पतले टुकड़े होते हैं जो माइक्रोटोम या बस एक रेजर ब्लेड का उपयोग करके बनाए जाते हैं। अनुभागों को पोषक तत्वों (ग्लूकोज या अन्य) और एक पदार्थ युक्त समाधान में ऊष्मायन किया जाता है जिसका किसी दिए गए प्रकार की कोशिकाओं में परिवर्तन निर्धारित करना आवश्यक होता है। ऊष्मायन के बाद, ऊष्मायन तरल में परीक्षण पदार्थ के चयापचय उत्पादों का विश्लेषण किया जाता है।
ऊतक अनुभागों की विधि पहली बार 20 के दशक की शुरुआत में वारबर्ग द्वारा प्रस्तावित की गई थी। इस तकनीक का उपयोग करके, ऊतक श्वसन (ऊतकों द्वारा ऑक्सीजन की खपत और कार्बन डाइऑक्साइड रिलीज) का अध्ययन करना संभव है। ऊतक वर्गों के उपयोग के मामले में चयापचय के अध्ययन में एक महत्वपूर्ण सीमा कोशिका झिल्ली है, जो अक्सर कोशिका की सामग्री और "पोषक तत्व" समाधान के बीच बाधाओं के रूप में कार्य करती है।
- समरूप और उपकोशिकीय अंश [दिखाओ]

होमोजेनेट्स कोशिका-मुक्त तैयारी हैं। वे कपड़े को रेत से रगड़कर या विशेष उपकरणों - होमोजेनाइज़र (चित्र 66) में कोशिका झिल्ली को नष्ट करके प्राप्त किए जाते हैं। होमोजेनेट्स में अतिरिक्त सब्सट्रेट्स और एंजाइमों के बीच कोई अभेद्यता बाधा नहीं होती है।
कोशिका झिल्लियों का विनाश कोशिका सामग्री और जोड़े गए यौगिकों के बीच सीधे संपर्क की अनुमति देता है। इससे यह स्थापित करना संभव हो जाता है कि अध्ययन के तहत प्रक्रिया के लिए कौन से एंजाइम, कोएंजाइम और सब्सट्रेट महत्वपूर्ण हैं।
समरूपों का विखंडन.होमोजेनेट से, उपकोशिकीय कणों को अलग किया जा सकता है, दोनों सुपरमॉलेक्यूलर (सेलुलर ऑर्गेनेल) और व्यक्तिगत यौगिक (एंजाइम और अन्य प्रोटीन, न्यूक्लिक एसिड, मेटाबोलाइट्स)। उदाहरण के लिए, विभेदक सेंट्रीफ्यूजेशन का उपयोग करके, आप नाभिक, माइटोकॉन्ड्रिया और माइक्रोसोम के अंश प्राप्त कर सकते हैं (माइक्रोसोम एंडोप्लाज्मिक रेटिकुलम के टुकड़े हैं)। ये अंगक आकार और घनत्व में भिन्न होते हैं और इसलिए विभिन्न अपकेंद्रित्र गति पर अवसादित होते हैं। पृथक अंगों के उपयोग से उनसे जुड़ी चयापचय प्रक्रियाओं का अध्ययन करना संभव हो जाता है। उदाहरण के लिए, पृथक राइबोसोम का उपयोग प्रोटीन संश्लेषण के मार्गों और तंत्रों का अध्ययन करने के लिए किया जाता है, और माइटोकॉन्ड्रिया का उपयोग क्रेब्स चक्र या श्वसन एंजाइमों की श्रृंखला की ऑक्सीडेटिव प्रतिक्रियाओं का अध्ययन करने के लिए किया जाता है।
माइक्रोसोम के अवसादन के बाद, कोशिका के घुलनशील घटक सतह पर तैरने वाले - घुलनशील प्रोटीन, मेटाबोलाइट्स में रहते हैं। इनमें से प्रत्येक अंश को उनके घटक घटकों को अलग करते हुए, अलग-अलग तरीकों का उपयोग करके आगे विभाजित किया जा सकता है। पृथक घटकों से, जैव रासायनिक प्रणालियों का पुनर्निर्माण करना संभव है, उदाहरण के लिए, एक सरल "एंजाइम + सब्सट्रेट" प्रणाली और प्रोटीन और न्यूक्लिक एसिड के संश्लेषण के लिए जटिल प्रणाली।
- एंजाइम, कोएंजाइम और अन्य प्रतिक्रिया घटकों का उपयोग करके इन विट्रो में एक एंजाइम प्रणाली का आंशिक या पूर्ण पुनर्निर्माण [दिखाओ]
अत्यधिक शुद्ध एंजाइमों और कोएंजाइमों को एकीकृत करने के लिए उपयोग किया जाता है. उदाहरण के लिए, इस विधि का उपयोग करके एक किण्वन प्रणाली को पूरी तरह से पुन: उत्पन्न करना संभव हो गया जिसमें खमीर किण्वन की सभी आवश्यक विशेषताएं हैं।
- व्यक्तिगत अंगों को हटाना [दिखाओ]
निःसंदेह, ये विधियाँ केवल अंतिम लक्ष्य को प्राप्त करने के लिए आवश्यक कदम के रूप में मूल्यवान हैं - पूरे जीव की कार्यप्रणाली को समझना।
मानव जैव रसायन के अध्ययन की विशेषताएं
पृथ्वी पर निवास करने वाले विभिन्न जीवों की आणविक प्रक्रियाओं में दूरगामी समानताएँ हैं। मैट्रिक्स बायोसिंथेसिस, ऊर्जा परिवर्तन के तंत्र और पदार्थों के चयापचय परिवर्तनों के मुख्य मार्ग जैसी मूलभूत प्रक्रियाएं बैक्टीरिया से लेकर उच्च जानवरों तक के जीवों में लगभग समान हैं। इसलिए, ई. कोलाई के साथ किए गए अध्ययनों के कई परिणाम मनुष्यों पर लागू होते प्रतीत होते हैं। प्रजातियों की फ़ाइलोजेनेटिक संबद्धता जितनी अधिक होगी, उनकी आणविक प्रक्रियाएँ उतनी ही अधिक सामान्य होंगी।
मानव जैव रसायन के बारे में अधिकांश ज्ञान इस प्रकार प्राप्त किया जाता है: अन्य जानवरों में ज्ञात जैव रासायनिक प्रक्रियाओं के आधार पर, मानव शरीर में इस प्रक्रिया के सबसे संभावित संस्करण के बारे में एक परिकल्पना बनाई जाती है, और फिर परिकल्पना का प्रत्यक्ष अध्ययन द्वारा परीक्षण किया जाता है। मानव कोशिकाएँ और ऊतक। यह दृष्टिकोण मनुष्यों से प्राप्त जैविक सामग्री की थोड़ी मात्रा पर शोध करना संभव बनाता है। सबसे अधिक उपयोग किए जाने वाले ऊतक सर्जिकल ऑपरेशन के दौरान निकाले गए ऊतक, रक्त कोशिकाएं (एरिथ्रोसाइट्स और ल्यूकोसाइट्स), साथ ही इन विट्रो कल्चर में विकसित मानव ऊतक कोशिकाएं हैं।
वंशानुगत मानव रोगों का अध्ययन, उनके उपचार के प्रभावी तरीकों के विकास के लिए आवश्यक है, साथ ही मानव शरीर में जैव रासायनिक प्रक्रियाओं के बारे में बहुत सारी जानकारी प्रदान करता है। विशेष रूप से, एंजाइम का जन्मजात दोष इसके सब्सट्रेट को शरीर में जमा होने का कारण बनता है; ऐसे चयापचय संबंधी विकारों का अध्ययन करते समय, कभी-कभी नए एंजाइम और प्रतिक्रियाएं खोजी जाती हैं, जो मात्रात्मक रूप से महत्वहीन होती हैं (यही कारण है कि मानक का अध्ययन करते समय उन पर ध्यान नहीं दिया गया), जो, हालांकि, महत्वपूर्ण महत्व रखते हैं।
प्रोटीन उत्प्रेरक के रूप में मॉड्यूलर इकाई 1 एंजाइम
सीखने के उद्देश्य सक्षम हों:
1. एंजाइमों के गुणों और एंजाइमी उत्प्रेरण की विशेषताओं को उनकी प्रोटीन प्रकृति द्वारा समझाइए।
2. कोएंजाइम के संश्लेषण के लिए सब्सट्रेट के रूप में मानव पोषण में विटामिन की भूमिका का आकलन करें।
3. निर्धारित करें कि क्या एंजाइम उनके नामकरण के अनुसार एक निश्चित वर्ग और उपवर्ग से संबंधित हैं।
4. एंजाइम गतिविधि की गणना करें और सब्सट्रेट के लिए एंजाइम की आत्मीयता का मूल्यांकन करें।
जानना:
1. प्रोटीन उत्प्रेरक के रूप में एंजाइमों की संरचनात्मक विशेषताएं।
2. एंजाइम विशिष्टता के प्रकार.
3. एंजाइमों के वर्गीकरण की मूल बातें, एंजाइमों के वर्ग, एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं के उदाहरण।
4. कोएंजाइम और सहकारकों की संरचना और एंजाइमी उत्प्रेरण में उनकी भूमिका, इस प्रक्रिया में विटामिन की भूमिका।
5. एंजाइमेटिक कैनेटीक्स की मूल बातें।
6. एंजाइम गतिविधि की इकाइयाँ और उनके निर्धारण की विधियाँ।
विषय 2.1. प्रोटीन के रूप में एंजाइम के गुण
उत्प्रेरक
1. एन्जाइम प्रोटीन उत्प्रेरक होते हैंजीवित कोशिकाओं में रासायनिक प्रतिक्रियाओं को तेज करना। उनमें प्रोटीन के सभी गुण और कुछ संरचनात्मक विशेषताएं हैं जो उनके उत्प्रेरक गुणों को निर्धारित करती हैं। इसके अलावा, एंजाइम उत्प्रेरण के सामान्य नियमों का पालन करते हैं और उनमें गैर-जैविक उत्प्रेरकों की विशेषता वाले गुण होते हैं: वे ऊर्जावान रूप से संभावित प्रतिक्रियाओं को तेज करते हैं, रासायनिक प्रणाली की ऊर्जा को स्थिर रखते हैं, और प्रतिक्रिया प्रक्रिया के दौरान उपभोग नहीं किए जाते हैं।
2. एंजाइमों की विशेषता है:
विशिष्टता.एक एंजाइम का जैविक कार्य, किसी भी प्रोटीन की तरह, इसकी संरचना में एक सक्रिय केंद्र की उपस्थिति से निर्धारित होता है जिसके साथ एक विशिष्ट लिगैंड संपर्क करता है। एंजाइम की सक्रिय साइट के साथ संपर्क करने वाले लिगैंड को कहा जाता है सब्सट्रेट.
उत्प्रेरक दक्षता.अधिकांश एंजाइम-उत्प्रेरित प्रतिक्रियाएं अत्यधिक कुशल होती हैं, जो गैर-उत्प्रेरित प्रतिक्रियाओं की तुलना में 10 8 -10 14 गुना तेजी से होती हैं। प्रत्येक एंजाइम अणु सब्सट्रेट के 100 से 1000 अणुओं को प्रति सेकंड एक उत्पाद में बदलने में सक्षम है।
गठनात्मक दायित्व.एक एंजाइम की उत्प्रेरक दक्षता, किसी भी प्रोटीन अणु की तरह, इसकी संरचना पर और विशेष रूप से, सक्रिय केंद्र की संरचना पर निर्भर करती है। कोशिकाओं में ऐसे पदार्थ होते हैं जो कुछ के टूटने और अन्य कमजोर बंधनों के निर्माण के कारण एंजाइम अणु की संरचना में मामूली बदलाव ला सकते हैं; इससे एंजाइम गतिविधि में वृद्धि या कमी हो सकती है।
3. एंजाइम गतिविधि को नियंत्रित किया जा सकता है।एक नियम के रूप में, कोशिका में एंजाइमों की क्रिया को सख्ती से आदेश दिया जाता है: एक एंजाइमेटिक प्रतिक्रिया का उत्पाद दूसरे का सब्सट्रेट होता है; इस प्रकार गठन चयापचय मार्ग।लगभग हर चयापचय पथ के कई एंजाइमों में से, प्रमुख हैं, या नियामक,एंजाइम जिनकी गतिविधि चयापचय पथ के अंतिम उत्पाद के लिए कोशिका की आवश्यकता के आधार पर भिन्न हो सकती है।
4. एंजाइमी प्रतिक्रियाओं के लिए इष्टतम स्थितियाँ:तापमान 37-38 डिग्री सेल्सियस; सामान्य वायुमंडलीय दबाव, पीएच 6.9-7.7, अधिकांश ऊतकों की विशेषता। इसके विपरीत, कुशल रासायनिक उत्प्रेरण के लिए अक्सर उच्च तापमान और दबाव, साथ ही अत्यधिक पीएच मान की आवश्यकता होती है।
विषय 2.2. सक्रिय केंद्र: एंजाइम क्रिया की विशिष्टता
1. एंजाइमों की सक्रिय साइट- यह एक प्रोटीन अणु का एक निश्चित खंड है जो सब्सट्रेट से पूरक रूप से जुड़ने और इसके उत्प्रेरक परिवर्तन को सुनिश्चित करने में सक्षम है। सक्रिय केंद्र की संरचना अमीनो एसिड रेडिकल्स द्वारा बनाई जाती है, ठीक वैसे ही जैसे किसी प्रोटीन के सक्रिय केंद्र के मामले में होती है। एंजाइम के सक्रिय केंद्र में अमीनो एसिड अवशेष होते हैं, जिनमें से कार्यात्मक समूह सब्सट्रेट (बाध्यकारी साइट) के पूरक बंधन को सुनिश्चित करते हैं, और अमीनो एसिड अवशेष, जिनमें से कार्यात्मक समूह सब्सट्रेट (उत्प्रेरक साइट) के रासायनिक परिवर्तन को पूरा करते हैं ( चित्र 2.1).
चावल। 2.1. एंजाइम के सक्रिय केंद्र की संरचना की योजना।
एंजाइम का सक्रिय केंद्र बनाने वाले अमीनो एसिड को लाल रंग में चिह्नित किया गया है: 1 - बाइंडिंग साइट; 2 - उत्प्रेरक अनुभाग
2. विशेषता- एंजाइमों का सबसे महत्वपूर्ण गुण जो एंजाइमों के जैविक महत्व को निर्धारित करता है। अंतर करना सब्सट्रेटऔर एंजाइम की उत्प्रेरक विशिष्टता,जो सक्रिय केंद्र की संरचना से निर्धारित होते हैं।
3. अंतर्गत सब्सट्रेट विशिष्टताप्रत्येक एंजाइम की केवल एक या कई विशिष्ट सब्सट्रेट्स के साथ बातचीत करने की क्षमता को संदर्भित करता है।
वहाँ हैं:
- पूर्ण सब्सट्रेट विशिष्टता,यदि एंजाइम की सक्रिय साइट केवल एक सब्सट्रेट की पूरक है;
- समूह सब्सट्रेट विशिष्टता,यदि एंजाइम संरचनात्मक रूप से समान सब्सट्रेट्स की एक छोटी मात्रा (समूह) के साथ एक ही प्रकार की प्रतिक्रिया उत्प्रेरित करता है;
- त्रिविम विशिष्टता,यदि एंजाइम सब्सट्रेट के मौजूदा स्टीरियोइसोमर्स में से केवल एक के लिए पूर्ण विशिष्टता प्रदर्शित करता है।
4. उत्प्रेरक विशिष्टताया सब्सट्रेट रूपांतरण मार्ग की विशिष्टता, विभिन्न एंजाइमों की कार्रवाई के तहत एक ही सब्सट्रेट के परिवर्तन को सुनिश्चित करती है। यह संबंधित एंजाइमों के सक्रिय केंद्रों की उत्प्रेरक साइटों की संरचना द्वारा सुनिश्चित किया जाता है। उदाहरण के लिए, एक अणु
मानव यकृत कोशिकाओं में ग्लूकोज-6-फॉस्फेट चार अलग-अलग एंजाइमों का एक सब्सट्रेट है: फॉस्फोग्लुकोम्यूटेज, ग्लूकोज-6-फॉस्फेट फॉस्फेट, फॉस्फोग्लुकोइसोमेरेज़ और ग्लूकोज-6-फॉस्फेट डिहाइड्रोजनेज। हालाँकि, इन एंजाइमों की उत्प्रेरक साइटों की संरचनात्मक विशेषताओं के कारण, ग्लूकोज-6-फॉस्फेट के विभिन्न परिवर्तन चार अलग-अलग उत्पादों के निर्माण के साथ होते हैं (चित्र 2.2)।
 चावल। 2.2. ग्लूकोज-6-फॉस्फेट के रूपांतरण के लिए उत्प्रेरक मार्ग।
चावल। 2.2. ग्लूकोज-6-फॉस्फेट के रूपांतरण के लिए उत्प्रेरक मार्ग।
सब्सट्रेट रूपांतरण मार्ग की विशिष्टता विभिन्न एंजाइमों की कार्रवाई के तहत एक ही सब्सट्रेट को बदलना संभव बनाती है। ग्लूकोज-6-फॉस्फेट अणु विभिन्न एंजाइमों के लिए एक सब्सट्रेट है, जो विभिन्न उत्पादों के निर्माण की ओर ले जाता है
विषय 2.3. एंजाइम क्रिया का तंत्र
1. उत्प्रेरण के दौरान, एंजाइम-सब्सट्रेट (ईएस) कॉम्प्लेक्स में एंजाइम की सक्रिय साइट से जुड़ा सब्सट्रेट, एक उत्पाद में रासायनिक रूपांतरण से गुजरता है, जिसे बाद में जारी किया जाता है। उत्प्रेरण प्रक्रिया को योजनाबद्ध रूप से निम्नानुसार दर्शाया जा सकता है:
एंजाइमी उत्प्रेरण की प्रक्रिया को चरणों में विभाजित किया जा सकता है (चित्र 2.3)। चरण I में, सब्सट्रेट एंजाइम के सक्रिय केंद्र के क्षेत्र में पहुंचता है और उन्मुख होता है। परिणामस्वरूप, चरण II पर प्रेरित पत्राचार[सब्सट्रेट (एस) और एंजाइम के सक्रिय केंद्र की संरचना में परिवर्तन] एक एंजाइम-सब्सट्रेट कॉम्प्लेक्स (ईएस) बनता है। चरण III में, सब्सट्रेट में बंधन अस्थिर हो जाते हैं और एक अस्थिर एंजाइम-उत्पाद कॉम्प्लेक्स (ईपी) बनता है। चरण IV में, कॉम्प्लेक्स (ईपी) सक्रिय साइट से प्रतिक्रिया उत्पादों की रिहाई और एंजाइम की रिहाई के साथ विघटित हो जाता है।
2. किसी रासायनिक प्रतिक्रिया की ऊर्जा को समझने के लिए, सब्सट्रेट और प्रतिक्रिया उत्पादों की ऊर्जा में परिवर्तन के साथ-साथ इस प्रक्रिया में एंजाइमों की भूमिका को भी ध्यान में रखना आवश्यक है। यह ज्ञात है कि प्रतिक्रिया होने के लिए, सब्सट्रेट्स को अतिरिक्त ऊर्जा की इतनी मात्रा प्राप्त होनी चाहिए (जिसे सक्रियण ऊर्जा ई ए कहा जाता है) जो सब्सट्रेट अणुओं के प्रतिक्रिया में प्रवेश करने के लिए आवश्यक है (चित्र 2.4)। एक एंजाइमेटिक प्रतिक्रिया के मामले में, सक्रियण ऊर्जा कम हो जाती है, जो अधिक कुशल प्रतिक्रिया सुनिश्चित करती है।
 चावल। 2.3. एंजाइमैटिक कटैलिसीस के चरण:
चावल। 2.3. एंजाइमैटिक कटैलिसीस के चरण:
मैं - एंजाइम के सक्रिय केंद्र में सब्सट्रेट के दृष्टिकोण और अभिविन्यास का चरण; II - एक एंजाइम-सब्सट्रेट कॉम्प्लेक्स (ईबी) का गठन; III - एक अस्थिर एंजाइम-उत्पाद परिसर (ईपी) का गठन; IV - एंजाइम के सक्रिय केंद्र से प्रतिक्रिया उत्पादों की रिहाई
 चावल। 2.4. रासायनिक प्रतिक्रिया के दौरान मुक्त ऊर्जा में परिवर्तन, एंजाइमों द्वारा अउत्प्रेरित और उत्प्रेरित।
चावल। 2.4. रासायनिक प्रतिक्रिया के दौरान मुक्त ऊर्जा में परिवर्तन, एंजाइमों द्वारा अउत्प्रेरित और उत्प्रेरित।
एंजाइम सक्रियण ऊर्जा ई ए को कम कर देता है, अर्थात। ऊर्जा अवरोध की ऊंचाई कम कर देता है; परिणामस्वरूप, प्रतिक्रियाशील अणुओं का अनुपात बढ़ जाता है और प्रतिक्रिया दर बढ़ जाती है
विषय 2.4. सह-कारक और सह-एंजाइम
अधिकांश एंजाइमों को उत्प्रेरक गतिविधि प्रदर्शित करने के लिए कुछ गैर-प्रोटीन पदार्थों - सहकारकों - की उपस्थिति की आवश्यकता होती है। सहकारकों के दो समूह हैं: धातु आयन और सहएंजाइम।
1. धातु आयन विभिन्न तरीकों से एंजाइम की कार्यप्रणाली में भाग लेते हैं।
सब्सट्रेट अणु की संरचना बदलें,जो सक्रिय केंद्र के साथ पूरक संपर्क सुनिश्चित करता है। उदाहरण के लिए, Mg2+-ATP कॉम्प्लेक्स एक सब्सट्रेट के रूप में कार्य करता है।
एंजाइम के सक्रिय केंद्र की मूल संरचना प्रदान करें।आयनों
Mg 2 +, Mn 2 +, Zn 2 +, Co 2 +, Mo 2 + एंजाइमों के सक्रिय केंद्र को स्थिर करने में शामिल हैं और कोएंजाइम को जोड़ने में योगदान करते हैं।
वे एंजाइम प्रोटीन अणु की संरचना को स्थिर करते हैं।उदाहरण के लिए, जिंक आयनों को एंजाइम अल्कोहल डिहाइड्रोजनेज की चतुर्धातुक संरचना को स्थिर करने की आवश्यकता होती है, जो इथेनॉल के ऑक्सीकरण को उत्प्रेरित करता है।
एंजाइमेटिक कटैलिसीस में सीधे शामिल।आयन Zn 2 +, Fe 2 +, Mn 2 +, Cu 2 + इलेक्ट्रोफिलिक कटैलिसीस में भाग लेते हैं। परिवर्तनशील संयोजकता वाले धातु आयन भी इलेक्ट्रॉन स्थानांतरण में भाग ले सकते हैं। उदाहरण के लिए, साइटोक्रोम (हीम युक्त प्रोटीन) में, लौह आयन एक इलेक्ट्रॉन को जोड़ने और दान करने में सक्षम है। इस गुण के कारण, साइटोक्रोम रेडॉक्स प्रतिक्रियाओं में भाग लेते हैं:
 2. कोएंजाइमकार्बनिक पदार्थ हैं, जो अक्सर विटामिन के व्युत्पन्न होते हैं, जो सीधे एंजाइमेटिक उत्प्रेरण में शामिल होते हैं, क्योंकि वे एंजाइमों के सक्रिय केंद्र में स्थित होते हैं। एक एंजाइम जिसमें एक कोएंजाइम होता है और एंजाइमेटिक गतिविधि होती है, कहलाता है holoenzyme.ऐसे एन्जाइम का प्रोटीन भाग कहलाता है एपोएंजाइम,जिसमें कोएंजाइम की अनुपस्थिति में कोई उत्प्रेरक गतिविधि नहीं होती है।
2. कोएंजाइमकार्बनिक पदार्थ हैं, जो अक्सर विटामिन के व्युत्पन्न होते हैं, जो सीधे एंजाइमेटिक उत्प्रेरण में शामिल होते हैं, क्योंकि वे एंजाइमों के सक्रिय केंद्र में स्थित होते हैं। एक एंजाइम जिसमें एक कोएंजाइम होता है और एंजाइमेटिक गतिविधि होती है, कहलाता है holoenzyme.ऐसे एन्जाइम का प्रोटीन भाग कहलाता है एपोएंजाइम,जिसमें कोएंजाइम की अनुपस्थिति में कोई उत्प्रेरक गतिविधि नहीं होती है।
 कोएंजाइम केवल प्रतिक्रिया के समय एंजाइम के प्रोटीन भाग से बंध सकता है या मजबूत सहसंयोजक बंधों द्वारा एपोएंजाइम से जुड़ा हो सकता है। बाद वाले मामले में इसे कहा जाता है कृत्रिम समूह।सबसे आम कोएंजाइम के उदाहरण - विटामिन डेरिवेटिव, साथ ही एंजाइमेटिक प्रक्रियाओं में उनकी भागीदारी - तालिका में दी गई है। 2.1.
कोएंजाइम केवल प्रतिक्रिया के समय एंजाइम के प्रोटीन भाग से बंध सकता है या मजबूत सहसंयोजक बंधों द्वारा एपोएंजाइम से जुड़ा हो सकता है। बाद वाले मामले में इसे कहा जाता है कृत्रिम समूह।सबसे आम कोएंजाइम के उदाहरण - विटामिन डेरिवेटिव, साथ ही एंजाइमेटिक प्रक्रियाओं में उनकी भागीदारी - तालिका में दी गई है। 2.1.
मेज़ 2.1. प्रमुख सहएंजाइमों की संरचना और कार्य
 तालिका का अंत. 2.1.
तालिका का अंत. 2.1.
 विषय 2.5. वर्गीकरण और नामकरण
विषय 2.5. वर्गीकरण और नामकरण
एंजाइमों
1. अधिकांश एंजाइमों के नाम में प्रत्यय "एएसई" होता है जो प्रतिक्रिया के सब्सट्रेट के नाम से जुड़ा होता है (उदाहरण के लिए: यूरेज़, सुक्रेज़, लाइपेज, न्यूक्लीज़) या किसी विशेष सब्सट्रेट के रासायनिक परिवर्तन के नाम से (उदाहरण के लिए: लैक्टेट) डिहाइड्रोजनेज, एडिनाइलेट साइक्लेज, फॉस्फोग्लुकोम्यूटेज, पाइरूवेट कार्बोक्सिलेज)। हालाँकि, एंजाइमों के कई तुच्छ, ऐतिहासिक रूप से निश्चित नाम उपयोग में हैं, जो सब्सट्रेट या रासायनिक परिवर्तन के प्रकार (उदाहरण के लिए, ट्रिप्सिन, पेप्सिन, रेनिन, थ्रोम्बिन, आदि) के बारे में कोई जानकारी नहीं देते हैं।
2. प्रकृति में पाए जाने वाले एंजाइमों को व्यवस्थित करने के लिए, इंटरनेशनल यूनियन ऑफ बायोकैमिस्ट्री एंड मॉलिक्यूलर बायोलॉजी (IUBMB) ने 1961 में एक नामकरण विकसित किया, जिसके अनुसार सभी एंजाइमों को उनके द्वारा उत्प्रेरित रासायनिक प्रतिक्रिया के प्रकार के आधार पर छह मुख्य वर्गों में विभाजित किया गया है। प्रत्येक वर्ग में कई उपवर्ग और उपवर्ग होते हैं, जो परिवर्तित किए जा रहे सब्सट्रेट के रासायनिक समूह, परिवर्तित समूहों के दाता और स्वीकर्ता, अतिरिक्त अणुओं की उपस्थिति आदि पर निर्भर करते हैं। छह वर्गों में से प्रत्येक का अपना क्रमांक होता है, जो सख्ती से उसे सौंपा जाता है: प्रथम श्रेणी - ऑक्सीडोरडक्टेस;द्वितीय श्रेणी - स्थानान्तरण;तीसरा ग्रेड - हाइड्रोलेज़; 4 था ग्रेड - lyases;पाँचवी श्रेणी - आइसोमेरेज़; 6 ठी श्रेणी - लिगेज
एंजाइम की सटीक पहचान करने के लिए यह वर्गीकरण आवश्यक है: प्रत्येक एंजाइम के लिए एक कोड संख्या होती है। उदाहरण के लिए, एंजाइम मालडिहाइड्रोजनेज का व्यवस्थित नाम एल-मैलेट: एनएडी ऑक्सीडोरडक्टेस है और कोड संख्या 1.1.1.38 है। पहला अंक एंजाइम वर्ग संख्या को इंगित करता है (इस मामले में, संख्या 1 इंगित करता है कि एंजाइम ऑक्सीडोरडक्टेस के वर्ग से संबंधित है); दूसरा अंक उत्प्रेरित होने वाली प्रतिक्रिया के प्रकार को इंगित करता है (इस उदाहरण में, हाइड्रॉक्सिल समूह ऑक्सीकरण होता है); तीसरे अंक का अर्थ है एक कोएंजाइम की उपस्थिति (इस मामले में, एनएडी+ कोएंजाइम), अंतिम अंक इस उपसमूह में एंजाइम की क्रम संख्या है।
3. एंजाइमों के मुख्य वर्गों की विशेषताएँ और उनके द्वारा उत्प्रेरित प्रतिक्रियाओं के उदाहरण।
1. ऑक्सीडोरडक्टेसविभिन्न रेडॉक्स प्रतिक्रियाओं को उत्प्रेरित करें। वर्ग को उपवर्गों में विभाजित किया गया है:
ए) डीहाइड्रोजनेजडिहाइड्रोजनीकरण प्रतिक्रियाओं को उत्प्रेरित करना (डीहाइड्रोजनीकृत सब्सट्रेट से दूसरे स्वीकर्ता में इलेक्ट्रॉनों के स्थानांतरण के साथ हाइड्रोजन का उन्मूलन)। सहएंजाइम NAD+, NADP+, FAD, FMN का उपयोग इलेक्ट्रॉन स्वीकर्ता के रूप में किया जाता है। इस उपवर्ग में एंजाइम मैलेट डिहाइड्रोजनेज (चित्र 2.5), आइसोसिट्रेट डिहाइड्रोजनेज, सक्सिनेट डिहाइड्रोजनेज, α-कीटोब्यूटाइरेट डिहाइड्रोजनेज, आदि शामिल हैं;
 चावल। 2.5. मैलेट डिहाइड्रोजनीकरण प्रतिक्रिया
चावल। 2.5. मैलेट डिहाइड्रोजनीकरण प्रतिक्रिया
बी) ऑक्सीडेस- आणविक ऑक्सीजन की भागीदारी के साथ ऑक्सीकरण प्रतिक्रियाओं को उत्प्रेरित करें (चित्र 2.6);
चावल। 2.6. प्रतिक्रिया एंजाइम साइटोक्रोम ऑक्सीडेज द्वारा उत्प्रेरित होती है
वी) ऑक्सीजनेज़(हाइड्रॉक्सिलेज़) सब्सट्रेट अणु के हाइड्रॉक्सिल समूह में ऑक्सीजन परमाणु को शामिल करके ऑक्सीकरण प्रतिक्रियाओं को उत्प्रेरित करते हैं। प्रतिक्रिया आणविक ऑक्सीजन की भागीदारी के साथ होती है, जिसका एक परमाणु सब्सट्रेट से जुड़ा होता है, और दूसरा पानी के अणु के निर्माण में शामिल होता है (चित्र 2.7)।
 चावल। 2.7. फेनिलएलनिन की हाइड्रॉक्सिलेशन प्रतिक्रिया।
चावल। 2.7. फेनिलएलनिन की हाइड्रॉक्सिलेशन प्रतिक्रिया।
प्रतिक्रिया सहएंजाइम: टेट्राहाइड्रोबायोप्टेरिन (एच 4 बीपी) और डायहाइड्रोबायोप्टेरिन (एच 2 बीपी)
2. स्थानांतरण- कार्यात्मक समूह स्थानांतरण प्रतिक्रियाओं को उत्प्रेरित करें। स्थानांतरित समूह के आधार पर, उन्हें उपवर्गों में विभाजित किया गया है: एमिनोट्रांस्फरेज़ (चित्र 2.8), एसाइलट्रांसफेरेज़, मिथाइलट्रांसफेरेज़, ग्लाइकोसिलट्रांसफेरेज़, किनेसेस (फॉस्फोट्रांसफेरेज़) (चित्र 2.9)।
 चावल। 2.8. एंजाइम एएलटी (एलानिन-ए-किटोग्लूटारेट एमिनोट्रांस्फरेज़) द्वारा उत्प्रेरित एक प्रतिक्रिया, जो ट्रांसफ़ेज़ के वर्ग से संबंधित है, जो एमिनोट्रांस्फरेज़ का एक उपवर्ग है।
चावल। 2.8. एंजाइम एएलटी (एलानिन-ए-किटोग्लूटारेट एमिनोट्रांस्फरेज़) द्वारा उत्प्रेरित एक प्रतिक्रिया, जो ट्रांसफ़ेज़ के वर्ग से संबंधित है, जो एमिनोट्रांस्फरेज़ का एक उपवर्ग है।
पीएफ - कोएंजाइम पाइरिडोक्सल फॉस्फेट
चावल। 2.9. एंजाइम प्रोटीन काइनेज द्वारा उत्प्रेरित एक प्रतिक्रिया, जो ट्रांसफ़रेज़ के वर्ग से संबंधित है, जो फ़ॉस्फ़ोट्रांसफ़ेरेज़ का एक उपवर्ग है।
एटीपी फॉस्फोरिक एसिड अवशेषों का दाता है
3. हाइड्रोलिसिसहाइड्रोलिसिस प्रतिक्रियाओं को उत्प्रेरित करना (विभाजन स्थल पर पानी के अणु के जुड़ने से सहसंयोजक बंधन का टूटना)। उन्हें सब्सट्रेट के आधार पर उपवर्गों में विभाजित किया गया है। नाम सब्सट्रेट अणु या हाइड्रोलाइज्ड होने वाले विशिष्ट रासायनिक बंधन के आधार पर बनते हैं: प्रोटीज़, एमाइलेज़, ग्लाइकोसिडेज़, न्यूक्लीज़, एस्टरेज़, फॉस्फेटेज़, आदि। प्रोटीन अणु के हाइड्रोलिसिस के लिए प्रतिक्रिया योजना का एक उदाहरण चित्र में दिखाया गया है। 2.10.
चावल। 2.10. प्रोटीन अणु हाइड्रोलिसिस प्रतिक्रिया
4. लाइसेस- लाइसेस में ऐसे एंजाइम शामिल होते हैं जो सब्सट्रेट से कुछ समूहों को गैर-हाइड्रोलाइटिक तरीके से तोड़ते हैं, जैसे सीओ 2, एच 2 ओ, एनएच 2 एसएच 2, आदि, या एक दोहरे बंधन के माध्यम से संलग्न करते हैं (उदाहरण के लिए, एक पानी का अणु)। डीकार्बाक्सिलेशन प्रतिक्रिया (सीओ 2 अणु का उन्मूलन) चित्र में दिखाया गया है। 2.11, और पानी के अणु को जोड़ने की प्रतिक्रिया (हाइड्रैटेज़ प्रतिक्रिया) चित्र में है। 2.12.
 चावल। 2.11. डीकार्बाक्सिलेशन प्रतिक्रिया (सीओ 2 अणु का उन्मूलन)
चावल। 2.11. डीकार्बाक्सिलेशन प्रतिक्रिया (सीओ 2 अणु का उन्मूलन)
पीएफ कोएंजाइम पाइरिडोक्सल फॉस्फेट
 चावल। 2.12. फ्यूमरेट में पानी के अणु को जोड़ने की प्रतिक्रिया
चावल। 2.12. फ्यूमरेट में पानी के अणु को जोड़ने की प्रतिक्रिया
5. आइसोमेरेज़विभिन्न इंट्रामोल्युलर परिवर्तनों को उत्प्रेरित करें (चित्र 2.13)।
 चावल। 2.13. प्रतिक्रिया एंजाइम फॉस्फोग्लुकोइसोमेरेज़ द्वारा उत्प्रेरित होती है
चावल। 2.13. प्रतिक्रिया एंजाइम फॉस्फोग्लुकोइसोमेरेज़ द्वारा उत्प्रेरित होती है
6. लिगेजेस(सिंथेटेस) उन प्रतिक्रियाओं को उत्प्रेरित करता है जो एक सहसंयोजक बंधन बनाने के लिए दो अणुओं को एक दूसरे से जोड़कर एक अणु को जटिल बनाती हैं; इस मामले में, एटीपी या अन्य उच्च-ऊर्जा यौगिकों की ऊर्जा का उपयोग किया जाता है (चित्र 2.14)।
 चावल। 2.14. प्रतिक्रिया एंजाइम ग्लूटामाइन सिंथेटेज़ द्वारा उत्प्रेरित होती है
चावल। 2.14. प्रतिक्रिया एंजाइम ग्लूटामाइन सिंथेटेज़ द्वारा उत्प्रेरित होती है
विषय 2.6. एन्जाइमेटिव कैनेटीक्स की मूल बातें
कटैलिसीस
1. एंजाइमैटिक प्रतिक्रियाओं की गतिकी एंजाइमोलॉजी की एक शाखा है जो प्रतिक्रियाशील पदार्थों की रासायनिक प्रकृति और पर्यावरणीय कारकों पर एंजाइमों द्वारा उत्प्रेरित रासायनिक प्रतिक्रियाओं की दर की निर्भरता का अध्ययन करती है।
एंजाइमों की उत्प्रेरक गतिविधि को मापने के लिए, प्रतिक्रिया दर या एंजाइम गतिविधि जैसे संकेतकों का उपयोग किया जाता है। एंजाइम प्रतिक्रिया दरसब्सट्रेट अणुओं की संख्या में कमी या प्रति इकाई समय उत्पाद अणुओं की संख्या में वृद्धि से निर्धारित होता है। एक एंजाइमेटिक प्रतिक्रिया की दर एंजाइम की उत्प्रेरक गतिविधि का एक माप है और इसे इस प्रकार दर्शाया जाता है एंजाइम गतिविधि.
व्यवहार में, एंजाइम की गतिविधि को चिह्नित करने के लिए पारंपरिक मूल्यों का उपयोग किया जाता है: गतिविधि की 1 अंतर्राष्ट्रीय इकाई (IU) एंजाइम की मात्रा से मेल खाती है जो इष्टतम परिस्थितियों (तापमान 37°) के तहत 1 मिनट में सब्सट्रेट के 1 μmol के रूपांतरण को उत्प्रेरित करती है। एंजाइमेटिक प्रतिक्रिया के लिए सी, समाधान का इष्टतम पीएच मान)।
प्रतिक्रियाएं. एंजाइम गतिविधि का आकलन करने के लिए इन गतिविधि इकाइयों का उपयोग चिकित्सा और फार्मास्युटिकल अभ्यास में किया जाता है:
किसी दिए गए ऊतक के अन्य प्रोटीनों के बीच एंजाइम अणुओं की संख्या का अनुमान लगाने के लिए, एंजाइम की विशिष्ट गतिविधि (Sp.A.) निर्धारित करें, जो संख्यात्मक रूप से एक मिलीग्राम (मिलीग्राम) की प्रति इकाई समय में परिवर्तित सब्सट्रेट (μmol में) की मात्रा के बराबर है। प्रोटीन का (ऊतक से पृथक एंजाइम):
एंजाइम की शुद्धि की डिग्री विशिष्ट गतिविधि से आंकी जाती है: कम विदेशी प्रोटीन, विशिष्ट गतिविधि जितनी अधिक होगी।
2. एंजाइमेटिक प्रतिक्रियाओं की गतिशीलता का अध्ययन एंजाइमेटिक प्रतिक्रिया के लिए इष्टतम स्थितियों के तहत किया जाता है। इष्टतम स्थितियाँ प्रत्येक एंजाइम के लिए अलग-अलग होती हैं और मुख्य रूप से उस तापमान से निर्धारित होती हैं जिस पर प्रतिक्रिया की जाती है और समाधान का पीएच मान होता है।
तापमान में वृद्धिकुछ सीमाओं तक, यह एंजाइमेटिक प्रतिक्रिया की दर को उसी तरह प्रभावित करता है जैसे तापमान किसी भी रासायनिक प्रतिक्रिया को प्रभावित करता है: बढ़ते तापमान के साथ, एंजाइमेटिक प्रतिक्रिया की दर बढ़ जाती है। हालाँकि, एक एंजाइमैटिक रासायनिक प्रतिक्रिया की दर का अपना तापमान इष्टतम होता है, जिसकी अधिकता एंजाइमेटिक गतिविधि में कमी के साथ होती है, जो प्रोटीन अणु के थर्मल विकृतीकरण से जुड़ी होती है (चित्र 2.15)। अधिकांश मानव एंजाइमों के लिए, इष्टतम तापमान 37-38 डिग्री सेल्सियस है।
 चावल। 2.15. तापमान पर एंजाइमेटिक प्रतिक्रिया दर (वी) की निर्भरता
चावल। 2.15. तापमान पर एंजाइमेटिक प्रतिक्रिया दर (वी) की निर्भरता
एंजाइम गतिविधि पीएच पर निर्भर करती हैवह घोल जिसमें एक एंजाइमेटिक प्रतिक्रिया होती है। एंजाइम गतिविधि पर पीएच का प्रभाव किसी दिए गए प्रोटीन और सब्सट्रेट के अमीनो एसिड अवशेषों के कार्यात्मक समूहों के आयनीकरण में परिवर्तन के कारण होता है, जो एंजाइम-सब्सट्रेट कॉम्प्लेक्स का इष्टतम गठन सुनिश्चित करता है। प्रत्येक एंजाइम के लिए एक pH मान होता है जिस पर उसकी अधिकतम गतिविधि देखी जाती है (चित्र 2.16)।
 चावल। 2.16. माध्यम के पीएच पर एंजाइमेटिक प्रतिक्रिया दर (वी) की निर्भरता
चावल। 2.16. माध्यम के पीएच पर एंजाइमेटिक प्रतिक्रिया दर (वी) की निर्भरता
3. एक एंजाइमेटिक प्रतिक्रिया की गतिज विशेषताएँ अभिकारकों की सांद्रता पर निर्भर करती हैं। यदि एंजाइम की सांद्रता स्थिर छोड़ दी जाती है, केवल सब्सट्रेट की मात्रा बदलती है, तो एंजाइमेटिक प्रतिक्रिया की दर का ग्राफ हाइपरबोला (चित्र 2.17) द्वारा वर्णित किया जाता है। जैसे-जैसे सब्सट्रेट की मात्रा बढ़ती है, प्रारंभिक प्रतिक्रिया दर बढ़ती है। जब एंजाइम पूरी तरह से सब्सट्रेट से संतृप्त हो जाता है, यानी। एंजाइम-सब्सट्रेट कॉम्प्लेक्स का अधिकतम संभव गठन किसी दिए गए एंजाइम एकाग्रता पर होता है, और उत्पाद निर्माण की उच्चतम दर देखी जाती है। सब्सट्रेट सांद्रता में और वृद्धि से बनने वाले उत्पाद की मात्रा में वृद्धि नहीं होती है, अर्थात। प्रतिक्रिया दर में वृद्धि नहीं होती. यह अवस्था अधिकतम प्रतिक्रिया गति से मेल खाती है वीमैक्स
वी अधिकतम मान एंजाइम की उत्प्रेरक गतिविधि को दर्शाता है और किसी दिए गए एंजाइम एकाग्रता और अतिरिक्त सब्सट्रेट की स्थितियों में उत्पाद निर्माण की अधिकतम संभावना निर्धारित करता है; वी मैक्स किसी दिए गए एंजाइम एकाग्रता के लिए एक स्थिर मूल्य है।
 चावल। 2.17. सब्सट्रेट एकाग्रता एस पर प्रतिक्रिया दर (वी) की निर्भरता:
चावल। 2.17. सब्सट्रेट एकाग्रता एस पर प्रतिक्रिया दर (वी) की निर्भरता:
वी मैक्स इष्टतम प्रतिक्रिया स्थितियों के तहत किसी दिए गए एंजाइम एकाग्रता पर अधिकतम प्रतिक्रिया दर है; के एम - माइकलिस स्थिरांक
4. एंजाइम दक्षता की मुख्य गतिज विशेषता है माइकलिस स्थिरांक - K m.माइकलिस स्थिरांक संख्यात्मक रूप से सब्सट्रेट एकाग्रता के बराबर है जिस पर आधी अधिकतम गति प्राप्त की जाती है। K m किसी दिए गए सब्सट्रेट के लिए दिए गए एंजाइम की आत्मीयता को दर्शाता है और एक स्थिर मान है। Km जितना कम होगा, किसी दिए गए सब्सट्रेट के लिए एंजाइम की आत्मीयता उतनी ही अधिक होगी, प्रारंभिक प्रतिक्रिया दर उतनी ही अधिक होगी, और इसके विपरीत, Km जितना अधिक होगा, सब्सट्रेट के लिए एंजाइम की आत्मीयता उतनी ही कम होगी और प्रारंभिक प्रतिक्रिया दर कम होगी।
1. तालिका को अपनी नोटबुक में कॉपी करें. 2.2. तालिका को भरने के लिए अपनी पाठ्यपुस्तक और अतिरिक्त साहित्य का उपयोग करें। मानव स्वास्थ्य के लिए विविध आहार की आवश्यकता के बारे में निष्कर्ष निकालें।
2. तालिका को अपनी नोटबुक में कॉपी करें. 2.3 और इसे भरें। अपनी पाठ्यपुस्तक का उपयोग करते हुए, प्रत्येक कोएंजाइम से जुड़ी एक प्रतिक्रिया लिखें।
3. एंजाइम गतिविधि ग्राफ़ को अपनी नोटबुक में स्थानांतरित करें (चित्र 2.18)। इन प्रतिक्रियाओं के V अधिकतम को परिभाषित करें और इंगित करें। पहले और दूसरे में K निर्दिष्ट करें
मामला। स्थिरांक K का जैवरासायनिक अर्थ क्या है?
तालिका 2.2. मुख्य पानी में घुलनशील विटामिन के लक्षण जो कोएंजाइम के अग्रदूत हैं
 तालिका 2.3. बुनियादी कोएंजाइम
तालिका 2.3. बुनियादी कोएंजाइम

 चावल। 2.18. सब्सट्रेट एकाग्रता पर एंजाइमेटिक प्रतिक्रियाओं की दर की निर्भरता
चावल। 2.18. सब्सट्रेट एकाग्रता पर एंजाइमेटिक प्रतिक्रियाओं की दर की निर्भरता
आत्म-नियंत्रण कार्य
1. सही जवाब चुनें। एंजाइम:
A. प्रोटीन हैं
बी. एंजाइमेटिक प्रतिक्रियाओं की दर कम करें
B. उनमें क्रिया की विशिष्टता होती है D. वे सरल प्रोटीन होते हैं E. वे विनियमन करने में सक्षम होते हैं
2. सही जवाब चुनें। माइकलिस स्थिरांक (किमी):
ए. एंजाइम बी की सब्सट्रेट विशिष्टता की एक विशेषता है। संख्यात्मक रूप से सब्सट्रेट एकाग्रता के बराबर है जिस पर वीमैक्स का आधा हिस्सा देखा जाता है
बी. सब्सट्रेट के लिए एंजाइम की आत्मीयता को दर्शाता है
डी. सब्सट्रेट डी के साथ एंजाइम के सक्रिय केंद्र की संतृप्ति की विशेषता है। एंजाइम की एक गतिज विशेषता है
3. सही जवाब चुनें। कोएंजाइम पीएफ निम्नलिखित वर्गों के एंजाइमों के साथ कार्य करता है:
A. ऑक्सीडोरडक्टेज़ B. ट्रांसफ़रेज़
बी. हाइड्रोलेज़ जी. लियाज़ डी. आइसोमेरेज़ेस
4. मिलान। प्रतिक्रिया का प्रकार जिसमें कोएंजाइम शामिल होता है:
A. कार्बोक्सिलेशन B. ऑक्सीकरण-कमी
बी. ट्रांसेमिनेशन डी. एसाइलेशन ई. एसिटिलेशन
कोएंजाइम:
2. पाइरिडोक्सल फॉस्फेट
5. मिलान। एंजाइम उत्प्रेरित करता है:
A. केवल अपरिवर्तनीय प्रतिक्रियाएँ
बी. संरचनात्मक रूप से समान सब्सट्रेट्स की एक छोटी संख्या (समूह) के साथ समान प्रकार की प्रतिक्रियाएं
B. सब्सट्रेट के मौजूदा स्टीरियोइसोमर्स में से केवल एक का रूपांतरण
D. सहएंजाइम की उपस्थिति में प्रतिक्रियाएं E. केवल एक सब्सट्रेट का रूपांतरण सब्सट्रेट विशिष्टता:
1. निरपेक्ष
2. समूह
3. त्रिविम विशिष्टता
6. "श्रृंखला" कार्य पूरा करें:
ए) रेडॉक्स प्रतिक्रियाएं वर्ग के एंजाइमों द्वारा उत्प्रेरित होती हैं
A. स्थानांतरण
बी ऑक्सीडोरडक्टेस
बी) इस वर्ग के एक उपवर्ग से संबंधित एंजाइम प्रतिक्रियाएँ करते हैं
सब्सट्रेट से हाइड्रोजन परमाणुओं का निष्कर्षण:
A. ऑक्सीडेस
बी हाइड्रॉक्सिलेज़
बी डिहाइड्रोजनेज
वी) इन एंजाइमों के लिए कोएंजाइम है:
बी. कोएंजाइम ए
जी) कोएंजाइम विटामिन पर आधारित है:
A. निकोटिनिक एसिड B. बायोटिन
बी. विटामिन बी 2
डी) इस विटामिन की कमी से निम्नलिखित बीमारियाँ होती हैं:
बी. पेलाग्रा
बी मैक्रोसाइटिक एनीमिया
7. मिलान। एंजाइम वर्ग:
A. ऑक्सीडोरडक्टेज़ B. हाइड्रोलेज़
बी. लिगाज़ा जी. लियासे
डी. ट्रांसफ़रेज़
एंजाइम:
1. सक्सिनेट डिहाइड्रोजनेज
2. पाइरूवेट कार्बोक्सिलेज़।
3. DNase.
8. छूटे हुए शब्दों से वाक्य पूरे करें:
गतिविधि। मजबूत सहसंयोजक बंधों द्वारा एपोएंजाइम से जुड़े सहएंजाइम को .................. कहा जाता है।
4. 1-ए; 2-बी; 3-ख
5. 1-डी; 2-बी; 3-ख
6. ए) बी; बी) बी; ग) बी; घ) ए; ई) बी
7. 1-ए; 2-बी; 3-ख
8. होलोएंजाइम, एपोएंजाइम, कोएंजाइम, कृत्रिम समूह
बुनियादी नियम और अवधारणाएँ
1. एंजाइमोलॉजी
2. एंजाइम उत्प्रेरण
3. एंजाइम-सब्सट्रेट कॉम्प्लेक्स
4. एंजाइमेटिक कटैलिसीस की गतिकी
5. सब्सट्रेट
6. एंजाइम सक्रिय साइट
7. अधिकतम प्रतिक्रिया गति - वी अधिकतम
8. माइकलिस स्थिरांक - K m
9. एंजाइम गतिविधि इकाइयाँ
10. एंजाइम कक्षाएं
11. एंजाइम विशिष्टता
12. एंजाइम सहकारक
13. एंजाइम की विशिष्ट गतिविधि
14. एपोएन्ज़ाइम
15. होलोएन्ज़ाइम
समस्याओं का समाधान
1. वर्तमान में, जैव रासायनिक प्रयोगशालाओं में, मानव जैविक तरल पदार्थों में एंजाइमों की गतिविधि को निर्धारित करने के लिए स्वचालित जैव रासायनिक विश्लेषक का उपयोग किया जाता है। प्रयोगशाला तकनीशियन को लैक्टेट डिहाइड्रोजनेज (एलडीएच) गतिविधि निर्धारित करने और दो रोगियों में एलडीएच गतिविधि की गणना करने के लिए उपयोग किए जाने वाले अभिकर्मकों को समझने में सहायता करें। इसके लिए:
ए) एलडीएच द्वारा उत्प्रेरित प्रतिक्रिया लिखें;
बी) सब्सट्रेट, कोएंजाइम, अग्रदूत विटामिन, एंजाइम का स्रोत इंगित करें;
ग) प्रतिक्रिया स्थितियों (तापमान, समय) की सूची बनाएं;
डी) समझाएं कि किस पैरामीटर से एंजाइमी प्रतिक्रिया की दर का आकलन किया जा सकता है;
च) आईयू/एल की इकाइयों में रोगियों के रक्त में एलडीएच गतिविधि की गणना करें। निष्कर्ष निकालें: कौन सा रोगी अधिक सक्रिय है?
तालिका 2.4. एलडीएच गतिविधि निर्धारित करने के लिए डेटा
2. मनुष्य होमोथर्मिक (तापमान को स्थिर स्तर पर बनाए रखा जाता है) जीवित जीव हैं। चिकित्सा में, कुछ मामलों में उपचार के लिए अत्यधिक तापमान का उपयोग किया जाता है। विशेष रूप से, लंबे समय तक ऑपरेशन के लिए हाइपोथर्मिक स्थितियों का उपयोग किया जाता है, विशेष रूप से मस्तिष्क और हृदय पर) हाइपरथर्मिक स्थितियों का उपयोग ऊतक जमावट के उद्देश्य से किया जाता है। एक एंजाइमोलॉजिस्ट के दृष्टिकोण से इन दृष्टिकोणों की वैधता की व्याख्या करें। जवाब देने के लिए:
ए) इंगित करें कि अधिकांश मानव एंजाइमों के लिए कौन सा तापमान इष्टतम है;
बी) तापमान पर एंजाइमेटिक प्रतिक्रियाओं की दर की निर्भरता का एक ग्राफ बनाएं;
ग) हाइपोथर्मिक परिस्थितियों में दीर्घकालिक सर्जिकल हस्तक्षेप की आवश्यकता की व्याख्या कर सकेंगे;
डी) वर्णन करें कि थर्मल ऊतक जमाव की विधि किस पर आधारित है;
ई) मनुष्यों पर गंभीर तापमान के संपर्क के परिणामों को इंगित करता है।
3. एक 35 वर्षीय मरीज मौखिक म्यूकोसा में सूजन प्रक्रियाओं, मांसपेशियों में थकान और नेत्रश्लेष्मलाशोथ की शिकायत के साथ क्लिनिक में आया था। रोगी ने लंबे समय तक नीरस आहार खाया, अपने आहार से लीवर, राई, दूध और खमीर जैसे खाद्य पदार्थों को बाहर रखा। डॉक्टर ने हाइपोविटामिनोसिस बी2 का निदान किया। देखे गए लक्षणों के कारण स्पष्ट करें। इसके लिए:
ए) विटामिन बी2 से बनने वाले कोएंजाइम का नाम बताएं;
बी) इंगित करें कि ये सहएंजाइम किन प्रतिक्रियाओं में शामिल हैं;
ग) कोएंजाइम के ऑक्सीकृत और अपचयित रूपों के लिए सूत्र के कार्यशील भाग लिख सकेंगे;
डी) इन कोएंजाइमों से जुड़ी प्रतिक्रियाओं के उदाहरण दें (पाठ्यपुस्तक सामग्री का उपयोग करें)।
4. एंजाइम एसिड फॉस्फेटेज़ फॉस्फोरिक एसिड एस्टर को हाइड्रोलाइज करता है। यह एंजाइम यकृत, प्लीहा और प्रोस्टेट की कोशिकाओं में बनता है; यह लाल रक्त कोशिकाओं, प्लेटलेट्स, मैक्रोफेज और ऑस्टियोक्लास्ट्स में निहित होता है। यह एंजाइम शुक्राणु के एक्रोसोम में भी निहित होता है और निषेचन के दौरान, ओओसाइट प्लाज़्मालेम्मा के फॉस्फोलिपिड्स को तोड़ देता है। एसिड फॉस्फेट की सबसे बड़ी एंजाइमेटिक गतिविधि अम्लीय पीएच मान (4.7-6.0) पर होती है। पीएच बनाम प्रतिक्रिया दर का एक ग्राफ बनाएं और बताएं कि पीएच परिवर्तन के साथ एसिड फॉस्फेट गतिविधि क्यों बदलती है। प्रतिक्रिया का एक चित्र प्रदान करें. एंजाइम वर्ग और उसकी विशिष्टता निर्धारित करें।
5. छोटी आंत के पेप्टाइडेज़ की कार्रवाई के तहत डाइपेप्टाइड रूपांतरण की प्रतिक्रिया दर का अध्ययन करते समय, निम्नलिखित परिणाम प्राप्त हुए: अधिकतम एंजाइम गतिविधि 40 μmol/min/mg, Km 0.01 है। सब्सट्रेट की किस सांद्रता पर प्रतिक्रिया दर 10 μmol/min/mg के बराबर है? कार्य डेटा का उपयोग करना:
ए) एक प्रतिक्रिया योजना लिखें, एंजाइम का वर्ग और वह बंधन निर्धारित करें जिसे यह सब्सट्रेट में नष्ट कर देता है;
बी) सब्सट्रेट एकाग्रता के आधार पर प्रतिक्रिया दर का एक ग्राफ बनाएं और समस्या के प्रश्न का उत्तर दें;
ग) Ksh की परिभाषा दें, Ksh के मान और सब्सट्रेट के लिए एंजाइम की आत्मीयता के बीच संबंध बताएं।
6. छात्र ने चिकन अंडे की सफेदी से पृथक एंजाइम लाइसोजाइम की विशिष्ट गतिविधि निर्धारित की। लाइसोजाइम जीवाणु कोशिका दीवार के ग्लाइकोप्रोटीन को हाइड्रोलाइज करता है। छात्र ने एक सब्सट्रेट, एक एंजाइम और एक बफर युक्त एक प्रतिक्रिया मिश्रण को ऊष्मायन किया जो 5.2 का इष्टतम पीएच मान प्रदान करता है और पाया कि 1 मिलीग्राम लाइसोजाइम के प्रभाव में, 15 मिनट में केवल 12 μmol उत्पाद का गठन किया गया था। हिसाब लगाकर कारण पता किया
एंजाइम की कम विशिष्ट गतिविधि, उन्हें याद आया कि उन्होंने थर्मोस्टेट चालू नहीं किया था और इसलिए नमूनों को कमरे के तापमान पर इनक्यूबेट किया, और एंजाइम टी 37 डिग्री सेल्सियस था। इष्टतम परिस्थितियों में प्रयोग को दोहराते हुए, उन्होंने पाया कि 15 मिनट में, 1 मिलीग्राम लाइसोजाइम की क्रिया से 45 µmol उत्पाद का निर्माण हुआ। दोनों मामलों में एंजाइम की विशिष्ट गतिविधि की गणना करें और एंजाइमेटिक प्रतिक्रिया की दर पर तापमान के प्रभाव के तंत्र की व्याख्या करें।
7. कोशिका में कई एंजाइमों की गतिविधि अन्य एंजाइमों - प्रोटीन काइनेज और फॉस्फोप्रोटीन फॉस्फेट द्वारा नियंत्रित होती है। इन प्रतिक्रियाओं की विशेषताओं को इंगित करें; इन एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं को लिखें, बताएं कि वे एंजाइमों के किस वर्ग से संबंधित हैं। सब्सट्रेट विशिष्टता पर ध्यान दें।
मॉड्यूलर इकाई 2 एंजाइम गतिविधि का विनियमन। एंजाइमोलॉजी के चिकित्सा पहलू
सीखने के उद्देश्य सक्षम हों:
1. शरीर की एंजाइमेटिक प्रतिक्रियाओं पर अवरोधकों - दवाओं, जहर - के प्रभाव के परिणामों की व्याख्या करें।
2. चयापचय पथ की गति को प्रभावित करने में एंजाइम गतिविधि के विनियमन के महत्व को समझाएं।
3. एंजाइमों को औषधि के रूप में उपयोग करने की मूल बातें समझाएं।
4. सामान्य परिस्थितियों में और विभिन्न चयापचय विकारों में एंजाइमों के गुणों और अंगों की एंजाइम संरचना के बारे में ज्ञान लागू करें।
5. रोगों के निदान में एंजाइम गतिविधि के निर्धारण के परिणामों की व्याख्या करें।
जानना:
1. एंजाइम अवरोधकों का उनकी क्रिया के तंत्र के अनुसार वर्गीकरण।
2. दवाओं के उदाहरण - एंजाइम अवरोधक।
3. शरीर में एंजाइम गतिविधि को विनियमित करने के लिए बुनियादी तंत्र।
4. चयापचय मार्गों के नियमन के सिद्धांत और चयापचय के नियमन में एंजाइमों की भूमिका।
5. रोगों के निदान और उपचार के लिए एंजाइमों के उपयोग की मूल बातें।
विषय 2.7. एंजाइम गतिविधि अवरोधक
1. पद के अंतर्गत "निषेधएंजाइम गतिविधि" कुछ रसायनों के कारण उत्प्रेरक गतिविधि में विशिष्ट कमी को संदर्भित करती है - अवरोधक.
एंजाइमी उत्प्रेरण के तंत्र को स्पष्ट करने और शरीर के चयापचय मार्गों में व्यक्तिगत एंजाइमेटिक प्रतिक्रियाओं की भूमिका स्थापित करने में मदद करने के लिए अवरोधक बहुत रुचि रखते हैं। कई दवाओं और जहरों की क्रिया एंजाइमेटिक गतिविधि के निषेध के सिद्धांत पर आधारित है।
2. अवरोधक अलग-अलग डिग्री की ताकत वाले एंजाइमों से बंधने में सक्षम होते हैं। इसके आधार पर वे भेद करते हैं प्रतिवर्तीऔर अपरिवर्तनीय अवरोध. प्रतिवर्ती अवरोधककमजोर गैर-सहसंयोजक बंधनों के साथ एंजाइम से जुड़ते हैं और, कुछ शर्तों के तहत, आसानी से एंजाइम से अलग हो जाते हैं:
ई+आई↔ ईआई.
अपरिवर्तनीय अवरोधअवरोधक अणु और एंजाइम के बीच सहसंयोजक स्थिर बंधन के गठन के मामले में देखा गया:
ई+आई→ ई-आई.
3. क्रिया के तंत्र के अनुसार, प्रतिवर्ती अवरोधकों को विभाजित किया गया है प्रतिस्पर्धीऔर गैर - प्रतिस्पर्धी।
प्रतिस्पर्धात्मक निषेध एंजाइम की सक्रिय साइट पर अवरोधक के बंधन के परिणामस्वरूप एंजाइमी प्रतिक्रिया की दर में प्रतिवर्ती कमी का कारण बनता है, जो एंजाइम-सब्सट्रेट कॉम्प्लेक्स के गठन को रोकता है। इस प्रकार का अवरोध तब होता है जब अवरोधक होता है सब्सट्रेट का संरचनात्मक एनालॉग;परिणामस्वरूप, एंजाइम के सक्रिय केंद्र से जुड़ने के लिए सब्सट्रेट और अवरोधक अणुओं के बीच प्रतिस्पर्धा होती है। इस मामले में, या तो सब्सट्रेट या अवरोधक एंजाइम के साथ संपर्क करता है, जिससे एंजाइम-सब्सट्रेट (ईएस) या एंजाइम-अवरोधक (ईआई) कॉम्प्लेक्स बनता है। जब एक एंजाइम-अवरोधक (ईआई) कॉम्प्लेक्स बनता है, तो कोई प्रतिक्रिया उत्पाद नहीं बनता है (चित्र 2.19)।
 चावल। 2.19. एंजाइम गतिविधि के प्रतिस्पर्धी निषेध की योजना
चावल। 2.19. एंजाइम गतिविधि के प्रतिस्पर्धी निषेध की योजना
प्रतिस्पर्धी प्रकार के निषेध के लिए, निम्नलिखित समीकरण मान्य हैं:
ई+एस↔तों →ई+पी; ई+आई↔ ई.आई.
प्रतिस्पर्धी निषेध की एक विशिष्ट विशेषता सब्सट्रेट एकाग्रता में वृद्धि के साथ इसके कमजोर होने की संभावना है, क्योंकि एक प्रतिवर्ती अवरोधक एंजाइम की संरचना को नहीं बदलता है। इसलिए, उच्च सब्सट्रेट सांद्रता पर, प्रतिक्रिया दर अवरोधक की अनुपस्थिति से भिन्न नहीं होती है, अर्थात। एक प्रतिस्पर्धी अवरोधक Vmax को नहीं बदलता है, लेकिन किमी बढ़ाता है।
प्रतिस्पर्धी निषेध का एक उत्कृष्ट उदाहरण मैलोनिक एसिड द्वारा सक्सेनेट डिहाइड्रोजनेज प्रतिक्रिया का निषेध है (चित्र 2.20)। मैलोनेट सक्सिनेट (दो कार्बोक्सिल समूहों की उपस्थिति) का एक संरचनात्मक एनालॉग है और सक्सिनेट डिहाइड्रोजनेज की सक्रिय साइट के साथ भी बातचीत कर सकता है। हालाँकि, मैलोनिक एसिड से कृत्रिम समूह FAD में दो हाइड्रोजन परमाणुओं का स्थानांतरण संभव नहीं है और इसलिए, प्रतिक्रिया दर कम हो जाती है।
 चावल। 2.20. मैलोनिक एसिड द्वारा सक्सेनेट डिहाइड्रोजनेज के प्रतिस्पर्धी निषेध का एक उदाहरण:
चावल। 2.20. मैलोनिक एसिड द्वारा सक्सेनेट डिहाइड्रोजनेज के प्रतिस्पर्धी निषेध का एक उदाहरण:
ए - सक्सिनेट आयनिक बंधों के कारण सक्सिनेट डिहाइड्रोजनेज एंजाइम के सक्रिय केंद्र से जुड़ जाता है; बी - एंजाइमेटिक प्रतिक्रिया के दौरान, दो हाइड्रोजन परमाणुओं को सक्सेनेट से हटा दिया जाता है और कोएंजाइम एफएडी में जोड़ा जाता है। परिणामस्वरूप, फ्यूमरेट बनता है, जिसे सक्सेनेट डिहाइड्रोजनेज की सक्रिय साइट से हटा दिया जाता है; बी - मैलोनेट सक्सिनेट का एक संरचनात्मक एनालॉग है; यह सक्सिनेट डिहाइड्रोजनेज की सक्रिय साइट से भी जुड़ता है, लेकिन रासायनिक प्रतिक्रिया नहीं होती है
4. कई दवाएं प्रतिस्पर्धी निषेध के तंत्र के माध्यम से अपना चिकित्सीय प्रभाव डालती हैं। उदाहरण के लिए, एसिटाइलकोलाइन से कोलीन और एसिटिक एसिड की हाइड्रोलिसिस प्रतिक्रिया एंजाइम एसिटाइलकोलिनेस्टरेज़ (एसीएचई) द्वारा उत्प्रेरित होती है (चित्र 2.21) और इस एंजाइम के प्रतिस्पर्धी अवरोधकों की उपस्थिति में इसे रोका जा सकता है (उदाहरण के लिए)। प्रोसेरिन, एंड्रोफोनियमआदि) (चित्र 2.22)। जब ऐसे अवरोधक जोड़े जाते हैं, तो एसिटाइलकोलिनेस्टरेज़ की गतिविधि कम हो जाती है, एसिटाइलकोलाइन (सब्सट्रेट) की सांद्रता बढ़ जाती है, जो तंत्रिका आवेगों के संचालन में वृद्धि के साथ होती है। प्रतिस्पर्धी एसिटाइलकोलाइन एस्टरेज़ अवरोधकों का उपयोग मस्कुलर डिस्ट्रॉफी के उपचार के साथ-साथ चोटों, पक्षाघात और पोलियोमाइलाइटिस के बाद आंदोलन विकारों के उपचार के लिए किया जाता है।
चावल। 2.21. AChE के प्रभाव में एसिटाइलकोलाइन हाइड्रोलिसिस की प्रतिक्रिया
 चावल। 2.22. AChE की सक्रिय साइट में प्रतिस्पर्धी अवरोधकों का बंधन
चावल। 2.22. AChE की सक्रिय साइट में प्रतिस्पर्धी अवरोधकों का बंधन
ए - एंजाइम के सक्रिय केंद्र में एक सब्सट्रेट (एसिटाइलकोलाइन) का जोड़।
तीर एसिटाइलकोलाइन हाइड्रोलिसिस की साइट को इंगित करता है; बी - एंजाइम के सक्रिय केंद्र में प्रतिस्पर्धी अवरोधक प्रोसेरिन का जोड़। कोई प्रतिक्रिया नहीं है; बी - एंजाइम के सक्रिय केंद्र के लिए प्रतिस्पर्धी अवरोधक एंड्रोफोनियम का लगाव। AChE की सक्रिय साइट पर अवरोधकों का जुड़ाव एसिटाइलकोलाइन के बंधन को रोकता है
दवाओं का एक और उदाहरण जिनकी क्रिया का तंत्र एंजाइम के प्रतिस्पर्धी निषेध पर आधारित है, अग्न्याशय के रोगों (तीव्र अग्नाशयशोथ, नेक्रोसिस) के लिए प्रोटीयोलाइटिक एंजाइम ट्रिप्सिन के पेप्टाइड अवरोधकों का उपयोग है। एप्रोटीनिन, ट्रैसिलोल, कॉन्ट्रिकल।ये दवाएं ट्रिप्सिन को रोकती हैं, जो आसपास के ऊतकों और रक्त में जारी होता है, और इस तरह अग्न्याशय के रोगों में अवांछित ऑटोलिटिक घटनाओं को रोकता है।
5. कुछ मामलों में, एंजाइम के सक्रिय केंद्र के साथ बातचीत करने वाले प्रतिस्पर्धी अवरोधकों का उपयोग किया जा सकता है छद्म सब्सट्रेट्स(एंटीमेटाबोलाइट्स), जो गलत संरचना वाले उत्पाद के संश्लेषण की ओर ले जाता है। परिणामी पदार्थों में "वांछित" संरचना नहीं होती है और इसलिए कार्यात्मक गतिविधि का अभाव होता है। इन दवाओं में सल्फोनामाइड दवाएं शामिल हैं।
6. गैर - प्रतिस्पर्धीप्रतिवर्ती एक एंजाइमेटिक प्रतिक्रिया का निषेध है जिसमें अवरोधक सक्रिय साइट के अलावा किसी अन्य साइट पर एंजाइम के साथ बातचीत करता है। गैर-प्रतिस्पर्धी अवरोधक सब्सट्रेट के संरचनात्मक एनालॉग नहीं हैं; एंजाइम में एक गैर-प्रतिस्पर्धी अवरोधक जोड़ने से सक्रिय केंद्र की संरचना बदल जाती है और एंजाइमी प्रतिक्रिया की दर कम हो जाती है, अर्थात। एंजाइमिक गतिविधि को कम करता है। गैर-प्रतिस्पर्धी अवरोधक का एक उदाहरण भारी धातु आयनों की क्रिया हो सकता है, जो एंजाइम अणु के कार्यात्मक समूहों के साथ बातचीत करते हैं, उत्प्रेरक में हस्तक्षेप करते हैं।
7. अपरिवर्तनीय अवरोधकएंजाइम अणु के साथ सहसंयोजक बंधों के निर्माण के परिणामस्वरूप एंजाइमी गतिविधि कम हो जाती है। अक्सर, एंजाइम का सक्रिय केंद्र संशोधन से गुजरता है। परिणामस्वरूप, एंजाइम अपना उत्प्रेरक कार्य नहीं कर पाता है।
एंजाइमों की क्रिया के तंत्र को स्पष्ट करने के लिए अपरिवर्तनीय अवरोधकों का उपयोग अधिक रुचिकर है। किसी एंजाइम के सक्रिय केंद्र की संरचना के बारे में महत्वपूर्ण जानकारी उन यौगिकों द्वारा प्रदान की जाती है जो सक्रिय केंद्र के कुछ समूहों को अवरुद्ध करते हैं। ऐसे अवरोधक कहलाते हैं विशिष्ट।विशिष्ट अवरोधकों में शामिल हैं डायसोप्रोपाइल फ्लोरोफॉस्फेट (डीएफपी)।डीपीपी सेरीन के ओएच समूह के साथ एक सहसंयोजक बंधन बनाता है, जो एंजाइम के सक्रिय केंद्र में निहित होता है और सीधे उत्प्रेरण में शामिल होता है, इसलिए डीपीपी को "सेरीन" एंजाइमों के एक विशिष्ट अपरिवर्तनीय अवरोधक के रूप में वर्गीकृत किया जाता है (चित्र 2.23)। डीपीपी का उपयोग एंजाइमोलॉजी में एंजाइमों के सक्रिय केंद्र की संरचना का अध्ययन करने के लिए किया जाता है।
विशिष्ट अवरोधकों के विपरीत अविशिष्टअवरोधक न केवल सक्रिय केंद्र में, बल्कि एंजाइम अणु के किसी भी हिस्से में स्थित कुछ एंजाइम समूहों के साथ सहसंयोजक बंधन बनाते हैं। उदाहरण के लिए, आयोडीन एसीटेट (चित्र 2.24) प्रोटीन के किसी भी एसएच समूह के साथ परस्पर क्रिया करता है। यह अंतःक्रिया एंजाइम अणु की संरचना को बदल देती है, और तदनुसार, सक्रिय केंद्र की संरचना को बदल देती है और उत्प्रेरक गतिविधि को कम कर देती है।
 चावल। 2.23. डीपीपी का उपयोग करके काइमोट्रिप्सिन गतिविधि का विशिष्ट निषेध
चावल। 2.23. डीपीपी का उपयोग करके काइमोट्रिप्सिन गतिविधि का विशिष्ट निषेध
 चावल। 2.24. आयोडीन एसीटेट द्वारा एंजाइम गतिविधि का गैर-विशिष्ट निषेध।
चावल। 2.24. आयोडीन एसीटेट द्वारा एंजाइम गतिविधि का गैर-विशिष्ट निषेध।
आयोडीन एसीटेट अणुओं द्वारा सिस्टीन एसएच समूहों के सहसंयोजक संशोधन के कारण गैर-विशिष्ट निषेध होता है
8. एक दवा का एक उदाहरण जिसकी क्रिया अपरिवर्तनीय एंजाइम निषेध से जुड़ी है, व्यापक रूप से उपयोग की जाने वाली एस्पिरिन है। इस विरोधी भड़काऊ गैर-स्टेरायडल दवा की कार्रवाई एंजाइम साइक्लोऑक्सीजिनेज के निषेध पर आधारित है, जो एराकिडोनिक एसिड से प्रोस्टाग्लैंडीन के गठन को उत्प्रेरित करता है। परिणामस्वरूप, एस्पिरिन का एसिटाइल अवशेष साइक्लोऑक्सीजिनेज की एक उपइकाई के सेरीन के मुक्त टर्मिनल OH समूह में जुड़ जाता है (चित्र 2.25)। यह प्रोस्टाग्लैंडीन के निर्माण को रोकता है (मॉड्यूल 8 देखें), जिसमें सूजन के मध्यस्थों सहित जैविक कार्यों की एक विस्तृत श्रृंखला होती है। इसलिए, एस्पिरिन को सूजनरोधी दवा के रूप में वर्गीकृत किया गया है। बाधित एंजाइम अणु नष्ट हो जाते हैं, प्रोस्टाग्लैंडीन संश्लेषण नए एंजाइम अणुओं के संश्लेषण के बाद ही बहाल होता है।
 चावल। 2.25. एक अपरिवर्तनीय अवरोधक - एस्पिरिन का उपयोग करके साइक्लोऑक्सीजिनेज निष्क्रियता का तंत्र
चावल। 2.25. एक अपरिवर्तनीय अवरोधक - एस्पिरिन का उपयोग करके साइक्लोऑक्सीजिनेज निष्क्रियता का तंत्र
विषय 2.8. एंजाइम गतिविधि का विनियमन
1. कोशिका में सभी रासायनिक प्रतिक्रियाएँ एंजाइमों की भागीदारी से होती हैं। इसलिए, चयापचय पथ (एक पदार्थ का दूसरे पदार्थ में क्रमिक परिवर्तन) की दर को प्रभावित करने के लिए, एंजाइम अणुओं की संख्या या उनकी गतिविधि को विनियमित करना पर्याप्त है। आमतौर पर चयापचय मार्गों में होते हैं प्रमुख एंजाइमजिससे पूरे पथ की गति नियंत्रित रहती है। इन एंजाइमों (चयापचय पथ में एक या अधिक) को कहा जाता है नियामक एंजाइम.एंजाइमेटिक प्रतिक्रियाओं की दर का विनियमन तीन स्वतंत्र स्तरों पर किया जाता है: एंजाइम अणुओं की संख्या को बदलकर, सब्सट्रेट और कोएंजाइम अणुओं की उपलब्धता, और एंजाइम अणु की उत्प्रेरक गतिविधि को बदलकर (तालिका 2.6)।
तालिका 2.5. एंजाइमी प्रतिक्रियाओं की दर को विनियमित करने के तरीके
नियमन की विधि | विशेषता |
एंजाइम अणुओं की संख्या में परिवर्तन | किसी कोशिका में एंजाइम अणुओं की संख्या दो प्रक्रियाओं के अनुपात से निर्धारित होती है: संश्लेषण और क्षय। एंजाइम संश्लेषण के नियमन का सबसे अधिक अध्ययन किया गया तंत्र प्रतिलेखन (एमआरएनए संश्लेषण) के स्तर पर है, जो कुछ मेटाबोलाइट्स, हार्मोन और कई जैविक रूप से सक्रिय अणुओं द्वारा नियंत्रित होता है। |
सब्सट्रेट और कोएंजाइम अणुओं की उपलब्धता | एक महत्वपूर्ण पैरामीटर जो एंजाइमेटिक प्रतिक्रिया के पाठ्यक्रम को नियंत्रित करता है वह सब्सट्रेट और कोएंजाइम की उपस्थिति है। प्रारंभिक सब्सट्रेट की सांद्रता जितनी अधिक होगी, प्रतिक्रिया दर उतनी ही अधिक होगी |
एक एंजाइम अणु की उत्प्रेरक गतिविधि में परिवर्तन | एंजाइम गतिविधि को विनियमित करने के मुख्य तरीके हैं: एलोस्टेरिक विनियमन; प्रोटीन-प्रोटीन अंतःक्रिया द्वारा विनियमन; एंजाइम अणु के फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा विनियमन; आंशिक (सीमित) प्रोटियोलिसिस द्वारा विनियमन |
आइए एंजाइम अणु की उत्प्रेरक गतिविधि को बदलकर एंजाइमेटिक प्रतिक्रियाओं की दर को विनियमित करने के तरीकों पर विचार करें।
2. एलोस्टेरिक विनियमन। एलोस्टेरिक एंजाइमबुलाया एंजाइम, गतिविधिकौन समायोजित कर सकते हैंका उपयोग करके प्रभावकारक पदार्थ.एलोस्टेरिक विनियमन में शामिल प्रभावकारक सेलुलर मेटाबोलाइट्स होते हैं जो अक्सर उसी मार्ग में भागीदार होते हैं जिसे वे नियंत्रित करते हैं।
वह कारक जो उत्पन्न करता है कमी (निषेध)एन्जाइम गतिविधि कहलाती है अवरोधक.वह कारक जो उत्पन्न करता है वृद्धि (सक्रियण)एन्जाइम गतिविधि कहलाती है उत्प्रेरक.
एलोस्टेरिक एंजाइमों में कुछ संरचनात्मक विशेषताएं होती हैं:
आमतौर पर हैं ऑलिगोमेरिक प्रोटीन,कई प्रोटोमर से मिलकर;
पास होना एलोस्टेरिक केंद्र,उत्प्रेरक सक्रिय स्थल से स्थानिक रूप से दूर;
इफ़ेक्टर एलोस्टेरिक (नियामक) केंद्रों पर गैर-सहसंयोजक रूप से एंजाइम से जुड़ते हैं।
एलोस्टेरिक केंद्र, उत्प्रेरक की तरह, लिगेंड के संबंध में विभिन्न विशिष्टता प्रदर्शित कर सकते हैं: यह निरपेक्ष या समूह हो सकता है। कुछ एंजाइमों में कई एलोस्टेरिक केंद्र होते हैं, जिनमें से कुछ सक्रियकर्ताओं के लिए विशिष्ट होते हैं, अन्य अवरोधकों के लिए।
प्रोटोमर जिस पर एलोस्टेरिक केंद्र स्थित होता है, कहलाता है नियामक प्रोटोमरभिन्न उत्प्रेरक प्रोटोमर,जिसमें एक सक्रिय केंद्र होता है जिसमें रासायनिक प्रतिक्रिया होती है।
एलोस्टेरिक एंजाइम्स का गुण होता है सहयोगात्मकता:एक एलोस्टेरिक केंद्र के साथ एक एलोस्टेरिक प्रभावकार की अंतःक्रिया सभी उपइकाइयों की संरचना में एक सहकारी परिवर्तन का कारण बनती है, जिससे सक्रिय केंद्र की संरचना में परिवर्तन होता है और सब्सट्रेट के लिए एंजाइम की आत्मीयता में परिवर्तन होता है, जो कम या बढ़ जाता है। एंजाइम की उत्प्रेरक गतिविधि. यदि एक अवरोधक एलोस्टेरिक केंद्र से जुड़ा हुआ है, तो सहकारी गठनात्मक परिवर्तनों के परिणामस्वरूप, सक्रिय केंद्र की संरचना में परिवर्तन होता है, जिससे सब्सट्रेट के लिए एंजाइम की आत्मीयता में कमी आती है और, तदनुसार, कमी आती है। एंजाइमी प्रतिक्रिया की दर. इसके विपरीत, यदि एक एक्टिवेटर एलोस्टेरिक केंद्र से जुड़ा होता है, तो सब्सट्रेट के लिए एंजाइम की आत्मीयता बढ़ जाती है, जिससे प्रतिक्रिया दर में वृद्धि होती है। एलोस्टेरिक प्रभावकों की कार्रवाई के तहत घटनाओं का क्रम चित्र में प्रस्तुत किया गया है। 2.26.
एलोस्टेरिक एंजाइमों का विनियमन प्रतिवर्ती:नियामक सबयूनिट से प्रभावकारक का पृथक्करण एंजाइम की मूल उत्प्रेरक गतिविधि को पुनर्स्थापित करता है।
एलोस्टेरिक एंजाइम प्रमुख प्रतिक्रियाओं को उत्प्रेरित करेंइस चयापचय मार्ग का.
एलोस्टेरिक एंजाइम विभिन्न चयापचय मार्गों में एक महत्वपूर्ण भूमिका निभाते हैं, क्योंकि वे कोशिका की आंतरिक संरचना में थोड़े से बदलाव पर बहुत तेज़ी से प्रतिक्रिया करते हैं। चयापचय प्रक्रियाओं की गति प्रतिक्रियाओं की दी गई श्रृंखला में उपयोग किए गए और गठित दोनों पदार्थों की एकाग्रता पर निर्भर करती है। पूर्ववर्ती चयापचय पथ में एलोस्टेरिक एंजाइमों के सक्रियकर्ता हो सकते हैं। उसी समय, जब किसी चयापचय मार्ग का अंतिम उत्पाद जमा हो जाता है, तो यह एंजाइम के एलोस्टेरिक अवरोधक के रूप में कार्य कर सकता है। नियमन की यह विधि शरीर में आम है और इसे "नकारात्मक प्रतिक्रिया" कहा जाता है:
 चावल। 2.26. एलोस्टेरिक एंजाइम की संरचना और कार्यप्रणाली की योजना:
चावल। 2.26. एलोस्टेरिक एंजाइम की संरचना और कार्यप्रणाली की योजना:
ए - एक नकारात्मक प्रभावकारक (अवरोधक) की क्रिया। अवरोधक (I) एलोस्टेरिक केंद्र से जुड़ जाता है, जो एंजाइम के सक्रिय केंद्र सहित एंजाइम अणु में सहकारी गठनात्मक परिवर्तन का कारण बनता है। सब्सट्रेट के लिए एंजाइम की आत्मीयता कम हो जाती है, और परिणामस्वरूप, एंजाइमेटिक प्रतिक्रिया की दर कम हो जाती है; बी - एक सकारात्मक प्रभावकारक (सक्रियकर्ता) की कार्रवाई। एक्टिवेटर (ए) एलोस्टेरिक केंद्र से जुड़ता है, जो सहकारी गठनात्मक परिवर्तनों का कारण बनता है। सब्सट्रेट के लिए एंजाइम की आत्मीयता बढ़ जाती है और एंजाइमेटिक प्रतिक्रिया की दर बढ़ जाती है। एंजाइम गतिविधि पर अवरोधक और उत्प्रेरक दोनों के प्रतिवर्ती प्रभाव का प्रदर्शन किया गया है
आइए ग्लूकोज अपचय की प्रक्रिया के एलोस्टेरिक विनियमन पर विचार करें, जो एटीपी अणु के निर्माण के साथ समाप्त होता है (चित्र 2.27)। इस घटना में कि कोशिका में एटीपी अणुओं का उपभोग नहीं किया जाता है, यह इस चयापचय मार्ग के एलोस्टेरिक एंजाइमों का अवरोधक है: फ़ॉस्फ़ोफ़्रुक्टोकिनेज़ और पाइरूवेट किनेज़। इसी समय, ग्लूकोज अपचय का मध्यवर्ती मेटाबोलाइट, फ्रुक्टोज-1,6-बिस्फोस्फेट, पाइरूवेट किनेज़ एंजाइम का एक एलोस्टेरिक उत्प्रेरक है। चयापचय मार्ग के अंतिम उत्पाद द्वारा अवरोध और प्रारंभिक चयापचयों द्वारा सक्रियण की अनुमति मिलती है
 चावल। 2.27. ग्लूकोज अपचय की प्रक्रिया का एलोस्टेरिक विनियमन।
चावल। 2.27. ग्लूकोज अपचय की प्रक्रिया का एलोस्टेरिक विनियमन।
एटीपी अणु चयापचय पथ एंजाइमों का एक एलोस्टेरिक अवरोधक है - फॉस्फोफ्रक्टोकिनेज और पाइरूवेट किनेज। फ्रुक्टोज-1,6-बिस्फोस्फेट अणु एंजाइम पाइरूवेट काइनेज का एक एलोस्टेरिक उत्प्रेरक है
चयापचय पथ की गति को नियंत्रित करें। एलोस्टेरिक एंजाइम, एक नियम के रूप में, चयापचय पथ की प्रारंभिक प्रतिक्रियाओं, अपरिवर्तनीय प्रतिक्रियाओं, दर-सीमित प्रतिक्रियाओं (सबसे धीमी) या चयापचय पथ के शाखा बिंदु पर प्रतिक्रियाओं को उत्प्रेरित करते हैं।
3. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा विनियमन।कुछ एंजाइम प्रोटीन-प्रोटीन परस्पर क्रिया के परिणामस्वरूप अपनी गतिविधि बदलते हैं। इस तरह से एंजाइम गतिविधि को बदलने के लिए कम से कम दो तंत्रों को प्रतिष्ठित किया जा सकता है: एक्टिवेटर प्रोटीन के अतिरिक्त के परिणामस्वरूप एंजाइमों का सक्रियण (जी प्रोटीन के α-सबयूनिट द्वारा एंजाइम एडिनाइलेट साइक्लेज का सक्रियण, मॉड्यूल 4 देखें) और परिवर्तन प्रोटोमर्स के संयोजन और पृथक्करण के परिणामस्वरूप उत्प्रेरक गतिविधि में।
प्रोटोमर्स के जुड़ाव या पृथक्करण द्वारा एंजाइमों की उत्प्रेरक गतिविधि के नियमन के एक उदाहरण के रूप में, हम एंजाइम प्रोटीन काइनेज ए के नियमन पर विचार कर सकते हैं।
प्रोटीन काइनेज ए(सीएमपी-आश्रित) में दो प्रकार की चार उपइकाइयाँ होती हैं: दो नियामक (आर) और दो उत्प्रेरक (सी)। इस टेट्रामर में उत्प्रेरक गतिविधि नहीं है। नियामक सबयूनिट में चक्रीय 3",5"-एएमपी (सीएमपी) (प्रत्येक सबयूनिट के लिए दो) के लिए बाइंडिंग साइट होती हैं। दो नियामक उपइकाइयों से चार सीएमपी अणुओं के जुड़ने से नियामक प्रोटोमर्स की संरचना में बदलाव होता है और टेट्रामेरिक कॉम्प्लेक्स का पृथक्करण होता है; यह दो सक्रिय उत्प्रेरक सबयूनिट जारी करता है (चित्र 2.28)। सक्रिय प्रोटीन काइनेज ए एटीपी से प्रोटीन के अमीनो एसिड अवशेषों के विशिष्ट ओएच समूहों में फॉस्फोरिक एसिड अवशेषों के स्थानांतरण को उत्प्रेरित करता है (यानी, यह प्रोटीन के फॉस्फोराइलेशन का कारण बनता है)।
 चावल। 2.28. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा प्रोटीन काइनेज ए (पीकेए) गतिविधि का विनियमन।
चावल। 2.28. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा प्रोटीन काइनेज ए (पीकेए) गतिविधि का विनियमन।
पीकेए चार सीएमपी अणुओं द्वारा सक्रिय होता है, जो दो नियामक सबयूनिटों से जुड़ता है, जिससे नियामक प्रोटोमर्स की संरचना में बदलाव होता है और टेट्रामेरिक कॉम्प्लेक्स का पृथक्करण होता है। यह दो सक्रिय उत्प्रेरक सबयूनिट जारी करता है जो प्रोटीन फॉस्फोराइलेशन का कारण बन सकता है
नियामक उपइकाइयों से सीएमपी अणुओं के टूटने से एक निष्क्रिय कॉम्प्लेक्स के गठन के साथ प्रोटेन कीनेज ए के नियामक और उत्प्रेरक उपइकाइयों का जुड़ाव होता है।
4. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइमों की उत्प्रेरक गतिविधि का विनियमन।जैविक प्रणालियों में, उनके सहसंयोजक संशोधन का उपयोग करके एंजाइमों की गतिविधि को विनियमित करने के लिए एक तंत्र अक्सर पाया जाता है। एंजाइमों के रासायनिक संशोधन की एक त्वरित और व्यापक विधि उनका फॉस्फोराइलेशन-डीफॉस्फोराइलेशन है।
एंजाइम के OH समूह फॉस्फोराइलेशन से गुजरते हैं, जो एंजाइमों द्वारा किया जाता है प्रोटीन किनेसेस(फॉस्फोराइलेशन) और फॉस्फोप्रोटीन फॉस्फेटेस(डीफॉस्फोराइलेशन)। फॉस्फोरिक एसिड अवशेषों के जुड़ने से सक्रिय केंद्र की संरचना और इसकी उत्प्रेरक गतिविधि में परिवर्तन होता है। इस मामले में, परिणाम दोहरा हो सकता है: कुछ एंजाइम फॉस्फोराइलेशन के दौरान सक्रिय होते हैं, जबकि अन्य, इसके विपरीत, कम सक्रिय हो जाते हैं (चित्र 2.29)। प्रोटीन किनेसेस और फॉस्फोप्रोटीन फॉस्फेटेस की गतिविधि हार्मोन द्वारा नियंत्रित होती है, जो चयापचय मार्गों में प्रमुख एंजाइमों की गतिविधि को पर्यावरणीय स्थितियों के आधार पर तेजी से भिन्न होने की अनुमति देती है।
 चावल। 2.29. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइम गतिविधि के नियमन की योजना।
चावल। 2.29. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइम गतिविधि के नियमन की योजना।
एंजाइमों का फास्फोराइलेशन एंजाइम प्रोटीन काइनेज की मदद से होता है। फॉस्फोरिक एसिड अवशेष का दाता एटीपी अणु है। एक एंजाइम का फॉस्फोराइलेशन इसकी संरचना और सक्रिय साइट की संरचना को बदल देता है, जो सब्सट्रेट के लिए एंजाइम की आत्मीयता को बदल देता है। इस मामले में, कुछ एंजाइम फॉस्फोराइलेशन के दौरान सक्रिय होते हैं, जबकि अन्य बाधित होते हैं। विपरीत प्रक्रिया - डीफॉस्फोराइलेशन - एंजाइम फॉस्फोप्रोटीन फॉस्फेटेस के कारण होता है, जो एंजाइम से फॉस्फोरिक एसिड अवशेषों को अलग कर देता है और एंजाइम को उसकी मूल स्थिति में लौटा देता है।
5. आंशिक (सीमित) प्रोटियोलिसिस द्वारा एंजाइमों की उत्प्रेरक गतिविधि का विनियमन।कुछ एंजाइम जो कोशिकाओं के बाहर (जठरांत्र पथ या रक्त प्लाज्मा में) कार्य करते हैं, उन्हें निष्क्रिय अग्रदूतों के रूप में संश्लेषित किया जाता है और केवल एक या अधिक विशिष्ट पेप्टाइड बांड के हाइड्रोलिसिस के परिणामस्वरूप सक्रिय होते हैं, जिससे अणु का हिस्सा समाप्त हो जाता है। प्रोटीन अणु के शेष भाग में, एक गठनात्मक पुनर्व्यवस्था होती है और एंजाइम का सक्रिय केंद्र बनता है (चित्र 2.30)। जब किसी एंजाइम की गतिविधि बदल जाती है तो आंशिक प्रोटियोलिसिस विनियमन का एक उदाहरण है
 चावल। 2.30. आंशिक प्रोटियोलिसिस द्वारा पेप्सिन का सक्रियण।
चावल। 2.30. आंशिक प्रोटियोलिसिस द्वारा पेप्सिन का सक्रियण।
पेप्सिनोजेन (एक निष्क्रिय अणु) के एक या अधिक पेप्टाइड बांड के हाइड्रोलिसिस के परिणामस्वरूप, अणु का हिस्सा अलग हो जाता है और पेप्सिन एंजाइम का सक्रिय केंद्र बनता है
अपरिवर्तनीय. ऐसे एंजाइम आमतौर पर थोड़े समय के लिए कार्य करते हैं, जो प्रोटीन अणु के जीवनकाल द्वारा निर्धारित होता है। आंशिक प्रोटियोलिसिस पाचन प्रोटियोलिटिक एंजाइमों (पेप्सिन, ट्रिप्सिन, काइमोट्रिप्सिन, इलास्टेज), पेप्टाइड हार्मोन (इंसुलिन), रक्त जमावट प्रणाली के प्रोटीन और कई अन्य प्रोटीनों के सक्रियण का आधार है।
विषय 2.9. चिकित्सा में एंजाइमों का अनुप्रयोग
1. चिकित्सा पद्धति में निदान के रूप में एंजाइमों का व्यापक रूप से उपयोग किया जाता है (एंजाइमोडायग्नोस्टिक्स)और उपचारात्मक (एंजाइम थेरेपी)निधि. एंजाइमों का भी उपयोग किया जाता है विशिष्ट अभिकर्मक
कई मेटाबोलाइट्स निर्धारित करने के लिए। उदाहरण के लिए, एंजाइम ग्लूकोज ऑक्सीडेज का उपयोग मूत्र और रक्त में ग्लूकोज के मात्रात्मक निर्धारण के लिए किया जाता है; एंजाइम यूरियाज़ का उपयोग जैविक तरल पदार्थों में यूरिया सामग्री का आकलन करने के लिए किया जाता है; विभिन्न डिहाइड्रोजनेज का उपयोग करके, उपयुक्त सब्सट्रेट्स की उपस्थिति का पता लगाया जाता है, उदाहरण के लिए पाइरूवेट, लैक्टेट, एथिल अल्कोहल, आदि।
2. एंजाइमोडायग्नोस्टिक्सइसमें मानव जैविक तरल पदार्थों में एंजाइमों की गतिविधि का निर्धारण करने के आधार पर एक बीमारी (या सिंड्रोम) का निदान करना शामिल है।
एंजाइम निदान के सिद्धांत निम्नलिखित सिद्धांतों पर आधारित हैं:
आम तौर पर, रक्त सीरम में एंजाइम होते हैं जो विशेष कार्य करते हैं, उदाहरण के लिए, रक्त जमावट प्रणाली में शामिल होते हैं। सेलुलर एंजाइम व्यावहारिक रूप से बरकरार कोशिकाओं से रक्त में प्रवेश नहीं करते हैं। न्यूनतम मात्रा में, रक्त में कुछ कोशिका एंजाइमों का पता लगाया जा सकता है;
पर हानिरक्त या अन्य जैविक तरल पदार्थ (उदाहरण के लिए, मूत्र) में कोशिका झिल्ली (सूजन, परिगलन), क्षतिग्रस्त कोशिकाओं के इंट्रासेल्युलर एंजाइमों की संख्या बढ़ जाती है, जिनकी गतिविधि विशेष जैव रासायनिक परीक्षणों द्वारा दर्ज की जा सकती है;
एंजाइमैटिक डायग्नोस्टिक्स के लिए, कुछ अंगों में प्रमुख या पूर्ण स्थानीयकरण वाले एंजाइमों का उपयोग किया जाता है। (अंग विशिष्टता);
जारी एंजाइम की मात्रा ऊतक क्षति की डिग्री के लिए आनुपातिक और इसकी गतिविधि निर्धारित करने के लिए पर्याप्त होनी चाहिए;
कोशिकाओं के क्षतिग्रस्त होने पर पाए जाने वाले जैविक तरल पदार्थों में एंजाइमों की गतिविधि सामान्य मूल्यों से भिन्न होती है और काफी लंबे समय (दिनों) तक स्थिर रहती है;
रक्त प्लाज्मा में केवल साइटोसोलिक स्थानीयकरण वाले एंजाइमों की उपस्थिति एक सूजन प्रक्रिया को इंगित करती है; यदि माइटोकॉन्ड्रियल या परमाणु एंजाइमों का पता लगाया जाता है, तो हम नेक्रोसिस जैसी गहरी कोशिका क्षति के बारे में बात कर सकते हैं।
वे एंजाइम जो समान रासायनिक प्रतिक्रिया उत्प्रेरित करते हैं लेकिन विभिन्न प्राथमिक प्रोटीन संरचनाओं के साथ कहलाते हैं आइसोजाइम.वे गतिज मापदंडों, सक्रियण स्थितियों और एपोएंजाइम और कोएंजाइम के बीच संबंध की विशेषताओं में एक दूसरे से भिन्न होते हैं। आइसोन्ज़ाइमों की उपस्थिति की प्रकृति अलग-अलग होती है, लेकिन अक्सर इन आइसोन्ज़ाइमों या उनके उप-इकाइयों को एन्कोडिंग करने वाले जीन की संरचना में अंतर के कारण होता है। आइसोएंजाइम के निर्धारण की विधियाँ भौतिक-रासायनिक गुणों में अंतर पर आधारित होती हैं। आइसोएंजाइम अक्सर होते हैं अंग-विशिष्ट,चूंकि प्रत्येक ऊतक में मुख्य रूप से एक प्रकार के आइसोएंजाइम होते हैं। नतीजतन, जब कोई अंग क्षतिग्रस्त हो जाता है, तो आइसोन्ज़ाइम का संबंधित रूप रक्त में प्रकट होता है। एंजाइमों के कुछ आइसोएंजाइम रूपों का पता लगाने से रोगों के निदान के लिए उनके उपयोग की अनुमति मिलती है।
उदाहरण के लिए, एक एंजाइम लैक्टेट डिहाइड्रोजनेज (एलडीएच)लैक्टेट (लैक्टिक एसिड) की प्रतिवर्ती ऑक्सीकरण प्रतिक्रिया को पाइरूवेट (पाइरुविक एसिड) में उत्प्रेरित करता है (चित्र 2.31)। लैक्टेट डिहाइड्रोजनेज एक मोल वाला ऑलिगोमेरिक प्रोटीन है। वजन 134,000 है, जिसमें दो प्रकार की चार उपइकाइयाँ शामिल हैं - एम (अंग्रेजी मांसपेशी से - मांसपेशी) और एच (अंग्रेजी हृदय से - हृदय)। इन उपइकाइयों का संयोजन लैक्टेट डिहाइड्रोजनेज के पांच आइसोफोर्मों के निर्माण का आधार बनता है (चित्र 2.32, ए)। एलडीएच 1 और एलडीएच 2 हृदय की मांसपेशियों और गुर्दे में सबसे अधिक सक्रिय हैं, एलडीएच 4 और एलडीएच 5 - कंकाल की मांसपेशियों और यकृत में। अन्य ऊतकों में इस एंजाइम के अन्य प्रकार होते हैं। एलडीएच आइसोफॉर्म इलेक्ट्रोफोरेटिक गतिशीलता में एक दूसरे से भिन्न होते हैं, जिससे एलडीएच आइसोफॉर्म की ऊतक पहचान स्थापित करना संभव हो जाता है (चित्र 2.32, बी)। हृदय, यकृत और मांसपेशियों की बीमारियों का निदान करने के लिए, इलेक्ट्रोफोरेसिस का उपयोग करके रक्त प्लाज्मा में एलडीएच आइसोफॉर्म का अध्ययन करना आवश्यक है। चित्र में. 2.32, बी इलेक्ट्रोफेरोग्राम दिखाता है
 चावल। 2.31. लैक्टेट डिहाइड्रोजनेज (एलडीएच) द्वारा उत्प्रेरित प्रतिक्रिया
चावल। 2.31. लैक्टेट डिहाइड्रोजनेज (एलडीएच) द्वारा उत्प्रेरित प्रतिक्रिया
 चावल। 2.32. लैक्टेट डिहाइड्रोजनेज आइसोफॉर्म:
चावल। 2.32. लैक्टेट डिहाइड्रोजनेज आइसोफॉर्म:
ए - विभिन्न एलडीएच आइसोफॉर्म की संरचना; बी - इलेक्ट्रोफेरोग्राम पर वितरण और विभिन्न अंगों में एलडीएच आइसोफॉर्म की सापेक्ष मात्रा; बी - सामान्य परिस्थितियों में और पैथोलॉजी में रक्त प्लाज्मा में एलडीएच आइसोफॉर्म की सामग्री (इलेक्ट्रोफेरोग्राम - बाईं ओर और फोटोमेट्रिक स्कैनिंग - दाईं ओर)
एक स्वस्थ व्यक्ति का रक्त प्लाज्मा, मायोकार्डियल रोधगलन वाले रोगी का और हेपेटाइटिस वाले रोगी का। रक्त प्लाज्मा में ऊतक-विशिष्ट एलडीएच आइसोफॉर्म का पता लगाना व्यापक रूप से नैदानिक परीक्षण के रूप में उपयोग किया जाता है।
एक अन्य उदाहरण क्रिएटिन काइनेज है। क्रिएटिन काइनेज (सीके)जो क्रिएटिन फॉस्फेट निर्माण की प्रतिक्रिया को उत्प्रेरित करता है (चित्र 2.33)। केके अणु एक डिमर है जिसमें दो प्रकार की सबयूनिट एम (अंग्रेजी मांसपेशी से - मांसपेशी) और बी (अंग्रेजी मस्तिष्क से - मस्तिष्क) शामिल है। ये सबयूनिट तीन आइसोन्ज़ाइम बनाते हैं: बीबी, एमबी, एमएम। बीबी आइसोन्ज़ाइम मुख्य रूप से मस्तिष्क में, एमएम कंकाल की मांसपेशियों में और एमवी हृदय की मांसपेशियों में पाया जाता है। केके आइसोफॉर्म में अलग-अलग इलेक्ट्रोफोरेटिक गतिशीलता होती है (चित्र 2.34)। रक्त प्लाज्मा में सीके गतिविधि का निर्धारण मायोकार्डियल रोधगलन के निदान में महत्वपूर्ण है (एमबी आइसोफॉर्म के स्तर में वृद्धि हुई है)। आघात और कंकाल की मांसपेशियों को क्षति के दौरान एमएम आइसोफॉर्म की मात्रा बढ़ सकती है। बीबी आइसोफॉर्म रक्त-मस्तिष्क बाधा को भेद नहीं सकता है, इसलिए यह स्ट्रोक के दौरान भी रक्त में व्यावहारिक रूप से अवांछनीय है और इसका कोई नैदानिक मूल्य नहीं है।
 चावल। 2.33. एंजाइम क्रिएटिन किनेज़ (सीके) द्वारा उत्प्रेरित प्रतिक्रिया
चावल। 2.33. एंजाइम क्रिएटिन किनेज़ (सीके) द्वारा उत्प्रेरित प्रतिक्रिया
 चावल। 2.34. विभिन्न क्रिएटिन काइनेज आइसोफॉर्म की संरचना और इलेक्ट्रोफोरेटिक गतिशीलता
चावल। 2.34. विभिन्न क्रिएटिन काइनेज आइसोफॉर्म की संरचना और इलेक्ट्रोफोरेटिक गतिशीलता
एंजाइमोडायग्नोस्टिक्सविभिन्न अंगों के रोगों का निदान स्थापित करने के लिए उपयोग किया जाता है। विश्लेषण का सेट एक विशेष जैव रासायनिक प्रयोगशाला की क्षमताओं पर निर्भर करता है और इसमें लगातार सुधार किया जा रहा है। सबसे आम एंजाइम डायग्नोस्टिक परीक्षण हैं:
हृदय रोगों (मायोकार्डियल रोधगलन) के लिए - लैक्टेट डिहाइड्रोजनेज, क्रिएटिन काइनेज, एस्पार्टेट एमिनोट्रांस्फरेज़, एलानिन एमिनोट्रांस्फरेज़। मायोकार्डियल रोधगलन के दौरान रक्त में दिखाई देने वाले पहले प्रोटीनों में से एक ट्रोपोनिन है;
यकृत रोगों के लिए - एलेनिन एमिनोट्रांस्फरेज़, एस्पार्टेट एमिनोट्रांस्फरेज़, एसिटाइलकोलिनेस्टरेज़, गामा-ग्लूटामाइल ट्रांसपेप्टिडेज़। अग्न्याशय के रोगों के लिए - अग्न्याशय एमाइलेज, लाइपेज;
प्रोस्टेट रोगों के लिए - एसिड फॉस्फेट।
3. एंजाइमों का औषधि के रूप में उपयोगनिम्नलिखित दिशाओं में सक्रिय रूप से विकास कर रहे हैं:
प्रतिस्थापन चिकित्सा - एंजाइमों की कमी की स्थिति में उनका उपयोग;
जटिल चिकित्सा के तत्व - अन्य चिकित्सा के साथ संयोजन में एंजाइमों का उपयोग।
एंजाइम रिप्लेसमेंट थेरेपी पाचन रस के अपर्याप्त स्राव से जुड़े गैस्ट्रोइंटेस्टाइनल रोगों के लिए प्रभावी है। उदाहरण के लिए, पेप्सिन का उपयोग कम स्रावी कार्य वाले जठरशोथ के लिए किया जाता है। मुख्य अग्न्याशय एंजाइमों (फेस्टल, एनज़िस्टल, मेसिम्फोर्ट इत्यादि) युक्त मौखिक दवाएं लेने से भी अग्न्याशय एंजाइमों की कमी को काफी हद तक पूरा किया जा सकता है।
एंजाइमों का उपयोग कई बीमारियों के लिए अतिरिक्त चिकित्सीय एजेंटों के रूप में किया जाता है। प्रोटियोलिटिक एंजाइम (ट्रिप्सिन, काइमोट्रिप्सिन) का उपयोग स्थानीय रूप से शुद्ध घावों के इलाज के लिए किया जाता है ताकि मृत कोशिकाओं के प्रोटीन को तोड़ा जा सके, श्वसन पथ की सूजन संबंधी बीमारियों में रक्त के थक्के या चिपचिपे स्राव को हटाया जा सके। एंजाइम तैयारी राइबोन्यूक्लिज़ और डीऑक्सीराइबोन्यूक्लिज़ का उपयोग एडेनोवायरल नेत्रश्लेष्मलाशोथ और हर्पेटिक केराटाइटिस के उपचार में एंटीवायरल दवाओं के रूप में किया जाता है।
रक्त के थक्के को नष्ट करने के लिए थ्रोम्बोसिस और थ्रोम्बोम्बोलिज्म में एंजाइम की तैयारी का व्यापक रूप से उपयोग किया जाता है। इस प्रयोजन के लिए, फ़ाइब्रिनोलिसिन, स्ट्रेप्टोलियाज़, स्ट्रेप्टोडेकेस और यूरोकाइनेज़ तैयारियों का उपयोग किया जाता है।
एंजाइम हयालूरोनिडेज़ (लिडेज़), जो हयालूरोनिक एसिड के टूटने को उत्प्रेरित करता है, का उपयोग जलने और ऑपरेशन के बाद आसंजन और निशान को ठीक करने के लिए चमड़े के नीचे और इंट्रामस्क्युलर रूप से किया जाता है।
एंजाइम एस्पेरेगिनेज (रक्त में अमीनो एसिड एएसएन को नष्ट कर देता है) का उपयोग रक्त के कैंसर के लिए किया जाता है, जो ट्यूमर कोशिकाओं में अमीनो एसिड एएसएन के प्रवाह को सीमित करता है। ल्यूकेमिया कोशिकाएं इस अमीनो एसिड को स्वतंत्र रूप से संश्लेषित करने में सक्षम नहीं हैं, इसलिए रक्त में इसकी सामग्री में कमी इन कोशिकाओं के विकास को बाधित करती है।
विषय 2.10. एन्जाइमोपैथियाँ
कई बीमारियों का आधार कोशिका में एंजाइमों के कामकाज में व्यवधान है - तथाकथित एंजाइमोपैथी.प्राथमिक (वंशानुगत) और माध्यमिक (अधिग्रहीत) एंजाइमोपैथी हैं। आम तौर पर प्रोटीनोपैथी की तरह, एक्वायर्ड एंजाइमोपैथी सभी बीमारियों में देखी जाती है।
प्राथमिक एंजाइमोपैथी में, दोषपूर्ण एंजाइम मुख्य रूप से अप्रभावी ऑटोसोमल तरीके से विरासत में मिलते हैं। इस मामले में, दोषपूर्ण एंजाइम युक्त चयापचय मार्ग बाधित हो जाता है (चित्र 2.35)। इस मामले में रोग का विकास "परिदृश्य" में से एक के अनुसार हो सकता है:
अंतिम उत्पादों का निर्माण बाधित हो जाता है, जिससे कुछ पदार्थों की कमी हो जाती है (उदाहरण के लिए, ऐल्बिनिज़म के साथ, त्वचा कोशिकाओं में वर्णक का उत्पादन नहीं होता है);
प्रीकर्सर सब्सट्रेट जमा होते हैं, जिनका शरीर पर विषाक्त प्रभाव पड़ता है (उदाहरण के लिए, एल्केप्टोनुरिया के साथ, एक मध्यवर्ती मेटाबोलाइट जमा होता है - होमोजेनेटिक एसिड, जो जोड़ों में जमा होता है, जिससे उनमें सूजन प्रक्रिया होती है)।
 चावल। 2.35. एंजाइम ई 3 एंजाइमोपैथी के साथ चयापचय मार्ग
चावल। 2.35. एंजाइम ई 3 एंजाइमोपैथी के साथ चयापचय मार्ग
पाठ्येतर कार्य के लिए असाइनमेंट
समस्याओं का समाधान
1. वसा ऊतक कोशिकाओं में, चयापचय प्रक्रियाओं का एनाबॉलिक से कैटोबोलिक में परिवर्तन पोषण की लय के आधार पर होता है। फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा प्रमुख एंजाइमों की गतिविधि को नियंत्रित करने वाले हार्मोन इस स्विच के नियमन में महत्वपूर्ण भूमिका निभाते हैं। प्रमुख वसा विखंडन एंजाइम (चित्र 2.36) की गतिविधि को विनियमित करने की योजना को पूरा करें, यदि यह ज्ञात हो कि यह एंजाइम (टीएजी लाइपेज) फॉस्फोराइलेटेड रूप में सक्रिय है और डीफॉस्फोराइलेटेड रूप में निष्क्रिय है। प्रश्न का उत्तर देने के लिए:
ए) आरेख को एक नोटबुक में कॉपी करें और उन एंजाइमों के नाम इंगित करें जो प्रोटीन के फॉस्फोराइलेशन और डीफॉस्फोराइलेशन का कारण बनते हैं (आयतों में उनके नाम लिखें);
बी) इन एंजाइमों के वर्ग का नाम बताएं;
ग) इन प्रतिक्रियाओं में शामिल अतिरिक्त सब्सट्रेट्स और उत्पादों को लिखें (वर्गों में उनके नाम लिखें);
घ) कोशिका चयापचय के नियमन में हार्मोन की भूमिका के बारे में निष्कर्ष निकालें।
 चावल। 2.36. TAG लाइपेज गतिविधि का विनियमन
चावल। 2.36. TAG लाइपेज गतिविधि का विनियमन
2. शतावरी अपचय की प्रतिक्रिया को उत्प्रेरित करने वाले शतावरी ने ल्यूकेमिया के उपचार में आवेदन पाया है। शतावरी के एंटी-ल्यूकेमिक प्रभाव के लिए शर्त यह थी कि शतावरी संश्लेषण के लिए एक दोषपूर्ण एंजाइम, शतावरी सिंथेटेज़, ल्यूकेमिक कोशिकाओं में पहचाना गया था। शतावरी के चिकित्सीय प्रभाव का औचित्य सिद्ध करें। जवाब देने के लिए:
ए) एस्पेरेगिन सिंथेटेज़ (धारा 7) और एस्पेरेगिनेज़ एंजाइमों द्वारा उत्प्रेरित प्रतिक्रियाओं को लिखें;
बी) उन वर्गों को इंगित करें जिनसे ये एंजाइम संबंधित हैं;
ग) शतावरी का उपयोग करते समय ट्यूमर कोशिकाओं में एएसएन की एकाग्रता के बारे में निष्कर्ष निकालें;
घ) समझाएं कि एस्पेरेजिनेज का उपयोग ट्यूमर ऊतक की वृद्धि दर को कम क्यों करता है।
3. इसे अपनी नोटबुक में स्थानांतरित करें और तालिका भरें। 2.7 इस मैनुअल, पाठ्यपुस्तक से सामग्री का उपयोग करके चिकित्सा में एंजाइमों के उपयोग पर।
4. इसे अपनी नोटबुक में स्थानांतरित करें और तालिका भरें। 2.8 दवाओं पर - एंजाइम अवरोधक, वर्तमान अनुभाग, पाठ्यपुस्तक, अतिरिक्त साहित्य का उपयोग करते हुए।
तालिका 2.7. औषधियाँ - एंजाइम अवरोधक
आत्म-नियंत्रण कार्य
1. सही उत्तर का चयन करें।
प्रतिस्पर्धी अवरोधक:
ए. एंजाइम के सक्रिय केंद्र के साथ सहसंयोजक बंधन बनाते हैं बी. एलोस्टेरिक केंद्र के साथ बातचीत करते हैं
बी. एंजाइम की सक्रिय साइट के साथ बातचीत करके कमजोर बंधन बनाता है
D. K w को कम करें D. V अधिकतम को कम करें
2. सही उत्तर का चयन करें। अपरिवर्तनीय अवरोधक:
A. वे सब्सट्रेट B के संरचनात्मक एनालॉग हैं। वे एंजाइम के साथ सहसंयोजक बंधन बनाते हैं
बी. एंजाइम के साथ कमजोर बंधन बनाते हैं
डी. नियामक केंद्र के साथ बातचीत करें
डी. सब्सट्रेट एकाग्रता में वृद्धि के साथ उनके प्रभाव को कम करें
3. सही जवाब चुनें। एलोस्टेरिक एंजाइम आम तौर पर होते हैं:
A. वे तृतीयक संरचना वाले प्रोटीन हैं
B. कई प्रोटोमर्स से मिलकर बना होता है C. अपरिवर्तनीय रूप से बाधित होता है
D. उनके सक्रिय और एलोस्टेरिक केंद्र अलग-अलग प्रोटोमर्स पर स्थित होते हैं
डी. इस प्रक्रिया के मेटाबोलाइट्स द्वारा विनियमित
4. सही जवाब चुनें।
जब एंजाइमों को आंशिक प्रोटियोलिसिस द्वारा नियंत्रित किया जाता है, तो निम्नलिखित होता है:
A. प्रोटीन पेप्टाइड श्रृंखला का छोटा होना
बी. एंजाइम की द्वितीयक और तृतीयक संरचना में परिवर्तन
बी. अपरिवर्तनीय सक्रियण
डी. अपरिवर्तनीय निषेध
D. सक्रिय केंद्र का गठन
5. सही उत्तर का चयन करें।
प्रोटीन-प्रोटीन अंतःक्रिया के माध्यम से एंजाइम गतिविधि का विनियमन निम्न के साथ होता है:
ए. अपरिवर्तनीय निषेध
बी. नियामक प्रोटीन उपइकाइयों का जुड़ाव या पृथक्करण
बी. एलोस्टेरिक केंद्र से एक प्रभावक अणु का जुड़ाव डी. एंजाइम का फॉस्फोराइलेशन
डी. एंजाइम का डिफॉस्फोराइलेशन
6. सही जवाब चुनें। एन्जाइमोडायग्नोस्टिक्स इस पर आधारित है:
A. ऊतक क्षति के दौरान रक्त में एंजाइमों का निकलना B. अंग विशिष्टता
बी. उच्च एंजाइम स्थिरता
डी. विभिन्न ऊतकों में कुछ आइसोएंजाइमों की प्रबलता डी. रक्त में नैदानिक रूप से महत्वपूर्ण एंजाइमों की कम गतिविधि या गतिविधि की पूर्ण अनुपस्थिति सामान्य है
7. मिलान।
रोगों के निदान के लिए उपयोग किया जाता है:
बी. प्रोस्टेट ग्रंथि
बी. अग्न्याशय डी. किडनी
डी. दिल एंजाइम:
1. क्रिएटिन काइनेज
2. एमाइलेज
3. एसिड फॉस्फेट
8. "श्रृंखला" कार्य पूरा करें:
ए) मायोकार्डियल रोधगलन के एंजाइमैटिक निदान के दौरान निर्धारित एंजाइमों में से एक है:
ए. एसिड फॉस्फेटस बी. लैक्टेट डिहाइड्रोजनेज
बी एमाइलेज़
बी) यह एंजाइम एंजाइमों के वर्ग से संबंधित है:
A. हाइड्रोलेज़ B. लिगेज
बी ऑक्सीडोरडक्टेस
वी) एंजाइमों के इस वर्ग के सहएंजाइमों में से एक है:
A. पाइरिडोक्सल फॉस्फेट B. बायोटिन
जी) वह विटामिन जो इस कोएंजाइम का अग्रदूत है:
A. निकोटिनिक एसिड B. पाइरिडोक्सिन
9. "श्रृंखला" कार्य पूरा करें:
ए) कार्बनिक फ्लोरोफॉस्फेट के साथ विषाक्तता के बाद, एक व्यक्ति अनुभव करता है:
ए. पुतली का फैलाव
बी. चिकनी मांसपेशियों का संकुचन बढ़ जाना
बी. चिकनी मांसपेशियों को आराम
बी) इस प्रभाव का कारण यह है:
A. Na+, E+-ATPase की ख़राब कार्यप्रणाली B. एसिटाइलकोलाइन की मात्रा में वृद्धि
बी. एसिटाइलकोलाइन की मात्रा कम करना
वी) यह इस तथ्य के कारण है कि फ्लोरोफॉस्फेट:
A. वे एसिटाइलकोलिनेस्टरेज़ (AChE) के प्रतिस्पर्धी अवरोधक हैं
B. AChE के साथ सहसंयोजक बंधन बनाएं
बी. एसिटाइलकोलाइन के संश्लेषण को बाधित करें
जी) निषेध की इस विधि को कहा जाता है:
ए. अपरिवर्तनीय बी. प्रतिवर्ती
बी. प्रतिस्पर्धी
डी) उपयोग करते समय निषेध की एक समान विधि देखी जाती है:
ए. ट्रैसिलोल बी. एस्पिरिन
बी प्रोसेरिना
"आत्म-नियंत्रण कार्यों" के उत्तर के मानक
3. बी, जी, डी
4. ए, बी, सी, डी
6. ए, बी, डी, डी
7. 1-डी, 2-बी, 3-बी
8. ए) बी, बी) सी, सी) सी, डी) ए
9. ए) बी, बी) बी, सी) बी, डी) ए, ई) बी
बुनियादी नियम और अवधारणाएँ
1. मेटाबोलिक मार्ग
2. एंजाइम निषेध
3. एंजाइम सक्रियण
4. प्रतिवर्ती निषेध
5. अपरिवर्तनीय निषेध
6. प्रतिस्पर्धात्मक निषेध
7. एलोस्टेरिक विनियमन
8. एलोस्टेरिक प्रभावकारक
9. प्रमुख एंजाइम
10. फोरस्फोरिलेशन द्वारा विनियमन - डिफॉस्फोराइलेशन
11. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा विनियमन
12. आंशिक प्रोटियोलिसिस
13. आइसोएंजाइम
14. एन्जाइमोपैथी
15. एंजाइमोडायग्नोस्टिक्स
कक्षा कार्य के लिए कार्य
समस्याओं का समाधान
1. मानव कोशिकाओं में, न्यूक्लिक एसिड के संश्लेषण के लिए आवश्यक प्यूरीन न्यूक्लियोटाइड के संश्लेषण के लिए चयापचय मार्ग राइबोस-5-फॉस्फेट के एक अणु से शुरू होता है। संश्लेषण प्रक्रिया के दौरान, एक निश्चित चरण में, यह प्रक्रिया शाखाबद्ध होती है और दो प्यूरीन न्यूक्लियोटाइड्स - एएमपी और जीएमपी (छवि 2.37) के गठन के साथ समाप्त होती है। कोशिका में इन न्यूक्लियोटाइड्स के समतुल्य अनुपात बनाने के लिए, एक नकारात्मक प्रतिक्रिया तंत्र का उपयोग करके कई प्रमुख एंजाइमों का बहु-चरण विनियमन होता है। इस प्रकार, एएमपी गठन की अधिकता के साथ, एडेनिलोसुसिनेट का गठन धीमा हो जाता है, और जीएमपी की अधिकता के साथ, ज़ैंथोसिन मोनोफॉस्फेट का गठन धीमा हो जाता है। वहीं, अगर इन दोनों न्यूक्लियोटाइड का सेवन नहीं किया जाता है, तो फॉस्फोरिबोसिल डिफॉस्फेट का निर्माण धीमा हो जाता है। अनुमान लगाएं कि प्यूरीन न्यूक्लियोटाइड के संश्लेषण के लिए चयापचय पथ के कौन से एंजाइम नियामक हैं। जवाब देने के लिए:
ए) परिभाषाएँ दें: "चयापचय मार्ग" और "चयापचय मार्ग के प्रमुख एंजाइम";
बी) अनुमान लगाएं कि चित्र में कौन सा एंजाइम दिखाया गया है। 2.37 नियामक हैं;
ग) इन एंजाइमों के नियमन के तंत्र, चयापचय पथ में उनके स्थानीयकरण और संरचनात्मक विशेषताओं को इंगित करें;
घ) नाम बताएं कि कौन से यौगिक और कौन से एंजाइम प्रभावकारी हैं;
ई) "नकारात्मक प्रतिक्रिया तंत्र द्वारा" विनियमन की अवधारणा को उचित ठहराएं।

चावल। 2.37. एक कोशिका में प्यूरीन न्यूक्लियोटाइड के निर्माण की योजना
2. 1935 में, जर्मन डॉक्टर जी. डोमैग्क ने डाई के रूप में संश्लेषित प्रोटोनसिल (लाल स्ट्रेप्टोसाइड) के रोगाणुरोधी प्रभाव की खोज की। यह जल्द ही स्थापित हो गया कि लाल स्ट्रेप्टोसाइड का सक्रिय सिद्धांत इसके चयापचय के दौरान बनने वाला सल्फोनामाइड (स्ट्रेप्टोसाइड) है, जो सल्फोनामाइड दवाओं के एक बड़े समूह का पूर्वज था (चित्र 2.38)।
 चावल। 2.38. फोलिक एसिड की संरचना और सल्फोनामाइड्स का सामान्य सूत्र
चावल। 2.38. फोलिक एसिड की संरचना और सल्फोनामाइड्स का सामान्य सूत्र
सल्फोनामाइड्स का बैक्टीरियोस्टेटिक प्रभाव यह है कि वे बैक्टीरिया द्वारा फोलिक एसिड के संश्लेषण के दौरान एंजाइम डायहाइड्रोप्टियोरेट सिंथेज़ के सक्रिय केंद्र में पैरा-एमिनोबेंजोइक एसिड (पीएबीए) को प्रतिस्थापित करते हैं, जो न्यूक्लिक एसिड के गठन के लिए आवश्यक है; परिणामस्वरूप, सूक्ष्मजीवों की वृद्धि और विकास बाधित हो जाता है। फोलिक एसिड मानव शरीर में संश्लेषित नहीं होता है, लेकिन विटामिन के रूप में भोजन के साथ आपूर्ति किया जाता है।
सल्फोनामाइड्स की जीवाणुरोधी क्रिया के तंत्र की व्याख्या करें; ऐसा करने के लिए, प्रश्नों के उत्तर दें:
ए) इस प्रकार के निषेध को क्या कहा जाता है (सल्फोनामाइड्स और पीएबीए की संरचनाओं की तुलना करें)? ऐसे अवरोधक Kt और Vmax को कैसे प्रभावित करते हैं?
ग) उपचार के दौरान आमतौर पर सल्फोनामाइड्स की लोडिंग खुराक तुरंत क्यों निर्धारित की जाती है?
घ) क्या सल्फोनामाइड्स मानव कोशिकाओं में न्यूक्लिक एसिड के निर्माण को प्रभावित करेंगे? अपना जवाब समझाएं।
3. अवसादग्रस्त विकारों से पीड़ित 2 रोगियों ने मनोचिकित्सक से परामर्श लिया। यह ज्ञात है कि कुछ मामलों में मनुष्यों में अवसाद का कारण सिनैप्टिक फांक में न्यूरोट्रांसमीटर की कमी है। इसके अलावा मस्तिष्क में मोनोमाइन ऑक्सीडेस (एमएओ) समूह के एंजाइम होते हैं, जो सिनैप्टिक फांक में जारी न्यूरोट्रांसमीटर को नष्ट कर देते हैं। पहले रोगी को पिरलिंडोल निर्धारित किया गया था, जो मध्यस्थ सेरोटोनिन का एक संरचनात्मक एनालॉग है। दूसरा नियालामाइड है, जो एमएओ की सक्रिय साइट पर सहसंयोजक रूप से बंधने में सक्षम है। इन दवाओं की कार्रवाई के तंत्र की व्याख्या करें और बताएं कि किस रोगी पर दवा के प्रति अधिक तेजी से प्रतिक्रिया होने की सबसे अधिक संभावना है। जवाब देने के लिए:
ए) एमएओ पर इन दवाओं के प्रभाव का वर्णन करें, इसमें अंतर बताएं
इस एंजाइम के साथ बातचीत के तंत्र;
बी) पिरलिंडोल और नियालामाइड द्वारा एमएओ निषेध के लिए एक योजना दें;
ग) इन दवाओं के निषेध की क्रियाविधि के आधार पर समझाइए
किसका शरीर पर लंबे समय तक प्रभाव रहेगा और क्यों।
4. हाल ही में, विंडशील्ड वॉशर एजेंटों सहित वाहन देखभाल उत्पादों में उपयोग किए जाने वाले तकनीकी तरल पदार्थों के उत्पादन के लिए मेथनॉल के उपयोग में वृद्धि हुई है। मिथाइल अल्कोहल या मेथनॉल का मुख्य खतरा सरोगेट अल्कोहल के रूप में इसका उपयोग है, जिससे मृत्यु हो जाती है। इस प्रकार, रोज़्ज़ड्राव के वैज्ञानिक और व्यावहारिक विष विज्ञान केंद्र के अनुसार, मेथनॉल द्वारा जहर वाले रोगियों का अनुपात अस्पताल में भर्ती सभी रोगियों में 0.1 से 0.5% तक है। मेथनॉल विषाक्तता का कारण बताएं और चिकित्सा उपचार कैसे प्रदान करें यदि यह ज्ञात है कि मेथनॉल एंजाइम एसीटैल्डिहाइड डिहाइड्रोजनेज की गतिविधि को रोकता है, जो इथेनॉल के अपचय में शामिल है, जो एसीटैल्डिहाइड के संचय का कारण बनता है। प्रश्न का उत्तर देने के लिए:
ए) इथेनॉल की ऑक्सीकरण प्रतिक्रियाएं लिखें, यह ध्यान में रखते हुए कि ऑक्सीकरण होता है
एक मध्यवर्ती यौगिक के निर्माण के साथ दो चरणों में होता है - एसीटैल्डिहाइड; अंतिम उत्पाद एसिटिक एसिड है; दोनों प्रतिक्रियाओं का कोएंजाइम NAD+ है;
बी) मेथनॉल का संरचनात्मक सूत्र लिखें और एंजाइम गतिविधि के निषेध के तंत्र को इंगित करें;
ग) मेथनॉल विषाक्तता के मामलों में उपचार की एक विधि का सुझाव दें।
5. पुराने दिनों में, इतालवी महिलाएं अपनी आंखों में बेलाडोना का रस डालती थीं, जिससे पुतलियां फैल जाती थीं और आंखों में एक विशेष चमक आ जाती थी। अब यह ज्ञात है कि एक समान प्रभाव कई पौधों में निहित अल्कलॉइड एट्रोपिन के कारण होता है: बेलाडोना, हेनबेन, धतूरा। एट्रोपिन की क्रिया की क्रियाविधि समझाइये। इसके लिए:
ए) उन रिसेप्टर्स का नाम बताएं जिन्हें एट्रोपिन रोकता है (मॉड्यूल 1 देखें), रिसेप्टर्स के प्रकार और घटनाओं के अनुक्रम को इंगित करें जब एट्रोपिन आंखों में जाता है;
बी) उत्तर दें कि एट्रोपिन और समान प्रभाव वाली दवाओं का उपयोग दवा में कहां किया जाता है;
ग) बताएं कि एट्रोपिन की अधिक मात्रा के मामले में क्या उपाय किए जा सकते हैं? एसिटाइलकोलाइन की सांद्रता बढ़ाने के संभावित तरीकों का औचित्य बताएं और इस क्रिया की आवश्यकता को समझाएं।
6. बड़ी खुराक का उपयोग कैफीनलोगों में एड्रेनालाईन के प्रभाव के समान लक्षण उत्पन्न होते हैं: हृदय गति में वृद्धि; ब्रोन्कियल फैलाव, उत्तेजना, ऊर्जा वाहक जमा करने वाले ऊतकों में चयापचय में परिवर्तन। कैफीन की क्रिया के तंत्र की व्याख्या करें, यह ध्यान में रखते हुए कि यह एंजाइम फॉस्फोडिएस्टरेज़ (पीडीई) का एक प्रतिस्पर्धी अवरोधक है, जो सीएमपी के टूटने के लिए जिम्मेदार है:
इस प्रश्न का उत्तर देने के लिए:
ए) उत्तर, कैफीन के प्रभाव में कोशिका में किस पदार्थ की सांद्रता बढ़ेगी;
बी) सेल में सीएमपी की नियामक कार्रवाई के तंत्र की व्याख्या कर सकेंगे; एंजाइम की संरचना को योजनाबद्ध रूप से चित्रित करें, जो कोशिका में सीएमपी की सांद्रता में वृद्धि के कारण सक्रिय होता है;
ग) नाम बताएं कि कैफीन के उपयोग के परिणामस्वरूप कोशिका में कौन सी प्रक्रियाएँ सक्रिय होंगी? इन प्रतिक्रियाओं का एक चित्र लिखें;
डी) याद रखें कि कार्रवाई का एक समान तंत्र उन दवाओं में देखा जाता है जो रक्त के रियोलॉजिकल गुणों में सुधार करते हैं (उदाहरण के लिए, ट्रेंटल),साथ ही ऐसी दवाएं जिनका उपयोग ब्रांकाई को आराम देने और ब्रोंकोस्पज़म से राहत देने के लिए किया जाता है (उदाहरण के लिए, थियोफिलाइन)।
7. रोगी एल को संदिग्ध मायोकार्डियल रोधगलन के साथ अस्पताल में भर्ती कराया गया था। मरीज के मुताबिक डॉक्टर के आने से 5 घंटे पहले उन्हें सांस लेने में तकलीफ महसूस हुई. डॉक्टर को मायोकार्डियल रोधगलन का संदेह हुआ और मरीज को अस्पताल में भर्ती कराया गया। अस्पताल में, निदान की पुष्टि के लिए कई दिनों तक जैव रासायनिक रक्त परीक्षण किया गया। विश्लेषण के परिणाम तालिका में प्रस्तुत किए गए हैं। 2.9. क्या प्राप्त डेटा डॉक्टर के निदान की पुष्टि करता है? जवाब देने के लिए:
एनजाइम | गतिविधि, आईयू/एल | बहुलता | गतिविधि, आईयू/एल | बहुलता |
पोत अवरोधन के 12 घंटे बाद | पोत अवरोधन के 72 घंटे बाद |
|||
पोत अवरोधन के 24 घंटे बाद | पोत अवरोधन के 96 घंटे बाद |
|||
पोत अवरोधन के 48 घंटे बाद | पोत अवरोधन के 120 घंटे बाद |
|||
चयापचय मार्गों के नियमन में तीन प्रकार के तंत्र शामिल होते हैं। उनमें से पहला, जो स्थिति में किसी भी बदलाव पर सबसे तेज़ी से प्रतिक्रिया करता है, एलोस्टेरिक एंजाइमों (चित्र 13-15) की क्रिया से जुड़ा है, जिसकी उत्प्रेरक गतिविधि विशेष पदार्थों के प्रभाव में बदल सकती है जिनमें उत्तेजक या निरोधात्मक प्रभाव (इन्हें प्रभावकारक या न्यूनाधिक कहा जाता है; धारा 9.18)।
एक नियम के रूप में, एलोस्टेरिक एंजाइम किसी दिए गए मल्टीएंजाइम अनुक्रम की शुरुआत में या शुरुआत के करीब एक स्थान पर कब्जा कर लेते हैं और उस चरण को उत्प्रेरित करते हैं जो संपूर्ण प्रक्रिया की दर को सीमित करता है; आमतौर पर ऐसे चरण की भूमिका व्यावहारिक रूप से अपरिवर्तनीय प्रतिक्रिया द्वारा निभाई जाती है।
चावल। 13-15. फीडबैक प्रकार के आधार पर कैटोबोलिक मार्ग का विनियमन, यानी इस प्रक्रिया के अंतिम उत्पाद द्वारा एलोस्टेरिक एंजाइम के निषेध के कारण। अक्षर J, K, L, आदि इस चयापचय पथ के मध्यवर्ती उत्पादों को इंगित करते हैं, और अक्षर E1, E2, E3, आदि उन एंजाइमों को इंगित करते हैं जो व्यक्तिगत चरणों को उत्प्रेरित करते हैं। पहला चरण एक एलोस्टेरिक एंजाइम (ईडी) द्वारा उत्प्रेरित होता है जो इस प्रतिक्रिया अनुक्रम के अंतिम उत्पाद द्वारा बाधित होता है। एलोस्टेरिक निषेध को एक टूटे हुए लाल तीर द्वारा दर्शाया जाता है जो निरोधात्मक मेटाबोलाइट को एलोस्टेरिक एंजाइम द्वारा उत्प्रेरित प्रतिक्रिया से जोड़ता है। विनियमित चरण (ईजे एंजाइम द्वारा उत्प्रेरित आमतौर पर सेलुलर स्थितियों के तहत एक लगभग अपरिवर्तनीय प्रतिक्रिया होती है।
एडीपी से एटीपी के संश्लेषण के साथ होने वाली अपचयी प्रक्रियाओं में, यह अंतिम उत्पाद, एटीपी, अक्सर अपचय के प्रारंभिक चरणों में से एक के एलोस्टेरिक अवरोधक के रूप में कार्य करता है। उपचय के शुरुआती चरणों में से एक का एलोस्टेरिक अवरोधक अक्सर जैवसंश्लेषण का अंतिम उत्पाद होता है, उदाहरण के लिए, कुछ अमीनो एसिड (धारा 9.18)। कुछ एलोस्टेरिक एंजाइमों की गतिविधि विशिष्ट सकारात्मक मॉड्यूलेटर द्वारा उत्तेजित होती है। एक एलोस्टेरिक एंजाइम जो कैटोबोलिक प्रतिक्रिया अनुक्रमों में से एक को नियंत्रित करता है, उदाहरण के लिए, सकारात्मक मॉड्यूलेटर, एडीपी या एएमपी के उत्तेजक प्रभाव और नकारात्मक मॉड्यूलेटर, एटीपी के निरोधात्मक प्रभाव के अधीन हो सकता है। ऐसे मामले भी होते हैं जब एक चयापचय मार्ग का एलोस्टेरिक एंजाइम अन्य चयापचय मार्गों के मध्यवर्ती या अंतिम उत्पादों के लिए एक विशिष्ट तरीके से प्रतिक्रिया करता है। इसके लिए धन्यवाद, विभिन्न एंजाइम प्रणालियों की कार्रवाई की गति का समन्वय करना संभव है।
दूसरे प्रकार का तंत्र जो उच्च जीवों में चयापचय को नियंत्रित करता है वह हार्मोनल विनियमन है (चित्र 13-16)। हार्मोन विशेष रासायनिक पदार्थ (रासायनिक "संदेशवाहक") होते हैं जो विभिन्न अंतःस्रावी ग्रंथियों द्वारा उत्पादित होते हैं और सीधे रक्त में छोड़े जाते हैं; वे रक्त द्वारा अन्य ऊतकों या अंगों तक पहुंचाए जाते हैं और यहां वे कुछ प्रकार की चयापचय गतिविधि को उत्तेजित या बाधित करते हैं। उदाहरण के लिए, हार्मोन एपिनेफ्रिन, अधिवृक्क मज्जा द्वारा स्रावित होता है और रक्त द्वारा यकृत तक ले जाया जाता है, जहां यह ग्लाइकोजन के ग्लूकोज में टूटने को उत्तेजित करता है, जिससे रक्त शर्करा के स्तर में वृद्धि होती है। इसके अलावा, एड्रेनालाईन कंकाल की मांसपेशियों में ग्लाइकोजन के टूटने को उत्तेजित करता है; इस प्रक्रिया से लैक्टेट का निर्माण होता है और एटीपी के रूप में ऊर्जा का भंडारण होता है। एपिनेफ्रीन मांसपेशियों की कोशिकाओं या यकृत कोशिकाओं की सतह पर विशिष्ट रिसेप्टर साइटों से जुड़कर ये प्रभाव पैदा करता है।
एड्रेनालाईन का बंधन एक संकेत के रूप में कार्य करता है; यह संकेत कोशिका के आंतरिक भागों में संचारित होता है और यहां एक सहसंयोजक संशोधन का कारण बनता है, जिसके प्रभाव में ग्लाइकोजन फॉस्फोरिलेज़ (सिस्टम में पहला एंजाइम जो ग्लाइकोजन को ग्लूकोज और अन्य उत्पादों में परिवर्तित करता है; धारा 9.22) एक से गुजरता है कम सक्रिय रूप से अधिक सक्रिय रूप में परिवर्तित (चित्र 13-16)।
चयापचय को विनियमित करने वाले तीसरे प्रकार के तंत्र कोशिका में इस एंजाइम की एकाग्रता में परिवर्तन से जुड़े होते हैं। किसी भी क्षण किसी भी एंजाइम की सांद्रता उसके संश्लेषण और क्षय की दर के अनुपात से निर्धारित होती है। कुछ शर्तों के तहत कुछ एंजाइमों के संश्लेषण की दर तेजी से बढ़ जाती है; तदनुसार, कोशिका में इस एंजाइम की सांद्रता बढ़ जाती है। उदाहरण के लिए, यदि किसी जानवर को कार्बोहाइड्रेट से भरपूर लेकिन प्रोटीन की कमी वाला आहार मिलता है, तो उसके जिगर में एंजाइमों का स्तर बेहद कम होता है जो सामान्य परिस्थितियों में अमीनो एसिड के एसिटाइल-सीओए में टूटने को उत्प्रेरित करता है। चूँकि ऐसे आहार में इन एंजाइमों की व्यावहारिक रूप से आवश्यकता नहीं होती है, इसलिए वे बड़ी मात्रा में उत्पन्न नहीं होते हैं। हालाँकि, पशु को प्रोटीन से भरपूर आहार पर स्विच करना उचित है, और एक दिन के भीतर उसके जिगर में एंजाइमों की मात्रा काफ़ी बढ़ जाएगी, जिसे अब पचने योग्य अमीनो एसिड को तोड़ने की आवश्यकता होगी।

चावल। 13-16. एंजाइमी प्रतिक्रियाओं का हार्मोनल विनियमन। यकृत कोशिकाओं की सतह पर स्थित विशिष्ट रिसेप्टर्स के लिए हार्मोन एड्रेनालाईन के लगाव के परिणामस्वरूप, एक झिल्ली-बाध्य एंजाइम (एडेनाइलेट साइक्लेज़) की भागीदारी के साथ चक्रीय एडिनाइलेट का निर्माण होता है। उत्तरार्द्ध एक एलोस्टेरिक एक्टिवेटर, या इंट्रासेल्युलर मध्यस्थ के रूप में कार्य करता है, जिसके प्रभाव में ग्लाइकोजन फॉस्फोराइलेज एक निष्क्रिय रूप से सक्रिय रूप में गुजरता है, जिसमें यकृत ग्लाइकोजन के रक्त ग्लूकोज में रूपांतरण में तेजी आती है। इस चयापचय मार्ग का अध्याय में विस्तार से वर्णन किया गया है। 25.

चावल। 13-17. एंजाइम प्रेरण. सब्सट्रेट ए की उच्च इंट्रासेल्युलर सांद्रता एंजाइम ई1, ई2 और ई3 के जैवसंश्लेषण को उत्तेजित कर सकती है। कोशिका में इन एंजाइमों की सामग्री बढ़ जाती है, और इस तरह उन प्रतिक्रियाओं को तेज करने का अवसर पैदा होता है, जिसके परिणामस्वरूप अतिरिक्त सब्सट्रेट ए हटा दिया जाता है। इसलिए सब्सट्रेट ए की अधिकता कोशिका नाभिक के लिए एक संकेत के रूप में कार्य करती है, जो इसे उन जीनों को "चालू" करने के लिए मजबूर करती है जो एंजाइम एल, ई2 और ई3 के गठन को नियंत्रित करते हैं। जीन को शामिल करने का अर्थ है संबंधित संदेशवाहक आरएनए का संश्लेषण; यह राइबोसोम में प्रवेश करता है, और परिणामस्वरूप उनमें एंजाइम E1, E2 और E3 का संश्लेषण होता है।
इसलिए, लिवर कोशिकाओं में विशिष्ट एंजाइमों के जैवसंश्लेषण को चालू या बंद करने की क्षमता होती है, जो उनमें प्रवेश करने वाले पोषक तत्वों की प्रकृति पर निर्भर करता है। इस घटना को एंजाइम प्रेरण कहा जाता है (चित्र 13-17)।
1. कोशिका में सभी रासायनिक प्रतिक्रियाएँ एंजाइमों की भागीदारी से होती हैं। इसलिए, चयापचय पथ (एक पदार्थ का दूसरे पदार्थ में क्रमिक परिवर्तन) की दर को प्रभावित करने के लिए, एंजाइम अणुओं की संख्या या उनकी गतिविधि को विनियमित करना पर्याप्त है। आमतौर पर चयापचय मार्गों में होते हैं प्रमुख एंजाइमजिससे पूरे पथ की गति नियंत्रित रहती है। इन एंजाइमों (चयापचय पथ में एक या अधिक) को कहा जाता है नियामक एंजाइम.एंजाइमेटिक प्रतिक्रियाओं की दर का विनियमन तीन स्वतंत्र स्तरों पर किया जाता है: एंजाइम अणुओं की संख्या को बदलकर, सब्सट्रेट और कोएंजाइम अणुओं की उपलब्धता, और एंजाइम अणु की उत्प्रेरक गतिविधि को बदलकर (तालिका 2.6)।
तालिका 2.5. एंजाइमी प्रतिक्रियाओं की दर को विनियमित करने के तरीके
| नियमन की विधि | विशेषता |
| एंजाइम अणुओं की संख्या में परिवर्तन | किसी कोशिका में एंजाइम अणुओं की संख्या दो प्रक्रियाओं के अनुपात से निर्धारित होती है: संश्लेषण और क्षय। एंजाइम संश्लेषण के नियमन का सबसे अधिक अध्ययन किया गया तंत्र प्रतिलेखन (एमआरएनए संश्लेषण) के स्तर पर है, जो कुछ मेटाबोलाइट्स, हार्मोन और कई जैविक रूप से सक्रिय अणुओं द्वारा नियंत्रित होता है। |
| सब्सट्रेट और कोएंजाइम अणुओं की उपलब्धता | एक महत्वपूर्ण पैरामीटर जो एंजाइमेटिक प्रतिक्रिया के पाठ्यक्रम को नियंत्रित करता है वह सब्सट्रेट और कोएंजाइम की उपस्थिति है। प्रारंभिक सब्सट्रेट की सांद्रता जितनी अधिक होगी, प्रतिक्रिया दर उतनी ही अधिक होगी |
| एक एंजाइम अणु की उत्प्रेरक गतिविधि में परिवर्तन | एंजाइम गतिविधि को विनियमित करने के मुख्य तरीके हैं: - एलोस्टेरिक विनियमन; - प्रोटीन-प्रोटीन इंटरैक्शन का उपयोग करके विनियमन; - एंजाइम अणु के फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा विनियमन; - आंशिक (सीमित) प्रोटियोलिसिस द्वारा विनियमन |
आइए एंजाइम अणु की उत्प्रेरक गतिविधि को बदलकर एंजाइमेटिक प्रतिक्रियाओं की दर को विनियमित करने के तरीकों पर विचार करें।
2. एलोस्टेरिक विनियमन। एलोस्टेरिक एंजाइमबुलाया एंजाइम, गतिविधिकौन समायोजित कर सकते हैंका उपयोग करके प्रभावकारक पदार्थ.एलोस्टेरिक विनियमन में शामिल प्रभावकारक सेलुलर मेटाबोलाइट्स होते हैं जो अक्सर उसी मार्ग में भागीदार होते हैं जिसे वे नियंत्रित करते हैं।
वह कारक जो उत्पन्न करता है कमी (निषेध)एन्जाइम गतिविधि कहलाती है अवरोधक.वह कारक जो उत्पन्न करता है वृद्धि (सक्रियण)एन्जाइम गतिविधि कहलाती है उत्प्रेरक.
एलोस्टेरिक एंजाइमों में कुछ संरचनात्मक विशेषताएं होती हैं:
आमतौर पर हैं ऑलिगोमेरिक प्रोटीन,कई प्रोटोमर से मिलकर;
पास होना एलोस्टेरिक केंद्र,उत्प्रेरक सक्रिय स्थल से स्थानिक रूप से दूर;
इफ़ेक्टर एलोस्टेरिक (नियामक) केंद्रों पर गैर-सहसंयोजक रूप से एंजाइम से जुड़ते हैं।
एलोस्टेरिक केंद्र, उत्प्रेरक की तरह, लिगेंड के संबंध में विभिन्न विशिष्टता प्रदर्शित कर सकते हैं: यह निरपेक्ष या समूह हो सकता है। कुछ एंजाइमों में कई एलोस्टेरिक केंद्र होते हैं, जिनमें से कुछ सक्रियकर्ताओं के लिए विशिष्ट होते हैं, अन्य अवरोधकों के लिए।
प्रोटोमर जिस पर एलोस्टेरिक केंद्र स्थित होता है, कहलाता है नियामक प्रोटोमरभिन्न उत्प्रेरक प्रोटोमर,जिसमें एक सक्रिय केंद्र होता है जिसमें रासायनिक प्रतिक्रिया होती है।
एलोस्टेरिक एंजाइम्स का गुण होता है सहयोगात्मकता:एक एलोस्टेरिक केंद्र के साथ एक एलोस्टेरिक प्रभावकार की अंतःक्रिया सभी उपइकाइयों की संरचना में एक सहकारी परिवर्तन का कारण बनती है, जिससे सक्रिय केंद्र की संरचना में परिवर्तन होता है और सब्सट्रेट के लिए एंजाइम की आत्मीयता में परिवर्तन होता है, जो कम या बढ़ जाता है। एंजाइम की उत्प्रेरक गतिविधि. यदि एक अवरोधक एलोस्टेरिक केंद्र से जुड़ा हुआ है, तो सहकारी गठनात्मक परिवर्तनों के परिणामस्वरूप, सक्रिय केंद्र की संरचना में परिवर्तन होता है, जिससे सब्सट्रेट के लिए एंजाइम की आत्मीयता में कमी आती है और, तदनुसार, कमी आती है। एंजाइमी प्रतिक्रिया की दर. इसके विपरीत, यदि एक एक्टिवेटर एलोस्टेरिक केंद्र से जुड़ा होता है, तो सब्सट्रेट के लिए एंजाइम की आत्मीयता बढ़ जाती है, जिससे प्रतिक्रिया दर में वृद्धि होती है। एलोस्टेरिक प्रभावकों की कार्रवाई के तहत घटनाओं का क्रम चित्र में प्रस्तुत किया गया है। 2.26.
एलोस्टेरिक एंजाइमों का विनियमन प्रतिवर्ती:नियामक सबयूनिट से प्रभावकारक का पृथक्करण एंजाइम की मूल उत्प्रेरक गतिविधि को पुनर्स्थापित करता है।
एलोस्टेरिक एंजाइम प्रमुख प्रतिक्रियाओं को उत्प्रेरित करेंइस चयापचय मार्ग का.
एलोस्टेरिक एंजाइम विभिन्न चयापचय मार्गों में एक महत्वपूर्ण भूमिका निभाते हैं, क्योंकि वे कोशिका की आंतरिक संरचना में थोड़े से बदलाव पर बहुत तेज़ी से प्रतिक्रिया करते हैं। चयापचय प्रक्रियाओं की गति प्रतिक्रियाओं की दी गई श्रृंखला में उपयोग किए गए और गठित दोनों पदार्थों की एकाग्रता पर निर्भर करती है। पूर्ववर्ती चयापचय पथ में एलोस्टेरिक एंजाइमों के सक्रियकर्ता हो सकते हैं। उसी समय, जब किसी चयापचय मार्ग का अंतिम उत्पाद जमा हो जाता है, तो यह एंजाइम के एलोस्टेरिक अवरोधक के रूप में कार्य कर सकता है। नियमन की यह विधि शरीर में आम है और इसे "नकारात्मक प्रतिक्रिया" कहा जाता है:
 चावल। 2.26. एलोस्टेरिक एंजाइम की संरचना और कार्यप्रणाली की योजना:
चावल। 2.26. एलोस्टेरिक एंजाइम की संरचना और कार्यप्रणाली की योजना:
ए - एक नकारात्मक प्रभावकारक (अवरोधक) की क्रिया। अवरोधक (I) एलोस्टेरिक केंद्र से जुड़ जाता है, जो एंजाइम के सक्रिय केंद्र सहित एंजाइम अणु में सहकारी गठनात्मक परिवर्तन का कारण बनता है। सब्सट्रेट के लिए एंजाइम की आत्मीयता कम हो जाती है, और परिणामस्वरूप, एंजाइमेटिक प्रतिक्रिया की दर कम हो जाती है; बी - एक सकारात्मक प्रभावकारक (सक्रियकर्ता) की कार्रवाई। एक्टिवेटर (ए) एलोस्टेरिक केंद्र से जुड़ता है, जो सहकारी गठनात्मक परिवर्तनों का कारण बनता है। सब्सट्रेट के लिए एंजाइम की आत्मीयता बढ़ जाती है और एंजाइमेटिक प्रतिक्रिया की दर बढ़ जाती है। एंजाइम गतिविधि पर अवरोधक और उत्प्रेरक दोनों के प्रतिवर्ती प्रभाव का प्रदर्शन किया गया है
आइए ग्लूकोज अपचय की प्रक्रिया के एलोस्टेरिक विनियमन पर विचार करें, जो एटीपी अणु के निर्माण के साथ समाप्त होता है (चित्र 2.27)। इस घटना में कि कोशिका में एटीपी अणुओं का उपभोग नहीं किया जाता है, यह इस चयापचय मार्ग के एलोस्टेरिक एंजाइमों का अवरोधक है: फ़ॉस्फ़ोफ़्रुक्टोकिनेज़ और पाइरूवेट किनेज़। इसी समय, ग्लूकोज अपचय का मध्यवर्ती मेटाबोलाइट, फ्रुक्टोज-1,6-बिस्फोस्फेट, पाइरूवेट किनेज़ एंजाइम का एक एलोस्टेरिक उत्प्रेरक है। चयापचय मार्ग के अंतिम उत्पाद द्वारा अवरोध और प्रारंभिक चयापचयों द्वारा सक्रियण की अनुमति मिलती है
 चावल। 2.27. ग्लूकोज अपचय की प्रक्रिया का एलोस्टेरिक विनियमन।
चावल। 2.27. ग्लूकोज अपचय की प्रक्रिया का एलोस्टेरिक विनियमन।
एटीपी अणु चयापचय पथ एंजाइमों का एक एलोस्टेरिक अवरोधक है - फॉस्फोफ्रक्टोकिनेज और पाइरूवेट किनेज। फ्रुक्टोज-1,6-बिस्फोस्फेट अणु एंजाइम पाइरूवेट काइनेज का एक एलोस्टेरिक उत्प्रेरक है
चयापचय पथ की गति को नियंत्रित करें। एलोस्टेरिक एंजाइम, एक नियम के रूप में, चयापचय पथ की प्रारंभिक प्रतिक्रियाओं, अपरिवर्तनीय प्रतिक्रियाओं, दर-सीमित प्रतिक्रियाओं (सबसे धीमी) या चयापचय पथ के शाखा बिंदु पर प्रतिक्रियाओं को उत्प्रेरित करते हैं।
3. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा विनियमन।कुछ एंजाइम प्रोटीन-प्रोटीन परस्पर क्रिया के परिणामस्वरूप अपनी गतिविधि बदलते हैं। इस तरह से एंजाइम गतिविधि को बदलने के लिए कम से कम दो तंत्रों को प्रतिष्ठित किया जा सकता है: एक्टिवेटर प्रोटीन के अतिरिक्त के परिणामस्वरूप एंजाइमों का सक्रियण (जी प्रोटीन के α-सबयूनिट द्वारा एंजाइम एडिनाइलेट साइक्लेज का सक्रियण, मॉड्यूल 4 देखें) और परिवर्तन प्रोटोमर्स के संयोजन और पृथक्करण के परिणामस्वरूप उत्प्रेरक गतिविधि में।
प्रोटोमर्स के जुड़ाव या पृथक्करण द्वारा एंजाइमों की उत्प्रेरक गतिविधि के नियमन के एक उदाहरण के रूप में, हम एंजाइम प्रोटीन काइनेज ए के नियमन पर विचार कर सकते हैं।
प्रोटीन काइनेज ए(सीएमपी-आश्रित) में दो प्रकार की चार उपइकाइयाँ होती हैं: दो नियामक (आर) और दो उत्प्रेरक (सी)। इस टेट्रामर में उत्प्रेरक गतिविधि नहीं है। नियामक सबयूनिट में चक्रीय 3",5"-एएमपी (सीएमपी) (प्रत्येक सबयूनिट के लिए दो) के लिए बाइंडिंग साइट होती हैं। दो नियामक उपइकाइयों से चार सीएमपी अणुओं के जुड़ने से नियामक प्रोटोमर्स की संरचना में बदलाव होता है और टेट्रामेरिक कॉम्प्लेक्स का पृथक्करण होता है; यह दो सक्रिय उत्प्रेरक सबयूनिट जारी करता है (चित्र 2.28)। सक्रिय प्रोटीन काइनेज ए एटीपी से प्रोटीन के अमीनो एसिड अवशेषों के विशिष्ट ओएच समूहों में फॉस्फोरिक एसिड अवशेषों के स्थानांतरण को उत्प्रेरित करता है (यानी, यह प्रोटीन के फॉस्फोराइलेशन का कारण बनता है)।
 चावल। 2.28. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा प्रोटीन काइनेज ए (पीकेए) गतिविधि का विनियमन।
चावल। 2.28. प्रोटीन-प्रोटीन अंतःक्रिया द्वारा प्रोटीन काइनेज ए (पीकेए) गतिविधि का विनियमन।
पीकेए चार सीएमपी अणुओं द्वारा सक्रिय होता है, जो दो नियामक सबयूनिटों से जुड़ता है, जिससे नियामक प्रोटोमर्स की संरचना में बदलाव होता है और टेट्रामेरिक कॉम्प्लेक्स का पृथक्करण होता है। यह दो सक्रिय उत्प्रेरक सबयूनिट जारी करता है जो प्रोटीन फॉस्फोराइलेशन का कारण बन सकता है
नियामक उपइकाइयों से सीएमपी अणुओं के टूटने से एक निष्क्रिय कॉम्प्लेक्स के गठन के साथ प्रोटेन कीनेज ए के नियामक और उत्प्रेरक उपइकाइयों का जुड़ाव होता है।
4. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइमों की उत्प्रेरक गतिविधि का विनियमन।जैविक प्रणालियों में, उनके सहसंयोजक संशोधन का उपयोग करके एंजाइमों की गतिविधि को विनियमित करने के लिए एक तंत्र अक्सर सामने आता है। एंजाइमों के रासायनिक संशोधन की एक त्वरित और व्यापक विधि उनका फॉस्फोराइलेशन-डीफॉस्फोराइलेशन है।
एंजाइम के OH समूह फॉस्फोराइलेशन से गुजरते हैं, जो एंजाइमों द्वारा किया जाता है प्रोटीन किनेसेस(फॉस्फोराइलेशन) और फॉस्फोप्रोटीन फॉस्फेटेस(डीफॉस्फोराइलेशन)। फॉस्फोरिक एसिड अवशेषों के जुड़ने से सक्रिय केंद्र की संरचना और इसकी उत्प्रेरक गतिविधि में परिवर्तन होता है। इस मामले में, परिणाम दोहरा हो सकता है: कुछ एंजाइम फॉस्फोराइलेशन के दौरान सक्रिय होते हैं, जबकि अन्य, इसके विपरीत, कम सक्रिय हो जाते हैं (चित्र 2.29)। प्रोटीन किनेसेस और फॉस्फोप्रोटीन फॉस्फेटेस की गतिविधि हार्मोन द्वारा नियंत्रित होती है, जो चयापचय मार्गों में प्रमुख एंजाइमों की गतिविधि को पर्यावरणीय स्थितियों के आधार पर तेजी से भिन्न होने की अनुमति देती है।
 चावल। 2.29. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइम गतिविधि के नियमन की योजना।
चावल। 2.29. फॉस्फोराइलेशन-डीफॉस्फोराइलेशन द्वारा एंजाइम गतिविधि के नियमन की योजना।
एंजाइमों का फास्फोराइलेशन एंजाइम प्रोटीन काइनेज की मदद से होता है। फॉस्फोरिक एसिड अवशेष का दाता एटीपी अणु है। एक एंजाइम का फॉस्फोराइलेशन इसकी संरचना और सक्रिय साइट की संरचना को बदल देता है, जो सब्सट्रेट के लिए एंजाइम की आत्मीयता को बदल देता है। इस मामले में, कुछ एंजाइम फॉस्फोराइलेशन के दौरान सक्रिय होते हैं, जबकि अन्य बाधित होते हैं। विपरीत प्रक्रिया - डीफॉस्फोराइलेशन - एंजाइम फॉस्फोप्रोटीन फॉस्फेटेस के कारण होता है, जो एंजाइम से फॉस्फोरिक एसिड अवशेषों को अलग कर देता है और एंजाइम को उसकी मूल स्थिति में लौटा देता है।
5. आंशिक (सीमित) प्रोटियोलिसिस द्वारा एंजाइमों की उत्प्रेरक गतिविधि का विनियमन।कुछ एंजाइम जो कोशिकाओं के बाहर (जठरांत्र पथ या रक्त प्लाज्मा में) कार्य करते हैं, उन्हें निष्क्रिय अग्रदूतों के रूप में संश्लेषित किया जाता है और केवल एक या अधिक विशिष्ट पेप्टाइड बांड के हाइड्रोलिसिस के परिणामस्वरूप सक्रिय होते हैं, जिससे अणु का हिस्सा समाप्त हो जाता है। प्रोटीन अणु के शेष भाग में, एक गठनात्मक पुनर्व्यवस्था होती है और एंजाइम का सक्रिय केंद्र बनता है (चित्र 2.30)। जब किसी एंजाइम की गतिविधि बदल जाती है तो आंशिक प्रोटियोलिसिस विनियमन का एक उदाहरण है
 चावल। 2.30. आंशिक प्रोटियोलिसिस द्वारा पेप्सिन का सक्रियण।
चावल। 2.30. आंशिक प्रोटियोलिसिस द्वारा पेप्सिन का सक्रियण।
पेप्सिनोजेन (एक निष्क्रिय अणु) के एक या अधिक पेप्टाइड बांड के हाइड्रोलिसिस के परिणामस्वरूप, अणु का हिस्सा अलग हो जाता है और पेप्सिन एंजाइम का सक्रिय केंद्र बनता है
अपरिवर्तनीय. ऐसे एंजाइम आमतौर पर थोड़े समय के लिए कार्य करते हैं, जो प्रोटीन अणु के जीवनकाल द्वारा निर्धारित होता है। आंशिक प्रोटियोलिसिस पाचन प्रोटियोलिटिक एंजाइमों (पेप्सिन, ट्रिप्सिन, काइमोट्रिप्सिन, इलास्टेज), पेप्टाइड हार्मोन (इंसुलिन), रक्त जमावट प्रणाली के प्रोटीन और कई अन्य प्रोटीनों के सक्रियण का आधार है।