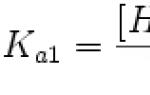कमजोर अम्लों के अम्लता स्थिरांक का निर्धारण। पानी में अम्लता और क्षारीयता लैक्टिक एसिड की अम्लता स्थिरांक का सूचकांक
जल का स्व-आयनीकरण
जल, बार-बार आसवन के बाद भी, विद्युत प्रवाह संचालित करने की क्षमता बरकरार रखता है। पानी की यह क्षमता उसके स्व-आयनीकरण के कारण है।
$2H_2O ↔ H_3O^+ + OH^-$
थर्मोडायनामिक संतुलन स्थिरांक का रूप है:
चित्र 1।
जहां $a_X^(rel)=\frac(a_X^(equal))(a_X^0)$ संतुलन प्रणाली में $X$ कण की सापेक्ष गतिविधि है;
$aX^(equal)$ एक संतुलन प्रणाली में कण $X$ की पूर्ण गतिविधि है;
$(a_x)^0$ सिस्टम की थर्मोडायनामिक स्थिति में $X$ की पूर्ण गतिविधि है।
संतुलन पर पानी की सापेक्ष गतिविधि व्यावहारिक रूप से एकता के बराबर होती है, क्योंकि प्रतिक्रिया की डिग्री बहुत छोटी होती है (यदि हम सैद्धांतिक रूप से गैर-आयनित पानी को मानक अवस्था के रूप में लेते हैं।
स्वच्छ जल में $OH^-$ और $H_3O^+$ आयनों के गतिविधि गुणांक एकता के करीब होंगे। प्रतिक्रिया का संतुलन दृढ़ता से बाईं ओर स्थानांतरित हो जाता है। $OH^-$ और $H_3O^+$ की सापेक्ष गतिविधियाँ उनकी दाढ़ सांद्रता के लगभग बराबर हैं। कहाँ
$(K_a)^0 \sim K_(auto) = $
जहां $ और $ दाढ़ सांद्रता हैं;
$K_(auto)$ - जल ऑटोप्रोलिसिस स्थिरांक $1.00\cdot 10^(-14) \mol^2/l^2$ के बराबर $25^\circ \C.$
इसलिए, शुद्ध पानी में $ और $ की सांद्रता बराबर होगी
$==\sqrt(10^(-14))=10^(-7)$ $25^\circ \ C.$ पर
गणना में आसानी के लिए, एकाग्रता को एक नकारात्मक लघुगणक के रूप में दर्शाया गया है, जिसे $pH$ के रूप में दर्शाया गया है:
$pH= -lg $
शुद्ध पानी के लिए संकेतक $pH$ $7$ हैं, अम्लीय घोल में $pH$ 7$।
एसिड पृथक्करण और अम्लता स्थिरांक
एसिड $AH$ के लिए, पृथक्करण को समीकरण द्वारा व्यक्त किया जा सकता है:
$AH + H_2O ↔ A^- + H_3O^+$
संतुलन की स्थिति में, एक अम्ल से दूसरे अम्ल में जाने पर पानी का सापेक्ष घनत्व थोड़ा बदल जाता है, और अनंत तनुकरण के साथ यह शून्य तक पहुंच जाता है। इसलिए, थर्मोडायनामिक अम्लता स्थिरांक $K_a^0$ ($AH$) का उपयोग किया जाता है।
गतिविधि गुणांक का अनुपात सभी एसिड के लिए समान है और यदि प्रक्रियाएं तनु समाधान में होती हैं तो एकता के बराबर है।
फिर, एक तनु जलीय घोल में, अम्लता स्थिरांक $Ka (AH$) का उपयोग एसिड शक्ति के माप के रूप में किया जाता है, जिसे सूत्र द्वारा निर्धारित किया जा सकता है:
$Ka (AH)=\frac()()$
सूत्र संतुलन की स्थिति में एक निश्चित तापमान $(25^\circ \C)$ पर कणों की दाढ़ सांद्रता को प्रदर्शित करता है।
अम्लता स्थिरांक जितना अधिक होगा, पृथक्करण की डिग्री उतनी ही अधिक होगी, एसिड उतना ही मजबूत होगा। अम्लता की गणना और लक्षण वर्णन के लिए, अम्लता स्थिरांक $pKa$ के ऋणात्मक लघुगणक का उपयोग किया जाता है।
$pKa (AH)= -lgKa (AH)$
अम्लता स्थिरांक का मान जितना अधिक होगा, अम्ल उतना ही कमजोर होगा।
अम्लता स्थिरांक का मान उस घोल के $pH$ मान के बराबर होता है जिस पर अम्ल आधा आयनित हो जाएगा:
$pKa (AH) = pH - लॉग \frac()()$
जलीय घोल में पानी के अणुओं की अम्लता को दर्शाने वाला मान बराबर है:
$Ka=\frac()()=\frac(Ka_(auto))()=\frac(10^(-14))(55.5)$
इस प्रकार, $25^\circ C$ के तापमान पर, $pKa (H_2O) = 15.7$। यह मान घोल में पानी के अणुओं की अम्लता को दर्शाता है।
हाइड्रोनियम आयन के लिए $pKa (H_3O^+) = pK_(ऑटो) - pKa = 14-15.7 = -1.7.$
$pKa$ मान सारणीबद्ध डेटा हैं। हालाँकि, $pKa 0$ वाले एसिड के लिए तालिका डेटा गलत होगा।
$A^-$ और $AH$ की सांद्रता के प्रत्यक्ष माप द्वारा पानी में अम्लता स्थिरांक निर्धारित करना तभी संभव है जब एसिड पृथक्करण कम से कम कुछ हद तक होता है, यहां तक कि मुश्किल से ध्यान देने योग्य भी।
यदि एसिड बहुत कमजोर है, जैसे कि यह व्यावहारिक रूप से अलग नहीं होता है, तो $A^-$ की सांद्रता को सटीक रूप से नहीं मापा जा सकता है। यदि, इसके विपरीत, एसिड इतना मजबूत है कि यह लगभग पूरी तरह से अलग हो जाता है, तो $AH$ की सांद्रता को मापना असंभव है। इस मामले में, अम्लता निर्धारित करने के लिए अप्रत्यक्ष तरीकों का उपयोग किया जाएगा।
आधार आयनीकरण स्थिरांक
पानी में किसी आधार के पृथक्करण स्थिरांक को व्यक्त करने के लिए, हम समीकरण का उपयोग करते हैं:
$B + H_2O ↔ BH^+ + OH^-$
बुनियादीता स्थिरांक है:
$Kb=\frac())([B])$
हाल ही में, बुनियादी स्थिरांक का व्यावहारिक रूप से गणना में उपयोग नहीं किया जाता है, क्योंकि संयुग्म एसिड की अम्लता स्थिरांक से आधार $BH^+ के बारे में सभी आवश्यक जानकारी प्राप्त की जा सकती है।$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
किसी अम्ल की अम्लता स्थिरांक शक्ति का माप होगा:
- $AH$ या $BH^+$ प्रोटॉन दाताओं के रूप में;
- $A^-$ या $B$ प्रोटॉन स्वीकर्ता के रूप में;
- एक मजबूत एसिड $AH$ या $BH^+$ एक कमजोर संयुग्म आधार $A^-$ या $B$ से मेल खाता है, और फिर $pKa$ का मान छोटा या नकारात्मक है;
- एक मजबूत आधार $A^-$ या $B$ एक कमजोर एसिड $AH$ या $BH^+$ से मेल खाता है और अम्लता स्थिरांक सकारात्मक होगा
एसिड या बेस की ताकत को सीधे $pKa (BH^+) की एक संकीर्ण सीमा में ही मापा जा सकता है। $ सीमा के बाहर, मूलता अप्रत्यक्ष तरीकों से निर्धारित की जाएगी। $-2$ से $17$ के अंतराल के बाहर $pka (BH^+)$ का मान ग़लत होगा।
एसिड की संरचना और ताकत के बीच सहसंबंध
केंद्रीय परमाणु की प्रकृति और एसिड अणु की संरचना के आधार पर एसिड की सापेक्ष शक्ति का अनुमान लगाया जा सकता है।
ऑक्सीजन मुक्त एसिड $HX$ और $H_2X$ (जहां $X$ एक हैलोजन है) की ताकत अधिक है, $X-H$ बंधन जितना कमजोर होगा, यानी $X$ परमाणु की त्रिज्या उतनी ही बड़ी होगी।
श्रृंखला $HF - HCl - HBr - HI$ और $H_2S - H_2Se - H_2Te$ में, एसिड की ताकत बढ़ जाती है।
ऑक्सीजन युक्त एसिड के लिए, $E(OH)nOm$ संरचना वाले यौगिक में m का मान जितना अधिक होगा, एसिड की ताकत उतनी ही अधिक होगी।
इस प्रकार, इस सिद्धांत के अनुसार अम्ल कोई भी पदार्थ है जिसके अणु (आयनों सहित) एक प्रोटॉन दान करने में सक्षम होते हैं, अर्थात। एक प्रोटॉन दाता बनें; आधार कोई भी पदार्थ है जिसके अणु (आयनों सहित) एक प्रोटॉन को जोड़ने में सक्षम होते हैं, अर्थात। एक प्रोटॉन स्वीकर्ता बनें; एम्फोलाइट कोई भी पदार्थ है जो प्रोटॉन का दाता और स्वीकर्ता दोनों है।
यह सिद्धांत न केवल तटस्थ अणुओं, बल्कि आयनों के अम्ल-क्षार गुणों की भी व्याख्या करता है। एक अम्ल, एक प्रोटॉन को छोड़कर, एक क्षार में बदल जाता है, जो इस अम्ल का संयुग्म है। शब्द "अम्ल" और "आधार" सापेक्ष अवधारणाएँ हैं, क्योंकि समान कण - अणु या आयन - साझेदार के आधार पर, मूल और अम्लीय दोनों गुण प्रदर्शित कर सकते हैं।
प्रोटोलिटिक संतुलन के दौरान, एसिड-बेस जोड़े बनते हैं। प्रोटॉन सिद्धांत के अनुसार, हाइड्रोलिसिस, आयनीकरण और न्यूट्रलाइजेशन प्रतिक्रियाओं को एक विशेष घटना के रूप में नहीं माना जाता है, बल्कि इसे एसिड से बेस तक प्रोटॉन का सामान्य स्थानांतरण माना जाता है।
हाइड्रोजन आयन के अलग होने के बाद कण A का निर्माण हुआ
पीएच मान
पानी, एक कमजोर इलेक्ट्रोलाइट के रूप में, कुछ हद तक आयनीकरण से गुजरता है:
एच 2 ओ ↔ एच + + ओएच -।
जलीय घोल में आयन जलयोजन से गुजरते हैं (aq.)
पानी की विशेषता प्रोटोलिटिक एम्फोटेरिसिटी है। पानी की स्व-आयनीकरण प्रतिक्रिया (ऑटोप्रोटोलिसिस), जिसके दौरान एक पानी के अणु (एसिड) से एक प्रोटॉन दूसरे पानी के अणु (आधार) में जाता है, समीकरण द्वारा वर्णित है:
एच 2 ओ + एच 2 ओ ↔ एच 3 ओ + + ओएच -।
जल ऑटोप्रोटोलिसिस का संतुलन स्थिरांक बराबर है:
सामूहिक क्रिया का नियम आयनीकरण स्थिरांक पर लागू होता है:
जहां a गतिविधि है.
संक्षिप्तता के लिए, अम्ल-क्षार संतुलन में H 3 O + के स्थान पर हम लिखते हैं
चूँकि पानी बड़ी मात्रा में घोल में होता है और थोड़ी मात्रा में आयनीकरण से गुजरता है, इसलिए यह ध्यान दिया जा सकता है कि इसकी सांद्रता स्थिर है और 55.6 mol (1000 g: 18 g/mol = 56 mol) प्रति लीटर पानी के बराबर है।
इसलिए, K और (H 2 O) का उत्पाद और पानी की सांद्रता 1.8 10 -16 mol/l 55.6 mol/l = 10 -14 mol 2 /l 2 के बराबर है। इस प्रकार, = 10 -14 (25 डिग्री सेल्सियस पर) एक स्थिर मान है, Kw द्वारा निरूपितऔर कहा जाता है जल ऑटोप्रोटोलिसिस स्थिरांक. कभी-कभी पुराना नाम प्रयोग किया जाता है - पानी का आयनिक उत्पाद।
ऐसे विलयन जिनमें हाइड्रोजन आयन और हाइड्रॉक्साइड आयन की सांद्रता समान होती है, उदासीन विलयन कहलाते हैं = = = 10 -7 mol/l. अम्लीय घोल में > , > 10 -7 mol/l, और क्षारीय घोल में > , > 10 -7 mol/l.
सरल बनाने के लिए, हम आधार के रूप में हाइड्रोजन संकेतक pH लेते हैं - हाइड्रोजन आयनों की सांद्रता का दशमलव लघुगणक, विपरीत चिह्न के साथ लिया जाता है: pH = -lg।
रोचक तथ्य:
आइसोहाइड्रिक अवस्था का उल्लंघन (पीएच स्थिरता) हृदय रोगों, इस्केमिया, मधुमेह मेलेटस (एसिडोसिस विकसित होता है) में देखा जाता है। सांस लेने, पेशाब करने और पसीने से एसिड-बेस संतुलन बना रहता है। ये सिस्टम धीरे-धीरे काम करते हैं, और शरीर के बफर सिस्टम द्वारा अम्लीय और क्षारीय चयापचय उत्पादों का तत्काल निराकरण किया जाता है। आइसोहाइड्री की स्थिति कई भौतिक-रासायनिक और शारीरिक तंत्रों की संयुक्त क्रिया द्वारा सुनिश्चित की जाती है। बफरिंग प्रभाव कई प्रोटोलिटिक संतुलनों को मिलाकर प्राप्त किया जाता है।
एसिड की ताकत एक प्रोटॉन दान करने की उनकी क्षमता से निर्धारित होती है।इस क्षमता का पैमाना है अम्लता स्थिरांक (Ka).
अम्लता स्थिरांक जितना अधिक होगा, एसिड उतना ही मजबूत होगा।उदाहरण के लिए, एसिटिक एसिड हाइड्रोसायनिक एसिड से अधिक मजबूत होता है, क्योंकि Ka(CH 3 COOH) = 1.74 10 -5, Ka(HCN) = 1 10 -9। गणना और रिकॉर्डिंग की सुविधा के लिए, वे अक्सर स्थिरांक का नहीं, बल्कि उनके नकारात्मक दशमलव लघुगणक का उपयोग करते हैं: pKa = -lgKa। pKa मान कहा जाता है अम्ल का शक्ति सूचक.पीकेए मान जितना अधिक होगा, एसिड उतना ही कमजोर होगा।
मजबूत एसिड लगभग पूरी तरह से अपने प्रोटॉन को पानी के अणुओं को दान कर देते हैं, इसलिए समाधान में मौजूद एसिड वास्तव में एक हाइड्रोनियम आयन है।
इस संबंध में, एक मजबूत मोनोबैसिक एसिड के समाधान के पीएच की गणना करते समय, प्रोटॉन की एकाग्रता एसिड की एकाग्रता के बराबर होती है
सी(H3O+)= सी(एचबी).
कमजोर एसिड के समाधान में, हाइड्रोनियम आयनों की सांद्रता एसिड की सांद्रता से काफी कम होती है। के आधार पर इसकी गणना की जाती है
इस समीकरण के दोनों पक्ष कमजोर एसिड के समाधान के पीएच की गणना के लिए एक सूत्र देते हैं: पीएच = 0.5 (पीकेए - लॉग सी(एचबी)).
29. कमजोर इलेक्ट्रोलाइट्स. अम्लता और क्षारीयता स्थिरांक। ओसवाल्ड का तनुकरण नियम.
कमजोर इलेक्ट्रोलाइट्स रासायनिक यौगिक होते हैं जिनके अणु, अत्यधिक पतले घोल में भी, आयनों में थोड़ा अलग हो जाते हैं जो कि असंबद्ध अणुओं के साथ गतिशील संतुलन में होते हैं। कमजोर इलेक्ट्रोलाइट्स में जलीय और गैर-जलीय घोल में अधिकांश कार्बनिक अम्ल और कई कार्बनिक आधार शामिल होते हैं।
कमजोर इलेक्ट्रोलाइट्स हैं:
लगभग सभी कार्बनिक अम्ल और पानी;
कुछ अकार्बनिक अम्ल: HF, HClO, HClO 2, HNO 2, HCN, H 2 S, HBrO, H 3 PO 4, H 2 CO 3, H 2 SiO 3, H 2 SO 3, आदि;
कुछ खराब घुलनशील धातु हाइड्रॉक्साइड: Fe(OH) 3, Zn(OH) 2, आदि।
एसिड पृथक्करण स्थिरांक (Ka) एसिड अवशेषों के हाइड्रोजन आयन और आयन में एसिड पृथक्करण की प्रतिक्रिया का संतुलन स्थिरांक है। पॉलीबेसिक एसिड के लिए, जिसका पृथक्करण कई चरणों में होता है, पृथक्करण के विभिन्न चरणों के लिए अलग-अलग स्थिरांक का उपयोग किया जाता है, उन्हें K a1, K a2, आदि के रूप में दर्शाया जाता है।
डिबासिक एसिड गणना का उदाहरण:

![]()
अधिक बार, पृथक्करण स्थिरांक K के बजाय, मान pK का उपयोग किया जाता है, जिसे स्थिरांक के नकारात्मक दशमलव लघुगणक के रूप में परिभाषित किया जाता है:
आधार एक रासायनिक यौगिक है जो एक प्रोटॉन (ब्रोंस्टेड आधार) या किसी अन्य रासायनिक यौगिक (लुईस आधार) के रिक्त कक्षक के साथ सहसंयोजक बंधन बना सकता है। संकीर्ण अर्थ में, क्षार का अर्थ है मूल हाइड्रॉक्साइड - जटिल पदार्थ, जिनके जलीय घोल में पृथक्करण पर, केवल एक प्रकार का आयन विभाजित होता है - हाइड्रॉक्साइड आयन OH-।
ब्रोंस्टेड-लोरी सिद्धांत हमें आधारों की ताकत को मापने की अनुमति देता है, यानी एसिड से प्रोटॉन को अलग करने की उनकी क्षमता। यह आम तौर पर बुनियादी स्थिरांक Kb का उपयोग करके किया जाता है - एक संदर्भ एसिड के साथ आधार की प्रतिक्रिया का संतुलन स्थिरांक, जिसके लिए पानी चुना जाता है। बुनियादी स्थिरांक जितना अधिक होगा, आधार की ताकत उतनी ही अधिक होगी और प्रोटॉन को अमूर्त करने की क्षमता उतनी ही अधिक होगी। अक्सर मूलभूत स्थिरांक को मूल स्थिरांक घातांक pKb के रूप में व्यक्त किया जाता है। उदाहरण के लिए, ब्रोंस्टेड आधार के रूप में अमोनिया के लिए हम लिख सकते हैं:

ओस्टवाल्ड का तनुकरण नियम एक संबंध है जो घोल की सांद्रता पर एक द्विआधारी कमजोर इलेक्ट्रोलाइट के तनु घोल की समतुल्य विद्युत चालकता की निर्भरता को व्यक्त करता है: ![]()
यहां K इलेक्ट्रोलाइट पृथक्करण स्थिरांक है, c एकाग्रता है, λ और λ∞ क्रमशः एकाग्रता c और अनंत तनुकरण पर समतुल्य विद्युत चालकता के मान हैं। यह संबंध सामूहिक कार्रवाई के नियम और समानता का परिणाम है जहां α पृथक्करण की डिग्री है।
30. पानी एक कमजोर इलेक्ट्रोलाइट है. जल का आयनिक उत्पाद. पीएच. पोह
पानी का आयनिक उत्पाद पानी में या जलीय घोल में हाइड्रोजन आयन H+ और हाइड्रॉक्सिल आयन OH− की सांद्रता का उत्पाद है, जो पानी का ऑटोप्रोटोलिसिस स्थिरांक है।
पानी, हालांकि एक कमजोर इलेक्ट्रोलाइट है, कुछ हद तक अलग हो जाता है:
इस प्रतिक्रिया का संतुलन बाईं ओर दृढ़ता से स्थानांतरित हो गया है। पानी के पृथक्करण स्थिरांक की गणना सूत्र का उपयोग करके की जा सकती है:
![]()
हाइड्रोनियम आयनों (प्रोटॉन) की सांद्रता;
हाइड्रॉक्साइड आयन सांद्रता;
पानी में पानी की सांद्रता (आणविक रूप में);
पानी में पानी की सांद्रता, इसके पृथक्करण की निम्न डिग्री को ध्यान में रखते हुए, व्यावहारिक रूप से स्थिर है और इसकी मात्रा (1000 g/l)/(18 g/mol) = 55.56 mol/l है।
25 डिग्री सेल्सियस पर, पानी का पृथक्करण स्थिरांक 1.8·10−16 mol/l है। समीकरण (1) को इस प्रकार पुनः लिखा जा सकता है:
आइए उत्पाद को K· = K में = 1.8·10−16 mol/l·55.56 mol/l = 10−14 mol²/l² = · (25 डिग्री सेल्सियस पर) निरूपित करें।
प्रोटॉन और हाइड्रॉक्साइड आयनों की सांद्रता के उत्पाद के बराबर स्थिरांक K को पानी का आयनिक उत्पाद कहा जाता है। यह न केवल शुद्ध पानी के लिए, बल्कि पदार्थों के पतले जलीय घोल के लिए भी स्थिर है। बढ़ते तापमान के साथ, पानी का पृथक्करण बढ़ता है, इसलिए, घटते तापमान के साथ Kv भी बढ़ता है - इसके विपरीत।
हाइड्रोजन सूचकांक, पीएच - एक समाधान में हाइड्रोजन आयनों की गतिविधि का एक माप, और मात्रात्मक रूप से इसकी अम्लता को व्यक्त करते हुए, हाइड्रोजन आयनों की गतिविधि के नकारात्मक (विपरीत चिह्न के साथ लिया गया) दशमलव लघुगणक के रूप में गणना की जाती है, जो प्रति लीटर मोल में व्यक्त की जाती है:
उलटा पीएच मान कुछ हद तक कम व्यापक है - समाधान की मूलता का एक संकेतक, पीओएच, समाधान में ओएच - आयनों की एकाग्रता के नकारात्मक दशमलव लघुगणक के बराबर है:
लिंकिंग स्तर:
सामान्य स्थिति में, ब्रोंस्टेड-लोरी प्रोटोलिटिक सिद्धांत के अनुसार, समीकरण (4.2) के अनुसार हमारे पास एक कमजोर मोनोप्रोटिक एसिड के पृथक्करण के लिए है:
सच्चा थर्मोडायनामिक स्थिरांक कोयह संतुलन होगा
जहां सभी गतिविधियां संतुलन में हैं। आइए इस अनुपात की कल्पना इस प्रकार करें:
आइए, पिछले मामले की तरह, दो स्थिरांकों के गुणनफल को निरूपित करें कोऔर a(H 2 O) से (H 2 O) = स्थिरांक पर टी=स्थिरांक. तब
या लगभग:
जहां सभी सांद्रताएं संतुलन में हैं। यहाँ मूल्य है को एबुलाया अम्ल पृथक्करण (आयनीकरण) स्थिरांक या बस अम्लता स्थिरांक।
कई कमजोर अम्लों के लिए संख्यात्मक मान को एबहुत छोटे हैं, इसलिए आकार के बजाय को एआवेदन करना शक्ति सूचक (या बस सूचक):
आर ए =- एलजी को ए .
अधिक को ए(अर्थात, जितना कम पी को ए ), एसिड जितना मजबूत होगा.
मान लीजिए कि मोनोबैसिक एसिड एचबी की प्रारंभिक सांद्रता समाधान में इसके पृथक्करण (आयनीकरण) की डिग्री के बराबर है। तब आयनों [H 3 O + ] और [B - ] की संतुलन सांद्रता [H 3 O + ] = [B - ] = के बराबर होगी αс ए , एक संतुलन एसिड एकाग्रता [НВ] = साथ ए - α साथ ए = साथ ए(1 - α). संतुलन सांद्रता के इन मूल्यों को संतुलन स्थिरांक (4.10) के लिए अभिव्यक्ति में प्रतिस्थापित करने पर, हम प्राप्त करते हैं:
अगर एकाग्रता की जगह साथ एइसका उलटा प्रयोग करें वी- तनुकरण (पतलाकरण), एल/मोल में व्यक्त, वी=1/साथ ए , फिर के लिए सूत्र को एऐसा दिखाई देगा:
ये रिश्ता भी और अभिव्यक्ति भी
वर्णन करना ओस्टवाल्ड का तनुकरण नियम (या तनुकरण नियम)कमजोर बाइनरी इलेक्ट्रोलाइट के लिए. A1 पर (कई विश्लेषणात्मक प्रणालियों में एक विशिष्ट मामला)
यह दिखाना आसान है कि, सामान्य स्थिति में, किसी भी संरचना K n A m के कमजोर इलेक्ट्रोलाइट के लिए, जो योजना के अनुसार आयनों में विघटित हो जाता है
के एन ए एम = पीको टी+ +टीए एन -
ओस्टवाल्ड के तनुकरण नियम का वर्णन संबंध द्वारा किया गया है
कहाँ साथ- एक कमजोर इलेक्ट्रोलाइट की प्रारंभिक सांद्रता, उदाहरण के लिए, एक कमजोर एसिड। तो, ऑर्थोफोस्फोरिक एसिड एच 3 पीओ 4 के लिए (पी = 3,
टी= 1), जो योजना के अनुसार पूरी तरह से आयनों में विघटित हो जाता है

![]() .
.
बाइनरी इलेक्ट्रोलाइट के लिए, संबंध (4.11) हो जाता है। A1 के लिए हमारे पास है:
आइए हम मोनोबैसिक एसिड एनवी के समाधान का संतुलन पीएच मान ज्ञात करें। हाइड्रोजन आयनों की संतुलन सांद्रता
संकेतन का उपयोग करने पर हमें प्राप्त होता है:
पीएच = 0.5(आर को ए+प साथ ए). (4.12)
इस प्रकार, एक कमजोर मोनोप्रोटिक एसिड के समाधान के संतुलन पीएच मान की गणना करने के लिए, इस एसिड की अम्लता स्थिरांक को जानना आवश्यक है को एऔर इसकी प्रारंभिक एकाग्रता साथ ए .
आइए 0.01 mol/l की प्रारंभिक सांद्रता वाले एसिटिक एसिड के घोल के pH की गणना करें।
एसिटिक एसिड के लिए कमरे के तापमान पर को ए = 1.74·10 -5 और पी को ए = 4,76.
सूत्र (4.12) के अनुसार हम लिख सकते हैं:
पीएच = 0.5(पी को ए+प साथ ए) = 0,5(476-0,01) = 0,5(4,76+2) = 3,38.
किसी भी कमजोर समाधान में संतुलन के लिए इसी तरह का विचार किया जा सकता है बहुक्षारकीअम्ल.
पॉलीबेसिक एसिड कई चरणों में चरणबद्ध तरीके से आयनों में अलग हो जाते हैं, जिनमें से प्रत्येक की अपनी संतुलन स्थिरांक विशेषता होती है चरणबद्ध एसिड पृथक्करण स्थिरांक।उदाहरण के लिए, ऑर्थोबोरिक एसिड एच 3 बीओ 3 के समाधान में संतुलन स्थापित किया गया है (स्थिर मान 25 डिग्री सेल्सियस के लिए दिए गए हैं):
एच 3 वीओ 3 + एच 2 ओ = एच 3 ओ + +, को 1
= ![]()
एच 2 ओ = एच 3 ओ + +, को 2
= ![]()
एच 2 ओ = एच 3 ओ + +, को 3 =
प्रत्येक बाद के चरण का एसिड पृथक्करण स्थिरांक पिछले चरण के पृथक्करण स्थिरांक से कम होता है - आमतौर पर परिमाण के कई आदेशों से।
सभी चरणबद्ध पृथक्करण स्थिरांकों का उत्पाद कुल अम्ल पृथक्करण स्थिरांक K के बराबर है:
को 1 को 2 ...को पी =के.
इस प्रकार, यह देखना आसान है कि ऑर्थोबोरिक एसिड का मूल्य क्या है
को 1
को 2
को 3
=क= ![]()
योजना के अनुसार पूर्ण अम्ल पृथक्करण स्थिरांक है:
4.3.2 कमजोर क्षारों के विलयन का क्षारीयता स्थिरांक और पीएच
अम्ल और क्षार के ब्रोंस्टेड-लोरी प्रोटोलिटिक सिद्धांत के अनुसार, सामान्य स्थिति में, जलीय घोल में एकल-अम्ल कमजोर आधार बी के आयनीकरण के लिए, हम लिख सकते हैं:
बी + एच 2 ओ = एचबी + + ओएच -
यदि आधार के आयनीकरण की डिग्री a1 है, तो सांद्रता स्थिरांक को इस रासायनिक संतुलन के स्थिरांक के रूप में लिया जा सकता है
पिछले वाले की तरह ही आगे बढ़ते हुए, हमें मिलता है:
को = =के बी = कब स्थिरांक टी= स्थिरांक
दो स्थिरांकों के गुणनफल के रूप में को= स्थिरांक और [H 2 O] = स्थिरांक.
चलिए मात्रा बताते हैं क बी , इसलिए, बराबर
क बी = , (4.13)
एक कमजोर एक-एसिड आधार का पृथक्करण (आयनीकरण) स्थिरांकयाबस एक मूलभूत स्थिरांकयह आधार, और परिमाण
पी क बी = क बी ,
बुनियादी स्थिरांक का एक शक्ति संकेतक (या बस एक संकेतक)।
विचाराधीन मामले में ओस्टवाल्ड कमजोर पड़ने वाले कानून के अनुसार (संबंध (4.11) के समान)
क बी =,
एक-एसिड कमजोर आधार के आयनीकरण की डिग्री कहां है, और इसकी प्रारंभिक एकाग्रता है। चूँकि कमजोर आधार a1 के लिए, तो
आइए कमरे के तापमान पर प्रश्न में मोनोएसिड बेस के जलीय घोल का संतुलन पीएच मान ज्ञात करें। सूत्र (4.7) के अनुसार हमारे पास है:
पीएच = पी को डब्ल्यू - पीओएच = 14 - पीओएच.
आइए pOH = [OH - ] का मान निर्धारित करें। ज़ाहिर तौर से
[ओह - ] = = ![]()
संकेतकों का उपयोग करते हुए pOH = [OH - ], p को बी =के बीऔर
पी = , हमें मिलता है: पीओएच = 0.5(पी को बी+पी). इस अभिव्यक्ति को पीएच के उपरोक्त सूत्र में प्रतिस्थापित करने पर, हम संबंध पर पहुंचते हैं
पीएच = 14 - पीओएच = 14 - 0.5 (पी को बी+पी).
तो, कमजोर एक-एसिड बेस के समाधान में संतुलन पीएच मान की गणना सूत्र (4.15) का उपयोग करके की जा सकती है:
पीएच = 14 - 0.5(पी को बी+पी). (4.15)
आइए हम अमोनिया के 0.01 mol/l जलीय घोल में pH की गणना करें, जिसके लिए कमरे के तापमान पर को बी= और पी को बी = 4,76.
अमोनिया के जलीय घोल में संतुलन स्थापित होता है:
जो अधिकतर बाईं ओर स्थानांतरित हो जाता है, ताकि अमोनिया के आयनीकरण की डिग्री हो। इसलिए, पीएच मान की गणना करने के लिए, आप संबंध (4.15) का उपयोग कर सकते हैं:
पीएच = 14 - 0.5(पी को बी+ पी) =
इसी तरह का विचार किसी भी कमज़ोर के लिए किया जा सकता है पॉलीएसिडमैदान. सच है, इसके परिणामस्वरूप अधिक बोझिल अभिव्यक्तियाँ होती हैं।
कमजोर पॉलीएसिड क्षार, कमजोर पॉलीबेसिक एसिड की तरह, चरणबद्ध तरीके से अलग हो जाते हैं, और पृथक्करण के प्रत्येक चरण में आधार का अपना चरणबद्ध पृथक्करण स्थिरांक होता है - चरणबद्ध बुनियादीता स्थिरांक।
उदाहरण के लिए, जलीय घोल में लेड हाइड्रॉक्साइड Pb(OH) 2 दो चरणों में आयनों में विघटित होता है:
![]()
उसी संतुलन को दूसरे तरीके से लिखा जा सकता है, एक पदार्थ के रूप में आधार की परिभाषा का पालन करते हुए (प्रोटोलिटिक सिद्धांत के ढांचे के भीतर) जो एक प्रोटॉन को जोड़ता है, इस मामले में, इसे पानी के अणु से स्वीकार करते हुए:
चरणबद्ध बुनियादी स्थिरांक को इस रूप में दर्शाया जा सकता है:
![]()
![]()
संकेतित संतुलन की इस रिकॉर्डिंग के साथ, यह माना जाता है कि पानी के अणु से एक प्रोटॉन पानी के अणु () के निर्माण के साथ हाइड्रॉक्सिल समूह में जाता है, जिसके परिणामस्वरूप सीसा (II) परमाणु के पास पानी के अणुओं की संख्या बढ़ जाती है। एक से बढ़ जाती है, और सीसा (II) परमाणु से जुड़े हाइड्रॉक्सिल समूहों की संख्या भी प्रत्येक पृथक्करण चरण पर एक से घट जाती है।
काम को 1 को 2 =क=[पीबी 2+ ][ओएच - ] 2 /[पीबी(ओएच) 2 ] =
2.865, कहाँ को- योजना के अनुसार कुल पृथक्करण स्थिरांक
या नीचे लिखी गई किसी भिन्न योजना के अनुसार
जो अंततः उसी परिणाम की ओर ले जाता है।
एक अन्य उदाहरण कार्बनिक आधार एथिलीनडायमाइन है, जो दो चरणों में जलीय घोल में आयनीकरण से गुजरता है। प्रथम चरण:
![]()
दूसरे चरण:
![]()
काम ![]() -
-
कुल पृथक्करण स्थिरांक. यह संतुलन से मेल खाता है
कमरे के तापमान के लिए संतुलन स्थिरांक के संख्यात्मक मान ऊपर दिए गए हैं।
जैसा कि पॉलीबेसिक एसिड के मामले में होता है, एक कमजोर पॉलीएसिड बेस के लिए प्रत्येक बाद के चरण का पृथक्करण स्थिरांक आमतौर पर पिछले चरण के पृथक्करण स्थिरांक से कम परिमाण के कई ऑर्डर होता है।
तालिका में तालिका 4.2 कुछ कमजोर अम्लों और क्षारों की अम्लता और क्षारीयता स्थिरांक के संख्यात्मक मान दिखाती है।
तालिका 4.2. कुछ अम्लों और क्षारों के जलीय विलयनों में वास्तविक थर्मोडायनामिक आयनीकरण स्थिरांक।
को ए- अम्लता स्थिरांक, को बी- मूलभूतता स्थिरांक,
को 1 - पहले चरण के लिए पृथक्करण स्थिरांक,
को 2
- दूसरे चरण के लिए पृथक्करण स्थिरांक, आदि।
| कमजोर अम्लों का पृथक्करण स्थिरांक |
||
| अम्ल | को ए | आर को ए=-एलजी को ए |
| नाइट्रोजन का अमीनोएसेटिक बेंज़ोइनाया बोरिक (ऑर्थोबोरिक) टेट्राबोरिक प्रोटोलिटिक प्रतिक्रियाओं के प्रकार. एमयू "समाधान" पीपी 52-55 पानी का ऑटोप्रोटोलिसिस। जल का आयनिक उत्पाद.एमयू "समाधान"» पृष्ठ 56 पानी के अणुओं का एक छोटा सा हिस्सा हमेशा आयनिक अवस्था में होता है, हालांकि यह एक बहुत कमजोर इलेक्ट्रोलाइट है। पानी का आयनीकरण और आगे पृथक्करण, जैसा कि पहले ही उल्लेख किया गया है, एसिड-बेस डिसप्रोपोर्टेशन या ऑटोप्रोटोलिसिस की प्रोटोलिटिक प्रतिक्रिया के समीकरण द्वारा वर्णित है। पानी एक बहुत कमजोर इलेक्ट्रोलाइट है, इसलिए इससे बनने वाला संयुग्म अम्ल और संयुग्म क्षार मजबूत होता है। इसलिए, इस प्रोटोलिटिक प्रतिक्रिया का संतुलन बाईं ओर स्थानांतरित हो जाता है। इस संतुलन का स्थिरांक K = के बराबर है जल आयन सान्द्रता के गुणनफल का मात्रात्मक मान × है पानी का आयनिक उत्पाद. यह बराबर है: × = K बराबर. × 2 = 1×10 – 14 इसलिए: KH 2O = × = 10 - 14 या सरलीकृत KH 2O = × = 10 - 14 KH2O पानी का आयनिक उत्पाद है, पानी का ऑटोप्रोटोलिसिस स्थिरांक या बस पानी का स्थिरांक है। KH2O तापमान पर निर्भर करता है। बढ़ते तापमान के साथ यह बढ़ता है। रासायनिक रूप से शुद्ध जल में = = = 1×10 – 7. यह एक तटस्थ वातावरण है. घोल में यह हो सकता है > - माध्यम अम्लीय है या< – среда щелочная = ; = पीएच मान विलयनों की अम्लता को मात्रात्मक रूप से व्यक्त करने के लिए उपयोग करें हाइड्रोजन आयन सांद्रता सूचकपीएच. हाइड्रोजन सूचकांक किसी घोल में मुक्त हाइड्रोजन आयनों की सांद्रता के ऋणात्मक दशमलव लघुगणक के बराबर का मान है। पीएच = - लॉग ⇒ = 10 - पीएच तटस्थ वातावरण में pH = 7 अम्लीय pH पर< 7 क्षारीय पीएच > 7 में माध्यम की बुनियादीता को चिह्नित करने के लिए, हाइड्रॉक्सिल संकेतक पीओएच का उपयोग किया जाता है рОН = - लॉग [ОH - ] ⇒ [ОH - ] = 10 - рОН पीएच + पीओएच = 14 Þ पीएच = 14 - पीओएच और पीओएच = 14 - पीएच अम्ल और क्षार के विलयन के लिए pH की गणना के सूत्र। पीएच = - लॉग
इसके पूर्ण पृथक्करण की स्थिति के तहत C(HCl) = 0.1 mol/l के साथ HCl घोल के pH की गणना करें। सी(एचसीएल) = 0.1 मोल/ली; पीएच = - लॉग 0.1 = 1 2. मजबूत आधार: [ОH - ] = С(1/z आधार) समान परिस्थितियों में NaOH विलयन के pH की गणना करें। C(NaOH) = 0.1 mol/l; = = 10 – 13 ; पीएच = - लॉग 10 - 13 = 13 3. कमजोर अम्ल 0.5 mol/L की दाढ़ सांद्रता वाले एसिटिक एसिड के घोल के pH की गणना करें। के सीएच 3COOH = 1.8×10 – 5. 3×10 – 3 पीएच = - लॉग 3×10 - 3 = 2.5 4. कमजोर बुनियाद 0.2 mol/L की दाढ़ सांद्रता वाले अमोनिया घोल के pH की गणना करें। के एनН 3 = 1.76×10 – 5 1.88×10 – 3 0.53×10 – 11; पीएच = - लॉग 0.53×10 - 11 = 11.3 5. सी(एच+) = [एच+] = 10 - पीएच pH = 7 पर, [H + ] = 10 - 7 पीएच निर्धारित करने के लिए विभिन्न तरीके हैं: संकेतक और आयनोमर उपकरणों का उपयोग करना। शरीर में रासायनिक प्रतिक्रियाओं और जैव रासायनिक प्रक्रियाओं के लिए पीएच का मान। कई प्रतिक्रियाओं को एक निश्चित दिशा में आगे बढ़ने के लिए कड़ाई से परिभाषित पीएच मान की आवश्यकता होती है। आम तौर पर, एक स्वस्थ शरीर में, अधिकांश जैविक तरल पदार्थों के वातावरण की प्रतिक्रिया तटस्थ के करीब होती है। रक्त - 7.4 लार - 6.6 आंत्र रस - 6.4 पित्त – 6.9 मूत्र - 5.6 गैस्ट्रिक जूस: ए) आराम पर - 7.3 बी) पाचन की स्थिति में - 1.5-2 मानक से पीएच के विचलन का नैदानिक (बीमारी की परिभाषा) और पूर्वानुमान संबंधी (बीमारी का कोर्स) महत्व है। एसिडोसिस पीएच में अम्लीय पक्ष में बदलाव है, पीएच कम हो जाता है, हाइड्रोजन आयनों की सांद्रता बढ़ जाती है। क्षारीयता पीएच में क्षारीय क्षेत्र में बदलाव है, पीएच बढ़ता है, और हाइड्रोजन आयनों की एकाग्रता कम हो जाती है। रक्त पीएच में मानक से दसवें हिस्से का अस्थायी विचलन शरीर में गंभीर गड़बड़ी पैदा करता है। रक्त पीएच में दीर्घकालिक विचलन घातक हो सकता है। रक्त पीएच में विचलन 6.8 - 8 हो सकता है; इस सीमा के बाहर किसी भी दिशा में परिवर्तन जीवन के साथ असंगत हैं। संयुक्त और पृथक प्रोटोलिटिक संतुलन। प्रोटोलिटिक प्रक्रियाएँ प्रतिवर्ती प्रतिक्रियाएँ हैं। प्रोटोलिटिक संतुलन कमजोर अम्ल और क्षार के निर्माण की ओर स्थानांतरित हो जाता है। उन्हें एक प्रोटॉन पर कब्ज़ा करने के लिए विभिन्न शक्तियों के आधारों के बीच प्रतिस्पर्धा के रूप में माना जा सकता है। वे पृथक एवं संयुक्त संतुलन की बात करते हैं। यदि एक साथ मौजूद कई संतुलन एक-दूसरे से स्वतंत्र होते हैं, तो उन्हें पृथक कहा जाता है। उनमें से एक में संतुलन में बदलाव से दूसरे में संतुलन स्थिति में बदलाव नहीं होता है। यदि उनमें से एक में संतुलन में बदलाव से दूसरे में संतुलन में बदलाव होता है, तो हम संयुक्त (संयुग्मित, प्रतिस्पर्धी) संतुलन की बात करते हैं। संयुक्त संतुलन वाली प्रणालियों में प्रमुख प्रक्रिया वह है जो संतुलन स्थिरांक के बड़े मूल्य की विशेषता रखती है। दूसरी प्रक्रिया प्रमुख होगी, क्योंकि इसका संतुलन स्थिरांक पहली प्रक्रिया के संतुलन स्थिरांक से अधिक है। दूसरी प्रक्रिया में संतुलन काफी हद तक दाईं ओर स्थानांतरित हो जाता है, क्योंकि मिथाइलमाइन अमोनिया से अधिक मजबूत आधार है, NH 4 + CH 3 NH 3 + से अधिक मजबूत एसिड है। निष्कर्ष: एक मजबूत आधार कमजोर आधार के आयनीकरण को दबा देता है। इसलिए, जब अमोनिया और मिथाइलमाइन के मिश्रण में थोड़ी मात्रा में हाइड्रोक्लोरिक एसिड मिलाया जाता है, तो यह मुख्य रूप से मिथाइलमाइन होगा जो प्रोटोनेशन से गुजरता है। और यह भी: सबसे मजबूत एसिड कमजोर एसिड के आयनीकरण को दबा देता है। इस प्रकार, गैस्ट्रिक जूस में पाया जाने वाला हाइड्रोक्लोरिक एसिड एसिटिक एसिड (भोजन से आने वाला) या एसिटाइलसैलिसिलिक एसिड (औषधीय पदार्थ) के आयनीकरण को दबा देता है। ______________________________________________________________ संबंधित प्रकाशन
| ||