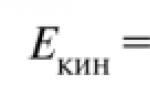Kusoma muundo wa molekuli. Njia za kusoma muundo wa molekuli. Historia ya asili na mali ya Masi
Sura ya 1. Uchambuzi wa maudhui ya kozi ya kemia kwa darasa la 8-11 juu ya muundo wa suala na utoaji wake kwa njia ya mfano wa kuona 14-54.
1.1. Malengo na sifa za kusoma muundo wa maada katika kozi ya kemia ya shule. 14
1.2. Kuiga kama njia ya utafiti wa kisayansi na jukumu lake katika malezi ya maarifa kamili juu ya muundo wa jambo. 27
1.3. Mifano ya jadi ya atomi na molekuli zinazotumiwa katika ufundishaji wa sayansi. 45 - 54 Hitimisho la Sura ya 1. 55
Sura ya 2. Mahitaji ya ufundishaji na ergonomic kwa uundaji na matumizi ya mifano ya kusoma muundo wa jambo. 57
2.1. Kanuni ya sayansi na urekebishaji wa data mpya ya kisayansi kwa ufundishaji. Mitindo ya kisasa katika maendeleo ya modeli. 57
2.2. Mahitaji ya ufundishaji na ergonomic kwa mifano ya atomi na molekuli na uwezo wao mpya wa didactic. 75
2.3. Tabia za seti ya mifano ya kusoma muundo wa dutu. 104 -
Hitimisho la Sura ya 2. 110
Sura ya 3. Shirika la matumizi ya seti ya mifano wakati wa kujifunza muundo wa suala katika kozi ya kemia ya shule ya sekondari. 112
3.1. Uwezekano wa njia ya kutumia tata na kuingizwa kwa mifano ya pete wakati wa kusoma muundo wa vitu katika kozi ya kemia ya shule ya sekondari. 112
3.2. Mbinu za kimbinu za kutumia seti ya miundo ikijumuisha modeli za dhamana za kuonyesha na kufanya kazi ya vitendo katika kemia isokaboni na ya kikaboni. 122
3.3 Majaribio ya majaribio ya ufanisi wa ufundishaji wa mchanganyiko wa mifano ya atomi na molekuli za kusoma muundo wa maada katika kozi ya kemia ya shule ya upili. 156
Hitimisho la Sura ya 3. 168
Orodha ya tasnifu zinazopendekezwa
Mbinu ya malezi ya dhana za kimsingi za kemia katika kozi ya awali kulingana na dhana za muundo wa jambo. 1984, mgombea wa sayansi ya ufundishaji Kuznetsova, Liliya Mikhailovna
Misingi ya kimbinu ya malezi ya maarifa ya kimfumo katika kemia katika shule za sekondari 1984, Daktari wa Sayansi ya Ualimu Tyldsepp, Aarne Albert-Romanovich
Kusoma miundo ya kinadharia ya atomi na kiini cha atomiki katika kozi ya msingi ya fizikia ya shule 2002, Mgombea wa Sayansi ya Ufundishaji Pekshieva, Irina Vladimirovna
Misingi ya kinadharia ya kuunda na kutumia mfumo wa nyenzo za kufundisha kemia katika shule ya sekondari 1988, Daktari wa Sayansi ya Pedagogical Nazarova, Tatyana Sergeevna
Fursa za kimbinu za kufundisha wanafunzi utekelezaji wa miunganisho ya taaluma mbalimbali kati ya kemia ya kikaboni na fizikia 1985, Mgombea wa Sayansi ya Ufundishaji Dyusyupova, Lidia Zeynelovna
Utangulizi wa tasnifu (sehemu ya muhtasari) juu ya mada "Uundaji na utumiaji wa mchanganyiko wa mifano ya atomi na molekuli kusoma muundo wa jambo katika kozi ya kemia ya shule ya upili"
Umuhimu wa utafiti
Katika shule ya sekondari ya kisasa, ufahamu wa ufahamu wa michakato ya kemikali unahitaji uchunguzi wa kina wa muundo wa atomi, molekuli, miundo ya kioo ya miili na asili ya vifungo vya kemikali. Kozi ya kemia ya shule ya upili inategemea nadharia ya atomiki-molekuli, sheria ya Avogadro, sheria za uthabiti wa utungaji na uhifadhi wa wingi wa vitu, mfumo wa upimaji wa vipengele vya kemikali wa D. I. Mendeleev, na nadharia ya muundo wa dutu.
Uundaji wa dhana juu ya muundo wa maada ni moja ya kazi muhimu zaidi katika kufundisha kemia.
Kuiga ni njia ya kuelewa sifa zilizosomwa za kitu kupitia mifano: vitendo vilivyo na mifano ambayo inaruhusu sisi kusoma sifa za mtu binafsi, vipengele au mali ya kitu au mfano unaotuvutia.
Mitindo ya kielimu ni sehemu muhimu ya seti ya kielimu na ya kimbinu, mahali pa msingi ambapo ni vitabu vya kiada na fasihi ya kielimu.
Mifano hufafanuliwa kama vielelezo vya kielimu vinavyochukua nafasi ya vitu vya asili na kuwasilisha muundo wao, mali muhimu, uhusiano na mahusiano.
Ya umuhimu mkubwa ni matumizi ya mifano wakati wa kusoma michakato ambayo haiwezi kuzingatiwa kwa sababu ya tofauti kubwa za wakati au mizani ya anga. Mfano huo unageuka kuwa kitu pekee ambacho ni carrier wa habari kuhusu mchakato au jambo. Katika hali kama hiyo, jaribio la mfano ni muhimu sana. Jaribio la mfano ni aina maalum ya majaribio, ambayo ina sifa ya matumizi ya mifano ya nyenzo zilizopo kama njia maalum za utafiti wa majaribio. Jaribio la mfano, ambalo modeli mbadala husomwa badala ya kitu chenyewe, hurejelewa katika hali ambapo kitu cha utafiti hakiwezi kufikiwa na tafakuri ya kuona, kama kitu cha ulimwengu mdogo. Kwa hivyo, shida ya modeli ni muhimu sana katika sayansi ya asili. Katika fizikia na kemia, hili ni tatizo la kuiga vitu vidogo vidogo, yaani, atomi na molekuli.
Mtu hupokea kiasi kikubwa cha habari kupitia maono, hivyo mifano "dhahiri" inapaswa kuwasilishwa kwanza. Ni vyema kuwa wao pia ni yanayoonekana, yaani, nyenzo. Uzoefu wa miaka mingi wa kutumia mifano katika mchakato wa kufundisha kemia umeonyesha jukumu lao kubwa katika mchakato wa kujifunza na ufanisi wa ushawishi wa mwalimu kwa mwanafunzi kwa msaada wao. Haja ya kutumia mifano ya kuona, uboreshaji wao unaoendelea na kuibuka kwa mifano mpya ni kwa sababu ya ukuzaji wa kemia kama sayansi na ukuzaji unaoendelea wa mbinu za teknolojia ya ufundishaji.
Jambo muhimu linalozuia uundaji wa mifano inayokidhi mahitaji ya ufundishaji na ergonomic ni kutokubaliana kwa dhana za kisasa za kisayansi na picha nyingi rahisi na za kuona zinazotumiwa katika uundaji wa mfano. Jaribio la kurekebisha data ya kisayansi kwa mchakato wa kujifunza shuleni husababisha kuundwa kwa mifano iliyorahisishwa na inahusishwa na makosa fulani katika maonyesho ya mali. Kwa kweli, uundaji wa mifano ya elimu unakuja kwa shida ya chaguo bora kati ya mifano ya viwango tofauti vya ugumu na nguvu tofauti za kuona. Kutoka kwa mtazamo wa didactic, hii inasababisha hitaji la kuunda seti ya mifano inayohusiana, sifa za maelezo ambazo zinapaswa kukidhi mahitaji yote ya modeli ya kuona.
Jaribio la kwanza la kupanga vifaa vya kielimu na uhalali wake kutoka kwa mtazamo wa maelezo ya sayansi ya kemikali na kanuni ya didactic ya taswira ya ufundishaji ilifanywa na A. A. Grabetsky na K. Ya. Parmenov katika kitabu "Vifaa vya Mafunzo katika Kemia. ” Waandishi huhitimisha kwamba visaidizi vya kuona vinapaswa kutumiwa kwa uangalifu katika mchakato wa kujifunza, katika mfumo fulani, kwamba ni muhimu kama zana muhimu ya didactic ambayo husaidia kufikia malengo ya elimu.
Walakini, mifano iliyotumiwa jadi haitoshi kuunda seti ya mifano ya mafunzo. Uteuzi wa mali zilizoundwa kwa msaada wao, kutokubaliana kwa mifano na ukosefu wa miunganisho ya kimuundo na kimantiki kati yao huunda vizuizi vya kujifunza na kutatiza mchakato wa uchukuaji wa habari. Orodha ya mifano iliyopendekezwa inapaswa kuongezwa na mifano ya kisasa ambayo inaweza kuturuhusu kuunganisha pamoja mifano ya kihistoria ya atomi, kuonyesha maendeleo ya ujuzi juu ya atomi (Democritus, Thomson, Rutherford), mifano ambayo tayari imekuwa ya jadi katika utafiti. ya kemia (mpira-na-fimbo, Stewart-Brigleb, au Pauling) ,miundo inayotumika katika mbinu za kisayansi za kukokotoa (mbinu ya M.O.). Ni muhimu kuunda mfumo wa hierarchical wa mifano, ambayo mifano mbalimbali inaweza kujengwa na vipengele vya kimuundo vya atomi vinaweza kuelezewa, kuonyesha, kulingana na hitaji, vipengele fulani vya mfano.
Kwa sababu ya ugumu wa kuwasilisha misingi ya kemia ya quantum, vitabu vya kiada vya darasa la nane na tisa haitoi maelezo muhimu ya sababu za uwekaji wa elektroni karibu na viini, na uwezekano wa kuamua idadi ya elektroni kwenye safu ya nishati sio. kuzingatiwa. Hii inafanya kuwa vigumu kuunda mawazo kuhusu muundo wa kielektroniki wa atomi, molekuli, na miili ya fuwele. Na hii inatumika kwa kazi kuu za kusoma kozi ya kemia, kuanzia darasa la nane la shule ya sekondari.
Shida za mifano na simulizi zinabaki kuwa muhimu katika kusoma sheria ya upimaji na mfumo wa mara kwa mara wa vitu vya kemikali D.I. Mendeleev: ni muhimu kuonyesha mifano ya shells za elektroni imara, ambazo huamua aina ya meza ya vipengele vya kemikali. Wakati wa kusoma vifungo vya kemikali, picha rahisi za mwingiliano wa atomi na malezi ya ganda la kawaida la Masi pia zinahitajika. Jambo kama hilo lazima liambatane na picha inayoonekana, na sio tu jina la mfano.
Haja ya vielelezo vya kuona ni kubwa sana hivi kwamba shule zimetoa miundo mingi ya kuona ili kuonyesha fomula za kielektroniki. Ili kuonyesha uhamisho wa elektroni kutoka atomi moja hadi nyingine, mbinu mbalimbali hutumiwa: bodi ya magnetic yenye picha ya uhakika (elektroni); masanduku yenye chips za rangi nyingi zinazowakilisha elektroni na miduara inayowakilisha atomi za vitu mbalimbali na ions; seti ya takwimu za plastiki za rangi zinazoonyesha aina mbalimbali za mawingu ya elektroni, hemispheres zinazowakilisha atomi au ioni kwa msingi wa magnetic. Vifaa vya kuona hapo juu na sawa ni sawa na kuchora nyaya za elektroniki kwenye ubao mweupe. Tofauti ni kwamba mifano, wakati inabaki iconic, hupata baadhi ya vipengele vya nyenzo - zinakuwa zinazoonekana na zenye nguvu, lakini hii haiongezi uwezo wao wa habari.
Shida ya haraka ni uundaji wa mifano mpya ya kielimu ambayo ni sawa na ile ya kisayansi na ina mali ya didactic. Wataalamu wa mbinu hulipa kipaumbele sana tatizo hili katika uboreshaji wa mifano ya kisayansi. A.I. Shpak alipendekeza kutumia elektroni kwa namna ya mfano wa kwanza katika daraja la nane, kwa kuzingatia eneo lake katika nafasi na sura ya wingu la elektroni. S. N. Drozdov ilipendekeza kutumia mifano iliyofanywa kwa waya laini ya shaba au alumini kwa kusudi hili.
B.C. Ili kuwasilisha swali la mwelekeo wa mawingu ya elektroni katika nafasi, Polosin alitumia mifano ya mipira na puto, pamoja na mifano ya kuanguka ya s- na p-orbitals iliyofanywa kwa waya zilizopakwa rangi tofauti. Kulingana na matokeo ya kufanya kazi na watoto wa shule, alihitimisha kuwa wakati wa kusoma matukio ya microworld, mtu hawezi kujizuia kwa aina moja tu ya misaada ya kuona; ni muhimu kutumia tata ya mifano mbalimbali na vifaa vingine vya kuona.
Yu. I. Bulavin alipendekeza kutumia mitambo na vifaa vya umeme ili kuzungusha sehemu zinazozalisha aina mbalimbali za mawingu ya elektroni.
S. S. Berdonosov, akisema kuwa mbinu ya kuelezea muundo wa molekuli rahisi zaidi (CHC, NH3, HgO, nk), ambayo hutumiwa kwa jadi katika shule ya upili, sio ya kuona sana na ngumu sana, kwa kuzingatia idadi ya mawazo ya bandia. , anapendekeza kwa busara kutumia mifano ya R. Gillespie, ambayo ni rahisi sana na inafanya iwezekanavyo kuelezea muundo wa molekuli sio tu na vifungo rahisi, lakini pia vitu vya utungaji ngumu zaidi ambao huunda vifungo viwili na tatu.
Miundo ya kielimu, kama ya utafiti, lazima iwe ya kuelimisha, yaani, matumizi yake lazima yatengeneze taswira iliyojaa habari muhimu na ya kutosha kuunda dhana kuhusu kitu kilichoigwa. Wakati huo huo, utajiri wa kielimu (kisayansi) wa mifano ya kufundisha haipaswi kupingana na kubadilika kwao kwa maalum ya mchakato wa elimu. Tofauti na mifano ya mafunzo ya utafiti ya kitu au jambo moja, haipaswi kupingana na sheria za dunia na inapaswa kuendana na kila mmoja. Utangamano unaeleweka kama uhusiano kati ya mifano ambayo inawezekana kuchukua nafasi ya modeli moja na nyingine bila kuathiri picha ya jumla ya kisayansi ya jambo linalosomwa. Matumizi ya mfano unaoendana, badala ya ile iliyopendekezwa, haipaswi kusababisha utata, lakini ama kwa utata wa njia ya maelezo, au, katika hali mbaya, kwa kupoteza upande wa mfano wa kitu.
Kwa ujumla, kuibuka kwa mifano tofauti kunaelezewa na viwango tofauti vya utata wa matukio yanayotengenezwa na maeneo tofauti ya matumizi yao. Kwa hiyo, mipaka ya matumizi ya mifano tofauti lazima lazima kuingiliana. Lazima kuwe na eneo la makutano ambayo angalau mifano miwili inaweza kutumika. Kwa kweli, muundo wowote changamano unapaswa kuendana na mtindo wowote rahisi, tofauti tu katika anuwai ya matumizi. Vinginevyo, mchakato wa kujifunza na kuingiza ujuzi juu ya kitu halisi au jambo la hatari huhamia kwenye uwanja wa kusoma vipengele vya mifano wenyewe na uhusiano wao katika hali mbalimbali. Mifano zinazolingana ambazo hutofautiana katika uwezo wa habari zinaweza kuunganishwa katika mfumo wa mifano ya ufundishaji, au kuunda mchanganyiko wa mifano ya kufundisha, matumizi ambayo yataepuka kugawanyika na kugawanyika kwa uigaji wa habari, kuhakikisha uwiano na ujuzi wa utaratibu.
Tatizo la utafiti liko katika mgongano kati ya hitaji la kuwajulisha wanafunzi kwa mujibu wa kiwango cha maendeleo ya kisasa ya sayansi na uwezo mdogo wa habari wa njia za jadi za didactic - mifano ya atomi na molekuli; kati ya hitaji la kuanzisha aina mpya ya ufundishaji - jaribio la mfano na ukosefu wa uwazi, na mara nyingi kutokubaliana kwa mifano inayotumiwa.
Lengo la utafiti ni mchakato wa kusoma muundo wa maada kwa kutumia mifano ya atomi na molekuli katika kozi ya kemia ya shule ya upili. Mada ya utafiti: nadharia na mazoezi ya kuunda na kutumia seti ya mifano ya atomi na molekuli kusoma muundo wa maada katika kozi ya kemia ya shule ya upili.
Kusudi la utafiti: kuamua njia na njia za kuunda na kutumia seti ya mifano ya kisasa ya atomi na molekuli kusoma muundo wa dutu, mali zao za mwili na kemikali. Nadharia ya utafiti: ikiwa mchanganyiko wa mifano ya elimu ya atomi na molekuli, iliyoundwa kwa kuzingatia mwelekeo wa kisasa wa modeli kulingana na mifano ya jadi na mpya, inakidhi mahitaji ya uwezo wa juu wa habari, ina uwezo mkubwa wa didactic na hutumiwa kuanzisha aina mpya ya mafundisho. - jaribio la mfano, basi hii itachangia : malezi katika wanafunzi wa ujuzi wa jumla na wa ufahamu kuhusu muundo wa jambo; kuelewa mali ya vitu; kuimarisha na kuhifadhi muda mrefu wa ujuzi; kuimarisha miunganisho ya taaluma tofauti na kuunda picha ya kisayansi ya ulimwengu. Malengo ya utafiti
1. Fanya uchanganuzi wa maudhui ya kozi ya kemia kwa darasa la 8-11 kuhusu muundo wa jambo na utoaji wake kwa zana za kielelezo cha kuona.
2. Kuunda mahitaji ya ufundishaji na ergonomic kwa mifano na kuunda seti moja ya mifano ya kielimu inayolingana ya kisayansi (ikiwa ni pamoja na mifano ya jadi iliyotumiwa na mpya ya umbo la pete), kuhakikisha mafanikio ya malengo ya ufundishaji kwa njia bora zaidi. 3. Kuendeleza mbinu za mbinu za kutumia seti ya mifano ya elimu, ikiwa ni pamoja na wale wenye umbo la pete, angalia uwezekano wa kufanya majaribio ya mfano kwa msaada wao, na kutathmini ufanisi wa ufundishaji wa matumizi yake katika mazoezi ya shule. Msingi wa mbinu ya utafiti ni utafiti wa kimsingi katika uwanja wa didactics, saikolojia, nadharia ya uumbaji na matumizi ya aina mbalimbali za vifaa vya kufundishia na complexes zao (A.A. Grabetsky, L.S. Zaznobina, A.A. Makarenya, E.E. Minchenkov, T. S. Nazarova, S.G. Shapovalenko), mbinu za kufundisha kemia (O.S. Zaitsev, N.E. Kuznetsova, L.A. Tsvetkov, G.M. Chernobelskaya, I.N. Chertkov), nadharia za kisaikolojia na za ufundishaji na ergonomic (V.V. Davydov, V.P. Matokeo ya Munches ya V. mafanikio ya kiufundi katika uwanja wa kuunda mifano ya chembe za msingi, atomi na misombo yao ya kemikali. Mbinu za utafiti
Uchambuzi wa fasihi ya ufundishaji, mbinu, kemikali, kisaikolojia na ufundishaji juu ya nadharia ya maarifa na usimamizi wa mchakato wa kupata maarifa, muundo na uundaji wa vifaa vya kufundishia juu ya shida za muundo wa jambo, uundaji na utumiaji wa mifano katika masomo muundo wa jambo.
Uchunguzi na ujanibishaji wa uzoefu wa ufundishaji wa madarasa ya shule, uzoefu wa walimu wa hali ya juu na wataalam wa mbinu, uvumbuzi wa ufundishaji, na pia uzoefu wa kazi ya vilabu vya nje ya shule ya wanafunzi.
Upimaji wa majaribio ya ufanisi wa ufundishaji wa kulinganisha wa ushawishi wa mifano ya mtu binafsi na tata kwa ujumla juu ya ubora wa elimu.
Hatua za utafiti
Katika hatua ya kwanza (1996-1998), shida na shida zinazowakabili walimu na wanafunzi wakati wa kusoma muundo wa jambo katika kozi ya kemia ya shule ya upili zilitambuliwa, zinazohusiana na muundo tata wa atomi na hitaji la haraka la kujua sheria. ya muundo wake. Njia imetambuliwa ya kutatua shida za kusimamia nyenzo za kielimu na kuunda hali za kuboresha ubora wa maarifa kwa kutumia seti ya mifano, inayoonyeshwa na kuunganishwa kwa vifaa vyote na fursa mpya za didactic.
Katika hatua ya pili (1999-2001), mwelekeo wa modeli za kisasa, mahitaji ya ufundishaji na ergonomic kwa mifano yalizingatiwa, seti ya mifano ya kielimu ilipendekezwa, pamoja na mifano mpya ya upande wa pete, na uwezo wa didactic wa tata ulizingatiwa.
Katika hatua ya tatu (2002-2003), mbinu na mbinu za kutumia seti ya mifano ya kusoma muundo wa jambo ziliamuliwa, mapendekezo ya mbinu yalitolewa, na ufanisi wa ufundishaji wa matumizi yake ulijaribiwa.
Riwaya ya kisayansi na umuhimu wa kinadharia wa utafiti
Wazo limetengenezwa kwa uundaji na utumiaji wa seti ya mifano ya kielimu ya atomi na molekuli kwa kusoma muundo wa jambo, pamoja na mahitaji ya kimsingi na maalum ya kielimu na ergonomic kwa mifano inayotumika, kwa kuzingatia mwelekeo wa kisasa wa modeli.
Mfululizo wa mifano mpya ya elimu inapendekezwa, ambayo ni vipengele muhimu kwa ajili ya kuunda seti ya zana za kuona za mfano ambazo zinakidhi mahitaji ya kisasa ya ufundishaji na ergonomic.
Mbinu za kimbinu zimetengenezwa kwa kutumia seti ya mifano, ikiwa ni pamoja na zile za pande zote, kwa ajili ya kufundisha kemia katika shule ya upili, kuhakikisha ufanisi wa upataji wa maarifa ya wanafunzi.
Umuhimu wa vitendo wa matokeo ya utafiti
Seti ya mifano ya elimu ya atomi na molekuli imeundwa, ikiwa ni pamoja na mifano mpya ya pande zote.
Seti za mifano ya annular zimetengenezwa na kuwekwa katika uzalishaji, na programu za picha za kompyuta zimeundwa kwa ajili ya kufahamiana na mifano ya annular.
Mfululizo wa meza juu ya mada "Muundo wa Mambo" imeandaliwa kwa ajili ya utekelezaji katika shule, iliyoandaliwa kwa misingi ya seti ya mifano ya elimu ya atomi na molekuli na kuingizwa kwa pete.
Uwezekano wa kutumia modeli mpya katika kufundisha kwa njia ya programu za picha za kompyuta zinazohakikisha na kudhibiti ufanisi wa unyambulishaji wa maarifa wa wanafunzi wakati wa kusoma maswala ya muundo wa jambo umejaribiwa.
Tasnifu zinazofanana katika taaluma maalum "Nadharia na Mbinu za Kufundisha na Elimu (kulingana na maeneo na viwango vya elimu)", 13.00.02 kanuni HAC
Mbinu za kimbinu za matumizi jumuishi ya zana za kielektroniki za elimu katika shule za sekondari: mfano wa kufundisha hisabati katika darasa la 5-6. 2007, mgombea wa sayansi ya ufundishaji Nikonova, Natalya Vasilievna
Ujumuishaji wa elimu ya media na kozi ya kemia ya shule ya upili 2004, Daktari wa Sayansi ya Pedagogical Zhurin, Alexey Anatolyevich
Ufanisi wa ufundishaji wa visaidizi vya skrini pamoja na jaribio la kemikali katika kozi ya kemia ya kikaboni ya shule ya upili 1984, Mgombea wa Sayansi ya Ufundishaji Nuguen Man Dung, 0
Misingi ya kimbinu ya kujenga kozi ya juu ya fizikia katika shule ya msingi 1997, Daktari wa Sayansi ya Pedagogical Dammer, Manana Dmitrievna
Matumizi ya uundaji wa kompyuta katika mchakato wa kujifunza: Kwa kutumia mfano wa kusoma fizikia ya molekuli katika shule ya sekondari 2002, mgombea wa sayansi ya ufundishaji Rozova, Natalia Borisovna
Hitimisho la tasnifu juu ya mada "Nadharia na mbinu ya mafunzo na elimu (kwa maeneo na viwango vya elimu)", Kozhevnikov, Dmitry Nikolaevich
Hitimisho la Sura ya 3.
1. Pengo kati ya kiwango cha msingi kinachokubalika cha ufundishaji katika madarasa ya elimu ya jumla na hitaji lililopo la kusoma fizikia na kemia kulingana na maoni ya kisasa ya kisayansi juu ya muundo wa atomi, kutokubaliana kwa kiitikadi kwa mifano ya obiti ya molekuli na mifano rahisi ya kitamaduni. kwa hitaji la kuleta yaliyomo katika mstari na kanuni za sio historia tu, lakini pia za kisayansi, za kimsingi, zinazoweza kubadilika na za kiteknolojia. Ukosefu wa usawa wa mifano katika elimu ya msingi husababisha ujuzi wa kitendawili. Mfano wa makombora ya elektroni yenye pete inaweza kuwa mtoaji wa ujuzi wa viwango tofauti vya utata kuhusu muundo wa atomi na sifa zake. Urahisi wake wa kimbinu na ufikiaji unairuhusu kutumika katika shule za sekondari, pamoja na katika madarasa ya kibinadamu, na utofauti wake na uwezekano wa kutumia mifano ngumu (inayotambulika ya pande zote: yenye ncha za wimbi, au kutoka kwa ond iliyofungwa) inaruhusu kutumika katika madarasa ya utafiti wa kina.
2. Miundo ya pande zote inaweza kutumika katika ufundishaji wa kozi nzima ya kemia, tangu mwanzo kabisa wa kusoma Sheria ya Muda. Matumizi ya mifano ya kuona hutolewa kwa mada mbalimbali: "Sheria ya mara kwa mara na mfumo wa mara kwa mara wa vipengele vya kemikali vya D.I. Mendeleev. Muundo wa atomi. Muundo wa vitu."
3. Tatizo la upungufu wa maudhui ya mafunzo, yanayotokana na utata na kutofautiana kwa kiasi kikubwa kwa mifano ya jadi iliyotumiwa, inaweza kutatuliwa na mabadiliko yaliyogawanyika katika maudhui yanayohusiana na kuanzishwa kwa mifano mpya katika mafunzo.
4. Mbinu mbalimbali za mbinu za kutumia mifano mpya katika mada kuu ya kozi ya kemia kwa darasa la 8-11 zinapendekezwa: matumizi ya mifano mpya ya maandamano hutolewa; kutumia vifaa vya video vya utangulizi na kufanya masomo ya kompyuta; Inapendekezwa kufanya kazi ya mbele, pamoja na kazi ya maabara na ya vitendo kwa namna ya majaribio ya mfano yaliyofanywa na wanafunzi kwa kujitegemea au kama sehemu ya timu.
5. Mifano za upande wa pete, kuchanganya faida za saketi zote za elektroniki na mifano ya obiti, hutoa fursa mpya za didactic kwa namna ya majaribio ya mfano, ambayo sampuli za ramani za kiteknolojia kwa wanafunzi zimetengenezwa, pamoja na meza juu ya mada "Muundo. ya Mambo” na mapendekezo ya kimbinu kwa walimu .
6. Takriban mipango ya mada ya vifaa vya programu inazingatiwa, fomu za shirika na mbinu za mbinu zinawasilishwa kwa fomu ya meza.
7. Imeandaliwa kwa njia hii, matumizi ya mifano mpya - ya pete inakuwezesha kuhamisha kujifunza kwa kiwango kipya cha mtazamo wa habari: kielelezo-kisual-ufanisi.
Utafiti uliokamilika ni wa kinadharia na vitendo na unalenga kutatua tatizo la kuunda mfumo wa kisayansi wa mifano ya elimu na njia za kuitumia kwa ufanisi shuleni.
1. Uchambuzi wa maudhui ya kozi ya kemia kwa darasa la 8-11 ulifanyika na mwelekeo katika uundaji na matumizi ya mifano ya elimu ya atomi na molekuli kwa kozi ya kemia ya shule ya upili iliamuliwa. Jukumu la mifano kama zana ya shughuli za mwalimu na mwanafunzi wakati wa kusoma sehemu ya "Muundo wa Mambo" imeonyeshwa. Kulingana na uchambuzi wa mfuko wa vifaa vya kufundishia vya maonyesho na vifaa vya kufundishia kwa kazi ya kujitegemea, hitaji la kuunda kizazi kipya cha mifano imetambuliwa ambayo itaepuka kugawanyika na kugawanyika kwa uigaji wa habari, kuhakikisha mshikamano na maarifa ya kimfumo, mifano inayounda. picha ya wazi ya usambazaji wa elektroni katika kila atomi au molekuli kwenye shells za elektroni.
2. Kanuni za kinadharia za uumbaji na matumizi ya mfumo wa mifano ya elimu kwa kemia ya kufundisha hutengenezwa, iliyotolewa kwa namna ya mahitaji ya ufundishaji na ergonomic kwa mifano. Seti ya miundo ya kielimu imeundwa, ikiwa ni pamoja na miundo mipya ya upande wa pete ambayo inakamilisha zile za jadi zinazotumiwa katika kozi za kemia za shule ya upili. Muundo wa sehemu ya mifano ya kusoma kozi ya kemia katika sehemu ya "Muundo wa Mambo" imedhamiriwa. Dhamana ya kemikali." Ili kurekebisha ujuzi wa kisayansi, aina tofauti za mifano ya upande wa pete zimependekezwa, kutumika kama chombo cha shughuli za wanafunzi, bila ambayo ni vigumu kutambua nyenzo za elimu na kuingiza maudhui yake ya kisayansi.
3. Mbinu imetengenezwa kwa kutumia seti ya mifano ya kuona (ikiwa ni pamoja na wale wa pete) katika kozi ya kemia ya shule ya sekondari, na inawezekana kuitumia kufanya majaribio ya mfano kwa namna ya maonyesho, maabara na kazi ya vitendo. Kwa urahisi na urahisi wa matumizi ya tata ya mifano na vipengele vilivyojengwa vya zana na teknolojia mpya, ujuzi wa awali wa wanafunzi hutolewa kupitia maonyesho ya video na masomo ya kompyuta. Nyenzo za video za didactic na programu za kompyuta zimetengenezwa kwa mafunzo kwa kutumia mifano mpya ya pete sio tu kwa maonyesho, lakini pia kwa kutekeleza michakato ya kielelezo na wanafunzi katika aina mbalimbali za shirika la madarasa (mtu binafsi na kikundi), ambayo inaruhusu kuhamisha mafunzo kwa mpya. kiwango cha mtazamo wa habari - kwa njia ya mfano-kimwonekano. Jaribio la majaribio la ufanisi wa ufundishaji wa kutumia mchanganyiko wa mifano ya atomi na molekuli katika mazoezi ya shule ilithibitisha nadharia ya utafiti huu.
Orodha ya marejeleo ya utafiti wa tasnifu Mgombea wa Sayansi ya Ufundishaji Kozhevnikov, Dmitry Nikolaevich, 2004
1. Bergman D.L. Mfano wa Pete ya Malipo ya Spinning ya Chembe za Msingi // Galilean Electrodynamics, 1991. vol. 2. - Nambari 2. - P. 30-32.
2. Bergman David.L. na Lucas J., Charles W. Miundo ya Kimwili ya Chembe za Awali, Atomu na Nuclei / Presentedat IVth Mkutano wa Kimataifa: Tatizo la Nafasi, Muda na Mwendo. St. Petersburg, Septemba 1997.
3. Lucas J. Mfano wa Kimwili wa Atomi na Nuclei //Galilean Electrodynamics, Januari/Februari 1996. juzuu ya 7, - No. 1, P. 3-12.
4. Snelson K. Picha ya atomi / kijitabu cha Maonyesho. Kituo cha Sayansi cha Maryland cha Baltimore, 1981.
5. Arkavenko L. N. Misingi ya mbinu kwa ajili ya uumbaji na matumizi ya mfumo wa vyombo na mitambo kwa kozi ya hiari "Kemia katika Viwanda": tasnifu ya Ph.D. (13.00.02) Moscow 1991. -218s.
6. Atsyukovsky V. A. Mienendo ya jumla ya ether. M.: Energoatomizdat, 1990. -70 p.
7. Beklyamishev V.O. Nadharia ya utupu. Sehemu ya 1. - St. Petersburg: 000 "Congress", 1998. -104 p.
8. Berdonosov S.S. Mfano wa R. Gillespie unaelezeaje muundo wa molekuli? //Kemia shuleni, 1996. Nambari 2. - ukurasa wa 16-21.
9. Vitabu vya Berdonosov S.S. Kemia: imani potofu za jadi na kisasa // Kemia shuleni, 2000. Nambari 5. - P. 22-27.
10. Yu. Boltyansky V. G. Mfumo wa uwazi: isomorphism pamoja na unyenyekevu // Sov. Pedagogy, 1970. - No. 5.
11. Borodin P.V. Mbinu yetu ya kujifunza muundo wa methane, ethylene na asetilini // Kemia shuleni, 1991. Nambari 6. - P. 40-41.
12. Bulavin Yu. I. Mifano ya nguvu ya mawingu ya elektroni // Kemia shuleni, 1995. Nambari 4. - ukurasa wa 69-70.
13. Bunin V. A. Hisabati na ugumu wa fizikia // Ufahamu na ukweli wa kimwili. M.: mh. Folium, 1997. - vol 2 - No 2. - ukurasa wa 71-79.
14. Vanyugina T.V., Milliaresi E.E. Kozi maalum ya hiari "Muundo wa anga na elektroniki wa misombo ya kikaboni" // Kemia shuleni, 1988. Nambari 4. - P. 43-44.
15. Verkhovsky V. N. na Smirnov A. D. Mbinu ya majaribio ya kemikali. Mwongozo kwa walimu. juzuu ya 1, ed. 6, iliyorekebishwa - M., Elimu, 1975.-368p.
16. Verkhovsky V. N. na Smirnov A. D. Mbinu ya majaribio ya kemikali. Mwongozo kwa walimu. juzuu ya 2, ed. 6, iliyorekebishwa - M., Elimu, 1975.-383p.
17. Vinogradova N.K. Misingi ya shirika na ya ufundishaji ya kubuni mazingira yenye umbo la somo la tata ya elimu "shule ya chekechea": maandishi ya tasnifu ya Ph.D. (13.00.02) - Moscow 1999.-313s.
18. Vlasov A.D. Schrödinger atomi // UFN, 1993. Nambari 2. - t. 163. - P. 97-103.
19. Vlasov A. D. Mwelekeo wa classical katika mechanics ya quantum. M.: MRTI RAS, 1993.-229 p.
20. Gabrielyan O. S., Smirnova T. V. Kusoma kemia katika daraja la 8: Mwongozo wa kimbinu kwa kitabu cha kiada Gabrielyan O. S. Kemia 8 kwa wanafunzi na walimu. Nyenzo za didactic. / Chini ya jumla mh. T.V. Smirnova. - M.: Blik Plus, 1997. - 224 p.
21. Galiulin R.V. Mihadhara juu ya misingi ya kijiometri ya crystallography: Maandishi ya mihadhara. Chelyabinsk: Ural. Jimbo Chuo Kikuu, Chelyab. jimbo chuo kikuu., 1989. - 81 p.
22. Gapich G. P. Somo la kuunganishwa la kurudia na jumla ya ujuzi // Kemia shuleni, 1998. Nambari 7. - P. 26-28.
23. Garkunov V.P. Mbinu za kufundisha kemia / Ed. N. E. Kuznetsova. M.: Elimu, 1984. -415 p.
24. Heisenberg V. Fizikia na Falsafa. M.: Nauka, 1989. -400 p.
25. Glinka N. L. Kemia ya jumla: Kitabu cha maandishi kwa vyuo vikuu. Toleo la 21. / Mh. Rabinovich V. A. - L.: Kemia, 1980. - 720 p.
26. Golubev I.M., Averin A.V. Picha ya a na z-connections katika picha moja // Kemia shuleni, 1990. Nambari 2. - P.39.
27. Golubev I.M. Juu ya dhana ya "wingu la elektroni" // Kemia shuleni, 1980. - No. 5. Uk.36.
28. Grabetsky A. A., Zaznobina L. S., Nazarova T. S. Matumizi ya vifaa vya kufundishia katika masomo ya kemia. M.: Elimu, 1988. - 160 p.
29. Grabetsky A.A., Nazarova T.S., Lavrova V.N. Jaribio la kemikali shuleni. M.: Elimu, 1987. -240 p.
30. Guzey, L. S., Sorokin V. V., Surovtseva R. P. Muundo wa atomiki na dhamana ya kemikali // Kemia shuleni, 1988. Nambari 2. - P. 46-51.
31. Guzey, L. S., Sorokin V. V., Surovtseva R. P. Muundo wa atomiki na dhamana ya kemikali // Kemia shuleni, 1988. No. 3. - ukurasa wa 42-48.
32. Guzik N.P. Kufundisha kemia hai: Kitabu cha walimu: Kutokana na uzoefu wa kazi. M.: Elimu, 1988. - 224 p.
33. Davydov V.V. Aina za jumla katika kufundisha. Matatizo ya kimantiki na kisaikolojia ya kujenga masomo ya elimu. M.: Pedagogy, 1972. -424 p.
34. Davydov V.V. Matatizo ya mafunzo ya maendeleo: Uzoefu wa utafiti wa kisaikolojia wa kinadharia na majaribio. M.: Pedagogy, 1986.-240 p.
35. Davydov V.V. Nadharia ya mafunzo ya maendeleo. M.: INTOR, 1996. -544 p.
36. Davydov V.V., Vardanyan A.U. Shughuli za kujifunza na masimulizi. -Yerevan: Luys, 1981. -220 p.
37. Daineko V.I. Hotuba "Nadharia ya muundo. Hydrocarbons: uhusiano kati ya muundo na mali" // Kemia shuleni, 1988. No. - P.36-43.
38. Didyk Yu.K., Urazakov E.I. Mkusanyiko wa mihadhara yenye shida juu ya fizikia: Kitabu cha maandishi. VVVSKU: Dubna, 1990. - 62 p.
39. Drizovskaya T.M. Njia za kufundisha kemia katika daraja la 9. Mwongozo kwa walimu. -M.: Elimu, 1965.-224 p.
40. Drozdov S.N. Tetrahedral mfano na matumizi yake // Kemia shuleni, 1982. Nambari 3. - P.52-54.
41. Dukov V.M. Karne mbili za kazi kwenye kitabu cha fizikia cha shule // Shida za kitabu cha shule. M.: Mwangaza, 1990. - toleo. 19, comp. V.R. Rokityansky. - ukurasa wa 236-269.
42. Egorova A. A. Juu ya uhusiano kati ya sayansi ya asili na kozi za kemia // Kemia shuleni, 1995.-No. 1.-P.30-31.
43. Zagorsky V.V. "Waldorf" mafundisho ya kemia //Kemia shuleni, 1995. -Nambari 3. Uk.10-13. 44. Zaitsev O. S. Kemia ya jumla. Hali ya dutu na athari za kemikali.
44. Kitabu cha kiada kwa vyuo vikuu. M.: Kemia, 1990. - 352 p. 45. Zaitsev O. S. Mbinu za kufundisha kemia. - M.: VLADOS, 1999. - 384 p.: mgonjwa. 46.3ankov L.V. Kazi zilizochaguliwa za ufundishaji. - M.: Shule Mpya, 1996. -426 p.
45. Zelinsky A.N. Academician N.D. Zelinsky (Mpya katika maisha, sayansi, teknolojia. Mfululizo "Kemia", No. 11). M.: Znanie, 1981.-64p.48.3inchenko V.P., Munipov V.M. Misingi ya ergonomics. M.: Nyumba ya Uchapishaji ya Chuo Kikuu cha Jimbo la Moscow, 1979.- 343 p.
46. Zorina L.Ya. Ubora wa utaratibu wa ujuzi. - M.: Maarifa 1976. - 64 p.
47. Ivanova R. G. Kuhusu utafiti wa kemia katika darasa la 7 na 8 // Kemia shuleni, 1981.- Nambari 4. P.24-29.
48. Ivanova R. G. Juu ya maelekezo kuu ya uppdatering elimu ya kemikali wakati wa mpito kwa shule ya miaka kumi na mbili // Kemia shuleni, 2000. No. 3. - P. 2-5.
49. Kanarev F.M. Mgogoro wa fizikia ya kinadharia. Krasnodar KSAU, 1998. -200 p.
50. Kachalova O. I. Kanuni za mbinu za kuandaa warsha ya shule katika kemia ya jumla (daraja la 11): abstract kwa Ph.D. (13.00.02) Omsk: OGPU, 1998.-20 p.
51. Kidd R., Ardini J., Anton A. Uwakilishi wa athari ya Compton kama mabadiliko ya Doppler mara mbili // Fizikia nje ya nchi: Kufundisha. M.: Mir, 1988. - ukurasa wa 68-79. Tafsiri ya makala Kidd R., Ardini J., Anton A.-Amer. J. Phys., 1985.-v 53,-No. 7.-p.641.
52. Kiiranen K. Mifano ya molekuli ya atomiki // Kemia shuleni, 1995. - No. 5. - P. 55-56.
53. Kozhevnikov D.N. Mifano ya pete ya molekuli // Journal ya Kemia ya Kimwili, 1996. Mst 70. - Nambari 6. - ukurasa wa 1134-1137.
54. Kuznetsova L. M. Uzoefu wetu katika kujifunza mada "Kuunganishwa kwa kemikali. Muundo wa jambo katika kozi ya kemia ya daraja la 8” // Kemia shuleni, 1982. Nambari 6. - P. 3942.
55. Kuznetsova N. E. Uundaji wa mifumo ya dhana katika kufundisha kemia. M.: Elimu, 1989. - 144 p.
56. Leonov V. S. Nadharia ya kati ya elastic quantized. Sehemu ya 2. - Minsk: nyumba ya uchapishaji "PolyBig", 1997. - 122 p.
57. Lorenz G. A. Nadharia ya elektroni na matumizi yake kwa matukio ya mwanga na mionzi ya joto. M.: Gostekhizdat, 1953. -472 p.
58. Lorenz G.A. Shida za zamani na mpya za fizikia. M.: Nauka, 1970. - 264 p.
59. Lyashenkov E.I., Gataulin A.G. Matumizi ya mipango ya mseto kwa mawingu ya elektroni ya atomi ya kaboni // Kemia shuleni, 1982. Nambari 5. - P. 41-42.
60. Makarenya A.A. Nadharia na mbinu za kufundisha kemia. Kazi zilizochaguliwa. -T. 2. Tyumen: TOGIRRO, 2000. - 335 p.
61. Maurina I. Ya., Lipina G.N. Baadhi ya mbinu za kutumia mifano katika darasani // Kemia shuleni, 1986. Nambari 3. - P. 51-53.
62. Medvedev Yu. N. Jambo la periodicity ya sekondari // Kemia shuleni, 1998. Nambari 3. - P. 9-19.
65. Minchenkov E.E. Dhana ya elimu ya kemikali shuleni // Kemia shuleni, 1993. Nambari 4. - P. 7-11.
66. Mikhailova I. B. Kutafakari kwa hisia katika ujuzi wa kisasa wa kisayansi. M.: Mysl, 1972. - 277s
67. Nazarova T. S. Misingi ya kinadharia ya uumbaji na matumizi ya mfumo wa nyenzo za kufundisha kemia katika shule ya sekondari. Tasnifu ya shahada ya kisayansi ya Udaktari wa Sayansi ya Ufundishaji. (13.00.02) Moscow: NIISMO, 1988.-42p.
68. Nazarova T.S., Polat E.S. Vifaa vya kufundishia: teknolojia ya uumbaji na matumizi. M.: Nyumba ya uchapishaji URAO, 1998. - 204 p.
69. Neyland O.Ya. Kemia ya kikaboni: Kitabu cha maandishi. kwa chem. mtaalamu. Vyuo vikuu. M.: Juu zaidi. Shule, 1990. -751 p.
70. Teknolojia mpya za ufundishaji na habari katika mfumo wa elimu: Kitabu cha maandishi kwa wanafunzi wa vyuo vikuu vya ufundishaji na mifumo ya mafunzo ya hali ya juu ya wafanyikazi wa kufundisha / Ed. E. S. Polat. M.: Nyumba ya uchapishaji. Center Academy, 1999. - 224 p.
71. Nurminsky I.I. Fizikia 11. Kitabu cha kiada kwa shule na madarasa yenye utafiti wa kina wa fizikia. - M.: NT-Center, 1993. - 160 p.
72. Nurminsky I. I., Gladysheva N. K. Fizikia 9: Kitabu cha maandishi kwa daraja la 9 la taasisi za elimu. - M.: Elimu, 1998. -256 p.
73. Kufundisha kemia katika darasa la 7: Mwongozo wa walimu./A. S. Koroshchenko, P. N. Zhukov, M. V. Zueva na wengine / Ed. A. S. Koroshchenko. M.: Elimu, 1988.-160 p.
74. Kemia ya kikaboni / Ed. Tyukavkina N. A. M.: Dawa, 1989. -432 ukurasa wa 82, Osidak V.N. Electron: muundo wa ndani // Mawazo ya Kimwili ya Urusi, - M.: RIA "Krechet", 1996. Nambari 2. - P. 49-59.
75. Pedagogy: Kitabu cha kiada kwa wanafunzi wa ualimu. Inst / Yu. K. Babansky, V. A. Slastenin, N. A. Sorokin, nk. / Ed. Yu. K. Babansky. Toleo la 2., ongeza. na kusindika - M.: Elimu, 1988. - 479 p.
76. Orodha ya vifaa vya elimu kwa taasisi za elimu nchini Urusi. N. Novgorod: Nizhpoligraf, 1994. - 309 p.
77. Pidkasisty P.I. Shughuli huru ya utambuzi wa watoto wa shule katika elimu: Utafiti wa kinadharia na majaribio. -M.: Pedagogy, 1980.-240 p.
78. Pidkasisty P.I., Portnov M.L. Sanaa ya kufundisha: Toleo la pili. Kitabu cha kwanza cha mwalimu. M.: Jumuiya ya Pedagogical ya Urusi, 1999.-212 p.
79. Plakhov I. A. Kutumia flannelgraph katika kujifunza mada "Dhana za awali za kemikali" // Kemia shuleni, 1995. No. 2. -S. 46-47.
80. Polosin V. S., Shirina L. K. Nadharia na mazoezi ya kutumia vielelezo vinavyobadilika katika kufundisha kemia / Matatizo ya mbinu za kufundisha kemia katika shule ya sekondari. Mh. M. P. Kashina na L. A. Tsvetkova. M.: Pedagogy, 1973. - 272 p.
81. Polosin B.C. Dissertations juu ya mbinu za kufundisha kemia //Kemia shuleni, 1980. Nambari 1. - P. 74-77.
82. Potapov Yu. S., Fominsky L. P. Nishati ya Vortex na fusion baridi ya nyuklia kutoka kwa mtazamo wa nadharia ya mwendo. Chisinau - Cherkasy: "OKO-Plus", 2000, 387 p.
83. Pugal N.A. Uundaji na matumizi ya mfumo wa vifaa vya kufundishia kwa biolojia katika shule ya sekondari. Tasnifu, 1994.
84. Microscopes ya X-ray // Katika ulimwengu wa sayansi. M.: Mir, 1991. - Nambari 4. - P.36-43.
85. Rodina N.A. Kazi ya kujitegemea ya wanafunzi katika fizikia katika darasa la 7-8 la shule ya sekondari: Vifaa vya Didactic / Gutnik U.M., Kirillov I.G., Rodina. N.A / mhariri. KWENYE. Nchi. 2 ed. - M.: Elimu, 1994. -126 p.
86. Romazanov B. I. Fizikia ya ether na asili ya nguvu / Matatizo ya nafasi, wakati, mvuto: Vifaa vya Int ya tatu. conf. 22-27. 05.94. -SPb.: Nyumba ya Uchapishaji ya Politekhnika, 1995. P. 175-185.
87. Romashina T. N., Chernobelskaya G. M. Ujumuishaji wa ujuzi katika kemia ya kikaboni kwa kutumia mipango ya kumbukumbu na mazoezi ya mafunzo // Kemia shuleni, 1985. Nambari 4. - P. 39-40.
88. Eb.Rudzitis G.E., Feldman F.G. Kemia: Kemia isokaboni. Kitabu cha maandishi kwa darasa la 8. wastani. shule M.: Elimu, 1993. - 158 p.
89. Rudzitis G.E., Feldman F.G. Kemia: Kemia isokaboni. Kitabu cha maandishi kwa darasa la 9. wastani. shule M.: Elimu, 1990. - 176 p.
90. Rudzitis G.E., Feldman F.G. Kemia: Kemia hai: Misingi ya kemia ya jumla (Ujumla na ukuzaji wa maarifa). Kitabu cha maandishi kwa darasa la 10. Jumatano, shule M.: Elimu, 1991. - 160 p.
91. Sadovskaya I. L. Mbinu ya kurekebisha upatikanaji wa ujuzi katika mchakato wa kufundisha biolojia katika chuo kikuu cha ufundishaji: maandishi ya tasnifu ya Ph.D. (13.00.02) - Krasnoyarsk: KSPU, 2000. 151 p.
92. Sapogin L. G. Visual microworld. Teknolojia ya vijana, 1989. - No. 1. -S. 40-45.
93. Simon R. Jaribio la ujuzi wa kemikali // Jaribio, mfano, nadharia. Uchunguzi, majaribio, mazoezi. Moscow-Berlin: Nyumba ya uchapishaji ya Nauka, 1982.-P. 76-87.
94. Skatkin M. N. Mbinu na mbinu za utafiti wa ufundishaji. Ili kumsaidia mtafiti anayeanza. M.: Pedagogy, 1986. - 152 p.
95. Skatkin M. N. Matatizo ya didactics ya kisasa. 2 ed. M.: Pedagogy, 1984. - 96 p.
96. Smirnova Zh. I. Utengenezaji wa mifano ya mpira-na-fimbo // Kemia shuleni, 1984. Nambari 1. - P. 61.
97. Smirnova T. V. Uundaji wa mtazamo wa kisayansi wa wanafunzi wakati wa kujifunza kemia: Mwongozo kwa walimu. M.: Elimu, 1984.-175 p.
98. Smirnova. T.V. Juu ya mbinu ya kusoma sehemu "Kemia Mkuu" // Kemia shuleni, 1989. Nambari 4. - P. 35-44.
99. Sologub A.I. Uzalishaji na matumizi ya mifano ya magnetic // Kemia shuleni, 1985. Nambari 3. - P. 55-56.
100. Solomon D. N., Stepanov E. Yu. Nyenzo za didactic kwa bodi ya sumaku // Kemia shuleni, 1982. Nambari 1. - P. 65.
101. Surovtseva R.P. Kazi za kazi ya kujitegemea katika kemia katika daraja la 9: Kitabu cha walimu. - M.: Elimu, 1995. 64 p.
102. Surovtseva R. P., Sofronov S. V. Kazi za kazi ya kujitegemea katika kemia katika daraja la 8: Kitabu cha walimu. M.: Elimu, 1993. - 96 p.
103. Surovtseva. R.P.; Minchenkov E. E.; Gabrielyan O. S. Takriban mipango ya mada ya nyenzo za elimu katika kemia kwa daraja la 8 // Kemia shuleni, 2000. Nambari 3. - P. 37-46.
104. Tikavy V. F. Vipengele vya muundo wa baadhi ya vitu rahisi na ngumu vya isokaboni // Kemia shuleni, 1991. Nambari 6. - P. 5-12.
105. Tyumentseva E. Yu. Tofauti ya usaidizi kwa wanafunzi wa idara ya maandalizi katika mchakato wa kufundisha kemia: maandishi ya tasnifu ya Ph.D. (13.00.02) Omsk: OGPU, 1999. - 213 p.
106. Kuimarisha mwelekeo wa polytechnic wa ufundishaji wa kemia. Kitabu kwa ajili ya walimu: kutokana na uzoefu wa kazi / handy. Kaverina A. A. M.: Elimu, 1987.-127p.
107. Fizikia na Astronomia. Kitabu cha majaribio kwa elimu ya jumla ya darasa la 8. kuanzishwa / Mh. A. A. Pinsky, V. G. Razumovsky. M.: Elimu, 1995.-303 p.
108. Freemantle M. Kemia kwa vitendo. Katika sehemu 2. Sehemu ya 1: Transl. kutoka kwa Kiingereza - M.: Mir, 1991.-528 p.
109. Freemantle M. Kemia kwa vitendo. Katika sehemu 2. Sehemu ya 2: Transl. kutoka kwa Kiingereza - M.: Mir, 1991.-622 p.
110. Hager N. Hatua za malezi ya mfano // Jaribio, mfano, nadharia. Mifano katika muundo wa utambuzi. Moscow-Berlin: Sayansi, 1982. - ukurasa wa 128-142.
111. Kemia na Maisha (Solter chemistry). Sehemu ya 1. Dhana za kemia: Trans. kutoka kwa Kiingereza -M.: RKhTU im. DI. Mendeleeva, 1997. 337 pp., mgonjwa.
112. Kemia na Maisha (Solter chemistry). Sehemu ya 2. Riwaya za kemikali: Trans. kutoka kwa Kiingereza M.: RKhTU im. DI. Mendeleeva, 1997. -437 p., mgonjwa.
113. Kemia na Maisha (Solter chemistry). Sehemu ya 3. Warsha: Trans. kutoka kwa Kiingereza M.: RKhTU im. DI. Mendeleeva, 1997. -406 p., mgonjwa.
114. Kemia na Maisha (Solter chemistry). Sehemu ya 4. Mwongozo kwa walimu: Trans. kutoka kwa Kiingereza M.: RKhTU im. DI. Mendeleeva, 1998. - 331 p., mgonjwa.
115. Khomchenko G. P. Kuhusu fomula za picha na miundo // Kemia shuleni, 1983. -№3.- P. 61-63.
116. Tsvetkov J1. A. Ili kuhalalisha maudhui ya elimu ya msingi ya kemikali // Kemia shuleni, 1999. Nambari 5. - P. 17-22.
117. Tsvetkov L. A. Ujumla wa ujuzi wa wanafunzi katika kemia ya kikaboni // Kemia shuleni, 1981. Nambari 6. - P. 17-24.
118. Tsvetkov L. A. Kemia ya kikaboni: Kitabu cha maandishi kwa darasa la 10 la shule ya upili. Toleo la 25, lililorekebishwa. - M.: Elimu, 1988. - 240 p.
119. Tsvetkov L. A. Kufundisha kemia ya kikaboni katika shule ya sekondari: Mwongozo kwa walimu. Toleo la 3, lililorekebishwa. - M.: Elimu, 1984. -256 p.
120. Chernobelskaya G.M. Misingi ya mbinu za kufundisha katika kemia. M.: Elimu, 1987.-256 p.
121. Chernobelskaya G.M. Mbinu za kufundisha kemia katika shule ya upili. M.: VLADOS, 2000. - 336 p.
122. Chertkov I.N. Mara nyingine tena kuhusu dhana ya "hali ya oxidation" katika kemia ya kikaboni // Kemia shuleni, 1998. - No. 7.-S. 31-32.
123. Chertkov I. N. Umuhimu wa kazi za A. M. Butlerov kwa ajili ya maendeleo ya mbinu za kufundisha kemia // Kemia shuleni, 1991. Nambari 6. - P. 13-19.
124. Shamilishvili O. Kh. Juu ya suala la uwazi katika utafiti wa mseto wa shells za elektroniki // Kemia shuleni, 1982. Nambari 5. - P. 43.
125. Shapovalenko S.G. Mbinu za kufundishia katika shule za miaka minane na sekondari. M.: Jimbo. Elimu-Ped. Nyumba ya uchapishaji min. Elimu ya RSFSR, 1963. -668 p.
126. Shelinsky G.I. Kozi ya kemia ya shule inapaswa kuwaje? // Kemia shuleni, 1985.-№4.-P. 45-48.
127. Shpak A.I. Seti ya visaidizi vya kusoma muundo wa maada katika kozi ya kemia ya darasa la nane la shule ya kina: muhtasari wa Ph.D. (731)-Saratov: SGPI, 1971.-26p.
128. Schrödinger E. Kazi zilizochaguliwa kwenye mechanics ya quantum. M.: Nauka, 1976.
129. Shtoff V. A. Matatizo ya mbinu ya ujuzi wa kisayansi. Monograph. -M.: Shule ya Juu, 1978. 269 p.
130. Shtoff V.A. Modeling na falsafa. M.: Nauka, 1966.
131. Atkins P. Utaratibu na machafuko katika asili: Transl. kutoka kwa Kiingereza / Dibaji Yu. G. Rudogo. M.: Mir, 1987. - 224 pp., mgonjwa.
132. Yuzvishin I. I. Informationology. Toleo la 3, Mch. na ziada - M.: Redio na Mawasiliano, 1996. -215 p.
133. Yaroslavskaya G. P. A kuweka kwa mfano vifungo vya kemikali na miundo ya atomiki // Kemia shuleni, 1986. Nambari 3. - P. 54-55.
134. Yatsuto M. A. Kutumia uwezo wa didactic wa kemia kuwatayarisha wanafunzi kwa maisha: maandishi ya tasnifu ya Ph.D. (13.00.02) Omsk: OGPU, 1999. - 192 p.
Tafadhali kumbuka kuwa maandishi ya kisayansi yaliyowasilishwa hapo juu yamewekwa kwa madhumuni ya habari pekee na yalipatikana kupitia utambuzi asilia wa maandishi ya tasnifu (OCR). Kwa hivyo, zinaweza kuwa na makosa yanayohusiana na kanuni za utambuzi zisizo kamili. Hakuna hitilafu kama hizo katika faili za PDF za tasnifu na muhtasari tunazowasilisha.
Hadi sasa, mamia ya mbinu tofauti zimetengenezwa na hutumiwa kikamilifu kujifunza muundo na mali ya molekuli. Wengi wao wanahitaji ujuzi wa nadharia ngumu za kimwili na matumizi ya vifaa vya gharama kubwa. Katika sehemu hii tutazingatia baadhi tu ya mbinu zinazotumiwa sana katika kusoma muundo wa molekuli na tutajaribu kutoa tafsiri rahisi ya kiini cha matukio ya kimwili ambayo yana msingi wa njia hizi. Lakini kwanza, acheni tugeukie mazingatio ya mwendo wa atomi na molekuli angani na mwendo wa atomi zilizofungwa katika molekuli. Hii ni kutokana na ukweli kwamba mbinu nyingi zinazotumiwa kuchunguza muundo wa molekuli zinatokana na utafiti wa harakati za elektroni na atomi katika molekuli na harakati za molekuli zenyewe.
SHAHADA ZA UHURU
Chembe ya uhakika ina digrii tatu za kijiometri za uhuru: inaweza kusonga katika pande tatu za perpendicular. Chembe inasemekana kuwa na digrii tatu za uhuru.
Chini ya kiwango cha uhuru katika michakato ya kubadilishana nishati, tunaelewa kiwango cha uhuru wa chembe inayoweza kushiriki katika mchakato wa kubadilishana nishati.
Wacha tuzingatie tabia ya kinetic ya atomi. Nishati ya kinetiki ya wastani ya mole moja ya atomi ni rahisi kukadiria kwa kutumia heliamu kama mfano. Inajulikana kuwa uwezo wa joto wa mole moja ya heliamu ni 12.47 J/(mol K). Hii ina maana kwamba kupokanzwa mole moja ya heliamu kwa digrii moja kunahitaji 12.47 J ya nishati.
Inapokanzwa, atomi za heliamu huanza kusonga kwa kasi angani pamoja na shoka zote tatu, ambazo ni sawa. Hakika, atomi za heliamu zina nishati ya kinetic pekee, ambayo inaweza kuwakilishwa kwa fomu sawa na heshima ya shoka tatu.
Hii ina maana kwamba kuongeza kasi ya mwendo wa joto pamoja na mhimili mmoja na ongezeko la joto kwa digrii moja inahitaji tu 4.15 J. Thamani ya mwisho ni sawa kabisa na R/2, ambapo R ni gesi ya ulimwengu wote sawa na 8.314472 (15) J/ (mol -TO). Tunatoa hitimisho hili kwa atomi na molekuli yoyote, ambayo inakubaliana na majaribio: uwezo wa joto wa kutafsiri kwa kiwango kimoja cha tafsiri ya uhuru wa chembe ni sawa na R/2.
Hadi kufikia hatua hii, tumepuuza muundo wa ndani wa atomi na molekuli. Sasa hebu tuchunguze ni jukumu gani elektroni na viini vya atomiki vinacheza katika michakato ya kubadilishana nishati.
Kwa joto karibu 300 K, wastani wa nishati ya kinetic ya mole moja ya atomi na molekuli ni, kulingana na usemi.
![]()
takriban 3740 J/mol. Nishati ya kinetic ya wastani ya molekuli moja huhesabiwa kwa kutumia equation
![]()
ambapo k ni Boltzmann ya mara kwa mara sawa na R/L/d = 1.38 10 -23 J/K.
Nishati ya kinetic ya wastani ya molekuli moja katika 300 K ni 6.2 10 -21 J au 0.039 eV kwa molekuli. Takriban kiasi sawa cha nishati huhamishwa wakati wa migongano. Hapo awali tumeonyesha kuwa nishati ya msisimko ya viwango vya nishati ya elektroniki inahitaji takriban 3-10 eV. Kwa hivyo, nishati ambayo kwa wastani inaweza kuhamishwa kutoka molekuli moja hadi nyingine haitoshi kabisa kusisimua viwango vya nishati ya elektroniki. Kwa hiyo, elektroni katika atomi na molekuli, licha ya kuwepo kwa digrii tatu za kutafsiri za uhuru kwa kila elektroni, kama sheria, hazichangia jumla ya uwezo wa joto. Isipokuwa inawezekana tu mbele ya viwango vya chini vya nishati ya elektroniki.
Hebu tugeukie viini vya atomi ambavyo ni sehemu ya molekuli. Kila msingi una viwango vitatu vya kutafsiri vya uhuru. Lakini katika utungaji wa molekuli, viini vinaunganishwa na vifungo vya kemikali, na kwa hiyo harakati zao haziwezi kutokea kabisa kwa machafuko. Kutokana na kuwepo kwa vifungo vya kemikali, harakati ya nuclei jamaa kwa kila mmoja inaweza kutokea tu ndani ya mipaka fulani, vinginevyo molekuli zingepitia mabadiliko ya kemikali. Ikiwa viini vyote vinasonga kwenye tamasha, basi harakati kama hizo zinaweza kuwa muhimu. Kwa mfano, hii hutokea wakati wa mwendo wa kutafsiri wa molekuli kwa ujumla. Katika kesi hii, nuclei zote katika molekuli zina sehemu sawa ya kasi katika mwelekeo wa mwendo wa kutafsiri.
Pamoja na mwendo wa kutafsiri, kuna uwezekano mwingine wa udhihirisho wa mwendo wa synchronous wa nuclei - hii ni mzunguko wa molekuli kwa ujumla. Katika hali ya jumla ya molekuli zisizo za mstari kuna digrii tatu za mzunguko wa uhuru karibu na shoka tatu za perpendicular zinazopita katikati ya wingi. Katikati ya misa lazima lazima iwe kwenye mhimili wa mzunguko, kwani vinginevyo ingehama wakati molekuli inapozunguka, ambayo haiwezekani kwa kutokuwepo kwa nguvu za nje.
Hapo awali ilionyeshwa kuwa nishati ya mzunguko imehesabiwa na quantum ya nishati ya mzunguko imedhamiriwa na mara kwa mara ya mzunguko sawa na H 2 / (2/). Viunga vinavyozunguka vya molekuli kawaida huwa chini ya k T(kwa joto la kawaida karibu 300 K thamani ya k T ni karibu 200 cm -1 au 0.026 eV, au 400 10 -23 J, au 2500 J/mol) na ni sawa na takriban 10 cm -1 (120 J/mol au 0.0012 eV/molekuli). Kwa hiyo, mzunguko wa Masi husisimua kwa urahisi kwa joto la kawaida. Uwezo wa joto kwa kila kiwango cha mzunguko wa uhuru pia ni sawa na R/2.
Tofauti na molekuli zisizo za mstari, molekuli za mstari zina digrii mbili tu za mzunguko za uhuru zinazohusiana na shoka mbili za perpendicular, ambazo ni perpendicular kwa mhimili wa molekuli. Je, kuna kiwango cha kuzunguka cha uhuru kuhusu mhimili unaoambatana na mhimili wa molekuli? Kwa kusema kweli, kiwango kama hicho cha uhuru kipo, lakini msisimko wa kuzunguka karibu na mhimili wa molekuli inamaanisha msisimko wa kuzunguka kwa viini karibu na mhimili unaopita katikati ya viini. Kiasi cha nishati ya mzunguko wa viini pia imedhamiriwa na viunga vya mzunguko h 2 / (2 1), Wapi 1 - sasa wakati wa inertia ya msingi. Kwa nuclei, mzunguko wa mzunguko ni wa utaratibu wa ukubwa (1.054) 2 10 _68 / (2 1.7 10 -27 Yu -30) = 3.2 10 -12 J, ambayo ni kubwa zaidi kuliko k T. Kwa hivyo, msisimko wa mwendo wa mzunguko wa viini pia hauwezi kutokea chini ya hali karibu na zile za kawaida.
Kwa ujumla, molekuli inaweza tu kuwa nayo 3N digrii za uhuru, wapi N- idadi ya cores. Kati ya hizi 3 N Kuna digrii tatu za uhuru kwa zile za kutafsiri, na tatu kwa molekuli zisizo za mstari au mbili kwa molekuli za mstari kwa digrii za mzunguko wa uhuru. Viwango vilivyobaki vya uhuru vinatetemeka. Molekuli zisizo za mstari zina 3 N-6 digrii vibrational ya uhuru, na linear -3N-5.
Tofauti na digrii za uhuru za mzunguko na za kutafsiri, kila kiwango cha uhuru cha mtetemo kina uwezo wa joto sawa na R, si R/2. Hii ni kutokana na ukweli kwamba wakati mwendo wa vibrational ni msisimko, nishati hutumiwa sio tu kwa kuongeza nishati ya kinetic ya nuclei, lakini pia katika kuongeza nishati ya uwezo wa mwendo wa vibrational.
Ikumbukwe kwamba hali na digrii za vibrational za uhuru ni ngumu zaidi kuliko zile za kutafsiri na za mzunguko. Ukweli ni kwamba maadili ya kawaida ya masafa ya vibrational yapo katika safu ya 1000-3000 cm -1. (1 cm -1 ~ 1.24 10 -4 eV.) Kwa hivyo, quanta ya msisimko wa vibrational itakuwa karibu 0.1-0.3 eV, ambayo ni mara kadhaa tu zaidi ya nishati ya mwendo wa joto (0.04 eV katika 300 K) . Kwa hiyo, kwa joto chini ya joto la kawaida (300 K), mwendo wa vibrational katika molekuli ni msisimko dhaifu, lakini kwa joto la juu ya joto la kawaida, vibrations, hasa katika molekuli za polyatomic, tayari zimesisimua kwa ufanisi. Joto la chumba huanguka katika safu ya kati.
Mitetemo yote katika molekuli inaweza kugawanywa katika kunyoosha na kuinama. Katika kesi ya vibrations kunyoosha, urefu wa dhamana ya kemikali hasa mabadiliko, na katika kesi ya vibrations deformation, pembe kati ya vifungo mabadiliko. Mitetemo ya kunyoosha ina masafa ya juu zaidi kuliko mitetemo ya kupinda, kwani nishati kidogo inahitajika ili kubadilisha pembe. Idadi ya mitetemo ya kunyoosha ni sawa na idadi ya vifungo kati ya atomi kwenye molekuli (vifungo viwili na vitatu vinazingatiwa katika kesi hii kama dhamana moja kati ya atomi!). Masafa ya mitetemo ya kunyoosha ni ya vifungo vya C-H, O-H, nk. kuhusu 3000-3400 cm" 1, C-C - kuhusu 1200 cm" 1, C=C - 1700 cm 4, OS - 2200 cm 4, C=0 - 1700 cm 1, vibrations deformation kawaida uongo katika eneo la 1000 cm" 1 Kutoka kwa data iliyowasilishwa ni wazi kwamba mzunguko wa vibration ya kunyoosha ya kifungo cha C-C huongezeka kadiri wingi wa dhamana unavyoongezeka.Hii inaweza kuelezewa na ongezeko la nguvu za dhamana.
Hebu tujadili jambo hili kwa undani zaidi. Mzunguko wa oscillator inavyoonyeshwa kwenye Mtini. 2.7, imedhamiriwa na usemi

Wapi T- wingi wa chembe ya oscillating. Katika kesi ya oscillator (Mchoro 2.7), molekuli ya oscillating T kushikamana na chemchemi kwenye ukuta, ambayo wingi wake ni kubwa sana, na kwa hiyo ukuta haushiriki katika mwendo wa oscillatory. Kwa upande wa molekuli, kila atomi inayotetemeka inaunganishwa na vifungo vya kemikali, vinavyofanya kazi kama chemchemi, na atomi nyingine ambazo uzito wake si mkubwa sana. Kwa hiyo, atomi zote zilizounganishwa na vifungo vya kemikali hushiriki katika mwendo wa vibrational. Kwa mfano, katika molekuli ya HC1, atomi ya hidrojeni na atomi ya klorini hutetemeka. Kama ifuatavyo kutoka kwa nadharia ya mwendo wa oscillatory, formula ya mzunguko wa oscillation ya oscillators ya aina ya HC1 inapaswa kuwa na fomu.
ambapo p ni misa iliyopunguzwa, sawa na
![]()
Wapi t ( ,t 2 - wingi wa atomi zinazoshiriki katika dhamana ya kemikali, na k ni nguvu isiyobadilika inayoonyesha nguvu ya kifungo. Nishati ya bondi moja ya C-C ni karibu 410 kJ/mol, mara mbili -
710 kJ / mol, mara tatu - 960 kJ / mol. Misa iliyopunguzwa ya oscillator ya C-C haitegemei asili ya uunganisho. Kwa hivyo, wakati wa kwenda kutoka kwa dhamana moja hadi tatu, mtu angetarajia kuongezeka kwa mzunguko wa oscillator kwa sababu ya 1.5, ambayo inazingatiwa kwa majaribio.
Masafa ya vifungo vya C-C ni takriban mara 2.5 chini ya mzunguko wa vifungo vya C-H. Hii ni kutokana na ukweli kwamba molekuli iliyopunguzwa kwa vibrations ya dhamana ya C-C ni kubwa kuliko kwa dhamana ya C-H, na nishati ya dhamana ya C-C ni ndogo.
Hebu tuangalie baadhi ya mifano ya molekuli maalum ambazo modi zao za mitetemo zinaonyeshwa kwenye Mtini. 7.1.
Molekuli ya maji. Ina digrii 9 za uhuru, ambazo tatu ni za kutafsiri, tatu ni za mzunguko, tatu ni za oscillatory. Kati ya masafa matatu ya vibrational, mbili za kwanza ni mitetemo ya kunyoosha, na ya tatu inainama.
Molekuli C0 2. Ina digrii 9 za uhuru: tatu - tafsiri, mbili - za mzunguko, nne - oscillatory. Kati ya masafa manne ya mitetemo, mawili ni mitetemo ya kunyoosha na mbili ni mitetemo ya mabadiliko.

Mchele. 7.1. Aina za vibration za molekuli H 2 0, C0 2, H 2 CO, zilizopatikana kwa misingi ya nadharia halisi.
Ishara "+" na "-" zinaonyesha mwelekeo wa vibrations perpendicular kwa ndege ya karatasi. Vibrations zote mbili za deformation hutofautiana tu katika ndege za pande zote za perpendicular ambayo vibrations hutokea. Oscillations hizi zina mzunguko sawa na huitwa degenerate.
Molekuli ya formaldehyde isiyo ya mstari ina digrii 12 za uhuru: tatu - tafsiri, tatu - za mzunguko, sita - oscillatory. Kati ya mitetemo sita, tatu ni mitetemo ya kunyoosha na tatu ni mitetemo inayopinda.
Kutoka Mtini. 7.1 inaonyesha kwamba mitetemo ya kunyoosha kawaida huenea kwa molekuli nzima: mitetemo ya dhamana moja tu ni nadra sana. Kwa njia hiyo hiyo, vibrations deformation huathiri pembe zote kwa shahada moja au nyingine.
Hebu sasa turudi kwenye hesabu ya uwezo wa joto wa molekuli. Kwa atomi (molekuli za monatomiki) kuna uwezo wa joto wa kutafsiri sawa na (3 / 2)R. Kwa molekuli za diatomiki kuna digrii tatu za kutafsiri za uhuru, mbili za mzunguko na moja ya vibrational. Kisha kwa kesi ya joto la chini (chumba), bila kuzingatia digrii za vibrational za uhuru, tunapata C = (3 / 2 + 3 / 2) R = (5 / 2) R. Katika hali ya joto la juu, uwezo wa joto ni (7/2) R.
Katika molekuli ya maji tuna digrii tatu za kutafsiri, tatu za mzunguko na tatu za vibrational za uhuru. Katika hali ya joto la chini, bila kuzingatia digrii za vibrational za uhuru, C = (3 / 2 + 3 / 2) R = 3R. Katika hali ya joto la juu, unahitaji kuongeza 3R nyingine kwa thamani hii. Matokeo yake ni 6R.
Muundo wa molekuli
Molekuli ni chembe ndogo zaidi ya dutu, inayojumuisha atomi zinazofanana au tofauti zilizounganishwa na vifungo vya kemikali, na ni mtoaji wa sifa zake za msingi za kemikali na kimwili. Vifungo vya kemikali husababishwa na mwingiliano wa elektroni za nje, za valence za atomi. Kuna aina mbili za vifungo mara nyingi hupatikana katika molekuli: ionic na covalent.
Kuunganishwa kwa Ionic (kwa mfano, katika NaCl, molekuli za KBr) hufanyika na mwingiliano wa umeme wa atomi wakati wa mpito wa elektroni kutoka atomi moja hadi nyingine, yaani, wakati wa kuundwa kwa ions chanya na hasi. Kifungo shirikishi (kwa mfano, katika H2, C2, molekuli za CO) hutokea wakati elektroni za valence zinashirikiwa na atomi mbili za jirani (mizunguko ya elektroni za valence lazima iwe ya kupingana). Dhamana ya ushirikiano inaelezwa kwa misingi ya kanuni ya kutofautiana kwa chembe zinazofanana, kwa mfano, elektroni katika molekuli ya hidrojeni. Kutofautiana kwa chembe husababisha mwingiliano maalum kati yao, unaoitwa mwingiliano wa kubadilishana. Hii ni athari ya quantum tu ambayo haina maelezo ya kitamaduni, lakini inaweza kufikiria kwa njia ambayo elektroni ya kila atomi ya molekuli ya hidrojeni hutumia wakati fulani kwenye kiini cha atomi nyingine na, kwa hivyo, unganisho la atomi. atomi zote zinazounda molekuli hutokea. Wakati atomi mbili za hidrojeni zinakuja pamoja kwa umbali kwa utaratibu wa radius ya Bohr, mvuto wao wa pande zote hutokea na molekuli thabiti ya hidrojeni huundwa.
Molekuli ni mfumo wa quantum; inaelezewa na equation ya Schrödinger, ambayo inazingatia harakati za elektroni katika molekuli, vibrations ya atomi za molekuli, na mzunguko wa molekuli. Kutatua equation hii ni shida ngumu sana, ambayo kawaida hugawanywa katika mbili: kwa elektroni na nuclei.
Nishati ya molekuli pekee
Mzunguko wa E E el +E hesabu +E, (1)
ambapo El ni nishati ya mwendo wa elektroni kuhusiana na nuclei, E hesabu - nishati ya vibration
viini (kama matokeo ya ambayo nafasi ya jamaa ya nuclei hubadilika mara kwa mara), mzunguko wa E ni nishati ya mzunguko wa nuclei (kama matokeo ya mwelekeo wa molekuli katika nafasi mara kwa mara hubadilika). Mfumo (1) hauzingatii nishati ya mwendo wa kutafsiri wa katikati ya wingi wa molekuli na nishati ya viini vya atomiki katika molekuli. Ya kwanza yao haijahesabiwa, kwa hivyo mabadiliko yake hayawezi kusababisha kuibuka kwa wigo wa Masi, na ya pili inaweza kupuuzwa ikiwa muundo wa hyperfine hauzingatiwi.
mistari ya spectral. Mahusiano E el:E hesabu:E mzunguko =1: m/M , Wapi T- wingi wa elektroni, M- kiasi cha mpangilio wa wingi wa viini vya atomiki katika molekuli, m/M10 -5 10 -3. Kwa hiyo, E el >> E hesabu >> E mzunguko. Imethibitishwa kuwa E el 1 10 eV, E coll 10 -2 10 -1 eV, E mzunguko 10 -5 10 -3 eV.
Kila moja ya nishati iliyojumuishwa katika usemi (1) imehesabiwa (inalingana na seti ya viwango tofauti vya nishati) na imedhamiriwa na nambari za quantum. Wakati wa kuhama kutoka hali moja ya nishati hadi nyingine, nishati E=h inafyonzwa au kutolewa. Wakati wa mabadiliko hayo, nishati ya mwendo wa elektroni, nishati ya vibration na mzunguko hubadilika wakati huo huo. Kutoka kwa nadharia na majaribio inafuata kwamba umbali kati ya viwango vya nishati ya mzunguko E kuoza ni chini sana kuliko umbali kati ya viwango vya vibrational E coll, ambayo, kwa upande wake, ni chini ya umbali kati ya viwango vya elektroniki E el. Katika Mtini. Kielelezo cha 1 kinaonyesha viwango vya nishati vya molekuli ya diatomiki (kwa mfano, viwango viwili tu vya elektroniki vinazingatiwa - vinaonyeshwa kwa mistari minene).
Mtazamo wa molekuli. Raman akitawanyika
Muundo wa molekuli na mali ya viwango vyao vya nishati huonyeshwa ndani spectra ya molekuli- utoaji (kufyonza) spectra inayotokea wakati wa mabadiliko ya quantum kati ya viwango vya nishati ya molekuli. Wigo wa utoaji wa molekuli imedhamiriwa na muundo wa viwango vyake vya nishati na sheria zinazolingana za uteuzi (kwa mfano, mabadiliko ya nambari za quantum zinazolingana na mwendo wa vibrational na mzunguko lazima iwe sawa na ± 1).
Kwa hivyo, kwa aina tofauti za mabadiliko kati ya viwango, aina tofauti za spectra za molekuli hutokea. Masafa ya mistari ya spectral inayotolewa na molekuli inaweza kuendana na mabadiliko kutoka ngazi moja ya kielektroniki hadi nyingine. (spekta ya elektroniki) au kutoka ngazi moja ya mtetemo (ya mzunguko) hadi nyingine (vibrational (mzunguko) spectra). Kwa kuongezea, mabadiliko yaliyo na maadili sawa ya hesabu ya E pia yanawezekana na E huzungushwa kwa viwango ambavyo vina thamani tofauti za vipengele vyote vitatu, na kusababisha kielektroniki-mtetemo na vibrational-mzunguko spectra. Kwa hiyo, wigo wa molekuli ni ngumu sana.
Mtazamo wa kawaida wa molekuli ni mistari, inayowakilisha mkusanyiko wa bendi nyembamba zaidi au chini katika maeneo ya ultraviolet, inayoonekana na ya infrared. Kutumia vyombo vya spectral vya azimio la juu, mtu anaweza kuona kwamba bendi ni mistari iliyo karibu sana ambayo ni vigumu kutatua. Muundo wa spectra ya molekuli ni tofauti kwa molekuli tofauti na inakuwa ngumu zaidi na kuongezeka kwa idadi ya atomi kwenye molekuli (inazingatiwa. pekee kupigwa kwa upana imara). Molekuli za polyatomiki pekee ndizo zenye mwonekano wa mtetemo na mzunguko, wakati molekuli za diatomiki hazina. Hii inafafanuliwa na ukweli kwamba molekuli za diatomiki hazina wakati wa dipole (wakati wa mabadiliko ya vibrational na mzunguko, hakuna mabadiliko katika wakati wa dipole, ambayo ni hali ya lazima kwa uwezekano wa mpito kutofautiana na sifuri).
Mnamo 1928, wanataaluma G. S. Landsberg (1890-1957) na L. I. Mandelstam na wakati huo huo wanafizikia wa India C. Raman (1888-1970) na K. Krishnan (b. 1911) waligundua jambo hilo. Raman kutawanya mwanga. Ikiwa mwanga wa monochromatic huanguka kwenye dutu (gesi, kioevu, kioo cha uwazi), basi katika wigo wa mwanga uliotawanyika, pamoja na mstari wa spectral ambao haujabadilishwa, mistari mpya hugunduliwa, masafa ambayo ni hesabu au tofauti za mzunguko. ya mwanga wa tukio na masafa i vibrations asili (au mizunguko) ya molekuli ya kati ya kutawanya.
Mistari katika wigo wa Raman yenye masafa - i , masafa ya chini
mwanga wa tukio huitwa Satelaiti za Stokes (au nyekundu), mistari yenye masafa + i, kubwa ,- satelaiti za anti-Stokes (au violet). Uchambuzi wa spectra ya Raman inaongoza kwa hitimisho zifuatazo: 1) mistari ya satelaiti iko kwa ulinganifu pande zote mbili za mstari usiobadilishwa; 2) masafa i usitegemee mzunguko wa tukio la mwanga kwenye dutu, lakini imedhamiriwa tu na dutu ya kueneza, yaani, wana sifa ya utungaji na muundo wake; 3) idadi ya satelaiti imedhamiriwa na suala la kueneza; 4) ukubwa wa satelaiti za anti-Stokes ni chini ya ukubwa wa satelaiti za Stokes na huongezeka kwa kuongezeka kwa joto la dutu ya kutawanya, wakati ukubwa wa satelaiti za Stokes hautegemei joto.
Nadharia ya Quantum inaeleza sheria za Raman kutawanya mwanga. Kwa mujibu wa nadharia hii, kueneza mwanga ni mchakato ambao photon moja inachukuliwa na photon moja hutolewa na molekuli. Ikiwa nguvu za photon ni sawa, basi mstari usio na mwanga huzingatiwa katika mwanga uliotawanyika. Hata hivyo, taratibu za kueneza zinawezekana ambazo nguvu za photoni zilizoingizwa na zinazotolewa ni tofauti. Tofauti katika nishati ya photon inahusishwa na mpito wa molekuli kutoka hali ya kawaida hadi hali ya msisimko (photon iliyotolewa itakuwa na mzunguko wa chini - satelaiti ya Stokes inaonekana) au kutoka kwa hali ya msisimko hadi hali ya kawaida (photon iliyotolewa itakuwa). kuwa na masafa ya juu - satelaiti ya anti-Stokes inaonekana).
Kutawanyika kwa nuru kunafuatana na mabadiliko ya molekuli kati ya viwango mbalimbali vya vibrational au mzunguko, kama matokeo ambayo idadi ya satelaiti ziko kwa ulinganifu huonekana. Idadi ya satelaiti imedhamiriwa na wigo wa nishati ya molekuli, yaani, inategemea tu asili ya dutu ya kueneza. Hivyo Kwa kuwa idadi ya molekuli zenye msisimko ni ndogo sana kuliko idadi ya zile ambazo hazijasisimka, nguvu ya satelaiti za anti-Stokes ni ndogo kuliko ile ya Stokes. Kwa kuongezeka kwa joto, idadi ya molekuli za msisimko huongezeka, kama matokeo ya ambayo ukubwa wa satelaiti za anti-Stokes pia huongezeka.
Mtazamo wa molekuli (ikiwa ni pamoja na spectra ya Raman) hutumiwa kujifunza muundo na mali ya molekuli, inayotumiwa katika uchambuzi wa spectral ya molekuli, spectroscopy ya laser, umeme wa quantum, nk.
Uchambuzi wa mgawanyiko wa X-ray: 1) Kutoka kwa mifumo ya diffraction iliyopatikana wakati boriti ya X-ray inapita kupitia kioo, umbali wa interatomic umeamua na muundo wa kioo umeanzishwa; 2) Inatumika sana kuamua muundo wa protini na molekuli za asidi ya nucleic; 3) Urefu wa dhamana na pembe zilizowekwa kwa molekuli ndogo hutumiwa kama viwango vya kawaida kwa kudhani kuwa zinabaki sawa katika miundo ngumu zaidi ya polima; 4) Moja ya hatua za kuamua muundo wa protini na asidi ya nucleic ni ujenzi wa mifano ya molekuli ya polima ambayo inalingana na data ya X-ray na kuhifadhi maadili ya kawaida ya urefu wa dhamana na pembe za dhamana.
Mwanga wa sumaku ya nyuklia: 1) Katika msingi - kunyonya kwa mawimbi ya sumakuumeme katika masafa ya masafa ya redio kwa viini vya atomiki kuwa na wakati wa sumaku; 2) Kunyonya kwa quantum ya nishati hutokea wakati viini viko kwenye uwanja wa magnetic wenye nguvu wa spectrometer ya NMR; 3) Viini vyenye mazingira tofauti ya kemikali kunyonya nishati katika uwanja wa sumaku wa voltage tofauti kidogo (au, kwa voltage ya mara kwa mara, oscillations tofauti kidogo ya masafa ya redio); 4) Matokeo yake ni Wigo wa NMR dutu ambayo viini vya ulinganifu wa sumaku vinaonyeshwa na ishara fulani - "mabadiliko ya kemikali" kuhusiana na kiwango chochote. ; 5) Mwonekano wa NMR hufanya iwezekane kubainisha idadi ya atomi za kipengele fulani katika kiwanja na idadi na asili ya atomi nyingine zinazozunguka kipengele fulani.
Mwanga wa paramagnetic wa elektroni (EPR): 1) Kunyonya kwa resonant ya mionzi na elektroni hutumiwa
Hadubini ya elektroni:1) Wanatumia darubini ya elektroni inayokuza vitu mara milioni; 2) Darubini za kwanza za elektroni zilionekana mnamo 1939; 3) Kwa azimio la ~ 0.4 nm, darubini ya elektroni inakuwezesha "kuona" molekuli za protini na asidi ya nucleic, pamoja na maelezo ya muundo wa organelles za mkononi; 4) Mnamo 1950 ziliundwa microtomes Na visu , kuruhusu kutengeneza sehemu za ultrathin (20-200 nm) za tishu zilizopachikwa awali kwenye plastiki.
Njia za kutengwa na utakaso wa protini: Mara tu chanzo cha protini kimechaguliwa, hatua inayofuata ni kuiondoa kutoka kwa tishu. Mara tu dondoo iliyo na sehemu kubwa ya protini ya riba imepatikana na chembe na nyenzo zisizo za protini zimeondolewa, utakaso wa protini unaweza kuanza. Kuzingatia . Inaweza kufanywa kwa kunyesha kwa protini ikifuatiwa na kuyeyuka kwa mvua kwa kiasi kidogo. Kwa kawaida, sulfate ya amonia au acetone hutumiwa. Mkusanyiko wa protini katika suluhisho la awali lazima iwe angalau 1 mg / ml. Denaturation ya joto . Katika hatua ya awali ya utakaso, matibabu ya joto wakati mwingine hutumiwa kutenganisha protini. Ni bora ikiwa protini ni thabiti katika hali ya joto huku protini zinazoandamana zikibadilishwa. Katika kesi hii, pH ya suluhisho, muda wa matibabu na joto ni tofauti. Ili kuchagua hali bora, mfululizo wa majaribio madogo hufanywa kwanza. Baada ya hatua za kwanza za utakaso, protini ziko mbali na hali ya homogeneous. Katika mchanganyiko unaosababishwa, protini hutofautiana kutoka kwa kila mmoja kwa umumunyifu, uzito wa Masi, malipo ya jumla ya molekuli, utulivu wa jamaa, nk. Kunyesha kwa protini na vimumunyisho vya kikaboni. Hii ni moja ya mbinu za zamani. Ina jukumu muhimu katika utakaso wa protini kwa kiwango cha viwanda. Vimumunyisho vinavyotumika zaidi ni ethanoli na asetoni, mara chache zaidi - isopropanol, methanoli, na dioxane. Utaratibu kuu wa mchakato: kadiri mkusanyiko wa kutengenezea kikaboni unavyoongezeka, uwezo wa maji kutengenezea molekuli za enzyme ya hydrophilic hupungua. Kuna kupungua kwa umumunyifu wa protini hadi kiwango ambacho ujumuishaji na mvua huanza. Kigezo muhimu kinachoathiri mvua ni saizi ya molekuli ya protini. Kadiri molekuli inavyokuwa kubwa, ndivyo msongamano wa kutengenezea kikaboni unavyopungua na kusababisha mvua ya protini. Uchujaji wa gel Kutumia njia ya kuchuja gel, macromolecules inaweza kutengwa haraka kulingana na saizi yao. Mtoaji wa chromatography ni gel, ambayo inajumuisha mtandao wa molekuli ya tatu-dimensional iliyounganishwa, iliyoundwa kwa namna ya shanga (granules) kwa kujaza kwa urahisi kwa nguzo. Hivyo Sephadexes ni dextrans zilizounganishwa (α-1→6-glucans za asili ya vijiumbe) zenye ukubwa maalum wa vinyweleo. Minyororo ya Dextran imeunganishwa na madaraja ya kaboni tatu kwa kutumia epichlorohydrin. Viungo zaidi vya msalaba, ukubwa mdogo wa shimo. Gel iliyopatikana hivyo ina jukumu la ungo wa Masi. Wakati suluhisho la mchanganyiko wa vitu linapitishwa kupitia safu iliyojaa granules za Sephadex zilizovimba, chembe kubwa zaidi ya saizi ya pore ya Sephadex itasonga haraka. Molekuli ndogo, kama vile chumvi, zitasonga polepole zinaposonga ndani ya chembechembe. Electrophoresis
Kanuni ya kimwili ya njia ya electrophoresis ni kama ifuatavyo. Molekuli ya protini katika myeyusho katika pH yoyote tofauti na sehemu yake ya isoelectric ina malipo fulani ya wastani. Hii husababisha protini kuhamia kwenye uwanja wa umeme. Nguvu ya kuendesha gari imedhamiriwa na ukubwa wa nguvu ya shamba la umeme E kuzidishwa na malipo ya jumla ya chembe z. Nguvu hii inapingwa na nguvu za viscous za kati, sawia na mgawo wa mnato. η , radius ya chembe r(Radi ya Stokes) na kasi v.; E ·z = 6πηrv.
Uamuzi wa uzito wa molekuli ya protini. Wingi spectrometry (maskiti spectroscopy, spectrography molekuli, uchambuzi spectral molekuli, molekuli spectrometric uchambuzi) ni mbinu ya kusoma dutu kwa kuamua uwiano wa wingi-kwa-chaji. Protini zina uwezo wa kupata chaji nyingi chanya na hasi. Atomi za vipengele vya kemikali zina molekuli maalum. Kwa hivyo, uamuzi sahihi wa wingi wa molekuli iliyochambuliwa inaruhusu mtu kuamua muundo wake wa msingi (tazama: uchambuzi wa msingi). Utazamaji wa wingi pia hutoa habari muhimu kuhusu muundo wa isotopiki wa molekuli zinazochambuliwa.
Njia za kutenganisha na kusafisha enzymes Kutengwa kwa enzymes kutoka kwa nyenzo za kibiolojia ndiyo njia pekee ya kweli ya kupata vimeng'enya . Vyanzo vya enzyme: vitambaa; bakteria zilizopandwa kwenye kati iliyo na substrate inayofaa; miundo ya seli (mitochondria, nk). Ni muhimu kwanza kuchagua vitu muhimu kutoka kwa nyenzo za kibiolojia.
Njia za kutenganisha vimeng'enya: 1) Uchimbaji(tafsiri kuwa suluhisho): suluhisho la buffer (huzuia acidification); kukausha na asetoni ; usindikaji nyenzo na mchanganyiko wa butanol na maji ; uchimbaji na vimumunyisho mbalimbali vya kikaboni, ufumbuzi wa maji ya sabuni ; usindikaji wa nyenzo na perhlorates, enzymes ya hidrolitiki (lipases, nucleases, enzymes ya proteolytic)
Butanol huharibu tata ya lipoprotein, na enzyme hupita kwenye awamu ya maji.
Matibabu na sabuni husababisha kufutwa kwa kweli kwa enzyme.
Kugawanyika. Mambo yanayoathiri matokeo: pH, mkusanyiko wa electrolyte. Ni muhimu kupima mara kwa mara shughuli za enzyme.
Kunyesha kwa sehemu na mabadiliko ya pH
Upungufu wa sehemu kwa kupokanzwa
Kunyesha kwa sehemu na vimumunyisho vya kikaboni
· kugawanyika kwa chumvi - kuweka chumvi nje
adsorption ya sehemu (A. Ya. Danilevsky): adsorbent huongezwa kwenye suluhisho la enzyme, kisha kila sehemu hutenganishwa na centrifugation.
§ ikiwa kimeng'enya kimetangazwa, hutenganishwa na kisha kutolewa kutoka kwa adsorbent.
§ ikiwa enzyme haijatangazwa, basi matibabu na adsorbent hutumiwa kutenganisha vitu vya ballast.
ufumbuzi wa enzyme hupitishwa kupitia safu na adsorbent na sehemu hukusanywa
Enzymes ni adsorbed kuchagua: safu chromatography, electrophoresis; crystallization - kupata enzymes zilizosafishwa sana.
Seli kama sehemu ya chini ya maisha.
Nadharia ya kisasa ya seli inajumuisha masharti ya msingi yafuatayo: Seli ni kitengo cha msingi cha muundo na maendeleo ya viumbe vyote vilivyo hai, kitengo kidogo zaidi cha wanaoishi. Seli za viumbe vyote vya unicellular na multicellular ni sawa (homologous) katika muundo, muundo wa kemikali, na maonyesho ya msingi ya kazi muhimu. na kimetaboliki. Uzazi wa seli hutokea kwa kugawanya, i.e. kila seli mpya. Katika viumbe tata vya seli nyingi, seli ni maalum katika kazi wanayofanya na kuunda tishu; Viungo vinaundwa na tishu. Cl ni mfumo wa maisha wa kimsingi wenye uwezo wa kujirekebisha, kujidhibiti na kujizalisha.
Muundo wa seli. ukubwa wa seli za prokaryotic wastani wa mikroni 0.5-5, saizi za seli za yukariyoti wastani kutoka mikroni 10 hadi 50.
Kuna aina mbili za shirika la seli: prokaryotic na yukariyoti. Seli za prokaryotic zina muundo rahisi. Hawana kiini tofauti cha kimofolojia; kromosomu pekee huundwa na DNA ya duara na iko kwenye saitoplazimu. Saitoplazimu ina ribosomu nyingi ndogo; Hakuna microtubules, hivyo cytoplasm haina mwendo, na cilia na flagella zina muundo maalum. Bakteria huwekwa kama prokaryotes. Viumbe hai vingi vya kisasa ni vya moja ya falme tatu - mimea, kuvu au wanyama, waliounganishwa katika ufalme mkuu wa yukariyoti. Viumbe vimegawanywa katika unicellular na multicellular. Viumbe vya unicellular vinajumuisha seli moja ambayo hufanya kazi zote. Prokaryotes zote ni unicellular.
Eukaryoti- viumbe ambavyo, tofauti na prokariyoti, vina kiini cha seli kilichoundwa, kilichotengwa kutoka kwa cytoplasm na membrane ya nyuklia. Nyenzo za urithi zimo katika molekuli kadhaa za DNA zenye nyuzi mbili (kulingana na aina ya kiumbe, idadi yao kwa kila kiini inaweza kuanzia mia mbili hadi mia kadhaa), iliyounganishwa kutoka ndani hadi kwenye membrane ya kiini cha seli na kuunda tata na protini za histone kwa idadi kubwa, inayoitwa chromatin. Seli za yukariyoti zina mfumo wa utando wa ndani ambao, pamoja na kiini, huunda idadi ya organelles nyingine (retikulamu ya endoplasmic, vifaa vya Golgi, nk). Kwa kuongeza, wengi wao wana symbionts ya kudumu ya intracellular ya prokaryotic - mitochondria, na mwani na mimea pia ina plastids.
Utando wa kibaolojia, mali na kazi zao Moja ya sifa kuu za seli zote za eukaryotiki ni wingi na utata wa muundo wa utando wa ndani. Utando hutenganisha saitoplazimu kutoka kwa mazingira, na pia huunda maganda ya viini, mitochondria na plastidi. Zinaunda maabara ya retikulamu ya endoplasmic na vilengelenge vilivyopangwa vilivyopangwa ambavyo vinaunda Golgi changamano. Utando huunda lysosomes, vakuli kubwa na ndogo za seli za mimea na kuvu, na vakuli za kupumua za protozoa. Miundo hii yote ni sehemu (compartments) zilizokusudiwa kwa michakato na mizunguko fulani maalum. Kwa hiyo, bila utando kuwepo kwa seli haiwezekani. utando wa plasma, au plasma,- membrane ya kudumu zaidi, ya msingi, ya ulimwengu kwa seli zote. Ni filamu nyembamba (takriban 10 nm) inayofunika seli nzima. Plasmalemma ina molekuli za protini na phospholipids. Molekuli za phospholipid zimepangwa katika safu mbili - na miisho ya hydrophobic ndani, vichwa vya hydrophilic kuelekea mazingira ya ndani na nje ya maji. Katika baadhi ya maeneo, bilayer (safu mbili) ya phospholipids hupenya kupitia na kupitia molekuli za protini (protini muhimu). Ndani ya molekuli za protini kama hizo kuna njia - pores ambayo vitu vyenye mumunyifu hupita. Molekuli nyingine za protini hupenya lipid bilayer nusu upande mmoja au nyingine (nusu-muhimu protini). Kuna protini za pembeni kwenye uso wa utando wa seli za yukariyoti. Molekuli za lipid na protini zinashikiliwa pamoja kwa sababu ya mwingiliano wa hydrophilic-hydrophobic. Tabia na kazi za membrane. Tando zote za seli ni miundo ya maji ya rununu, kwani molekuli za lipid na protini hazijaunganishwa na vifungo vya ushirika na zinaweza kusonga haraka sana kwenye ndege ya membrane. Shukrani kwa hili, utando unaweza kubadilisha usanidi wao, i.e. wana fluidity. Utando ni miundo yenye nguvu sana. Wanapona haraka kutokana na uharibifu na pia kunyoosha na mkataba na harakati za seli. Utando wa aina tofauti za seli hutofautiana kwa kiasi kikubwa katika muundo wa kemikali na katika maudhui ya jamaa ya protini, glycoproteins, lipids ndani yao, na, kwa hiyo, katika asili ya vipokezi vilivyomo. Kwa hiyo, kila aina ya seli ina sifa ya mtu binafsi, ambayo imedhamiriwa hasa glycoprotini. Glycoproteini za mnyororo wa matawi zinazojitokeza kutoka kwa membrane ya seli zinahusika utambuzi wa mambo mazingira ya nje, na pia katika utambuzi wa seli zinazohusiana. Kwa mfano, yai na manii hutambuana kwa glycoproteini za uso wa seli ambazo hushikana pamoja kama vipengele tofauti vya muundo mzima. Utambuzi kama huo wa pande zote ni hatua ya lazima kabla ya mbolea. Kuhusishwa na kutambuliwa udhibiti wa usafiri molekuli na ioni kupitia membrane, pamoja na majibu ya immunological ambayo glycoproteins hufanya jukumu la antijeni. Kwa hivyo, sukari inaweza kufanya kazi kama molekuli za habari (kama vile protini na asidi ya nucleic). Utando pia una vipokezi maalum, vibeba elektroni, vibadilishaji nishati, na protini za kimeng'enya. Protini huhusika katika kuhakikisha usafirishaji wa molekuli fulani ndani au nje ya seli, hutoa muunganisho wa kimuundo kati ya cytoskeleton na membrane za seli, au hutumika kama vipokezi vya kupokea na kubadilisha ishara za kemikali kutoka kwa mazingira. upenyezaji wa kuchagua. Hii ina maana kwamba molekuli na ioni hupita ndani yake kwa kasi tofauti, na ukubwa mkubwa wa molekuli, polepole kasi ambayo wao hupitia kwenye membrane. Mali hii inafafanua utando wa plasma kama kizuizi cha osmotic . Maji na gesi zilizoyeyushwa ndani yake zina uwezo wa juu wa kupenya; Ioni hupita kwenye membrane polepole zaidi. Kueneza kwa maji kupitia membrane inaitwa kwa osmosis.Kuna njia kadhaa za kusafirisha vitu kwenye membrane.
Usambazaji- kupenya kwa vitu kupitia membrane kando ya gradient ya mkusanyiko (kutoka eneo ambalo mkusanyiko wao ni wa juu hadi eneo ambalo ukolezi wao ni wa chini). Kwa uenezaji uliowezeshwa protini maalum za usafiri wa utando hufunga kwa ioni au molekuli moja au nyingine kwa kuchagua na kuzisafirisha kwenye utando pamoja na upinde rangi wa ukolezi.
Usafiri ulio hai inahusisha gharama za nishati na hutumika kusafirisha vitu dhidi ya gradient yao ya ukolezi. Yeye uliofanywa na protini maalum za carrier zinazounda kinachojulikana pampu za ion. Iliyosomwa zaidi ni Na - / K - pampu katika seli za wanyama, ambayo husukuma kikamilifu Na + ions nje wakati wa kunyonya K - ions. Kutokana na hili, mkusanyiko wa juu wa K - na mkusanyiko wa chini wa Na + huhifadhiwa kwenye seli ikilinganishwa na mazingira. Utaratibu huu unahitaji nishati ya ATP. Kama matokeo ya usafirishaji wa kazi kwa kutumia pampu ya membrane kwenye seli, mkusanyiko wa Mg 2- na Ca 2+ pia umewekwa.
Katika endocytosis ( endocytosis ...- ndani) eneo fulani la plasmalemma hunasa na, kama ilivyokuwa, hufunika nyenzo za ziada, kuifunga kwenye vacuole ya membrane ambayo hutokea kama matokeo ya uvamizi wa membrane. Baadaye, vacuole kama hiyo inaunganishwa na lysosome, enzymes ambayo huvunja macromolecules kuwa monomers.
Mchakato wa nyuma wa endocytosis ni exocytosis ( exocytosis ...- nje). Shukrani kwa hilo, seli huondoa bidhaa za intracellular au mabaki yasiyotumiwa yaliyofungwa kwenye vacuoles au vesicles. Vesicle inakaribia utando wa cytoplasmic, huunganishwa nayo, na yaliyomo yake hutolewa kwenye mazingira. Hii ndio jinsi enzymes ya utumbo, homoni, hemicellulose, nk.
Kwa hivyo, utando wa kibaolojia, kama vipengele kuu vya kimuundo vya seli, hutumikia sio tu mipaka ya kimwili, lakini ni nyuso za kazi zenye nguvu. Michakato mingi ya kibaolojia hufanyika kwenye utando wa organelles, kama vile kunyonya kwa vitu, ubadilishaji wa nishati, awali ya ATP, nk.
Kazi za utando wa kibiolojia zifuatazo: Wao hutenganisha yaliyomo ya seli kutoka kwa mazingira ya nje na yaliyomo ya organelles kutoka kwa saitoplazimu. Wanahakikisha usafirishaji wa vitu ndani na nje ya seli, kutoka kwa saitoplazimu hadi kwa viungo na kinyume chake. Wanafanya kama vipokezi (kupokea na kubadilisha vitu vya kemikali kutoka kwa mazingira, utambuzi wa vitu vya seli, nk). Ni vichocheo (hutoa michakato ya kemikali ya karibu-utando). Shiriki katika ubadilishaji wa nishati.
"Popote tunapopata uhai tunapata kuwa unahusishwa na mwili wa protini, na popote tunapopata mwili wowote wa protini ambao uko katika mchakato wa kuoza, tunapata bila ubaguzi jambo la maisha."
Protini ni misombo ya kikaboni yenye nitrojeni yenye molekuli ya juu inayojulikana na utungaji wa vipengele vilivyofafanuliwa kikamilifu na hutengana na asidi ya amino wakati wa hidrolisisi.
Vipengele vinavyowatofautisha na misombo mingine ya kikaboni
1. Aina isiyoweza kuharibika ya muundo na wakati huo huo upekee wake maalum wa juu
2. Aina kubwa ya mabadiliko ya kimwili na kemikali
3. Uwezo wa kubadilisha na kwa kawaida kabisa usanidi wa molekuli katika kukabiliana na mvuto wa nje.
4. Tabia ya kuunda miundo ya supramolecular na complexes na misombo mingine ya kemikali
Nadharia ya polypeptide ya muundo wa protini
E. Fisher pekee (1902) ndiye aliyeunda nadharia ya polipeptidi majengo. Kulingana na nadharia hii, protini ni polipeptidi changamano ambapo amino asidi ya mtu binafsi huunganishwa kwa kila mmoja na vifungo vya peptidi vinavyotokana na mwingiliano wa α-carboxyl COOH na α-NH 2 vikundi vya amino asidi. Kutumia mfano wa mwingiliano wa alanine na glycine, malezi ya dhamana ya peptidi na dipeptidi (pamoja na kutolewa kwa molekuli ya maji) inaweza kuwakilishwa na equation ifuatayo:
Jina la peptidi lina jina la asidi ya amino ya N-terminal ya kwanza na kikundi cha bure cha NH 2 (na mwisho -yl, kawaida kwa acyls), majina ya asidi ya amino inayofuata (pia yenye miisho -yl) na jina kamili la asidi ya amino ya C-terminal yenye kikundi cha bure cha COOH. Kwa mfano, pentapeptidi ya amino asidi 5 inaweza kuteuliwa kwa jina lake kamili: glycyl-alanyl-seryl-cysteynyl-alanine, au kifupi Gly-Ala-Ser-Cys-Ala.
ushahidi wa majaribio wa nadharia ya polipeptidi muundo wa protini.
1. Protini za asili zina idadi ndogo ya vikundi vya bure vya COOH na NH 2 vichache, kwa kuwa wengi wao wako katika hali ya kufungwa, wakishiriki katika uundaji wa vifungo vya peptidi; Vikundi visivyolipishwa vya COOH na NH 2 katika asidi ya amino ya N- na C-terminal ya peptidi yanapatikana kwa kupandisha daraja.
2. Katika mchakato wa asidi au hidrolisisi ya alkali squirrel Kiasi cha stoichiometric cha COOH inayoweza kubadilika na vikundi vya NH 2 huundwa, ambayo inaonyesha kutengana kwa idadi fulani ya vifungo vya peptidi.
3. Chini ya utendakazi wa vimeng'enya vya proteolytic (proteinasi), protini hugawanywa katika vipande vilivyoainishwa kabisa, vinavyoitwa peptidi, na asidi ya amino ya mwisho inayolingana na uteuzi wa kitendo cha protini. Muundo wa baadhi ya vipande hivi vya hidrolisisi isiyokamilika ulithibitishwa na usanisi wao wa kemikali uliofuata.
4. Mmenyuko wa biuret (kuchorea rangi ya bluu-violet mbele ya suluhisho la sulfate ya shaba katika kati ya alkali) hutolewa na biuret zote zilizo na dhamana ya peptidi na protini, ambayo pia ni ushahidi wa kuwepo kwa vifungo sawa katika protini.
5. Uchambuzi wa mifumo ya diffraction ya X-ray ya fuwele za protini inathibitisha muundo wa polipeptidi wa protini. Kwa hivyo, uchambuzi wa diffraction ya X-ray na azimio la 0.15-0.2 nm inaruhusu sio tu kuhesabu umbali wa interatomic na saizi za pembe za dhamana kati ya atomi za C, H, O na N, lakini pia "kuona" picha ya jumla. mpangilio wa mabaki ya amino asidi katika mnyororo wa polipeptidi na anga mwelekeo wake (conformation).
6. Uthibitisho mkubwa wa nadharia ya polipeptidi muundo wa protini ni uwezekano wa kuunganisha kwa njia za kemikali za polipeptidi na protini zilizo na muundo tayari unaojulikana: insulini - mabaki ya amino asidi 51, lisozimu - mabaki 129 ya amino asidi, ribonuclease - mabaki 124 ya amino asidi. Protini zilizounganishwa zilikuwa na sifa za physicochemical na shughuli za kibiolojia sawa na protini za asili.
Mnamo 1852, mwanakemia wa Kiingereza Edward Frankland aliweka mbele nadharia ambayo baadaye ilijulikana kama nadharia ya valency, kulingana na ambayo kila chembe ina uwezo fulani wa kueneza (au valence). Kwanza kabisa, kwa kuanzishwa kwa dhana ya "valence," iliwezekana kuelewa tofauti kati ya uzito wa atomiki na uzito sawa wa vipengele. Hata katikati ya karne ya 19, wanakemia wengi bado walichanganya dhana hizi.
Uzito sawa wa atomi ni sawa na uzito wake wa atomiki uliogawanywa na valency yake.
Nadharia ya valence ilichukua jukumu muhimu katika ukuzaji wa nadharia ya kemia na haswa katika kemia ya kikaboni. Baada ya molekuli ya kwanza ya kikaboni kujengwa, ikawa wazi kwa nini molekuli za kikaboni huwa kubwa zaidi na ngumu zaidi kuliko molekuli za isokaboni.
Kulingana na mawazo ya Kekule, atomi za kaboni zinaweza kuungana kwa kutumia moja au zaidi ya vifungo vyake vinne vya valence, na kutengeneza minyororo mirefu. Inavyoonekana, hakuna atomi zingine zinazomiliki uwezo huu wa ajabu kwa kiwango ambacho kaboni inayo.
Umuhimu wa fomula za kimuundo ulikuwa dhahiri sana hivi kwamba wanakemia wengi wa kikaboni walizipitisha mara moja. Walitangaza kuwa majaribio yote ya kuonyesha molekuli za kikaboni kuwa yamepitwa na wakati kama miundo iliyojengwa kutoka kwa radicals. Matokeo yake, ilipatikana kuwa muhimu kuonyesha muundo wake wa atomiki wakati wa kuandika formula ya kiwanja.
Mwanakemia wa Kirusi Alexander Mikhailovich Butlerov alitumia mfumo huu mpya wa fomula za kimuundo katika nadharia yake ya muundo wa misombo ya kikaboni. Katika miaka ya 60 ya karne ya 19, alionyesha jinsi, kwa kutumia kanuni za kimuundo, sababu za kuwepo kwa isoma zinaweza kuelezewa wazi.
Butlerov alielezea mawazo ya msingi ya nadharia ya muundo wa kemikali katika ripoti "Juu ya muundo wa kemikali wa jambo," iliyosomwa katika sehemu ya kemikali ya Congress of German Naturalists and Doctors in Speyer (Septemba, 1861). Misingi ya nadharia hii imeundwa kama ifuatavyo:
- 1) Atomi katika molekuli zimeunganishwa kwa kila mmoja katika mlolongo fulani kulingana na valencies zao. Mlolongo wa vifungo vya interatomic katika molekuli inaitwa muundo wake wa kemikali na unaonyeshwa na fomula moja ya kimuundo (fomula ya muundo).
- 2) Muundo wa kemikali unaweza kuamua kwa kutumia mbinu za kemikali. (Njia za kisasa za kimwili pia zinatumika kwa sasa).
- 3) Mali ya vitu hutegemea muundo wao wa kemikali.
- 4) Kulingana na mali ya dutu iliyotolewa, mtu anaweza kuamua muundo wa molekuli yake, na kulingana na muundo wa molekuli, mtu anaweza kutabiri mali.
- 5) Atomi na vikundi vya atomi kwenye molekuli vina ushawishi wa pande zote kwa kila mmoja.
Msingi wa nadharia ya Butlerov ni wazo la mpangilio wa mwingiliano wa kemikali wa atomi kwenye molekuli. Utaratibu huu wa mwingiliano wa kemikali haujumuishi mawazo kuhusu utaratibu wa kuunganisha kemikali na mpangilio wa kimwili wa atomi. Kipengele hiki muhimu cha nadharia ya muundo wa kemikali inaruhusu mtu kutegemea daima wakati wa kujenga mfano wa kimwili wa molekuli.
Baada ya kuanzisha dhana ya muundo wa kemikali, A.M. Butlerov alitoa ufafanuzi mpya wa asili ya jambo: "asili ya kemikali ya chembe changamano imedhamiriwa na asili ya sehemu zake za msingi, idadi yao na muundo wa kemikali."
Kwa hivyo, A.M. Butlerov alikuwa wa kwanza kuthibitisha kwamba kila molekuli ina muundo maalum wa kemikali, kwamba muundo huamua mali ya dutu, na kwamba kwa kujifunza mabadiliko ya kemikali ya dutu, muundo wake unaweza kuanzishwa.
Maoni ya A.M. Uelewa wa Butlerov juu ya maana ya fomula za muundo wa kemikali hufuata kutoka kwa vifungu vya msingi vya nadharia yake. Butlerov aliamini kuwa fomula hizi hazipaswi kuwa "kawaida", "majibu", lakini kikatiba. Kwa maana hii, kwa kila dutu moja tu formula ya busara inawezekana, kwa misingi ambayo mtu anaweza kuhukumu mali zake za kemikali.
Butlerov alikuwa wa kwanza kuelezea uzushi wa isomerism kwa ukweli kwamba isoma ni misombo ambayo ina muundo sawa wa kimsingi, lakini muundo tofauti wa kemikali. Kwa upande mwingine, utegemezi wa mali ya isoma na misombo ya kikaboni kwa ujumla juu ya muundo wao wa kemikali inaelezewa na kuwepo kwao kwa "ushawishi wa pande zote wa atomi" unaopitishwa kando ya vifungo, kama matokeo ya atomi, kulingana na muundo wao. mazingira, kupata "maana za kemikali" tofauti. Butlerov mwenyewe na haswa wanafunzi wake V.V. Markovnikov na A.N. Popov aliweka msimamo huu wa jumla katika mfumo wa "sheria" nyingi. Tayari katika karne ya 20. sheria hizi, kama dhana nzima ya ushawishi wa kuheshimiana wa atomi, zilipokea tafsiri ya elektroniki.
Kwa hivyo, Butlerov alifungua njia ya uundaji wa utaratibu wa misombo ya kikaboni, kufuatia ambayo kemia ya kikaboni huanza kushinda ushindi mmoja baada ya mwingine katika ushindani na asili kwa ajili ya kuundwa kwa maadili ya nyenzo ili kukidhi mahitaji ya watu.
Maendeleo muhimu katika muundo wa molekuli ni pamoja na ugunduzi wa Pasteur wa isoma za macho na kupitishwa kwa modeli ya pande tatu ya molekuli.