Ветви общей печеночной артерии. Печень (Длина собственной печеночной артерии). Внутренняя сонная артерия
Печёночная артерия является ветвью чревного ствола. Она проходит по верхнему краю поджелудочной железы к начальному отделу двенадцатиперстной кишки, затем направляется вверх между листками малого сальника, располагаясь спереди от воротной вены и медиальнее общего жёлчного протока, и в воротах печени делится на правую и левую ветви. Её ветвями также являются правая желудочная и гастродуоденальная артерии. Часто встречаются дополнительные ветви. Топографическая анатомия тщательно изучена на печени доноров .При травме живота или катетеризации печёночной артерии возможно её расслоение. Эмболизация печёночной артерии иногда ведёт к развитию гангренозного холецистита .
Клинические проявления
Диагноз редко ставится при жизни больного; работ с описанием клинической картины мало. Клинические проявления связаны с фоновым заболеванием, например с бактериальным эндокардитом, узелковым периартериитом, или определяются тяжестью перенесённой операции на верхних отделах брюшной полости. Боль в эпигастральной области справа возникает внезапно и сопровождается шоком и гипотензией. Отмечается болезненность при пальпации правого верхнего квадранта живота и края печени. Быстро нарастает желтуха. Обычно обнаруживаются лейкоцитоз, лихорадка, а при биохимическом исследовании крови -признаки цитолитического синдрома. Протромбиновое время резко возрастает, появляется кровоточивость. При окклюзии крупных ветвей артерии развивается коматозное состояние и больной умирает в течение 10сут.
Необходимо проведение печёночной артериографии. С её помощью можно обнаружить обструкцию печёночной артерии. В портальных и субкапсулярных областях развиваются внутрипеченочные коллатерали. Внепеченочные коллатерали с соседними органами формируются в связочном аппарате печени [З].
Сканирование .Инфаркты обычно округлой или овальной, изредка клиновидной формы, располагаются в центре органа. В раннем периоде они выявляются как гипоэхогенные очаги при ультразвуковом исследовании (УЗИ) или нечётко отграниченные области пониженной плотности на компьютерных томограммах, не изменяющиеся при введении контрастного вещества. Позднее инфаркты выглядят как сливные очаги с чёткими границами. Магнитно-резонансная томография (МРТ) позволяет выявить инфаркты как участки с низкой интенсивностью сигнала на Т 1-взвешенных изображениях и с высокой интенсивностью на Т2-взвешенных изображениях .При больших размерах инфаркта возможно образование «озёрец» жёлчи, иногда содержащих газ.
Лечение должно быть направлено на устранение причины повреждения. Для профилактики вторичной инфекции при гипоксии печени используют антибиотики. Основной целью является лечение острой печёночно-клеточной недостаточности. В случае травмы артерии применяют чрескожную эмболизацию .
Повреждение печёночной артерии при трансплантации печени
При повреждении жёлчных протоков вследствие ишемии говорят об ишемическом холангите .Он развивается у больных, перенёсших трансплантацию печени при тромбозе или стенозе печёночной артерии или окклюзии околопротоковых артерий |8[. Диагностика затрудняется тем, что картина при исследовании биоптатов может свидетельствовать об обструкции жёлчных путей без признаков ишемии.
После трансплантации печени тромбоз печёночной артерии обнаруживают с помощью артериографии. Допплеровское исследование не всегда позволяет выявить изменения, к тому же правильная оценка его результатов затруднительна [б]. Показана высокая достоверность спиральной КТ .
Аневризмы печёночной артерии
Аневризмы печёночной артерии встречаются редко и составляют пятую часть всех аневризм висцеральных сосудов. Они могут быть осложнением бактериального эндокардита, узелкового периартериита или артериосклероза. Среди причин возрастает роль механических повреждений, например вследствие дорожно-транспортных происшествий или врачебных вмешательств, таких как операции на жёлчных путях, биопсия печени и инвазивные рентгенологические исследования. Ложные аневризмы встречаются у больных с хроническим панкреатитом и образованием псевдокист .Гемобилия часто связана с ложными аневризмами . Аневризмы бывают врождёнными , внутри- и внепеченочными, размером от булавочной головки до грейпфрута. Аневризмы выявляют при ангиографии или случайно обнаруживают во время хирургической операции или при аутопсии.
Клинические проявления разнообразны. Только у трети больных отмечается классическая триада: желтуха |24|, боли в животе и гемобилия. Частым симптомом являются боли в животе; период от их появления до разрыва аневризмы может достигать 5мес.
У 60-80%больных причиной первичного обращения к врачу бывает разрыв изменённого сосуда с истечением крови в брюшную полость, жёлчные пути или желудочно-кишечный тракт и развитием гемоперитонеума, гемобилии или кровавой рвоты.
УЗИ позволяет поставить предварительный диагноз; его подтверждают с помощью печёночной артериографии и КТ с контрастированием (см. рис. 11-2) .Импульсное допплеровское УЗИ позволяет выявить турбулентность кровотока в аневризме .
Лечение. При внутрипеченочных аневризмах применяют эмболизацию сосуда под контролем ангиографии (см. рис. 11-3и 11-4).У больных с аневризмами общей печёночной артерии необходимо хирургическое вмешательство. При этом артерию перевязывают выше и ниже места аневризмы.
Печёночные артериовенозные фистулы
Частыми причинами артериовенозных фистул являются тупая травма живота, биопсия печени или опухолей, как правило первичного рака печени. У больных с наследственной геморрагической телеангиэктазией (болезнь Рандю-Вебера-Ослера) обнаруживают множественные фистулы, которые могут привести к застойной сердечной недостаточности.
При больших размерах свища можно выслушать шум над правым верхним квадрантом живота. Печёночная артериография позволяет подтвердить диагноз. В качестве лечебного мероприятия обычно используют эмболизацию желатиновой пеной.
Аневризмы висцеральных ветвей аорты редкая патология, частота встречаемости которой по данным рутинной аутопсий и неинвазивных методов диагностики не превышает 0.1-2% . Первые упоминания о аневризме печёночной артерии встречаются у J. Wilson в 1809 г., в протоколе аутопсии 50-и летнего священника погибшего от разрыва «полости связанной с левой печеночной артерией» (приведено по Guida P.M. и Moore S.W.). В 1847 г. E. Crisp, изучая описания 591 случаев аневризм висцеральных ветвей, не находит среди них ни одного случая аневризмы печеночной артерии . В 1891 г. Hale White впервые описывает триаду клинических признаков сопутствующих заболеванию, к которым относятся боль в правом верхнем квадранте живота, желудочно-кишечное кровотечение и желтушность кожных покровов, которые по сей день используются для первичной диагностики данной патологии. К 1895 г. был зарегистрирован 21 случай аневризм печеночной артерии, ни один из которых не был диагностирован прижизненно и каждый из которых привел к гибели пациента. Первый опыт успешного лечения известен с 1903 г., когда H. Kehr впервые проводит лигирование аневризмы печеночной артерии с прорывом в желчный пузырь. В 1943 г. G. Gordon Taylor впервые применяет методику аневризмографии. Таким образом к 1954 г. известно о 100 клинических наблюдениях аневризмы печеночной артерии, но лишь в двух случаях диагноз был выставлен до операции .
Hepatic artery aneurysm is a rare condition that is life-threatening if not diagnosed and treated promptly. Due to the wide incorporation of high-tech methods of diagnosis in medical practice, it is now possible to diagnose patients early, provide care and, as a result, increase the survival rate. Based on the review of articles published in foreign medical journals, authors highlight the role of radiological methods in the diagnosis of this pathology and present a case report showing their application. The present clinical case demonstrates the possibilities of diagnosis and treatment, as well as difficulties caused primarily rarity of diseases.
Морфология и этиопатогенез.
Под аневризмой следует понимать локальное расширение диаметра сосуда в 1,5 раза по сравнению с его не расширенным участком. В зависимости от механизма формирования аневризмы их разделяют на истинные и ложные. Истинные аневризмы развиваются при аномалиях стенки сосуда, в результате чего происходит расширение и истончение всех её трех слоев. В начале прошлого века считалось что основным этиологическим фактором приводящим к формированию истинных аневризм является грибковое поражение, однако в настоящее время большая роль отводится атеросклеротическим изменениям стенок, особенно при наличии таких факторов риска как длительная гипертензия, дислипидэмия, курение и пр. Так при анализе 300 публикаций F.T. Curran и S.A. Taylor отмечают, что частота встречаемости атеросклеротических изменений, как первичных так и вторичных, составляется до 32%. Среди других факторов авторы приводят примеры фибромышечной дисплазии, системных васкулитов, заболеваний соединительной ткани, инфекции, а так же травмы и посттравматические изменений, частота же микотических поражений не превышает 4 % .
Пусковым фактором в формировании ложных аневризм в настоящее время считается повреждение в виде разрыва внутреннего и среднего слоев стенок сосуда (интимы и медии) с отграничением крови адвентицией или окружающими периваскулярными тканями (например в результате панкреатита, аутоимунного или механического повреждения стенки во время эндоваскулярного, лапароскопического или хирургического вмешательства) . В пример можно привести травмирование интимы с расслоением сосудистой стенки, как редкого осложнения при хирургической установке интраартериального порта для проведения регионарной химиотерапии при паллиативном лечении нерезектабельных раков или метастатического поражения печени .
В большинстве публикаций приводятся данные, что среди всех случаев висцеральных аневризм частота встречаемости аневризмы селезеночной артерии составляет 60%, затем по частоте следуют аневризмы печеночной артерии (20%). Однако в комплексном ретроспективном обзоре литературы и клинических наблюдений за период с 1985 по 1995 проведенный в 2002 году в клинике Mayo, среди всех аневризм висцеральных ветвей авторы описывают 103 случая аневризмы печеночной артерии и 83 случая аневризм селезеночной артерии . Данные изменения соотношения авторы связывают, во-первых, с тенденцией к более широкому использованию чрескожных диагностических и терапевтических манипуляций, во-вторых, с более широким применением компьютерной томографии при тупых травмах брюшной полости, в результате чего увеличилось число случайных находок «скрытых» аневризм, не проявляющих себя клинически .
По морфологии аневризмы печеночной артерии могут быть классифицированы как веретенообразные и мешотчатые. По локализации чаще поражается правая печеночная артерия (47%), затем следует общая печеночная артерия (22%), собственно печеночная артерия (16%), левая печеночная артерия (13%) и пузырная артерия (1%) .
Диагностика.
Аневризмы печеночной артерии в большинстве случаев диагностируют случайно в результате обследования пациента по поводу неспецифических абдоминальных болей или какого-либо сопутствующего заболевания . В некоторых наблюдениях на обзорных снимках определяется кольцо кальцификации в области правого подреберья . При рентгеноскопии с барием заболевание можно заподозрить по деформации двенадцатиперстной кишки за счет вне органного сдавления объемным образованием. При проведении эзофагогастродуоденоскопии (ЭГДС) аневризма может симулировать подслизистое образование двенадцатиперстной кишки, выступающее в просвет, при образовании аневризмодуоденальной фистулы на вершине образования может определяется эрозия или язва .
Ультразвуковая картина вариабельна, она зависит от размеров аневризматического мешка и степени его тромбирования. Истинная аневризма чаще представляет собой гипоэхогенное округлое однокамерное образование прилежащее к печеночной артерии, наличие нескольких камер в образовании указывает на ложную аневризму. Цветовое доплеровское картирование при наличии признака «инь - янь» (за счет высокоскоростного движения крови «туда и обратно») в области шейки позволяет отдифференцировать ложные аневризмы от истинных, однако данный паттерн так же может встречаться и при истинной мешотчатой аневризме, в данном случае анализ изображений в клиническом контексте (анамнез) позволяет дифференцировать ложные аневризмы от истинных мешотчатых. УЗИ является ценным диагностическим инструментом для выявления аневризм за счет легкой доступности, незнвазивности, дешевизны, быстроты получения результатов, а так же отсутствия ионизирующего излучение и необходимости применения контрастных веществ. Метод имеет чувствительность 94% и специфичность 97% в обнаружении аневризм. Однако данный метод является оператор-зависимым, а получение данных у пациентов в тяжелом состоянии может быть затруднено.
Мультидетекторная компьютерная томография является ценным инструментом, позволяющим уточнить топографо-анатомическое взаимоотношение аневризмы с окружающими структурами, изучить анатомию сосудов, получить информацию состоянии сосудистой стенки, оценить состояние окружающих тканей и спланировать тактику и объем предстоящего вмешательства. Истинные аневризмы при компьютерной томографии аневризмы, как правило, имеют веретеновидную форму, часто распространяются на значительную длину, с вовлечением всей окружности и всех трех слоев стенки сосуда. Ложные аневризмы обычно имеют мешотчатую форму с узкой шейкой, имеют гладкие хорошо отграниченные стенки, представленные отграничением крови адвентицией или окружающими периваскулярными тканями. Наличие иррегулярных стенок с нечеткими границами, широкой шейки позволяет предположить микотическую природу аневризмы. При неусиленном исследовании аневризма может выглядеть как изоденсивная округлая структура прилежащая к сосуду. Введение контрастного вещества показывает заполнение просвета аневризматического мешка, а отсутствие его полного наполнения может указывать на наличие пристеночных тромботических масс. Компьютерная томография в отличии от УЗИ является оператор-независимым методом и имеет более короткое время получения диагностических изображений. Однако постобработка исходных данных и создание трехмерных реконструкций может быть трудоемкой и требует наличия специализированного программного обеспечения на рабочей станции врача. Компьютерная томография обеспечивает оценку всего сосудистого русла, в то время как субстракционная ангиография ограничена выбранным сосудистым бассейном, однако в отличии от нее обладает меньшим пространственным разрешением . В исследовании J. A. Soto и др , чувствительность и специфичность метода составила 95,1% и 98,7%.
Осложнения.
Наиболее тяжелым осложнением данного заболевания является разрыв аневризмы с развитием желудочно-кишечного кровотечения и геморрагического шока, приводящих к летальному исходу. Прорыв крови может происходить в брюшную полость (43%), в просвет желудка и двенадцатиперстной кишки (11%), в желчные протоки (41%) или в воротную вену (5%) . Риск разрыва при диаметре аневризмы более 2 см достигает 50%, а общая смертность вследствие разрыва приближается к 70% . Увеличение диаметра аневризмы при выборе нехирургической тактики ведения отмечено в 27% случаев и составило до 0,8 см в течении трех лет . Кроме того, отмечено что риск разрыва аневризм возникших в результате неатеросклеротических изменений гораздо выше. Вследствие высокой частоты спонтанного разрыва при аневризмах более 2 см в диаметре показано оперативное лечение .
Лечение.
Методом первого выбора в лечении аневризм печеночных артерий являются рентгеноэндоваскулярные вмешательства. Выбор стратегии лечения зависит от локализации аневризмы. Аневризмы ветвей печенонй артерии, как правило, заполняются отделяемыми спиралями или специальными клеями (например Onyx) без риска ишемии паренхимы, в виду двойного кровоснабжения печени. Аневризмы общей печеночной артерии могут быть выключены из кровотока спиралями дистальнее и проксимальнее шейки аневризмы, при этом гастродуоденальная артерия обеспечит собственную печеночную артерию достаточным кровотоком. Аневризмы собственной печеночной артерии и ее бифуркации должны быть исключены из кровотока с сохранением проходимость сосуда. При широкой шейке аневризмы возможно применение баллон ассистирующей технологии, когда отделяемые спирали удерживаются в ее полости с помощью раздутого баллонного катетера. В литературе есть несколько сообщений об успешной имплантации перенаправляющих поток стентов для исключения из кровотока аневризмы. После выполнения эндоваскулярной процедуры рекомендуется контрольное исследование через месяц и через полгода.
В отечественной литературе описания случаев аневризм печеночной артерии единичны . Учитывая редкость данной патологии, а также то, что клиническая картина не обладает выраженной специфичностью и диагностика до развития угрожающих жизни пациента осложнений сложна, приводим собственное клиническое наблюдение.
Пациент 44 лет доставлен по каналу скорой медицинской помощи в приемное отделение ГКБ№71 ДЗ г. Москвы с жалобами на выраженную слабость, головокружение и неоднократные потери сознания в течении двух недель. В последние 4 дня отмечает появление стула черного цвета. Накануне присоединились боли в области сердца не купируемые самостоятельно, в связи с чем обратился за медицинской помощью.
При поступлении состояние стабильно тяжелое. Пациент в сознании, контактен, адекватен. Кожные покровы бледные. Гемодинамика стабильная. Из лабораторных данных обращает внимание нормохромная анемия. При проведении ЭГДС в просвете желудка умеренное количество «кофейной гущи» и пищи. Привратник проходим, луковица двенадцатиперстной кишки деформирована - по верхней стенке имеется сдавление из вне до 2/3 просвета без признаков самостоятельной или передаточной пульсации, на вершине которого определяется язвенный дефект размерами до 0.5 см с фибрином на дне.
При УЗИ брюшной полости в проекции пилорического отдела и луковицы двенадцатиперстной кишки определяется объемное образование неоднородной эхоструктуры, размерами 56х36х57 мм. При ЦДК образование аваскулярно, определяется передаточная пульсация, дистальнее образования - общая печеночная артерия.
При компьютерной томографии брюшной полости с болюсным контрастным усилением по стандартному 3-х фазному протоколу выявлено расширение и извитость ветвей чревного ствола: общая печеночная артерия (до уровня ворот печени) до 15 мм, утолщение стенок до 5 мм, селезеночная артерия до 11 мм с утолщением стенок до 13 мм. В области луковицы двенадцатиперстной кишки определяется округлое образование до 35 мм, оттесняющее кишку, не отделимое по дорсальному контуру от печеночной артерии. В отсроченной фазе отмечается незначительное накопление контраста капсулой образования. В просвете желудка и тонкой кишки на фоне контрастного содержимого определяются множественные свертки.
Заключение: «разрыв фузиформной аневризмы общей печеночной артерии с прорывом крови в желудок или двенадцатиперстную кишку».
По согласованию пациент переведен в специализированное учреждение, где в результате рецидива профузного желудочно-кишечного кровотечения по экстренным показаниям проводится операция.
Интраоперационно обнаружено аневризматическое расширение печеночной артерии до 5-6 см на протяжении до 5 см, заканчивающееся в месте бифуркации. При ревизии установлено, что имеется дефект стенки аневризмы по нижнему краю, распространяющийся на заднюю стенку желудка в области привратника и начальные отделы ДПК с образованием “дочерней” ложной аневризмы до 4 см, выполненной старыми и свежими свертками. Истинная аневризма общей печеночной артерии резецирована. Общая печеночная артерия протезирована протезом GORE-TEX 10 мм. Полость ложной аневризмы тампонирована прядью большого сальника. Течение послеоперационного периода без осложнений. Больной выписан на 17-е сутки в удовлетворительном состоянии.
Заключение.
Аневризмы печеночных артерий являются редкой патологией, а учитывая скудность и стертость клинической картины, для выявления и верификации данной патологии необходимо применять весь доступный комплекс методов лучевой визуализации. Последовательность применения методов исследования должна соответствовать нарастанию их инвазивности. Ультразвуковое исследование на раннем этапе позволяет без лучевой нагрузки на пациента диагностировать аневризму и оценить сосуд, являющийся её источником. Диагностическая точность компьютерной томографии сопоставима с информативностью традиционной ангиографии и позволяет не только уточнить взаимоотношение аневризмы с окружающими структурами, но и оценить состояние окружающих тканей, вследствие чего разумно использовать её следующим этапом диагностического процесса не только для уточнения диагноза но и для планирования объема оперативного лечения.
Рентгенэндоваскулярное лечение является эффективным методом, позволяющим добиться надежного выключения аневризмы из кровотока, тип вмешательства зависит от топографо-анатомических особенностей аневризмы.
Несвоевременная диагностика данной патологии грозит серьезными осложнениями вплоть до летального исхода.
Интерес представленного клинического наблюдения обусловлен, на наш взгляд, редкой встречаемостью патологии и убедительностью данных полученных с помощью УЗИ и компьютерной томографии.
Литература
- Huang Y. K., Hsieh H. C., Tsai F. C., Chang S. H., Lu M. S. Visceral artery aneurysm: risk factor analysis and therapeutic opinion. Eur J Vasc Endovasc Surg. 2007; 33: 293-301.
- Лесняк В. Н., Кемеж Ю. В., Ермичева А. Ю. КТ-диагностика аневризм висцеральных ветвей брюшной аорты. Российский электронный журнал лучевой диагностики 1: 65-70.
- Guida P. M., Moore S. W. Aneurysm of the hepatic artery. Report of five cases with a brief review of the previously reported cases. Surgery 1966; 60: 299-310.
- Crisp E. A Treatise on the Structure, Diseases and Injuries of the Blood-Vessels With statistical deductions, etc. John Churchil 1847;
- Friedenwald J., Tannenbaum K. Aneurysm of hepatic artery. American Journal of the Medical Sciences 1923; 11-28.
- Oser L., von Neusser E., Quincke H. I., Hoppe-Seyler G. K. F. Diseases of the Liver, Pancreas and Suprarenal Capsules:. Sanders 1905;
- Hale-White W. Common Affections of the Liver. Nisbet 1908;
- Messina L. M., Shanley C. J. Visceral Artery Aneurysms. Surgical Clinics of North America 1997; 77: 425-442.
- Щербюк А., Артюхина Е., Ульянов Д., Фролов К., Зайцев А., Чжао А. Аневризма печеночной артерии как причина механической желтухи. Врач 2007; 12: 65-67.
- Kehr H. Der erste Fall von erfolgreicher Unterbindung der Arteria hepatica propria wegen Aneurysma. Munchen Med Wschr 1903; 1: 1861-1863.
- Gordon-Taylor G. Rare Cause of Severe Gastro-intestinal Haemorrhage. British medical journal 1943; 1: 504.
- Siew S. Aneurysm of the hepatic artery; report of a case and review of the literature. S Afr J Clin Sci 1952; 3: 143-153.
- Barnett W. O., Wagner J. A. Aneurysm of the hepatic arterya cause of obscure abdominal hemorrhage. Annals of surgery 1953; 137: 561.
- Curran F. T., Taylor S. A. Hepatic artery aneurysm. Postgrad Med J 1986; 62: 957-959.
- Ikeda O., Tamura Y., Nakasone Y., Iryou Y., Yamashita Y. Nonoperative management of unruptured visceral artery aneurysms: treatment by transcatheter coil embolization. J Vasc Surg 2008; 47: 1212-1219.
- Квашнин А. И., Атаманов С. А., Мельник А. В., Быков О. А., Помкин А. А., Ширкин М. Г. Эндоваскулярная редукция ложной аневризмы собственной печеночной артерии. Клинический случай. Международный журнал интервенционной кардиоангиологии.
- Abbas M. A., Fowl R. J., Stone W. M., Panneton J. M., Oldenburg W. A., Bower T. C. et al. Hepatic artery aneurysm: factors that predict complications. J Vasc Surg 2003; 38: 41-45.
- Shanley C. J., Shah N. L., Messina L. M. Common splanchnic artery aneurysms: splenic, hepatic, and celiac. Ann Vasc Surg 1996; 10: 315-322.
- Sachdev-Ost U. Visceral artery aneurysms: review of current management options. Mt Sinai J Med 2010; 77: 296-303.
- O"Driscoll D., Olliff S. P., Olliff J. F. Hepatic artery aneurysm. Br J Radiol 1999; 72: 1018-1025.
- Man C. B., Behranwala K. A., Lennox M. S. Ruptured hepatic artery aneurysm presenting as abdominal pain: a case report. Cases J 2009; 2: 8529.
- Huang C-T, Chiu C-Y, Chen K-H, Lee T-H. A Common Hepatic Artery Aneurysm Mimicking A Duodenal Submucosal Tumor Presenting as Upper Gastrointestinal Bleeding: A Case Report. J Int Med Taiwan 2010; 21: 56-61.
- Shaw J. F. Hepatic artery aneurysms. Br J Hosp Med 1982; 28: 407-409.
- Chung-Tsui. C. H. A Common Hepatic Artery Aneurysm Mimicking A Duodenal Submucosal Tumor Presenting as Upper Gastrointestinal Bleeding: A Case Report. 2010; 51-56.
- Athey P. A., Sax S. L., Lamki N, Cadavid G. Sonography in the diagnosis of hepatic artery aneurysms. AJR Am J Roentgenol. 1986; 147: 725-727.
- Saad N. E., Saad W. E., Davies M. G., Waldman D. L., Fultz P. J., Rubens D. J. Pseudoaneurysms and the role of minimally invasive techniques in their management. Radiographics 2005; S173-189.
- Katyal S., Oliver J. H., 3rd, Buck D. G., Federle M. P. Detection of vascular complications after liver transplantation: early experience in multislice CT angiography with volume rendering. AJR Am J Roentgenol. 2000; 175: 1735-1739.
- Molina J. A., Benito Santamaría V., Guerrero R., Babun Y. Spectrum of CT Angiography Findings of Pseudoaneurysm. ECR 2013;
- Soto J. A., Munera F., Morales C., Lopera J. E., Holguin D., Guarin O. et al. Focal arterial injuries of the proximal extremities: helical CT arteriography as the initial method of diagnosis. Radiology 2001; 218: 188-194.
- Затевахин И. И., Цициашвили М. Ш., Золкин В. Н., Сидельцева А. А. Разрыв аневризмы печеночной артерии с формированием дуоденальной фистулы.
- Carr S. C., Mahvi D. M., Hoch J. R., Archer C. W., Turnipseed W. D. Visceral artery aneurysm rupture. J Vasc Surg 2001; 33: 806-811.
- Wojtaszek M. Managing Visceral Artery Aneurysms. Endovascular today. 2013; 10: 77-81.
- Таразов П. Г., Рыжиков В. К., Полысалов В. Н., Прозоровский К. В., Поликарпов А. А. Безуспешная эмболизация аневризмы общей печеночной артерии. Хирургия 1998; 8: 54-55.
- Тимербулатов В. М., Тимербулатов М. В., Ишметов В. Ш., Чудновец Л. Г., Мустафакулов У. С. Аневризмы висцеральных артерий брюшной полости. Клиническая и экспериментальная хирургия.
- Щербюк А., Артюхина Е., Ульянов Д., Фролов К., Зайцев А., Чжао А. Аневризма печеночной артерии как причина механической желтухи.
Как же осуществляется кровоснабжение печени? Кровь к печени поступает из двух источников: по воротной вене и по печеночной артерии, а оттекает по печеночным венам. Таким образом, печень имеет две афферентные и одну эфферентную систему кровеносных сосудов. Большая часть крови (70-75%) поступает в печень по воротной вене. Через сосудистое русло печени протекает до 1,5 л крови в минуту, т.е. около 25% от общего минутного объема кровотока. Объемная скорость кровотока через печень составляет 50-80 мл крови на 100 г печени в минуту. В печеночных синусоидах кровоток существенно замедлен, т. к. площадь поперечного сечения их приближается к 400 м2, превышая площадь поперечного сечения капилляров легких. Давление в печеночной артерии составляет 120 мм рт. ст., в воротной вене - 8-12 мм рт. ст., в печеночных венах - от 0 до 5 мм рт. ст. В портальных и венозных сосудах давление обычно измеряют в мм водяного столба, что точнее отражает динамику небольших изменений (соотношение мм рт. ст./мм вод. ст. = 1/13,5). В печени может депонироваться более 20% объема циркулирующей крови. При шоке в сосудах портальной системы иногда скапливается до 70% общего объема крови.
Портальная кровь отличается от венозной крови не только содержащимися в ней продуктами расщепления пищевых веществ, всасываемых из кишок и транспортируемых в печень, но и более высокой оксигенацией. Содержание кислорода в портальной крови натощак в среднем лишь на 1,9 об.% ниже, чем в артериальной (в венозной крови ниже в среднем на 7 об.%). По воротной вене доставляется 50-70% всего поступающего в печень кислорода, и этого количества в большинстве случаев оказывается достаточно, чтобы удовлетворить минимальную потребность в нем печеночных клеток при остром нарушении артериального кровоснабжения печени (перевязка печеночной артерии). Снижение системного артериального давления приводит к уменьшению содержания кислорода в портальной крови.
Кровоснабжение печени: Печеночная артерия
Топографическая анатомия кровоснабжения печени артериальными сосудами весьма вариабельна. Тем не менее условно можно выделить типичный, наиболее часто встречающийся (в 40–80%) вариант формирования и расположения печеночных артерий. В большинстве случаев сосуд диаметром 5–7 мм, называемый общей печеночной артерией (a. hepatica communis), берет начало от чревного ствола (truncus celia-cus). На уровне верхнего края привратника или двенадцатиперстной кишки в печеночно-двенадцатиперстной связке кпереди от воротной вены она делится на желудочно-двенадцатиперстную артерию (a. gastro-duodenalis) и собственную печеночную артерию (a. hepatica propria). Последняя имеет диаметр 3–5 мм, располагается между листками печеночно-двенадцатиперстной связки кнутри от общего желчного и печеночного протоков и разделяется на правую и левую печеночные артерии (aa. hepaticae dextra et sinistra), которые проникают в печень. От собственной или общей печеночной артерии отходит правая желудочная артерия (a. gastrica dextra), а от правой печеночной - пузырная артерия (a. cystica) к желчному пузырю.
Внутри кровоснабжение печени артериями делится следующим образом. Правая печеночная артерия отдает ветвь к хвостатой доле, затем ответвляется парамедианная артерия, разделяющаяся на артерии к V и VIII сегментам. Продолжение основного ствола представляет собой артерию латерального сектора, которая делится на артерии VI и VII сегментов. Левая печеночная артерия отдает ветви к I и IV сегментам, затем разделяется на ветви к II и III сегментам. В большинстве случаев ветви левой печеночной артерии не повторяют хода ветвей воротной вены. Нередко кровоснабжение IV сегмента осуществляется из правой печеночной артерии (т. н. транспозиция сегментарной артерии слева направо). Вариант архитектоники левой печеночной артерии, соответствующий архитектонике левой ветви воротной вены встречается в 14% случаев. На субсегментарном уровне портальному сосуду обычно сопутствуют две артериальные веточки.
Среди многообразия иных анатомических вариантов артериального кровоснабжения печени необходимо выделить те, которые встречаются чаще, либо усложняют оперативные вмешательства на органах гепато-панкреатодуоденальной зоны.
Общая печеночная артерия отходит от верхней брыжеечной (1–4%), от аорты (2–7%) или отсутствует.
Собственная печеночная артерия отсутствует (до 50%), при этом правая и левая печеночные артерии начинаются непосредственно от общей печеночной артерии или из других источников.
Собственная печеночная артерия образует три ветви, одна из которых - средняя печеночная артерия - изолированно обеспечивает кровоснабжение квадратной доли печени.
Правая ветвь собственной печеночной артерии проходит впереди общего желчного или печеночного протоков (5–15%) либо позади воротной вены (13%). Это усложняет вмешательства на внепеченочных желчных протоках либо обнаружение и выделение артерии.
Правая печеночная артерия отходит от верхней брыжеечной артерии (12–19%). При этом она располагается позади поджелудочной железы и двенадцатиперстной кишки, а затем по наружному краю печеночно-двенадцатиперстной связки и справа от желчного пузыря позади шейки его. Вероятность повреждения такого сосуда при холецистэктомии возрастает.
Левая печеночная артерия отходит от левой желудочной артерии (12%). Такой сосуд называют левожелудочно-печеночным стволом. В 2% случаев он обеспечивает изолированное кровоснабжение левой доли печени. Перевязка его проксимальнее отхождения печеночной ветви при выполнении резекции желудка может привести к нарушению кровоснабжения II–III сегментов печени. (Лишенные артериального притока участки печени приобретают темно-фиолетовый цвет.)
Помимо основных артерий кровоснабжение печени может осуществляться при помощи добавочных сосудов, которые чаще всего отходят от левой желудочной, верхней брыжеечной, желудочно-двенадцатиперстной артерий. В.В. Кованов и Т.И. Аникина (1974) различают добавочные и дополнительные сосуды. В отличие от добавочных, дополнительные артерии являются единственными источниками артериального кровоснабжения автономных областей печени (чаще в левой ее половине), и перевязка таких сосудов может привести к тяжелым ишемическим повреждениям соответствующих сегментов.
7400 0
Анатомия артерий, кровоснабжающих желчевыводящую систему, еще более разнообразна, чем анатомия самой желчевыводящей системы. Этим она отличается от системы портального кровоснабжения, которая имеет постоянное строение, обеспечивает 60-70% всего печеночного кровотока и поступление значительного количества кислорода. В 80% случаев общая печеночная артерия начинается от чревного ствола (рис. 1).
В 5-8% случаев — непосредственно от аорты или верхней брыжеечной артерии. Только у 55% индивидуумов эта артерия подходит к печени единым стволом. У 12% вообще отсутствует общий ствол, из которого брали бы начало правая и левая печеночные ветви, а каждая из этих ветвей отходит от аорты самостоятельно. Эти же ветви могут раздельно начинаться от чревного ствола, его ветвей, аорты, или верхней брыжеечной артерии.
Позади заднего листка сумки малого сальника общая печеночная артерия на коротком участке идет вправо, вдоль верхнего края поджелудочной железы, приподнимая гепатопанкреатическую складку брюшины у каудального края сальникового отверстия. В этом месте от нее отходит гастродуоденальная артерия, которая опускается вниз на головку поджелудочной железы, позади первого отдела 12-перстной кишки.
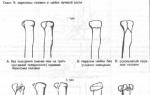
Продолжение основного ствола общей печеночной артерии называется собственной артерией печени. После отхождения от нее правой артерии желудка собственная артерия печени поворачивает вверх, в гепатодуоденальную связку, свободный край желудочно-печеночного сальника. Затем эта артерия проходит в портальной триаде, занимая передне-левое положение, и разделяется на правую и левую ветви вблизи ворот печени. Правая ветвь обычно проходит позади общего печеночного протока и входит в печеночно-пузырный треугольник, образованный пузырным протоком, печеночным протоком и нижней поверхностью печени.
Исходящая из собственной артерии печени правая печеночная ветвь в 75% случаев проходит позади общего печеночного протока, а в остальных случаях - впереди (рис. 2 А и Б). Весьма часто (15%) правая печеночная артерия изгибается в виде гусеницы вплотную к пузырному протоку (рис. 2 В), что создает опасность ее повреждения при выполнении холецистоэктомии.
Примерно в 20% случаев встречаются аномальные варианты строения как правой, так и левой печеночных артерий (рис. 3 А). Немного чаше, чем в половине случаев, аномальные сосуды заменяют собой нормальные собственные артерии, а в остальных случаях являются дополнительными. Аномальная левая печеночная артерия обычно исходит из дуги левой артерии желудка и проходит через верхнюю часть малого сальника к левой доле печени. Аномальная правая ветвь, как правило, начинается из проксимального отдела верхней брыжеечной артерии, позади шейки поджелудочной железы (рис. 3 Б). Она идет вправо, глубже верхней брыжеечной вены и общего желчного протока, обычно позади пузырного протока и впадает в пузырно-шеечный треугольник, где и может повреждаться при операциях.
В 75% случаев пузырная артерия отходит от задней поверхности правой печеночной артерии, образуя треугольник Гало (рис. 4). В этом треугольнике обычно находится лимфатический узел. Приближаясь к шейке желчного пузыря, пузырная артерия дает маленькую ветвь к пузырному протоку и делится на глубокую и поверхностную ветви. Глубокая ветвь проходит между желчным пузырем и его печеночным ложем. Пузырная артерия может разделиться в самом начале и, если во время операции лигировать только поверхностную ветвь, то из неперевязанной глубокой ветви может возникнуть опасное кровотечение.
В четверти случаев пузырная артерия начинается вне пузырно-печеночного треугольника, отходя от любого из близко расположенных сосудов, проходящих впереди общего печеночного или общего желчного протока. Изредка пузырная артерия является двойной, причем обе ветви обычно начинаются из правой печеночной артерии. Если не удается обнаружить область бифуркации пузырной артерии, следует предполагать наличие второй пузырной ветви.
Желчные протоки, проходящие вне печени, окружены тонкой сетью сосудов, именуемой эпихоледохеальным сплетением (рис 5). Это сплетение получает питающие ветви сверху, из печеночных и пузырных артерий, и снизу, из гастродуоденальной и ретродуоденальной артерий. Разные типы строения печеночной артерии ведут к разным вариантам строения исходящих из нее ветвей. Тонкие (диаметром 0.3 мм) сосуды на поверхности протока обычно имеют форму дуг, окружающих проток с обеих сторон на его супрадуоденальном участке. Кровоснабжение данного пограничного участка, в основном, идет снизу. В этой зоне чаще всего возникают ишемические поражения и послеоперационные стриктуры. Сосудистое сплетение может повреждаться механически либо термически (особенно при монополярной каутеризации).
Винд Г. Дж.
Прикладная лапароскопическая анатомия: брюшная полость и малый таз