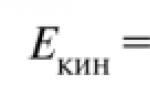Да изучава структурата на молекулите. Методи за изследване на структурата на молекулите. Естествена история и молекулярни свойства
Глава 1. Анализ на съдържанието на курса по химия за 8-11 клас върху структурата на материята и нейното осигуряване със средства за визуално моделиране 14-54.
1.1. Цели и характеристики на изучаването на структурата на материята в училищен курс по химия. 14
1.2. Моделирането като метод на научно изследване и неговата роля за формирането на цялостни знания за структурата на материята. 27
1.3. Традиционни модели на атоми и молекули, използвани в преподаването на природни науки. 45 - 54 Заключения към глава 1. 55
Глава 2. Педагогически и ергономични изисквания за създаване и използване на модели за изучаване на структурата на материята. 57
2.1. Принципът на научност и адаптиране на нови научни данни за преподаване. Съвременни тенденции в развитието на моделирането. 57
2.2. Педагогически и ергономични изисквания към моделите на атоми и молекули и техните нови дидактически възможности. 75
2.3. Характеристики на набор от модели за изследване на структурата на веществата. 104 -
Заключения към глава 2. 110
Глава 3. Организация на използването на набор от модели при изучаване на структурата на материята в гимназиален курс по химия. 112
3.1. Методически възможности за използване на комплекса с включване на пръстеновидни модели при изучаване на структурата на веществата в гимназиален курс по химия. 112
3.2. Методически техники за използване на набор от модели, включително съпътстващи модели за демонстриране и провеждане на практическа работа по неорганична и органична химия. 122
3.3 Експериментална проверка на педагогическата ефективност на комплекс от модели на атоми и молекули за изучаване на структурата на материята в гимназиален курс по химия. 156
Заключения към глава 3. 168
Препоръчителен списък с дисертации
Методика за формиране на основни понятия по химия в началния курс въз основа на моделни понятия за структурата на материята 1984 г., кандидат на педагогическите науки Кузнецова, Лилия Михайловна
Методически основи за формиране на системни знания по химия в средните училища 1984 г., доктор на педагогическите науки Tyldsepp, Aarne Albert-Romanovich
Изучаване на теоретични модели на атома и атомното ядро в основния курс по физика 2002 г., кандидат на педагогическите науки Пекшиева, Ирина Владимировна
Теоретични основи за създаване и използване на система от материални средства за обучение по химия в средното училище 1988 г., доктор на педагогическите науки Назарова, Татяна Сергеевна
Методически възможности за обучение на студентите за осъществяване на междупредметни връзки между органична химия и физика 1985 г., кандидат на педагогическите науки Дюсюпова, Лидия Зейнеловна
Въведение в дисертацията (част от автореферата) на тема „Създаване и използване на комплекс от модели на атоми и молекули за изучаване на структурата на материята в гимназиален курс по химия“
Уместността на изследването
В съвременното средно училище съзнателното разбиране на химичните процеси изисква задълбочено изучаване на структурата на атомите, молекулите, кристалните структури на телата и природата на химичните връзки. Курсът по химия в гимназията се основава на атомно-молекулярната теория, закона на Авогадро, законите за постоянство на състава и запазване на масата на материята, периодичната система на химичните елементи на Д. И. Менделеев и теорията за структурата на веществата.
Формирането на представи за строежа на материята е една от най-важните задачи в обучението по химия.
Моделирането е метод за разбиране на изследваните качества на даден обект чрез модели: действия с модели, които ни позволяват да изучаваме индивидуални качества, аспекти или свойства на обект или прототип, които ни интересуват.
Учебните модели са съществен компонент на учебно-методическия комплект, централно място в който заемат учебниците и учебната литература.
Моделите се определят като образователни нагледни средства, които заместват природните обекти и предават тяхната структура, съществени свойства, връзки и отношения.
От особено значение е използването на модели при изучаване на процеси, които не могат да бъдат наблюдавани поради големи разлики във времеви или пространствени мащаби. Моделът се оказва единственият обект, който е носител на информация за процес или явление. В такава ситуация експериментът с модел е от голямо значение. Моделният експеримент е специална форма на експеримент, която се характеризира с използването на съществуващи материални модели като специално средство за експериментално изследване. Моделен експеримент, при който се изучава заместващ модел вместо самия обект, се прибягва в случаите, когато обектът на изследване е недостъпен за визуално съзерцание, като обект на микросвета. Следователно проблемът за моделирането е особено актуален в природните науки. Във физиката и химията това е проблемът за моделиране на микрообекти, тоест атоми и молекули.
Човек получава най-голямо количество информация чрез зрението, така че първо трябва да се представят „очевидни“ модели. За предпочитане е те да са и материални, тоест материални. Опитът от дългогодишното използване на модели в процеса на преподаване на химия показа тяхната голяма роля в учебния процес и ефективността на влиянието на учителя върху ученика с тяхна помощ. Необходимостта от използване на визуални модели, тяхното непрекъснато усъвършенстване и появата на нови модели се дължат на развитието на химията като наука и продължаващото развитие на методите на преподаване на технологии.
Важен фактор, който предотвратява създаването на модели, които отговарят на педагогическите и ергономичните изисквания, е несъвместимостта на съвременните научни концепции с повечето прости и визуални изображения, използвани при моделирането. Опитът за адаптиране на научните данни към учебния процес в училище води до създаване на опростени модели и е свързан с определени грешки в показването на свойствата. Всъщност създаването на образователни модели се свежда до проблема за оптимален избор между модели с различна степен на сложност и различна визуална сила. От дидактическа гледна точка това неизбежно води до необходимостта от формиране на набор от взаимосвързани модели, чиито описателни характеристики трябва да задоволяват всички нужди на визуалното моделиране.
Първият опит за систематизиране на учебното оборудване и неговото обосноваване от гледна точка на спецификата на химическата наука и дидактическия принцип на визуализация на обучението е извършен от А. А. Грабецки и К. Я. Парменов в книгата „Учебно оборудване по химия. ” Авторите заключават, че визуалните помагала трябва да се използват обмислено в процеса на обучение, в определена система, че те са ценни като важен дидактически инструмент, който помага за постигане на образователни цели.
Въпреки това, традиционно използваните модели не са достатъчни за формиране на набор от модели за обучение. Избирателността на свойствата, моделирани с тяхна помощ, взаимната несъвместимост на моделите и липсата на структурни и логически връзки между тях създава пречки за обучението и усложнява процеса на усвояване на информация. Списъкът с препоръчани модели трябва да бъде допълнен с такива съвременни модели, които биха ни позволили да свържем заедно исторически модели на атома, отразяващи развитието на знанията за атома (Демокрит, Томсън, Ръдърфорд), модели, които вече са станали традиционни в изследването по химия (топка и пръчка, Stewart-Brigleb или Pauling), модели, използвани в изчислителни научни методи (метод на M.O.). Необходимо е да се създаде йерархична система от модели, в рамките на която да се изграждат различни модели и да се обясняват структурните особености на атома, илюстрирайки, в зависимост от необходимостта, определени моделирани аспекти.
Поради сложността на представяне на основите на квантовата химия, учебниците за осми и девети клас не предоставят необходимото обяснение на причините за разположението на електроните около ядрата и възможността за определяне на броя на електроните в енергийния слой не е разглеждан. Това затруднява формирането на идеи за електронната структура на атомите, молекулите и кристалните тела. И това се отнася за основните задачи на изучаването на курс по химия, като се започне от осми клас на средното училище.
Проблемите на моделите и симулацията остават актуални при изучаването на периодичния закон и периодичната система на химичните елементи D.I. Менделеев: необходимо е да се демонстрират модели на стабилни електронни обвивки, които определят вида на таблицата на химичните елементи. При изучаване на химичните връзки са необходими и прости изображения на взаимодействието на атомите с образуването на обща молекулна обвивка. Такова явление трябва да бъде придружено от визуален образ, а не само от символично обозначение.
Нуждата от визуални модели е толкова голяма, че училищата са създали много визуални модели за показване на електронни формули. За демонстриране на изместването на електрони от един атом към друг се използват различни подходи: магнитна дъска с изображение на точка (електрон); кутии с многоцветни чипове, изобразяващи електрони и кръгчета, изобразяващи атоми на различни вещества и йони; набор от цветни пластмасови фигури, изобразяващи различни видове електронни облаци, полукълба, представляващи атоми или йони на магнитна основа. Горните и подобни визуални помагала са еквивалентни на рисуване на електронни схеми върху бяла дъска. Разликата е, че моделите, оставайки емблематични, придобиват някои черти на материалност – стават осезаеми и динамични, но това не увеличава информационния им капацитет.
Актуален проблем е създаването на нови образователни модели, които да са подобни на научните и да имат дидактически свойства. Методолозите обръщат голямо внимание на този проблем при усъвършенстването на научните модели. A.I. Shpak предложи да се използва електрон под формата на първия модел в осми клас, като се има предвид местоположението му в пространството и формата на електронния облак. S. N. Drozdov препоръчва използването на модели от мека медна или алуминиева тел за тази цел.
пр.н.е. За да представи въпроса за посоката на електронните облаци в космоса, Полосин използва модели на топки и балони, както и сгъваеми модели на s- и p-орбитали, направени от тел, боядисана в различни цветове. Въз основа на резултатите от работата с ученици той заключи, че при изучаването на явленията на микросвета не можете да се ограничите само до един вид визуални средства, необходимо е да използвате комплекс от различни модели и други визуални средства.
Ю. И. Булавин предложи използването на механични и електрически устройства за въртене на части, които възпроизвеждат различни форми на електронни облаци.
С. С. Бердоносов, заявявайки, че подходът за обясняване на структурата дори на най-простите молекули (CHC, NH3, HgO и др.), Който традиционно се използва в гимназията, не е много визуален и много сложен, базиран на редица изкуствени допускания , той разумно предлага да се използват моделите на Р. Гилеспи, които са много прости и позволяват да се обясни структурата не само на молекули с прости връзки, но и на вещества с много по-сложен състав, които образуват двойни и тройни връзки.
Учебните модели, както и изследователските, трябва да бъдат информативни, т.е. тяхното използване трябва да създава образ, богат на информация, необходима и достатъчна за формиране на представа за моделирания обект. В същото време информативното (научното) богатство на моделите на обучение не трябва да противоречи на тяхната адаптивност към спецификата на образователния процес. За разлика от изследователските обучителни модели на един обект или явление, те не трябва да противоречат на световните закони и трябва да са съвместими помежду си. Съвместимостта се разбира като такава връзка между моделите, при която е възможно да се замени един модел с друг, без да се компрометира цялостната научна картина на изследваното явление. Използването на съвместим модел, вместо препоръчания, не трябва да води до противоречия, а или до усложняване на метода на обяснение, или в краен случай до загуба на моделираната страна на обекта.
Като цяло появата на различни модели се обяснява с различни нива на сложност на моделираните явления и различни области на тяхното приложение. Следователно границите на приложение на различните модели трябва задължително да се пресичат. Трябва да има зона на пресичане, в която могат да се използват поне два модела. В идеалния случай всеки сложен модел трябва да е съвместим с всеки по-прост модел, различаващ се само в обхвата на употреба. В противен случай процесът на учене и усвояване на знания за реален обект или явление рискува да премине в областта на изучаване на характеристиките на самите модели и техните взаимоотношения в различни условия. Съвместими модели, които се различават по информационен капацитет, могат да бъдат комбинирани в система от модели на обучение или да образуват комплекс от модели на обучение, чието използване ще избегне фрагментацията и фрагментацията на асимилацията на информация, осигурявайки съгласуваност и систематичност на знанията.
Изследователският проблем се крие в противоречието между необходимостта от информиране на учениците в съответствие с нивото на съвременното развитие на науката и ниския информационен капацитет на традиционните дидактически средства - модели на атоми и молекули; между необходимостта от въвеждане на сравнително нова форма на обучение – моделен експеримент и липсата на яснота, а често и взаимната несъвместимост на използваните модели.
Обектът на изследването е процесът на изучаване на структурата на материята с помощта на модели на атоми и молекули в гимназиален курс по химия. Предмет на изследване: теория и практика за създаване и използване на набор от модели на атоми и молекули за изучаване на структурата на материята в курса по химия в гимназията.
Цел на изследването: да се определят начини и средства за създаване и използване на набор от съвременни модели на атоми и молекули за изследване на структурата на веществата, техните физични и химични свойства. Изследователска хипотеза: ако комплекс от образователни модели на атоми и молекули, създаден, като се вземат предвид съвременните тенденции в моделирането, базирани на традиционни и нови модели, отговаря на изискванията за висок информационен капацитет, има широки дидактически възможности и се използва за въвеждане на нова форма на обучение - моделен експеримент, тогава това ще допринесе за: формиране у учениците на цялостни и съзнателни знания за структурата на материята; разбиране на свойствата на веществата; задълбочаване и дълготрайно запазване на знанията; укрепване на междудисциплинарните връзки и създаване на единна научна картина на света. Цели на изследването
1. Извършете анализ на съдържанието на курса по химия за 8-11 клас върху структурата на материята и нейното осигуряване с инструменти за визуално моделиране.
2. Формулирайте педагогически и ергономични изисквания към моделите и формирайте единен набор от взаимно съгласувани научно обосновани образователни модели (включително както традиционно използвани, така и нови пръстеновидни модели), осигуряващи постигането на педагогическите цели по най-ефективните начини. 3. Разработете методически техники за използване на набор от образователни модели, включително пръстеновидни, проверете възможността за провеждане на моделни експерименти с тяхна помощ и оценете педагогическата ефективност на използването му в училищната практика. Методологическата основа на изследването са фундаментални изследвания в областта на дидактиката, психологията, теорията за създаването и използването на различни видове учебни помагала и техните комплекси (A.A. Grabetsky, L.S. Zaznobina, A.A. Makarenya, E.E. Minchenkov, T.S. Назарова, С.Г. Шаповаленко), методи на преподаване на химия (О.С. Зайцев, Н.Е. Кузнецова, Л.А. Цветков, Г.М. Чернобелская, И.Н. Чертков), психолого-педагогически и ергономични теории (В.В. Давидов, В.П. Зинченко, В.М. Мунипов), резултати от анализ на научни и технически постижения в областта на създаването на модели на елементарни частици, атоми и техните химични съединения. Изследователски методи
Анализ на педагогическа, методическа, химическа, психологическа и педагогическа литература по теория на знанието и управление на процеса на придобиване на знания, проектиране и създаване на учебни помагала по проблемите на структурата на материята, създаване и използване на модели в изучаването на структурата на материята.
Наблюдение и обобщаване на педагогическия опит на училищните класове, опита на напреднали учители и методисти, педагогически иновации, както и опита на извънучилищната клубна работа на учениците.
Експериментално тестване на сравнителната педагогическа ефективност на влиянието на отделните модели и комплекса като цяло върху качеството на образованието.
Етапи на изследване
На първия етап (1996-1998 г.) бяха идентифицирани проблемите и трудностите, пред които са изправени учителите и учениците при изучаване на структурата на материята в гимназиален курс по химия, свързани със сложната структура на атома и спешната необходимост от познаване на законите на неговата структура. Идентифициран е метод за решаване на проблемите с усвояването на учебния материал и създаване на условия за подобряване на качеството на знанията с помощта на набор от модели, характеризиращи се с взаимосвързаност на всички компоненти и нови дидактически възможности.
На втория етап (1999-2001 г.) бяха разгледани тенденциите в съвременното моделиране, педагогическите и ергономичните изисквания за моделите, беше предложен набор от образователни модели, включително нови рингови модели, и бяха разгледани дидактическите възможности на комплекса.
На третия етап (2002-2003 г.) бяха определени техники и методи за използване на набор от модели за изследване на структурата на материята, изготвени бяха методически препоръки и беше тествана педагогическата ефективност на използването му.
Научна новост и теоретична значимост на изследването
Разработена е концепция за създаване и използване на набор от учебни модели на атоми и молекули за изучаване на структурата на материята, включваща основни и специфични педагогически и ергономични изисквания към използваните модели, като се вземат предвид съвременните тенденции в моделирането.
Предлага се серия от нови образователни модели, които са необходимите компоненти за създаване на набор от инструменти за визуално моделиране, които отговарят на съвременните педагогически и ергономични изисквания.
Разработени са методически техники за използване на набор от модели, включително пръстеновидни, за обучение по химия в гимназията, осигуряващи ефективността на усвояването на знанията на учениците.
Практическо значение на резултатите от изследването
Създаден е набор от образователни модели на атоми и молекули, включително нови пръстеновидни модели.
Разработени са и са пуснати в производство комплекти от пръстеновидни модели и са създадени компютърни графични програми за запознаване с пръстеновидни модели.
Подготвена е поредица от таблици по темата „Структура на материята“ за прилагане в училищата, разработени на базата на набор от образователни модели на атоми и молекули с включване на пръстеновидни.
Тествана е възможността за използване на нови модели в обучението под формата на компютърно-графични програми, които осигуряват и контролират ефективността на усвояването на знания от учениците при изучаване на въпроси на структурата на материята.
Подобни дисертации по специалност „Теория и методика на обучението и възпитанието (по области и степени на образование)”, 13.00.02 код HAC
Методически подходи към интегрираното използване на електронни образователни инструменти в средните училища: примерът за преподаване на математика в 5-6 клас 2007 г., кандидат на педагогическите науки Никонова, Наталия Василиевна
Интегриране на медийното образование с курса по химия в средното училище 2004 г., доктор на педагогическите науки Джурин, Алексей Анатолиевич
Педагогическа ефективност на екранните помощни средства в комбинация с химичен експеримент в курс по органична химия в гимназията 1984 г., кандидат на педагогическите науки Нугуен Ман Дунг, 0
Методически основи за изграждане на разширен курс по физика в началното училище 1997 г., доктор на педагогическите науки Дамер, Манана Дмитриевна
Използването на компютърно моделиране в процеса на обучение: Използване на примера за изучаване на молекулярна физика в средно училище 2002 г., кандидат на педагогическите науки Розова, Наталия Борисовна
Заключение на дисертацията на тема „Теория и методика на обучението и възпитанието (по области и нива на образование)”, Кожевников, Дмитрий Николаевич
Изводи към глава 3.
1. Пропастта между приетото основно ниво на преподаване в общообразователните класове и съществуващата необходимост от изучаване на физика и химия в светлината на съвременните научни представи за структурата на атома, идеологическата несъвместимост на молекулярните орбитални модели с по-простите традиционни модели води до до необходимостта съдържанието да се приведе в съответствие с принципите не само на историчност, но и на научност, фундаменталност, адаптивност и технологичност. Взаимното несъответствие на моделите в основното образование води до парадоксално познание. Модел на електронни обвивки с пръстеновидни ръбове може да бъде носител на знания с различни нива на сложност за структурата на атома и неговите свойства. Неговата методическа простота и достъпност му позволява да се използва в средните училища, включително в часовете по хуманитарни науки, а неговата вариативност и възможността за използване на сложни модели (разпознаваеми пръстеновидни: с вълнообразни ръбове или от затворени спирали) позволява да се използва в класове за задълбочено изучаване.
2. Пръстеностранните модели могат да се използват по време на преподаването на целия курс по химия, от самото начало на изучаването на Периодичния закон. Използването на визуални модели е предвидено за широк кръг от теми: "Периодичният закон и периодичната система на химичните елементи на Д. И. Менделеев. Структурата на атома. Структурата на веществата."
3. Проблемът с непълноценността на учебното съдържание, генериран от сложността и прекомерната непоследователност на традиционно използваните модели, може да бъде решен чрез фрагментирана промяна в съдържанието, свързана с въвеждането на нови модели в обучението.
4. Предложени са различни методически похвати за използване на нови модели в основните теми от курса по химия за 8-11 клас: предвидено е използването на нови модели за демонстрации; използване на въвеждащи видео материали и провеждане на компютърни уроци; Предлага се както фронтална работа, така и лабораторна и практическа работа под формата на моделни експерименти, провеждани от студентите самостоятелно или като част от екип.
5. Пръстеновидните модели, съчетаващи предимствата както на електронните схеми, така и на орбиталните модели, предоставят нови дидактически възможности под формата на моделни експерименти, за които са разработени образци на технологични карти за ученици, както и таблици по темата „Структура на материята” и методически препоръки за учителите .
6. Разглежда се приблизителното тематично планиране на програмните материали, организационните форми и методическите похвати са представени в табличен вид.
7. Подготвен по този начин, използването на нови - пръстеновидни модели ви позволява да прехвърлите обучението на ново ниво на възприемане на информация: образно-визуално-ефективно.
Завършеното изследване е с теоретико-практическо естество и е насочено към решаване на проблема за създаване на научно обоснована система от образователни модели и начини за ефективното й използване в училище.
1. Извършен е анализ на съдържанието на курса по химия за 8-11 клас и са определени тенденциите в създаването и използването на образователни модели на атоми и молекули за гимназиален курс по химия. Показана е ролята на моделите като инструмент за дейността на учителя и ученика при изучаване на раздела „Структура на материята“. Въз основа на анализа на фонда от демонстрационни учебни помагала и учебно оборудване за самостоятелна работа е идентифицирана необходимостта от създаване на ново поколение модели, които ще избегнат разпокъсаността и фрагментацията на усвояването на информацията, осигурявайки съгласуваност и систематичност на знанията, модели, които създават ясно изображение на разпределението на електроните във всеки атом или молекула през електронни обвивки.
2. Формулирани са теоретични принципи за създаване и прилагане на система от образователни модели за обучение по химия, представени под формата на педагогически и ергономични изисквания към моделите. Разработен е набор от образователни модели, включително нови кръгли модели, които допълват традиционно използваните в курсовете по химия в гимназията. Определен е съставът на компонентите на моделите за изучаване на курс по химия в раздела „Структура на материята“. Химическа връзка." За да се адаптират научните знания, са предложени различни видове пръстеновидни модели, използвани като инструмент за дейността на учениците, без които е трудно да се възприеме учебният материал и да се асимилира неговото научно съдържание.
3. Разработена е методика за използване на набор от визуални модели (включително пръстеновидни) в курса по химия в гимназията и е възможно да се използват за провеждане на моделни експерименти под формата на демонстрации, лабораторни и практически работи. За удобство и лекота на използване на комплекс от модели с вградени компоненти на нови инструменти и технологии се осигурява първоначално запознаване на учениците чрез видео демонстрации и компютърни уроци. Разработени са дидактически видео материали и компютърни програми за обучение, като се използват нови кръгли модели не само за демонстрации, но и за провеждане на процеси на моделиране от учениците в различни организационни форми на занятия (индивидуални и групови), което позволява прехвърляне на обучението в нов ниво на възприемане на информацията – образно-нагледно.ефективни. Експериментален тест за педагогическата ефективност на използването на комплекс от модели на атоми и молекули в училищната практика потвърди хипотезата на това изследване.
Списък с литература за дисертационно изследване Кандидат на педагогическите науки Кожевников, Дмитрий Николаевич, 2004 г.
1. Бергман Д.Л. Модел на въртящ се заряден пръстен на елементарни частици // Galilean Electrodynamics, 1991. vol. 2. - № 2. - С. 30-32.
2. Бергман David.L. и Лукас Дж., Чарлз У. Физически модели за елементарни частици, атоми и ядра / Представено на IV-та международна конференция: Проблем на пространството, времето и движението. Св. Петербург, септември 1997 г.
3. Лукас Дж. Физически модел за атоми и ядра // Галилеева електродинамика, януари/февруари 1996 г. том 7, - № 1, стр. 3-12.
4. Снелсън К. Портрет на атом / Изложбена книжка. Научен център на Мериленд в Балтимор, 1981 г.
5. Arkavenko L. N. Методически основи за създаване и използване на система от инструменти и инсталации за факултативния курс „Химия в промишлеността“: дисертация на Ph.D. (13.00.02) Москва 1991. -218с.
6. Ацюковски В. А. Обща динамика на етера. М.: Енергоатомиздат, 1990. -70 с.
7. Беклямишев В.О. Теория на вакуума. Част 1. - Санкт Петербург: 000 "Конгрес", 1998. -104 с.
8. Бердоносов С. С. Как моделът на Р. Гилеспи обяснява структурата на молекулите? //Химия в училище, 1996. № 2. - стр. 16-21.
9. Бердоносов С. С. Учебници по химия: традиционни погрешни схващания и модерност // Химия в училище, 2000. № 5. - С. 22-27.
10. Ю. Болтянски В. Г. Формула за яснота: изоморфизъм плюс простота // Сов. Педагогика, 1970. - № 5.
11. Бородин П. В. Нашият подход към изучаването на структурата на метан, етилен и ацетилен // Химия в училище, 1991. № 6. - С. 40-41.
12. Булавин Ю. И. Динамични модели на електронни облаци // Химия в училище, 1995. № 4. - стр. 69-70.
13. Бунин В. А. Математика и трудности на физиката // Съзнание и физическа реалност. М.: изд. Фолиум, 1997. - Т. 2. - № 2. - С. 71-79.
14. Vanyugina T.V., Milliaresi E.E. Избираем специален курс „Пространствена и електронна структура на органични съединения” // Химия в училище, 1988. № 4. - С. 43-44.
15. Верховски В. Н. и Смирнов А. Д. Техника на химичен експеримент. Наръчник за учители. том 1, изд. 6-ти, преработен - М., Образование, 1975.-368с.
16. Верховски В. Н. и Смирнов А. Д. Техника на химичен експеримент. Наръчник за учители. том 2, изд. 6-ти, преработен - М., Образование, 1975.-383с.
17. Виноградова Н. К. Организационни и педагогически основи за проектиране на предметно-оформена среда на образователния комплекс „училище за детска градина“: текст на дисертацията на д-р. (13.00.02) - Москва 1999.-313s.
18. Власов А. Д. Атом на Шрьодингер // UFN, 1993. № 2. - т. 163. - С. 97-103.
19. Власов А. Д. Класическо направление в квантовата механика. М.: МРТИ РАН, 1993.-229 с.
20. Габриелян О. С., Смирнова Т. В. Изучаване на химия в 8 клас: Методическо ръководство към учебника Габриелян О. С. Химия 8 за ученици и учители. Дидактически материали. / Под общ изд. Т. В. Смирнова. - М.: Блик Плюс, 1997. - 224 с.
21. Galiulin R.V. Лекции по геометричните основи на кристалографията: Текст на лекциите. Челябинск: Урал. състояние Университет, Челяб. състояние унив., 1989. - 81 с.
22. Гапич Г. П. Интегриран урок за повторение и обобщаване на знания // Химия в училище, 1998. № 7. - С. 26-28.
23. Гаркунов В. П. Методи на преподаване на химия / Изд. Н. Е. Кузнецова. М.: Образование, 1984. -415 с.
24. Хайзенберг В. Физика и философия. М.: Наука, 1989. -400 с.
25. Глинка Н. Л. Обща химия: Учебник за университети. 21-во изд. / Ед. Рабинович В. А. - Л.: Химия, 1980. - 720 с.
26. Голубев И. М., Аверин А. В. Изображение на a и z-връзки в една картина // Химия в училище, 1990. № 2. - С.39.
27. Голубев И.М. За понятието „електронен облак” // Химия в училище, 1980. - № 5. стр.36.
28. Грабецки А. А., Зазнобина Л. С., Назарова Т. С. Използване на учебни помагала в уроците по химия. М.: Образование, 1988. - 160 с.
29. Грабецки А.А., Назарова Т.С., Лаврова В.Н. Химичен експеримент в училище. М.: Образование, 1987. -240 с.
30. Гузей, Л. С., Сорокин В. В., Суровцева Р. П. Атомна структура и химическа връзка // Химия в училище, 1988. № 2. - С. 46-51.
31. Гузей, Л. С., Сорокин В. В., Суровцева Р. П. Атомна структура и химическа връзка // Химия в училище, 1988. № 3. - стр. 42-48.
32. Guzik N.P. Преподаване на органична химия: Книга за учители: От трудов опит. М.: Образование, 1988. - 224 с.
33. Давидов В. В. Видове обобщение в обучението. Логически и психологически проблеми на конструирането на учебни предмети. М .: Педагогика, 1972. -424 с.
34. Давидов В. В. Проблеми на обучението за развитие: Опит от теоретични и експериментални психологически изследвания. М.: Педагогика, 1986.-240 с.
35. Давидов В. В. Теория на обучението за развитие. М.: INTOR, 1996. -544 с.
36. Давидов В.В., Варданян А.У. Учебни дейности и симулации. -Ереван: Луйс, 1981. -220 с.
37. Daineko V. I. Лекция „Теория на структурата. Въглеводороди: връзка между структура и свойства” // Химия в училище, 1988. № 1. - С.36-43.
38. Дидик Ю.К., Уразаков Е.И. Сборник проблемни лекции по физика: Учебник. VVVSKU: Дубна, 1990. - 62 с.
39. Дризовская Т.М. Методика на обучението по химия в 9 клас. Наръчник за учители. -М .: Образование, 1965.-224 с.
40. Дроздов С. Н. Тетраедричен модел и неговото използване // Химия в училище, 1982. № 3. - С.52-54.
41. Дуков В.М. Два века работа върху училищен учебник по физика // Проблеми на училищен учебник. М.: Просвещение, 1990. - бр. 19, комп. В.Р. Рокитянски. - стр. 236-269.
42. Егорова А. А. За връзката между естествените науки и курсовете по химия // Химия в училище, 1995.-№ 1.-С.30-31.
43. Загорски В. В. „Валдорфско” обучение по химия // Химия в училище, 1995. -№ 3. С.10-13. 44. Зайцев О. С. Обща химия. Състояние на веществата и химични реакции.
44. Учебник за ВУЗ. М.: Химия, 1990. - 352 с. 45. Зайцев О. С. Методи на преподаване на химия. - М.: ВЛАДОС, 1999. - 384 с.: ил. 46.3анков Л.В. Избрани педагогически трудове. - М.: Ново училище, 1996. -426 с.
45. Зелински A.N. Академик Н. Д. Зелински (Новото в живота, науката, технологията. Серия „Химия“, № 11). М.: Знание, 1981.-64с.48.3инченко В.П., Мунипов В.М. Основи на ергономията. М.: Издателство на Московския държавен университет, 1979.- 343 с.
46. Зорина Л.Я. Систематично качество на знанията. - М.: Знание 1976. - 64 с.
47. Иванова Р. Г. За изучаването на химия в 7 и 8 клас // Химия в училище, 1981.- № 4. С.24-29.
48. Иванова Р. Г. За основните насоки за актуализиране на химическото образование по време на прехода към дванадесетгодишно училище // Химия в училище, 2000. № 3. - С. 2-5.
49. Канарев Ф.М. Кризата на теоретичната физика. Краснодар KSAU, 1998. -200 с.
50. Качалова О. И. Методически принципи за организиране на училищен семинар по обща химия (11 клас): автореферат за докторска степен. (13.00.02) Омск: ОГПУ, 1998.-20 с.
51. Кид Р., Ардини Дж., Антон А. Представяне на ефекта на Комптън като двойно доплерово изместване // Физика в чужбина: Преподаване. М.: Мир, 1988. - стр. 68-79. Превод на статията Kidd R., Ardini J., Anton A.-Amer. J. Phys., 1985.-v 53,-No. 7.-p.641.
52. Киранен К. Атомни молекулярни модели // Химия в училище, 1995. - № 5. - С. 55-56.
53. Кожевников Д. Н. Пръстеновидни модели на молекули // Journal of Physical Chemistry, 1996. т. 70. - № 6. - стр. 1134-1137.
54. Кузнецова Л. М. Нашият опит в изучаването на темата „Химично свързване. Структурата на материята в курса по химия за 8 клас” // Химия в училище, 1982. № 6. - С. 3942.
55. Кузнецова Н. Е. Формиране на системи от понятия в обучението по химия. М.: Образование, 1989. - 144 с.
56. Леонов В. С. Теория на еластичната квантована среда. Част 2. - Минск: издателство "PolyBig", 1997. - 122 с.
57. Лоренц Г. А. Теорията на електроните и нейното приложение към явленията на светлината и топлинното излъчване. М.: Гостехиздат, 1953. -472 с.
58. Лоренц Г.А. Стари и нови проблеми на физиката. М.: Наука, 1970. - 264 с.
59. Ляшенков E.I., Гатаулин A.G. Използване на хибридизационни схеми за електронни облаци на въглероден атом // Химия в училище, 1982. № 5. - С. 41-42.
60. Макареня А.А. Теория и методика на обучението по химия. Избрани произведения. -T. 2. Тюмен: ТОГИРРО, 2000. - 335 с.
61. Маурина И. Я., Липина Г.Н. Някои техники за използване на модели в класната стая // Химия в училище, 1986. № 3. - С. 51-53.
62. Медведев Ю. Н. Феноменът на вторичната периодичност // Химия в училище, 1998. № 3. - С. 9-19.
65. Минченков E.E. Концепцията за химическо образование в училище // Химия в училище, 1993. № 4. - С. 7-11.
66. Михайлова И. Б. Сетивното отражение в съвременното научно познание. М.: Мисъл, 1972. - 277s
67. Назарова Т. С. Теоретични основи на създаването и използването на система от материални средства за обучение по химия в средното училище. Дисертация за научна степен доктор на педагогическите науки. (13.00.02) Москва: НИИСМО, 1988.-42с.
68. Назарова Т. С., Полат Е. С. Учебни средства: технология на създаване и използване. М .: Издателство УРАО, 1998. - 204 с.
69. Нейланд О.Я. Органична химия: Учебник. за хим. специалист. университети. М.: По-високо. училище, 1990. -751 с.
70. Нови педагогически и информационни технологии в образователната система: Учебник за студенти от педагогически университети и системи за повишаване на квалификацията на преподавателския състав / Изд. E. S. Polat. М.: Издателство. Център Академия, 1999. - 224 с.
71. Нурмински И.И. Физика 11. Учебник за училищата и паралелките със задълбочено изучаване на физика. - М.: NT-Център, 1993. - 160 с.
72. Нурмински И. И., Гладишева Н. К. Физика 9: Учебник за 9 клас на учебните заведения. - М.: Образование, 1998. -256 с.
73. Обучението по химия в 7. клас: Помагало за учители./А. С. Корошченко, П. Н. Жуков, М. В. Зуева и др. / Изд. А. С. Корощенко. М.: Образование, 1988.-160 с.
74. Органична химия / Ed. Tyukavkina N. A. M .: Медицина, 1989. -432 стр. 82, Osidak V.N. Електрон: вътрешна структура // Физическата мисъл на Русия, - М.: РИА "Кречет", 1996. № 2. - С. 49-59.
75. Педагогика: Учебник за студенти пед. Inst / Ю. К. Бабански, В. А. Сластенин, Н. А. Сорокин и др. / Ред. Ю. К. Бабански. 2-ро изд., доп. и обработени - М.: Образование, 1988. - 479 с.
76. Списъци на учебно оборудване за образователни институции в Русия. Н. Новгород: Нижполиграф, 1994. - 309 с.
77. Pidkasisty P.I. Самостоятелна познавателна дейност на учениците в обучението: Теоретично и експериментално изследване. -М .: Педагогика, 1980.-240 с.
78. Пидкасисти П.И., Портнов М.Л. Изкуството на преподаване: Второ издание. Първата книга на учителя. М.: Педагогическо общество на Русия, 1999.-212 с.
79. Плахов И. А. Използване на фланелограф при изучаване на темата „Първоначални химически понятия“ // Химия в училище, 1995. № 2. -С. 46-47.
80. Полосин В. С., Ширина Л. К. Теория и практика на използване на динамични визуални средства в обучението по химия / Проблеми на методите на преподаване на химия в средното училище. Изд. М. П. Кашина и Л. А. Цветкова. М .: Педагогика, 1973. - 272 с.
81. Polosin B.C. Дисертации по методика на преподаване на химия // Химия в училище, 1980. № 1. - С. 74-77.
82. Потапов Ю. С., Фомински Л. П. Вихрова енергия и студен ядрен синтез от гледна точка на теорията на движението. Кишинев - Черкаси: "ОКО-Плюс", 2000 г., 387 с.
83. Pugal N.A. Създаване и използване на система от учебни помагала по биология в средното училище. Дисертация, 1994г.
84. Рентгенови микроскопи // В света на науката. М.: Мир, 1991. - № 4. - С.36-43.
85. Родина Н.А. Самостоятелна работа на учениците по физика в 7-8 клас на средното училище: Дидактически материали / Гутник У.М., Кирилов И.Г., Родина. N.A / изд. НА. Роден край. 2-ро изд. - М.: Образование, 1994. -126 с.
86. Romazanov B. I. Физика на етера и природата на силите / Проблеми на пространството, времето, гравитацията: Материали на третия междун. конф. 22-27. 05.94. -СПб .: Издателство Политехника, 1995. С. 175-185.
87. Ромашина Т. Н., Чернобелская Г. М. Консолидиране на знанията по органична химия с помощта на референтни схеми и тренировъчни упражнения // Химия в училище, 1985. № 4. - С. 39-40.
88. Eb.Rudzitis G.E., Feldman F.G. Химия: Неорганична химия. Учебник за 8 клас. ср. училище М .: Образование, 1993. - 158 с.
89. Рудзитис Г.Е., Фелдман Ф.Г. Химия: Неорганична химия. Учебник за 9 клас. ср. училище М.: Образование, 1990. - 176 с.
90. Рудзитис Г.Е., Фелдман Ф.Г. Химия: Органична химия: Основи на общата химия (Обобщаване и задълбочаване на знанията). Учебник за 10 клас. сряда, училище М.: Образование, 1991. - 160 с.
91. Садовская И. Л. Методика за коригиране на усвояването на знания в процеса на обучение по биология в педагогически университет: текст на дисертацията на д-р. (13.00.02) - Красноярск: KSPU, 2000. 151 с.
92. Сапогин Л. Г. Визуален микросвят. Младежка техника, 1989. - № 1. -С. 40-45.
93. Саймън Р. Експеримент в химическото познание // Експеримент, модел, теория. Наблюдение, експеримент, практика. Москва-Берлин: Издателство Наука, 1982.-С. 76-87.
94. Скаткин М. Н. Методология и методи на педагогическото изследване. В помощ на начинаещия изследовател. М .: Педагогика, 1986. - 152 с.
95. Скаткин М. Н. Проблеми на съвременната дидактика. 2-ро изд. М.: Педагогика, 1984. - 96 с.
96. Смирнова Ж. И. Производство на модели с топка и прът // Химия в училище, 1984. № 1. - С. 61.
97. Смирнова Т. В. Формиране на научния мироглед на учениците при изучаване на химия: Наръчник за учители. М.: Образование, 1984.-175 с.
98. Смирнова. Т. В. За методологията за изучаване на раздела „Обща химия” // Химия в училище, 1989. № 4. - С. 35-44.
99. Sologub A.I. Производство и приложение на магнитни модели // Химия в училище, 1985. № 3. - С. 55-56.
100. Соломон Д. Н., Степанов Е. Ю. Дидактически материал за магнитната дъска // Химия в училище, 1982. № 1. - С. 65.
101. Суровцева Р. П. Задачи за самостоятелна работа по химия в 9 клас: Книга за учители. - М.: Образование, 1995. 64 с.
102. Суровцева Р. П., Софронов С. В. Задачи за самостоятелна работа по химия в 8. клас: Книга за учители. М.: Образование, 1993. - 96 с.
103. Суровцева. Р.П.; Минченков Е. Е.; Габриелян О. С. Приблизително тематично планиране на учебен материал по химия за 8 клас // Химия в училище, 2000. № 3. - С. 37-46.
104. Тикави В. Ф. Характеристики на структурата на някои прости и сложни неорганични вещества // Химия в училище, 1991. № 6. - С. 5-12.
105. Тюменцева Е. Ю. Диференциация на помощта за учениците от подготвителния отдел в процеса на обучение по химия: текст на дисертацията на д-р. (13.00.02) Омск: ОГПУ, 1999. - 213 с.
106. Засилване на политехническата насоченост на обучението по химия. Книга за учители: от трудов стаж / удоб. Каверина А. А. М.: Образование, 1987.-127с.
107. Физика и астрономия. Пробен учебник за 8 клас общообразователна подготовка. заведение / Ед. А. А. Пински, В. Г. Разумовски. М.: Образование, 1995.-303 с.
108. Freemantle M. Химия в действие. В 2 ч. Част 1: Прев. от английски - М.: Мир, 1991.-528 с.
109. Freemantle M. Химия в действие. В 2 ч. Част 2: Прев. от английски - М.: Мир, 1991.-622 с.
110. Хагер Н. Етапи на формиране на модел // Експеримент, модел, теория. Модели в структурата на познанието. Москва-Берлин: Наука, 1982. - стр. 128-142.
111. Химия и живот (Solter chemistry). Част 1. Концепции на химията: Прев. от английски -М .: РХТУ им. DI. Менделеева, 1997. 337 с., ил.
112. Химия и живот (Solter chemistry). Част 2. Химически романи: Прев. от английски М.: РХТУ им. DI. Менделеева, 1997. -437 с., ил.
113. Химия и живот (Solter chemistry). Част 3. Семинар: Прев. от английски М.: РХТУ им. DI. Менделеева, 1997. -406 с., ил.
114. Химия и живот (Solter chemistry). Част 4. Ръководство за учители: Прев. от английски М.: РХТУ им. DI. Менделеева, 1998. - 331 с., ил.
115. Хомченко Г. П. За графичните и структурни формули // Химия в училище, 1983. -№3.- С. 61-63.
116. Цветков J1. А. За обосноваване на съдържанието на основното химическо образование // Химия в училище, 1999. № 5. - С. 17-22.
117. Цветков Л. А. Обобщаване на знанията на учениците по органична химия // Химия в училище, 1981. № 6. - С. 17-24.
118. Цветков Л. А. Органична химия: Учебник за 10 клас на гимназията. 25-то изд., преработено. - М.: Образование, 1988. - 240 с.
119. Цветков Л. А. Обучение по органична химия в средното училище: Наръчник за учители. 3-то издание, преработено. - М.: Образование, 1984. -256 с.
120. Чернобелская Г.М. Основи на методите на обучение по химия. М.: Образование, 1987.-256 с.
121. Чернобелская Г.М. Методика на обучението по химия в гимназията. М.: ВЛАДОС, 2000. - 336 с.
122. Чертков I.N. Още веднъж за понятието „степен на окисление” в органичната химия // Химия в училище, 1998. - № 7.-S. 31-32.
123. Чертков И. Н. Значението на трудовете на А. М. Бутлеров за развитието на методите на преподаване на химия // Химия в училище, 1991. № 6. - С. 13-19.
124. Шамилишвили О. Х. По въпроса за яснотата при изучаването на хибридизацията на електронни черупки // Химия в училище, 1982. № 5. - С. 43.
125. Шаповаленко С.Г. Методика на обучението в осемгодишните и средните училища. М.: Държава. Учебно-пед. Издателство мин. Просвета на РСФСР, 1963. -668 с.
126. Shelinsky G.I. Какъв трябва да бъде училищният курс по химия? // Химия в училище, 1985.-№4.-С. 45-48.
127. Шпак А.И. Комплект помагала за изучаване на структурата на материята в курса по химия за осми клас на общообразователно училище: автореферат за докторска степен. (731)-Саратов: СГПИ, 1971.-26с.
128. Шрьодингер Е. Избрани произведения по квантова механика. М.: Наука, 1976.
129. Щоф В. А. Проблеми на методологията на научното познание. Монография. -М .: Висше училище, 1978. 269 с.
130. Щоф В.А. Моделиране и философия. М.: Наука, 1966.
131. Аткинс П. Ред и безредие в природата: Превод. от английски / Предговор Ю. Г. Рудого. М.: Мир, 1987. - 224 с., ил.
132. Юзвишин И. И. Информология. 3-то издание, рев. и допълнителни - М.: Радио и комуникации, 1996. -215 с.
133. Ярославская Г. П. Комплект за моделиране на химични връзки и атомни структури // Химия в училище, 1986. № 3. - С. 54-55.
134. Yatsuto M. A. Използване на дидактическите възможности на химията за подготовка на учениците за живота: текст на дисертацията на Ph.D. (13.00.02) Омск: ОГПУ, 1999. - 192 с.
Моля, имайте предвид, че научните текстове, представени по-горе, са публикувани само за информационни цели и са получени чрез разпознаване на текст на оригинална дисертация (OCR). Следователно те могат да съдържат грешки, свързани с несъвършени алгоритми за разпознаване. В PDF файловете на дисертациите и резюметата, които предоставяме, няма такива грешки.
Към днешна дата са разработени и активно се използват стотици различни методи за изследване на структурата и свойствата на молекулите. Много от тях изискват владеене на сложни физични теории и използване на скъпо оборудване. В този раздел ще разгледаме само някои от най-често използваните методи за изследване на структурата на молекулите и ще се опитаме да дадем проста интерпретация на същността на физическите явления, които са в основата на тези методи. Но първо, нека се обърнем към разглеждането на движението на атомите и молекулите в пространството и движението на свързаните атоми в молекулите. Това се дължи на факта, че много методи, използвани за изследване на структурата на молекулите, се основават на изследването на движението на електрони и атоми в молекулите и движението на самите молекули.
ГРАДУСИ НА СВОБОДА
Една точкова частица има три геометрични степени на свобода: тя може да се движи в три взаимно перпендикулярни посоки. Твърди се, че една частица има три степени на свобода.
Под степен на свободав процесите с обмен на енергия разбираме степента на свобода на частица, която може да участва в процеса на обмен на енергия.
Нека разгледаме кинетичното поведение на атомите. Средната кинетична енергия на един мол атоми е лесно да се оцени, като се използва хелий като пример. Добре известно е, че топлинният капацитет на един мол хелий е 12,47 J/(mol K). Това означава, че нагряването на един мол хелий с един градус изисква 12,47 J енергия.
При нагряване атомите на хелия започват да се движат по-бързо в пространството по трите оси, които са равни. Всъщност атомите на хелия имат само кинетична енергия, която може да бъде представена във форма, еквивалентна по отношение на три оси
Това означава, че ускорението на топлинното движение по една ос с повишаване на температурата с един градус изисква само 4,15 J. Последната стойност е точно равна на R/2, където R е универсалната газова константа, равна на 8,314472(15) J/ (mol -TO). Ние разширяваме това заключение до всички атоми и молекули, което е в съгласие с експеримента: транслационният топлинен капацитет на една транслационна степен на свобода на частицата е равен на R/2.
До този момент сме пренебрегвали вътрешната структура на атомите и молекулите. Сега нека разгледаме каква роля играят електроните и атомните ядра в процесите на обмен на енергия.
При температури около 300 K средната кинетична енергия на един мол атоми и молекули е, в съответствие с израза
![]()
приблизително 3740 J/mol. Средната кинетична енергия на една молекула се изчислява с помощта на уравнението
![]()
където k е константата на Болцман, равна на R/L/d = 1,38·10 -23 J/K.
Средната кинетична енергия на една молекула при 300 K е 6,2 10 -21 J или 0,039 eV на молекула. Приблизително същото количество енергия се прехвърля по време на сблъсъци. По-рано показахме, че енергията на възбуждане на електронни енергийни нива изисква около 3-10 eV. По този начин енергията, която средно може да бъде прехвърлена от една молекула към друга, е напълно недостатъчна за възбуждане на електронни енергийни нива. Следователно електроните в атомите и молекулите, въпреки наличието на три транслационни степени на свобода за всеки електрон, като правило не допринасят за общия топлинен капацитет. Изключения са възможни само при наличие на ниски нива на електронна енергия.
Нека се обърнем към ядрата на атомите, които са част от молекулите. Всяко ядро има три транслационни степени на свобода. Но в състава на молекулите ядрата са свързани помежду си чрез химически връзки и следователно тяхното движение не може да се случи напълно хаотично. Поради съществуването на химически връзки, движението на ядрата едно спрямо друго може да се случи само в определени граници, в противен случай молекулите биха претърпели химични трансформации. Ако всички ядра се движат съгласувано, тогава такива движения могат да бъдат значителни. Например, това се случва по време на транслационното движение на молекулата като цяло. В този случай всички ядра в молекулата имат еднаква компонента на скоростта в посоката на транслационното движение.
Наред с постъпателното движение има и друга възможност за проява на синхронно движение на ядрата - това е въртенето на молекулите като цяло. В общия случай на нелинейните молекули има три ротационни степени на свобода около три взаимно перпендикулярни оси, минаващи през центъра на масата. Центърът на масата задължително трябва да е на оста на въртене, тъй като в противен случай той би се изместил, когато молекулата се върти, което е невъзможно при липса на външни сили.
По-рано беше показано, че ротационната енергия се квантува и квантът на ротационната енергия се определя от ротационна константа, равна на H 2 /(2/). Ротационните константи на молекулите обикновено са значително по-малки от k T(при нормални температури около 300 K стойността на k Tе около 200 cm -1 или 0,026 eV, или 400 10 -23 J, или 2500 J/mol) и са равни на приблизително 10 cm -1 (120 J/mol или 0,0012 eV/молекула). Следователно молекулярните ротации се възбуждат лесно при обикновени температури. Топлинният капацитет на ротационна степен на свобода също е равен на R/2.
За разлика от нелинейните молекули, линейните молекули имат само две ротационни степени на свобода спрямо две взаимно перпендикулярни оси, които са перпендикулярни на оста на молекулата. Има ли ротационна степен на свобода около ос, съвпадаща с оста на молекулата? Строго погледнато, такава степен на свобода съществува, но възбуждането на въртене около оста на молекулата означава възбуждане на въртене на ядрата около ос, минаваща през центровете на ядрата. Квантите на ротационната енергия на ядрата също се определят от ротационните константи h 2 /(2 1), Където 1 - сега инерционният момент на сърцевината. За ядрата ротационната константа е от порядъка на (1,054) 2 10 _68 /(2 1,7 10 -27 Yu -30) = 3,2 10 -12 J, което е много по-голямо от k T.Следователно възбуждането на въртеливото движение на ядрата също не може да се случи при условия, близки до обикновените.
Като цяло една молекула може да има само 3Nстепени на свобода, където Н-брой ядра. От тези 3 нИма три степени на свобода за транслационни и три за нелинейни молекули или две за линейни молекули за ротационни степени на свобода. Останалите степени на свобода са вибрационни. Нелинейните молекули имат 3 н-6 вибрационни степени на свобода и линейни -3N-5.
За разлика от ротационните и транслационните степени на свобода, всяка вибрационна степен на свобода има топлинен капацитет, равен на R, а не на R/2. Това се дължи на факта, че когато се възбужда вибрационно движение, енергията се изразходва не само за увеличаване на кинетичната енергия на ядрата, но и за увеличаване на потенциалната енергия на вибрационното движение.
Трябва да се отбележи, че ситуацията с вибрационните степени на свобода е много по-сложна, отколкото с транслационните и ротационните. Факт е, че типичните стойности на вибрационните честоти са в диапазона 1000-3000 cm -1. (1 cm -1 ~ 1,24 10 -4 eV.) Следователно, квантите на вибрационно възбуждане ще бъдат около 0,1-0,3 eV, което е само няколко пъти по-голямо от енергията на топлинното движение (0,04 eV при 300 K). Следователно, при температури под стайна температура (300 K), вибрационното движение в молекулите е слабо възбудено, но при температури над стайната температура, вибрациите, особено в многоатомните молекули, вече са ефективно възбудени. Стайните температури попадат в междинния диапазон.
Всички вибрации в молекулите могат да бъдат разделени на разтягане и огъване. При разтягащите вибрации се променя главно дължината на химичната връзка, а при деформационните - ъглите между връзките. Вибрациите при разтягане имат по-високи честоти от вибрациите при огъване, тъй като за промяна на ъгъла е необходима по-малко енергия. Броят на разтягащите вибрации е равен на броя на връзките между атомите в молекулата (в този случай двойните и тройните връзки се считат за една връзка между атомите!). Честотите на разтягащите вибрации са за C-H, O-H и др. връзки. около 3000-3400 cm" 1, C-C - около 1200 cm" 1, C=C - 1700 cm 4, OS - 2200 cm 4, C=0 - 1700 cm 1, деформационните вибрации обикновено се намират в района на 1000 cm" 1 От представените данни става ясно, че честотата на разтягащата вибрация на C-C връзката се увеличава с увеличаването на множествеността на връзката. Това може да се обясни с увеличаване на силата на връзката.
Нека обсъдим този феномен по-подробно. Честотата на осцилатора, показана на фиг. 2.7, се определя от израза

Където T- маса на осцилиращата частица. В случай на осцилатор (фиг. 2.7), осцилиращата маса Tзакрепен с пружина към стената, чиято маса е много голяма и поради това стената не участва в трептящото движение. В случая на молекулите всеки вибриращ атом е свързан чрез химични връзки, действащи като пружини, с други атоми, чиято маса не е безкрайно голяма. Следователно всички атоми, свързани с химични връзки, участват във вибрационно движение. Например в молекулата на НС1 вибрират както водородният атом, така и хлорният атом. Както следва от теорията на осцилаторното движение, формулата за честотата на трептене на осцилатори тип HC1 трябва да има формата
където p е намалената маса, равна на
![]()
Където t ( ,t 2 -масата на атомите, участващи в химическа връзка, а k е силовата константа, характеризираща силата на връзката. Енергията на единична C-C връзка е около 410 kJ/mol, двойна -
710 kJ/mol, троен - 960 kJ/mol. Намалената маса на C-C осцилатора не зависи от естеството на връзката. По този начин, когато се преминава от единична към тройна връзка, може да се очаква увеличение на честотата на осцилатора с фактор 1,5, което се наблюдава експериментално.
Честотите на C-C връзките са приблизително 2,5 пъти по-ниски от честотите на C-H връзките. Това се дължи на факта, че намалената маса за вибрации на C-C връзката е по-голяма, отколкото за C-H връзката, а енергията на C-C връзката е по-малка.
Нека да разгледаме някои примери за специфични молекули, чиито вибрационни режими са показани на фиг. 7.1.
Водна молекула.Има 9 степени на свобода, от които три са транслационни, три са ротационни, три са осцилационни. От трите вибрационни честоти, първите две са вибрации на разтягане, а третата е на огъване.
Молекула C0 2. Има 9 степени на свобода: три - транслационни, две - ротационни, четири - колебателни. От четирите вибрационни честоти, две са вибрации на разтягане и две са вибрации на деформация.

Ориз. 7.1. Вибрационни форми на молекули H 2 0, C0 2, H 2 CO, получени въз основа на точна теория
Знаците "+" и "-" показват посоките на вибрациите, перпендикулярни на равнината на листа. И двете деформационни вибрации се различават само във взаимно перпендикулярните равнини, в които възникват вибрациите. Тези трептения имат еднаква честота и се наричат изродени.
Нелинейна формалдехидна молекулаима 12 степени на свобода: три - транслационни, три - ротационни, шест - колебателни. От шестте вибрации, три са вибрации на разтягане и три са вибрации на огъване.
От фиг. 7.1 показва, че вибрациите на разтягане обикновено се простират до цялата молекула: вибрациите само на една връзка са много редки. По същия начин деформационните вибрации засягат в една или друга степен всички ъгли.
Нека сега се върнем към изчисляването на топлинния капацитет на молекулите. За атомите (едноатомни молекули) има главно транслационен топлинен капацитет, равен на (3 / 2)R. За двуатомните молекули има три транслационни степени на свобода, две ротационни и една вибрационна. Тогава за случая на ниски (стайни) температури, без да се вземат предвид вибрационните степени на свобода, получаваме C = (3 / 2 + 3 / 2)R = (5 / 2)R. В случай на високи температури топлинният капацитет е (7 / 2)R.
Във водната молекула имаме три транслационни, три ротационни и три вибрационни степени на свобода. В случай на ниски температури, без да се вземат предвид вибрационните степени на свобода, C = (3 / 2 + 3 / 2)R = 3R. В случай на високи температури трябва да добавите още 3R към тази стойност. Резултатът е 6R.
Молекулярна структура
Молекулата е най-малката частица от веществото, състояща се от еднакви или различни атоми, свързани помежду си чрез химични връзки, и е носител на неговите основни химични и физични свойства. Химичните връзки са причинени от взаимодействието на външните, валентни електрони на атомите. Има два вида връзки, които най-често се срещат в молекулите: йонни и ковалентни.
Йонното свързване (например в молекулите на NaCl, KBr) се осъществява чрез електростатичното взаимодействие на атомите по време на прехода на електрона от един атом към друг, т.е. по време на образуването на положителни и отрицателни йони. Ковалентна връзка (например в H2, C2, CO молекули) възниква, когато валентните електрони се споделят от два съседни атома (завъртанията на валентните електрони трябва да са антипаралелни). Ковалентната връзка се обяснява въз основа на принципа на неразличимостта на идентични частици, например електрони в молекула на водорода. Неразличимостта на частиците води до специфично взаимодействие между тях, т.нар обменно взаимодействие.Това е чисто квантов ефект, който няма класическо обяснение, но може да си представим по такъв начин, че електронът на всеки от атомите на водородната молекула прекарва известно време в ядрото на другия атом и, следователно, връзката на възникват и двата атома, които образуват молекулата. Когато два водородни атома се съберат на разстояние от порядъка на радиуса на Бор, възниква тяхното взаимно привличане и се образува стабилна водородна молекула.
Молекулата е квантова система; описва се от уравнението на Шрьодингер, което отчита движението на електроните в молекулата, вибрациите на атомите на молекулата и въртенето на молекулата. Решаването на това уравнение е много трудна задача, която обикновено се разделя на две: за електрони и ядра.
Енергия на изолирана молекула
EE el +E броене +E ротация, (1)
където E el е енергията на движение на електроните спрямо ядрата, E бр - вибрационна енергия
ядра (в резултат на което относителното положение на ядрата периодично се променя), E ротация е енергията на въртене на ядрата (в резултат на което периодично се променя ориентацията на молекулата в пространството). Формула (1) не отчита енергията на транслационното движение на центъра на масата на молекулата и енергията на атомните ядра в молекулата. Първият от тях не е квантован, така че неговите промени не могат да доведат до появата на молекулен спектър, а вторият може да бъде игнориран, ако не се вземе предвид свръхфината структура
спектрални линии. Отношения E el:E броене:E ротация =1: m/M , Където T- електронна маса, М- количество от порядъка на масата на атомните ядра в молекула, m/M10 -5 10 -3. Следователно, E el >> E броене >> E ротация. Доказано е, че E el 1 10 eV, E coll 10 -2 10 -1 eV, E въртене 10 -5 10 -3 eV.
Всяка от енергиите, включени в израз (1), е квантована (съответства на набор от дискретни енергийни нива) и се определя от квантови числа. При преминаване от едно енергийно състояние в друго се поглъща или излъчва енергия E=h. По време на такива преходи едновременно се променят енергията на движение на електрони, енергията на вибрациите и въртенето. От теорията и експеримента следва, че разстоянието между ротационните енергийни нива E rot е много по-малко от разстоянието между вибрационните нива E coll, което от своя страна е по-малко от разстоянието между електронните нива E el. На фиг. Фигура 1 схематично показва енергийните нива на двуатомна молекула (например, разглеждат се само две електронни нива - показани с дебели линии).
Молекулярни спектри. Раманово разсейване
Структурата на молекулите и свойствата на техните енергийни нива се проявяват в молекулярни спектри- емисионни (абсорбционни) спектри, възникващи по време на квантови преходи между енергийните нива на молекулите. Емисионният спектър на една молекула се определя от структурата на нейните енергийни нива и съответните правила за подбор (например промяната в квантовите числа, съответстваща както на вибрационно, така и на въртеливо движение, трябва да бъде равна на ± 1).
Така че, с различни видове преходи между нивата, възникват различни видове молекулни спектри. Честотите на спектралните линии, излъчвани от молекулите, могат да съответстват на преходи от едно електронно ниво към друго (електронни спектри)или от едно вибрационно (ротационно) ниво на друго (вибрационни (ротационни) спектри).Освен това са възможни и преходи със същите стойности на E count и E се завъртат до нива, които имат различни стойности на трите компонента, което води до електронно-вибрационни и вибрационно-ротационни спектри.Следователно спектърът на молекулите е доста сложен.
Типичните молекулярни спектри са на ивици, представляващи колекция от повече или по-малко тесни ленти в ултравиолетовите, видимите и инфрачервените области. Използвайки спектрални инструменти с висока разделителна способност, може да се види, че лентите са линии, толкова близко разположени, че е трудно да се разделят. Структурата на молекулните спектри е различна за различните молекули и става по-сложна с увеличаване на броя на атомите в молекулата (наблюдавано самоплътни широки ивици). Само многоатомните молекули имат вибрационни и ротационни спектри, докато двуатомните молекули ги нямат. Това се обяснява с факта, че двуатомните молекули нямат диполни моменти (по време на вибрационни и ротационни преходи няма промяна в диполния момент, което е необходимо условие вероятността на прехода да е различна от нула).
През 1928 г. академиците Г. С. Ландсберг (1890-1957) и Л. И. Манделщам и по същото време индийските физици К. Раман (1888-1970) и К. Кришнан (р. 1911) откриват феномена Раманово разсейване на светлината.Ако строго монохроматична светлина падне върху вещество (газ, течност, прозрачен кристал), тогава в спектъра на разсеяната светлина, в допълнение към неизместената спектрална линия, се откриват нови линии, честотите на които са суми или разлики на честотата на падащата светлина и честотите азестествени вибрации (или ротации) на молекулите на разсейващата среда.
Линии в рамановия спектър с честоти - аз , по-ниски честоти
падаща светлина се наричат Стоксови (или червени) сателити,линии с честоти + аз, голям ,- анти-Стоксови (или виолетови) сателити.Анализът на спектрите на Раман води до следните заключения: 1) сателитните линии са разположени симетрично от двете страни на неизместената линия; 2) честоти азне зависят от честотата на падане на светлината върху веществото, а се определят само от разсейващото вещество, т.е. характеризират неговия състав и структура; 3) броят на сателитите се определя от разсейващото вещество; 4) интензитетът на анти-Стоксовите спътници е по-малък от интензитета на спътниците на Стокс и се увеличава с повишаване на температурата на разпръскващото вещество, докато интензитетът на спътниците на Стокс практически не зависи от температурата.
Квантовата теория обяснява законите на рамановото разсейване на светлината. Според тази теория разсейването на светлината е процес, при който един фотон се абсорбира и един фотон се излъчва от молекула. Ако енергиите на фотоните са еднакви, тогава в разсеяната светлина се наблюдава неизместена линия. Възможни са обаче процеси на разсейване, при които енергиите на погълнатите и излъчените фотони са различни. Разликата в енергията на фотона се свързва с прехода на молекулата от нормално състояние към възбудено състояние (излъченият фотон ще има по-ниска честота - появява се спътник на Стокс) или от възбудено състояние към нормално състояние (излъченият фотон ще имат по-висока честота - появява се анти-Стоксов спътник).
Разсейването на светлината се съпровожда от преходи на молекулата между различни вибрационни или ротационни нива, в резултат на което се появяват множество симетрично разположени сателити. Следователно броят на сателитите се определя от енергийния спектър на молекулите, т.е. зависи само от естеството на разпръскващото вещество. ТакаТъй като броят на възбудените молекули е много по-малък от броя на невъзбудените, интензитетът на анти-Стоксовите спътници е по-малък от този на Стоксовите. С повишаване на температурата броят на възбудените молекули се увеличава, в резултат на което нараства и интензитетът на анти-Стоксовите сателити.
Молекулярните спектри (включително спектрите на Раман) се използват за изследване на структурата и свойствата на молекулите, използвани в молекулярния спектрален анализ, лазерната спектроскопия, квантовата електроника и др.
Рентгенов дифракционен анализ: 1) От дифракционните модели, получени при преминаване на рентгенов лъч през кристала, се определят междуатомните разстояния и се установява структурата на кристала; 2) Широко прилаган да определят структурата на протеините и молекулите на нуклеиновите киселини; 3)Дължините и ъглите на връзката, точно установени за малки молекули, се използват като стандартни стойности при допускането, че те остават същите в по-сложни полимерни структури; 4) Един от етапите при определяне на структурата на протеините и нуклеиновите киселини е изграждането на молекулярни модели на полимери, които са в съответствие с рентгеновите данни и запазват стандартните стойности на дължините на връзките и ъглите на връзката
Ядрено-магнитен резонанс: 1) В основата - поглъщане на електромагнитни вълни в радиочестотния диапазон от атомни ядра притежаващ магнитен момент; 2) Поглъщането на енергиен квант възниква, когато ядрата са в силното магнитно поле на NMR спектрометъра; 3) Ядра с различна химична среда абсорбират енергия в магнитно поле с малко по-различно напрежение (или при постоянно напрежение, леко различна честота на радиочестотни трептения); 4) Резултатът е ЯМР спектър вещество, в което магнитно асиметричните ядра се характеризират с определени сигнали - „химични измествания“ по отношение на всеки стандарт ; 5) ЯМР спектрите позволяват да се определи броят на атомите на даден елемент в съединението и броят и естеството на другите атоми около даден елемент.
Електронен парамагнитен резонанс (EPR): 1) Използва се резонансно поглъщане на лъчение от електрони
Електронна микроскопия:1) Те използват електронен микроскоп, който увеличава обектите милиони пъти; 2) Първите електронни микроскопи се появяват през 1939 г.; 3) С разделителна способност ~0,4 nm, електронният микроскоп ви позволява да „видите“ молекули на протеини и нуклеинови киселини, както и подробности за структурата на клетъчните органели; 4) През 1950 г. те са проектирани микротоми И ножове , което позволява да се направят ултратънки (20–200 nm) срезове от тъкани, предварително вградени в пластмаса
Методи за изолиране и пречистване на протеини:След като бъде избран източник на протеин, следващата стъпка е извличането му от тъканта. След като бъде получен екстракт, съдържащ значителна част от протеина, който представлява интерес, и частиците и непротеиновият материал са отстранени, пречистването на протеина може да започне. Концентрация . Може да се извърши чрез утаяване на протеина, последвано от разтваряне на утайката в по-малък обем. Обикновено се използва амониев сулфат или ацетон. Концентрацията на протеин в първоначалния разтвор трябва да бъде най-малко 1 mg/ml. Термична денатурация . В началния етап на пречистване понякога се използва топлинна обработка за разделяне на протеини. Той е ефективен, ако протеинът е относително стабилен при условия на нагряване, докато съпътстващите протеини са денатурирани. В този случай рН на разтвора, продължителността на обработката и температурата се променят. За да се изберат оптимални условия, първо се провеждат серия от малки експерименти. След първите етапи на пречистване протеините далеч не са хомогенни. В получената смес протеините се различават един от друг по разтворимост, молекулно тегло, общ заряд на молекулата, относителна стабилност и др. Утаяване на протеини с органични разтворители.Това е един от старите методи. Той играе важна роля в пречистването на протеини в индустриален мащаб. Най-често използваните разтворители са етанол и ацетон, по-рядко – изопропанол, метанол и диоксан. Основният механизъм на процеса: с увеличаване на концентрацията на органичния разтворител способността на водата да солватира заредени хидрофилни ензимни молекули намалява. Има намаляване на разтворимостта на протеина до ниво, при което започва агрегацията и утаяването. Важен параметър, влияещ върху утаяването, е размерът на протеиновата молекула. Колкото по-голяма е молекулата, толкова по-ниска е концентрацията на органичния разтворител, причиняващ утаяване на протеини. Гел филтрация Използвайки метода на гел филтрация, макромолекулите могат бързо да бъдат разделени според техния размер. Носителят за хроматография е гел, който се състои от омрежена триизмерна молекулярна мрежа, оформена под формата на перли (гранули) за лесно запълване на колони. Така Сефадексиса омрежени декстрани (α-1→6-глюкани от микробен произход) с определени размери на порите. Декстрановите вериги са омрежени с тривъглеродни мостове с помощта на епихлорхидрин. Колкото повече напречни връзки, толкова по-малки са размерите на отворите. Така полученият гел играе ролята на молекулно сито. Когато разтвор на смес от вещества преминава през колона, пълна с набъбнали гранули на сефадекс, големи частици, по-големи от размера на порите на сефадекс, ще се движат бързо. Малките молекули, като соли, ще се движат бавно, докато се движат вътре в гранулите. Електрофореза
Физическият принцип на метода на електрофорезата е следният. Белтъчна молекула в разтвор при всяко pH, различно от нейната изоелектрична точка, има определен среден заряд. Това кара протеина да се движи в електрическо поле. Движещата сила се определя от големината на напрегнатостта на електрическото поле думножен по общия заряд на частицата z. Тази сила се противопоставя на вискозните сили на средата, пропорционални на коефициента на вискозитет η , радиус на частицата r(радиус на Стокс) и скорост v.; E ·z = 6πηrv.
Определяне на молекулното тегло на протеина.Масовата спектрометрия (масова спектроскопия, масова спектрография, масов спектрален анализ, масспектрометричен анализ) е метод за изследване на вещество чрез определяне на съотношението маса към заряд. Протеините са способни да придобиват множество положителни и отрицателни заряди. Атомите на химичните елементи имат специфична маса. По този начин точното определяне на масата на анализираната молекула позволява да се определи нейният елементен състав (виж: елементен анализ). Масспектрометрията също предоставя важна информация за изотопния състав на молекулите, които се анализират.
Методи за изолиране и пречистване на ензими Изолирането на ензими от биологичен материал е единственият реален начин за получаване на ензими . Източници на ензими:тъкани; бактерии, култивирани върху среда, съдържаща подходящ субстрат; клетъчни структури (митохондрии и др.). Необходимо е първо да изберете необходимите обекти от биологичен материал.
Методи за изолиране на ензими: 1) Екстракция(превод в решение):буферен разтвор (предотвратява подкисляването); изсушаване с ацетон ; обработка на материала със смес от бутанол и вода ; екстракция с различни органични разтворители, водни разтвори на детергенти ; обработка на материал с перхлорати, хидролитични ензими (липази, нуклеази, протеолитични ензими)
Бутанолът разрушава липопротеиновия комплекс и ензимът преминава във водната фаза.
Третирането с детергент води до истинско разтваряне на ензима.
Фракциониране.Фактори, влияещи върху резултатите: рН, електролитна концентрация. Необходимо е постоянно измерване на ензимната активност.
Фракционно утаяване с промени в pH
Фракционна денатурация чрез нагряване
Фракционно утаяване с органични разтворители
· фракциониране със соли – изсоляване
фракционна адсорбция (А. Я. Данилевски): адсорбентът се добавя към ензимния разтвор, след което всяка порция се отделя чрез центрофугиране
§ ако ензимът е адсорбиран, той се отделя и след това се елуира от адсорбента
§ ако ензимът не е адсорбиран, тогава се използва обработка с адсорбент за отделяне на баластни вещества
ензимният разтвор преминава през колона с адсорбент и фракциите се събират
Ензимите се адсорбират селективно: колонна хроматография; електрофореза; кристализация – получаване на високо пречистени ензими.
Клетката като минимална единица на живота.
Съвременната клетъчна теория включва следните основни положения: Клетката е основната единица на структурата и развитието на всички живи организми, най-малката единица на живите. Клетките на всички едноклетъчни и многоклетъчни организми са сходни (хомоложни) по структура, химичен състав и основни прояви на жизнените функции. и метаболизъм. Възпроизвеждането на клетките става чрез разделянето им, т.е. всяка нова клетка. В сложните многоклетъчни организми клетките са специализирани във функцията, която изпълняват и образуват тъкани; Органите са изградени от тъкани. Cl е елементарна жива система, способна на самообновяване, саморегулиране и самопроизводство.
Клетъчна структура.размерите на прокариотните клетки са средно 0,5-5 микрона, размерите на еукариотните клетки са средно от 10 до 50 микрона.
Има два вида клетъчна организация: прокариотнии еукариотни. Прокариотните клетки имат сравнително проста структура. Те нямат морфологично отделно ядро, единствената хромозома се образува от кръгова ДНК и се намира в цитоплазмата. Цитоплазмата съдържа множество малки рибозоми; Няма микротубули, така че цитоплазмата е неподвижна, а ресничките и флагелите имат специална структура. Бактериите се класифицират като прокариоти. Повечето съвременни живи организми принадлежат към едно от трите царства – растения, гъби или животни, обединени в надцарството на еукариотите. Организмите се делят на едноклетъчни и многоклетъчни. Едноклетъчните организми се състоят от една клетка, която изпълнява всички функции. Всички прокариоти са едноклетъчни.
Еукариоти- организми, които за разлика от прокариотите имат образувано клетъчно ядро, ограничено от цитоплазмата с ядрена мембрана. Генетичният материал се съдържа в няколко линейни двуверижни ДНК молекули (в зависимост от вида на организма техният брой на ядро може да варира от две до няколкостотин), прикрепени отвътре към мембраната на клетъчното ядро и образуващи комплекс с хистонови протеини в огромното мнозинство, наречени хроматин. Еукариотните клетки имат система от вътрешни мембрани, които в допълнение към ядрото образуват редица други органели (ендоплазмен ретикулум, апарат на Голджи и др.). В допълнение, по-голямата част от тях имат постоянни вътреклетъчни прокариотни симбионти - митохондрии, а водораслите и растенията също имат пластиди.
Биологични мембрани, техните свойства и функции Една от основните характеристики на всички еукариотни клетки е изобилието и сложността на структурата на вътрешните мембрани. Мембраните ограничават цитоплазмата от околната среда и също така образуват черупките на ядрата, митохондриите и пластидите. Те образуват лабиринт от ендоплазмен ретикулум и подредени сплескани везикули, които изграждат комплекса на Голджи. Мембраните образуват лизозоми, големи и малки вакуоли на растителни и гъбични клетки и пулсиращи вакуоли на протозои. Всички тези структури са отделения (отделения), предназначени за определени специализирани процеси и цикли. Следователно без мембрани съществуването на клетка е невъзможно. плазмената мембрана,или плазмалема,- най-постоянната, основна, универсална мембрана за всички клетки. Това е тънък (около 10 nm) филм, покриващ цялата клетка. Плазмалема се състои от протеинови молекули и фосфолипиди. Фосфолипидните молекули са подредени в два реда - с хидрофобни краища навътре, хидрофилни глави към вътрешната и външната водна среда. На някои места двойният слой (двоен слой) на фосфолипидите е проникнат през и през от протеинови молекули (интегрални протеини). Вътре в такива протеинови молекули има канали - пори, през които преминават водоразтворимите вещества. Други протеинови молекули проникват в липидния бислой наполовина от едната или другата страна (полуинтегрални протеини). На повърхността на мембраните на еукариотните клетки има периферни протеини. Липидните и протеиновите молекули се държат заедно поради хидрофилно-хидрофобни взаимодействия. Свойства и функции на мембраните. Всички клетъчни мембрани са подвижни течни структури, тъй като липидните и протеиновите молекули не са свързани помежду си чрез ковалентни връзки и могат да се движат доста бързо в равнината на мембраната. Благодарение на това мембраните могат да променят конфигурацията си, т.е. те имат течливост. Мембраните са много динамични структури. Те бързо се възстановяват от увреждане и също така се разтягат и свиват с клетъчните движения. Мембраните на различните видове клетки се различават значително както по химичен състав, така и по относителното съдържание на протеини, гликопротеини, липиди в тях и следователно по естеството на рецепторите, които съдържат. Следователно всеки тип клетка се характеризира с индивидуалност, която се определя основно гликопротеини.Гликопротеините с разклонена верига, излизащи от клетъчната мембрана, участват в разпознаване на факторивъншната среда, както и при взаимното разпознаване на сродни клетки. Например яйцеклетка и сперматозоид се разпознават взаимно чрез гликопротеини на клетъчната повърхност, които се вписват заедно като отделни елементи на цяла структура. Такова взаимно признаване е необходим етап, предхождащ оплождането. Свързано с разпознаване регулиране на транспортамолекули и йони през мембраната, както и имунологичен отговор, при който гликопротеините играят ролята на антигени. По този начин захарите могат да функционират като информационни молекули (като протеини и нуклеинови киселини). Мембраните също съдържат специфични рецептори, преносители на електрони, преобразуватели на енергия и ензимни протеини. Протеините участват в осигуряването на транспорта на определени молекули във или извън клетката, осигуряват структурна връзка между цитоскелета и клетъчните мембрани или служат като рецептори за приемане и преобразуване на химически сигнали от околната среда. селективна пропускливост.Това означава, че молекулите и йоните преминават през нея с различна скорост и колкото по-голям е размерът на молекулите, толкова по-бавна е скоростта, с която преминават през мембраната. Това свойство определя плазмената мембрана като осмотична бариера . Водата и разтворените в нея газове имат максимална проникваща способност; Йоните преминават през мембраната много по-бавно. Дифузията на водата през мембраната се нарича чрез осмоза.Има няколко механизма за транспортиране на вещества през мембраната.
дифузия- проникване на вещества през мембрана по концентрационен градиент (от област, където концентрацията им е по-висока, към област, където концентрацията им е по-ниска). С улеснена дифузияспециални мембранни транспортни протеини селективно се свързват с един или друг йон или молекула и ги транспортират през мембраната по концентрационен градиент.
Активен транспортвключва енергийни разходи и служи за транспортиране на вещества срещу градиента на тяхната концентрация. Тойосъществявани от специални протеини-носители, които образуват т.нар йонни помпи.Най-изследваната е Na - / K - помпата в животинските клетки, която активно изпомпва Na + йони, докато абсорбира K - йони. Поради това в клетката се поддържа по-висока концентрация на K - и по-ниска концентрация на Na + в сравнение с околната среда. Този процес изисква ATP енергия. В резултат на активен транспорт с помощта на мембранна помпа в клетката се регулира и концентрацията на Mg 2- и Ca 2+.
При ендоцитоза (ендо...- навътре) определена област от плазмалемата улавя и, така да се каже, обгръща извънклетъчен материал, затваряйки го в мембранна вакуола, която възниква в резултат на инвагинация на мембраната. Впоследствие такава вакуола се свързва с лизозома, чиито ензими разграждат макромолекулите до мономери.
Обратният процес на ендоцитоза е екзоцитоза (екзо...- навън). Благодарение на него клетката отстранява вътреклетъчните продукти или неразградените остатъци, затворени във вакуоли или везикули. Везикулата се приближава до цитоплазмената мембрана, слива се с нея и съдържанието й се освобождава в околната среда. Така се отстраняват храносмилателни ензими, хормони, хемицелулоза и др.
По този начин биологичните мембрани, като основни структурни елементи на клетката, служат не само като физически граници, но са динамични функционални повърхности. Върху мембраните на органелите протичат множество биохимични процеси, като активно усвояване на вещества, преобразуване на енергия, синтез на АТФ и др.
Функции на биологичните мембраниследното: Те разграничават съдържанието на клетката от външната среда и съдържанието на органелите от цитоплазмата. Осигуряват транспорта на вещества в и извън клетката, от цитоплазмата към органелите и обратно.Те действат като рецептори (получаване и трансформиране на химични вещества от околната среда, разпознаване на клетъчни вещества и др.). Те са катализатори (осигуряващи химически процеси в близост до мембраната). Участвайте в преобразуването на енергия.
„Където и да намерим живот, ние го намираме свързан с някакво протеиново тяло и където и да намерим някакво протеиново тяло, което е в процес на разлагане, ние откриваме без изключение феномена на живота.“
Протеините са високомолекулни азотсъдържащи органични съединения, характеризиращи се със строго определен елементен състав и при хидролиза се разлагат до аминокиселини.
Характеристики, които ги отличават от другите органични съединения
1. Неизчерпаемо разнообразие на структурата и същевременно нейната висока специфична уникалност
2. Огромен набор от физични и химични трансформации
3. Способността за обратима и съвсем естествена промяна на конфигурацията на молекулата в отговор на външни влияния
4. Склонност към образуване на надмолекулни структури и комплекси с други химични съединения
Полипептидна теория за структурата на протеина
само Е. Фишер (1902) формулира полипептидната теория сгради. Според тази теория протеините са сложни полипептиди, в които отделните аминокиселини са свързани една с друга чрез пептидни връзки, които възникват от взаимодействието на α-карбоксил COOH и α-NH2 групи от аминокиселини. Използвайки примера за взаимодействие на аланин и глицин, образуването на пептидна връзка и дипептид (с освобождаване на водна молекула) може да бъде представено със следното уравнение:
Наименованието на пептидите се състои от името на първата N-терминална аминокиселина със свободна NH2 група (с окончание -ил, характерно за ацилите), имената на следващите аминокиселини (също с окончания -ил) и пълно име на С-терминалната аминокиселина със свободна СООН група. Например, пентапептид от 5 аминокиселини може да бъде обозначен с пълното му име: глицил-аланил-серил-цистеинил-аланин или съкратено Gly-Ala-Ser-Cys-Ala.
експериментални доказателства за полипептидната теория протеинова структура.
1. Естествените протеини съдържат сравнително малко титруеми свободни COOH и NH 2 групи, тъй като абсолютното мнозинство от тях са в свързано състояние, участвайки в образуването на пептидни връзки; Основно свободни COOH и NH 2 групи в N- и C-крайните аминокиселини на пептида са налични за титруване.
2. В процеса на киселинна или алкална хидролиза катерицаОбразуват се стехиометрични количества титруеми СООН и NH 2 групи, което показва разпадането на определен брой пептидни връзки.
3. Под действието на протеолитични ензими (протеинази) протеините се разделят на строго определени фрагменти, наречени пептиди, с крайни аминокиселини, съответстващи на селективността на действие на протеиназите. Структурата на някои от тези фрагменти на непълна хидролиза е доказана чрез техния последващ химичен синтез.
4. Биуретовата реакция (синьо-виолетово оцветяване в присъствието на разтвор на меден сулфат в алкална среда) се дава както от биурет, съдържащ пептидна връзка, така и от протеини, което също е доказателство за наличието на подобни връзки в протеините.
5. Анализът на рентгенови дифракционни модели на протеинови кристали потвърждава полипептидната структура на протеините. По този начин рентгеновият дифракционен анализ с разделителна способност 0,15–0,2 nm позволява не само да се изчислят междуатомните разстояния и размерите на ъглите на връзката между C, H, O и N атомите, но и да се „види“ картината на общата подреждането на аминокиселинните остатъци в полипептидната верига и нейната пространствена ориентация (конформация).
6. Значително потвърждение на полипептидната теория протеинова структурае възможността за синтезиране чрез чисто химически методи на полипептиди и протеини с вече известна структура: инсулин - 51 аминокиселинни остатъка, лизозим - 129 аминокиселинни остатъка, рибонуклеаза - 124 аминокиселинни остатъка. Синтезираните протеини имат физикохимични свойства и биологична активност, подобни на естествените протеини.
През 1852 г. английският химик Едуард Франкланд излага теория, която по-късно става известна като теория на валентността, според която всеки атом има определен капацитет на насищане (или валентност). На първо място, с въвеждането на понятието „валентност“ беше възможно да се разбере разликата между атомното тегло и еквивалентното тегло на елементите. Дори в средата на 19 век много химици все още объркват тези понятия.
Еквивалентното тегло на един атом е равно на неговото атомно тегло, разделено на неговата валентност.
Теорията на валентността изигра решаваща роля в развитието на теорията на химията и в частност на органичната химия. След като първата органична молекула беше построена, стана напълно ясно защо органичните молекули са склонни да бъдат много по-големи и по-сложни от неорганичните молекули.
Според идеите на Кекуле, въглеродните атоми могат да се свързват един с друг, използвайки една или повече от четирите си валентни връзки, образувайки дълги вериги. Очевидно никой друг атом не притежава тази забележителна способност в степента, в която я притежава въглеродът.
Полезността на структурните формули беше толкова очевидна, че много органични химици ги възприеха веднага. Те обявиха за напълно остарели всички опити да се изобразят органичните молекули като структури, изградени от радикали. В резултат на това беше установено, че е необходимо да се покаже неговата атомна структура, когато се пише формулата на съединение.
Руският химик Александър Михайлович Бутлеров използва тази нова система от структурни формули в своята теория за структурата на органичните съединения. През 60-те години на 19 век той показва как с помощта на структурни формули могат ясно да се обяснят причините за съществуването на изомерите.
Бутлеров очертава основните идеи на теорията за химическата структура в доклада „За химическата структура на материята“, прочетен в химическата секция на Конгреса на немските естествоизпитатели и лекари в Шпайер (септември 1861 г.). Основите на тази теория са формулирани по следния начин:
- 1) Атомите в молекулите са свързани помежду си в определена последователност според техните валентности. Последователността на междуатомните връзки в една молекула се нарича нейната химическа структура и се отразява от една структурна формула (структурна формула).
- 2) Химическата структура може да се определи с помощта на химични методи. (В момента се използват и съвременни физични методи).
- 3) Свойствата на веществата зависят от техния химичен строеж.
- 4) Въз основа на свойствата на дадено вещество може да се определи структурата на неговата молекула, а въз основа на структурата на молекулата могат да се предскажат свойствата.
- 5) Атомите и групите от атоми в една молекула си влияят взаимно.
Основата на теорията на Бутлеров е идеята за реда на химичното взаимодействие на атомите в молекулата. Този ред на химично взаимодействие не включва идеи за механизма на химичното свързване и физическото разположение на атомите. Тази важна характеристика на теорията за химическата структура позволява винаги да се разчита на нея, когато се конструира физически модел на молекула.
След като установи концепцията за химичната структура, A.M. Бутлеров дава нова дефиниция на природата на материята: „химическата природа на сложната частица се определя от естеството на нейните елементарни съставни части, тяхното количество и химична структура“.
Така А.М. Бутлеров е първият, който установи, че всяка молекула има определена химическа структура, че структурата определя свойствата на веществото и че чрез изучаване на химичните превръщания на веществото може да се установи неговата структура.
Изгледи на A.M. Разбирането на Бутлеров за значението на химическите структурни формули следва от основните положения на неговата теория. Бутлеров смята, че тези формули не трябва да бъдат „типични“, „реакционни“, а конституционни. В този смисъл за всяко вещество е възможна само една рационална формула, въз основа на която може да се съди за неговите химични свойства.
Бутлеров е първият, който обяснява явлението изомерия с факта, че изомерите са съединения, които имат еднакъв елементарен състав, но различни химични структури. От своя страна зависимостта на свойствата на изомерите и органичните съединения като цяло от тяхната химична структура се обяснява с наличието в тях на „взаимно влияние на атомите“, предавано по връзките, в резултат на което атомите, в зависимост от тяхната структура среда, придобиват различни „химически значения“. Самият Бутлеров и особено неговите ученици В.В. Марковников и А.Н. Попов конкретизира това общо положение под формата на множество „правила”. Още през 20в. тези правила, както и цялата концепция за взаимно влияние на атомите, получиха електронна интерпретация.
Така Бутлеров отваря пътя към систематичното създаване на органични съединения, след което органичната химия започва да печели една победа след друга в съревнование с природата за създаване на материални ценности за задоволяване на нуждите на хората.
Важен напредък в молекулярната структура включва откритието на Пастьор за оптичните изомери и приемането на триизмерен модел на молекулата.